黄芪甲苷和三七总皂苷配伍抗大鼠脑缺血再灌注损伤及其药动学的研究
2017-10-28李静娴杨筱倩唐标刘晓丹唐映红邓常清黄小平
李静娴+杨筱倩+唐标+刘晓丹+唐映红+邓常清+黄小平
[摘要] 研究黄芪甲苷(AST Ⅳ)和三七总皂苷(PNS)配伍对大鼠脑缺血再灌注损伤的影响,并从4种主要有效成分AST Ⅳ、人参皂苷Rg1(Rg1)、人参皂苷Rb1(Rb1)、三七皂苷R1(R1)在脑缺血再灌注大鼠体内的药动学行为探讨二者协同增强抗脑缺血再灌注损伤的机制。采用改良线栓法制备大鼠大脑中动脉栓塞脑缺血/再灌注模型,以神经功能评分、脑梗死面积、病理形态学指标综合评价AST Ⅳ和PNS配伍抗脑缺血再灌注损伤的药理效应;采用高效液相色谱-串联四极杆质谱法(UPLC-MS/MS)測定给药后不同时间大鼠血浆中AST Ⅳ,Rg1,Rb1,R1的含量,计算药代动力学参数,分析AST Ⅳ和PNS配伍后主要有效成分药代动力学行为的变化。结果发现AST Ⅳ,PNS单用及其配伍可以缩小大鼠脑梗死面积,降低神经功能缺失行为学评分,改善脑缺血后病理形态变化,AST Ⅳ和PNS配伍的效应强于二者单用。药代动力学分析结果,AST Ⅳ和PNS配伍后,AST Ⅳ,Rg1,Rb1,R1的曲线下面积(AUC)显著增加,平均驻留时间MRT0-t延长,达峰浓度(Cmax)显著增加,表观分布容积(Vz/F)减少,且体内清除速率显著减慢。表明AST Ⅳ和PNS配伍具有协同增强抗脑缺血再灌注损伤的作用,且二者配伍可使主要有效成分的药动学行为发生改变,提示其机制可能是AST Ⅳ和PNS配伍后,可在脑缺血状态下延长药物的体内滞留时间,使生物利用度增加,达到增强药效、延长药效、发挥协同增效的目的。
[关键词] 黄芪甲苷; 三七总皂苷; 配伍; 脑缺血再灌注; 药动学
[Abstract] The aim is to study the effect of astragaloside Ⅳ (AST Ⅳ) combined with Panax notoginseng saponins (PNS) on cerebral ischemia-reperfusion injury, and to probe the synergistic mechanism through the pharmacokinetics of the four major components such as AST Ⅳ, ginsenoside Rg1 (Rg1), ginsenoside Rb1 (Rb1), notoginsenoside R1 (R1) in cerebral ischemia-reperfusion rats. Following the establishment of cerebral ischemia/reperfusion model in rats by modified suture method, neurological function score, cerebral infarction area and pathomorphology were used to evaluate the pharmacological effect that the combination of AST Ⅳ and PNS antagonized cerebral ischemia-reperfusion injury; the contents of AST Ⅳ, Rg1, Rb1, R1 in rat plasma of different time points were determined with ultra performance liquid chromatography tandem massspectrometry (UPLC-MS/MS), pharmacokinetic parameters were calculated and pharmacokinetics changes of the main effective components were analyzed. The results showed that AST Ⅳ, PNS alone and their combination could reduce the cerebral infarction area of rats, relieve the behavioral scores of neurologic deficit, improve the pathological changes after cerebral ischemia, the effects of the combination were better. Among AST Ⅳ, Rg1, Rb1, R1, the area under the curve (AUC) was significantly increased, the mean residence time of (MRT0-t) was delayed, the peak concentration (Cmax) was significantly raised, the apparent volume of distribution (Vz/F) was reduced, and the clearance rate in vivo was significantly slowed. It suggested that AST Ⅳ combined with PNS has synergistic enhancement on anti-cerebral ischemia/reperfusion injury, moreover, make the pharmacokinetic behavior of the main effective components change, the mechanism may be associated with prolonging the retention time of the effective components in cerebral ischemia condition, elevating the bioavailability.
[Key words] astragaloside Ⅳ; Panax notoginseng saponins; combination; cerebral ischemia/reperfusion; pharmacokinetics
脑血管疾病属于中医“中风”范畴,具有发病率高、致残率高、死亡率高和复发率高等特点[1],是严重威胁人类健康的重大疾患之一。其中缺血性中风是脑血管疾病的主要类型,发病率约占中风的80%。现代中医临床研究表明,脑缺血的基本病机是虚、火、风、痰、气、血,而气虚血瘀是缺血性中风的主要病理機制。因此,以益气活血为基本治法治疗常可收到良好的疗效。
黄芪和三七是治疗心脑血管疾病的常用有效中药,黄芪具有补气升阳等作用,三七具有活血散瘀、消肿止痛等功效,二者配伍,符合益气活血的治疗原则[2-3]。中药药物化学研究表明,黄芪中具有抗脑缺血作用的主要有效组分为黄芪总苷(astragaloside,AST),黄芪甲苷(astragaloside Ⅳ,AST Ⅳ)是其主要有效成分[4];三七中具有抗脑缺血作用的主要有效组分是三七总皂苷(Panax notoginseng saponins,PNS),主要含人参皂苷Rb1(ginsenoside Rb1,Rb1)、人参皂苷Rg1(ginsenoside Rg1,Rg1)和三七皂苷R1(notoginsenoside R1,R1)[5-6]。前期研究表明,黄芪与三七的有效组(成)分配伍具有协同抗脑缺血再灌注损伤的作用,其机制与抑制神经细胞凋亡和炎症反应、改善脑组织能量代谢、以及抗氧化应激和细胞自噬性损伤等有关[7-10]。虽然以往已经初步揭示了黄芪和三七有效组(成)分配伍可以通过多环节、多靶点协同增强抗脑缺血的作用,但黄芪和三七配伍协同增效的物质基础和作用原理还不是很清楚。推测黄芪和三七配伍可能通过影响中药成分的药代动力学行为,从而促进药物的吸收并延长药物在体内的驻留时间,发挥对脑缺血的协同增效作用。因此本研究采用大鼠脑缺血再灌注模型,研究AST Ⅳ和PNS配伍后抗脑缺血再灌注的药理作用,并测定配伍前后不同时间点血浆中主要成分AST Ⅳ,Rg1,Rb1,R1的药代动力学参数变化,探讨AST Ⅳ和PNS配伍协同增效抗缺血性脑损伤的作用和药动学的相关性。
1 材料
1.1 动物
SPF级雄性健康Sprague-Dawley(SD)大鼠,体质量220~250 g,由湖南斯莱克景达实验动物有限公司提供。动物合格证号为SCXK(湘)2013-0004。饲养于SPF级动物实验室。实验前适应性喂养饲养5~7 d,给药前禁食12 h,自由饮水。
1.2 试药
AST Ⅳ(纯度≥98.05%,批号MUST-14102910),PNS(纯度≥98%,批号MUST-14122912),Rg1(纯度≥98.06%,批号MUST-14120407),Rb1(纯度≥98.74%,批号MUST-15032211),R1(纯度≥98.67%,批号MUST-14123111)均购自成都曼斯特生物科技有限公司,2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)(美国Sigma,批号BCBP3272V),水合氯醛(梯希爱化成工业发展有限公司,批号8MQ20-CC),甲醇、乙腈均为色谱纯(德国Merck),水为超纯水,其他试剂均为分析纯。AST Ⅳ,PNS用时以0.5%羧甲基纤维素钠配置成相应浓度混悬液。
2 方法
2.1 抗脑缺血再灌注损伤药效实验
2.1.1 分组及给药 清洁级SD大鼠72只,随机分为6组:假手术组、模型组、AST Ⅳ组、PNS组、AST Ⅳ、PNS配伍组(高、低剂量)。每组8只,采用灌胃给药的方法(10 mL·kg-1)。剂量按前期实验换算成大鼠用量:AST Ⅳ(28 mg·kg-1)组、PNS(80 mg·kg-1)组、AST Ⅳ和PNS高剂量配伍组(AST Ⅳ 56 mg·kg-1+PNS 160 mg·kg-1),AST Ⅳ和PNS低剂量配伍组(AST Ⅳ 28 mg·kg-1+PNS 80 mg·kg-1)。每日1次,连续灌胃2 d,于末次给药1 h后制作脑缺血再灌注模型,再灌注期间同时给药。假手术组及模型组大鼠给予等量生理盐水。
2.1.2 脑缺血模型的制作 采用改良Longa法[11-12]制作局灶性脑缺血模型。用10%水合氯醛(300 mg·kg-1)腹腔注射麻醉后,将大鼠颈前正中皮肤切开,钝性分离右侧颈总动脉(common carotid arteries,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),用5-0手术线分别结扎ECA的远端并于结扎点近侧凝断ECA及其分支,并对ICA远侧部进行活结结扎,动脉夹夹闭ICA远侧部与CCA。以直径0.28 mm的尼龙线线栓自ECA经CCA分叉部插入ICA,松开ICA上的动脉夹,并将线栓插入ICA颅内段,插入长度约为(18±2) mm,活结扎住ICA内的线栓以防止出血和线栓的移动,缝合颈部皮肤。阻断血流2 h后,拔出线栓进行再灌注。假手术组仅将CCA,ECA,ICA游离出来,不做插线处理,其他操作同模型组一致。
2.1.3 测定指标与分析 神经功能学评分:大鼠再灌注24 h后,按Longa法对动物的神经功能进行评分,标准如下[12]:①0分,实验动物正常,未观察到神经功能缺失症状;②1分,实验动物不能完全伸展脑缺血对侧前爪(轻度);③2分,实验动物向脑缺血对侧转圈(中度);④3分,实验动物爬行时向脑缺血对侧倾倒(重度);⑤4分,实验动物不能自发行走,意识丧失。1~3分作为脑缺血成功样本入选。脑梗死面积:采用TTC染色法。再灌注24 h后,大鼠断头处死,迅速取脑,置于-20 ℃冰箱冰冻15 min,去除小脑、脑干等,将大脑均匀地切成5片2 mm连续冠状切片。然后迅速将脑片置于2% TTC磷酸盐缓冲液中,37 ℃恒温水浴箱避光染色30 min,每5 min将脑片轻轻翻动1次。染色后,用4%多聚甲醛将脑片固定24 h。非缺血区组织为玫瑰红色,梗死区组织为白色。 脑组织病理形态:采用HE染色法。再灌注24 h后,大鼠断头处死迅速取脑,放入4%多聚甲醛中固定2~3 d。经视交叉平面冠状切取2 mm厚脑组织,经梯度酒精上行脱水、二甲苯透明、石蜡包埋、切成3 μm薄的切片,用于HE染色。HE染色切片在显微镜(10×40)下随机取缺血皮质区5个非重叠的视野对损伤细胞进行观察,损伤细胞表现为空泡样变性、嗜酸性样变性、核固缩、核溶解等改变。分别计数每个高倍视野中的细胞总数及损伤细胞数,计算细胞损伤率=(损伤细胞数/细胞总数)×100%。
2.1.4 统计方法 采用SPSS 17.0统计软件进行统计分析,实验数据用±s表示。各组间计量资料的比较采用单因素方差分析,配伍低剂量组和两成分单用组的组间比较(因配伍低剂量组药物剂量与两成分单用组的药物剂量相同)采用LSD法。P<0.05为差异具有统计学意义。
2.2 脑缺血再灌注模型下ASTⅣ和PNS配伍给药后药动学实验
2.2.1 分组、给药与样品采集 SD大鼠,实验前适应性喂养5 d,给药前12 h禁食,自由饮水。根据前期实验结果,选用配伍低剂量组进行药动学的研究,将动物分为AST Ⅳ(28 mg·kg-1)组、PNS(80 mg·kg-1)组、AST Ⅳ+PNS配伍组(AST Ⅳ 28 mg·kg-1+PNS 80 mg·kg-1),每组3只。各组分别进行脑缺血再灌注模型的制作,并于造模后2 h分别灌胃给药,给药体积10 mL·kg-1;在给药后0.083,0.25,0.5,1,2,3,4,6,12,24 h于大鼠心脏采血0.5 mL(为保证有足够血量的抽取和防止低血容量引起动物死亡,在给药前20 min于大鼠腹腔注射2 mL生理盐水)。血样置EDTA-K2抗凝试管中,4 ℃下3 500 r·min-1离心5 min,取上清液即得含药血浆样品,-80 ℃保存备用。
2.2.2 血浆样品预处理 精密吸取100 μL血浆样品置于具塞离心管中,加入480 μL无水乙醇沉淀蛋白,涡旋振荡3 min后,12 000 r·min-1离心10 min,取上清液过0.22 μm滤膜(滤膜首先用甲醇冲过后空气挥干)后待测。
2.2.3 标准品溶液的配制 精密称取AST Ⅳ,Rb1,Rg1,R1对照品,分别置于10 mL量瓶中,加甲醇溶解并定容至刻度,得质量浓度分别为519,511,520,504 mg·L-1的对照品溶液,-20 ℃避光保存备用。
2.2.4 色谱条件 ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),流动相A相为0.1%甲酸的水溶液,B相为0.1%甲酸乙腈溶液;流速0.3 mL·min-1;进样量3 μL;梯度洗脱程序:0~1 min,25% B;1~4.5 min,25%~35% B;4.5~7 min,35%~55% B;7~8 min,55%~95% B;8~15 min,95% B;15~15.1 min,95%~25% B;15.1~20 min,25% B。
2.2.5 质谱条件 采用电喷雾离子源负离子模式(ESI-),多反应监测模式(MRM)。AST Ⅳ,Rg1,Rb1,R1的监测离子对分别为m/z 829.5→783.4,845.5→637.4,1 107.6→179.1,931.5→799.4,毛細管电压4.0 kV,干燥气温度为335 ℃,流速为11 L·min-1,雾化气压力为40 psi。4种被测定成分质谱参数见表1。
3 结果
3.1 AST Ⅳ和PNS配伍对脑缺血再灌注损伤的影响
3.1.1 对神经功能缺失评分的影响 假手术组大鼠神经行为功能正常,行为学评分为0分。模型组大鼠出现了对侧前爪不能完全伸展,或向对侧转圈或者倾倒的神经功能障碍,其神经功能缺失评分显著高于假手术组(P<0.01)。与模型组比较,AST Ⅳ单用组、PNS单用组、AST Ⅳ+PNS配伍低剂量组和高剂量组的神经功能缺失评分显著降低(P<0.01)。与AST Ⅳ单用组和PNS单用组比较,AST Ⅳ+PNS配伍低剂量组神经功能缺失评分显著降低(P<0.01),见表2。
3.1.2 对脑梗死面积的影响 假手术组脑组织TTC染色示均匀红色,未见有苍白梗死区域。模型组出现较大范围的苍白梗死灶。与模型组比较,各用药组的脑梗死面积缩小,且AST Ⅳ+PNS配伍的不同剂量组脑梗死面积缩小更为显著,见图1。
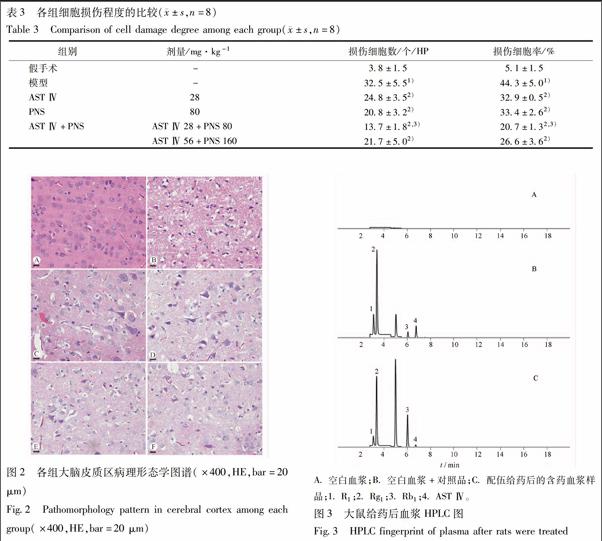
3.1.3 对脑组织形态学的影响 光镜下可见,假手术组大鼠大脑皮质区细胞结构完整,形态规则,连接紧密,核仁清晰可见,间质无炎性细胞浸润,神经纤维密集,排列紧密,偶见细胞损伤改变。模型组大鼠脑组织细胞周围间隙增大,胞核不规整,毛细血管萎缩,间质水肿明显,排列紊乱,细胞核深染固缩或出现嗜酸性样变性,损伤细胞增多,损伤细胞显著多于假手术组(P<0.01)。与模型组比较,各给药组大鼠细胞轻度肿胀,细胞间隙增大有所减轻,核固缩与嗜酸性样变性细胞减少,细胞损伤程度减轻。与模型组比较,AST Ⅳ单用组、PNS单用组、AST Ⅳ+PNS配伍低剂量组和高剂量组损伤细胞数和损伤细胞率显著低于模型组(P<0.01)。与AST Ⅳ和PNS单用组比较,AST Ⅳ+PNS配伍低剂量组损伤细胞数和细胞损伤率显著减少(P<0.01),见表3,图2。
3.2 AST Ⅳ和PNS配伍对脑缺血再灌注状态下药动学的影响
3.2.1 专属性考察 空白血浆、空白血浆加AST Ⅳ,Rg1,Rb1,R1对照品和AST Ⅳ与PNS配伍给药后血浆的色谱图同,见图3。由图3可见,AST Ⅳ,Rg1,Rb1,R1的保留时间分别为 6.7,3.4,6.0,3.1 min,空白血浆在相同保留时间处无吸收峰,方法专属性良好。
3.2.2 线性关系考察 精密吸取一定量的5种对照品储备液于离心管中,用大鼠空白血浆分别稀释成质量浓度为5,2,1,0.2,0.1,0.04,0.02,0.01 mg·L-1的系列血浆样品,按2.2.2项处理,并按照2.2.4项检测条件进行测定。以峰面积(y)对质量浓度(x)进行线性回归,得标准曲线,并计算AST Ⅳ,Rg1,Rb1,R1线性回归方程y=20.711 6x+3.182 9(r=0.998 7),y=104.308 4x-41.339 0(r=0.997 1),y=9.807 5x-1.179 4(r=0.999 1),y=26.797 7x-11.034 6(r=0.997 2)。在0.01~5 mg·L-1线性关系良好,按信噪比S/N≥3计,最低检测限为0.01 mg·L-1。
3.2.3 精密度试验 取9份100 μL空白血浆分别置具塞试管中,加入3种不同质量浓度的混合对照品溶液适量,用大鼠空白血浆配制成质量浓度分别为0.01,0.1,0.5 mg·L-1的低、中、高3种质量浓度质控血浆样品,每个质量浓度样品3份,按2.2.2项方法处理,并按照2.2.4项检测条件进行测定,同一质量浓度样品每1 h测定1次,共测定6次,计算日内精密度相对标准偏差(relative standard deviation,RSD);每天测定1次,连续测定6 d,计算日间精密度RSD。AST Ⅳ,Rg1,Rb1,R1的日内精密度RSD分别为3.6%,3.9%,2.1%,3.3%,日间精密度RSD分别为3.3%,4.5%,2.2%,4.3%,均<10%(n=3),表明所建立的检测方法精密度符合药动学分析要求。
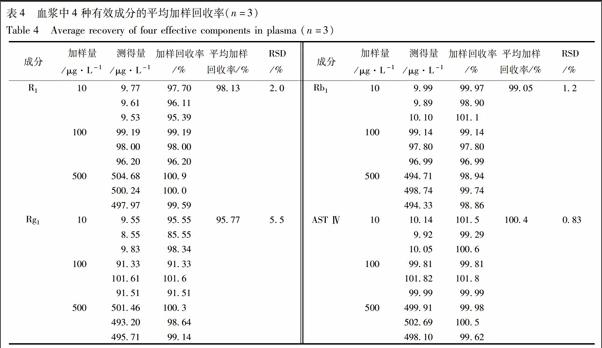
3.2.4 加样回收率及基质效应试验 取空白血浆配制上述各成分低、中、高3个质量浓度的对照品血浆,同时以相同浓度的对照品进样,每个质量浓度平行3份,按相同的预处理方法和色谱条件进行处理和测定。得到血浆中AST Ⅳ,Rg1,Rb1,R1的平均加样回收率分别为100.4%,95.77%,99.05%,98.13%;RSD分别为0.83%,5.5%,1.2%,2.0%(n=3),表示回收率良好,满足样品测定要求,见表4。另取空白血浆,按2.2.2项处理获得的上清液中加入相应质量浓度的对照品溶液,进样测得峰面积A;相应质量的对照品溶液直接进样测得峰面积B,计算基质效应=A/B×100%。基质效应分别为(99.31±2.61)%,(96.91±4.61)%,(95.05±2.32)%,(96.86±2.67)%,RSD均较小,符合药动学研究要求。
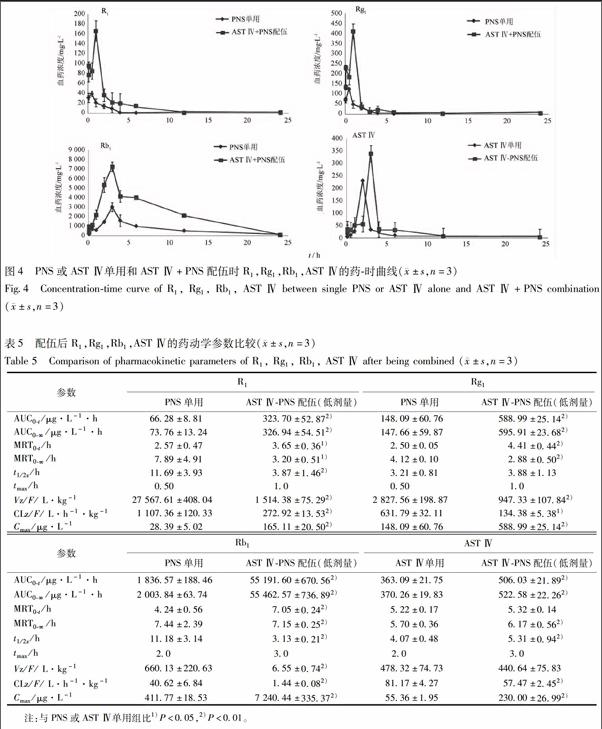
3.2.5 药动学参数测定和分析 药物单用和配伍给药后各有效成分在脑缺血再灌注大鼠体内的血药浓度-时间曲线,见图4。所得大鼠血药浓度数据采用药动学计算程序DAS 3.1.6 药动学程序软件进行拟合,采用非房室模型计算药动学参数,数据以±s表示,得到的药动学参数用SPSS 17.0进行分析,两组间的比较,方差齐者采用成组t检验,方差不齐者采用Wilcoxon秩和检验。P<0.05为差异具有统计学意义,见表5。
与单用PNS相比,AST Ⅳ和PNS配伍给药后,R1的曲线下面积(AUC)增大(P<0.01),平均驻留时间MRT0-t延长(P<0.05),半衰期(t1/2z)缩短(P<0.01),表观分布容积(Vz/F)减少(P<0.01),清除率(CLz)减小(P<0.01),药峰浓度(Cmax)显著增加(P<0.01)。显示配伍给药后,R1在体内吸收量显著增加,分布减少,药物停留时间延长,清除速度减慢。
与单用PNS相比,AST Ⅳ和PNS配伍给药后,Rg1的曲线下面积AUC增大(P<0.01),平均驻留时间MRT0-t延长(P<0.01),表观分布容积Vz/F减少(P<0.01),清除率CLz减小(P<0.01),藥峰浓度(Cmax)显著增加(P<0.01)。显示AST Ⅳ和PNS配伍可使Rg1在体内的吸收量增加,分布减少,清除速率减慢,在体内的驻留时间延长。
与单用PNS相比,AST Ⅳ和PNS配伍给药后,Rb1的曲线下面积AUC增加(P<0.01),平均驻留时间 MRT0-t显著延长(P<0.01),半衰期t1/2z缩短(P<0.01),表观分布容积Vz/F减少(P<0.01),清除率CLz减小(P<0.01),药峰浓度(Cmax)显著增加(P<0.01)。显示AST Ⅳ和PNS配伍可使Rb1在体内的吸收程度增加,分布减少,清除速度减慢,驻留时间延长。
与单用AST Ⅳ相比,AST Ⅳ和PNS配伍给药后,AST Ⅳ的曲线下面积AUC明显增加(P<0.01),清除率CLz减小(P<0.01),药峰浓度(Cmax)显著增加(P<0.01)。提示AST Ⅳ和PNS配伍后可使AST Ⅳ吸收量显著增加,体内清除减慢。
由此可见,AST Ⅳ和PNS 单用时4个有效成分的达峰浓度较低,曲线下面积较小,清除速率较快。AST Ⅳ和PNS配伍后,可使有效成分达峰浓度和曲线下面积增加。
4 讨论
中医历来重视药物的配伍应用,但中药配伍并不是单个成分的简单相加,更多地是通过配伍影响了中药成分在体内的吸收和代谢,使药物成分的药代动力学行为等发生变化,从而促进药物的吸收和进入病变部位,延长药物在体内的滞留时间,使血药浓度升高,发挥协同增强药物效应的作用。黄芪和三七配伍符合益气活血的治疗原则,已有的临床应用和实验研究证明二者配伍具有协同增效抗脑缺血损伤的作用[13-16],而且以往的研究也证明二者有效组(成)分配伍可作用于脑缺血的病理生理多环节发挥协同作用,但配伍后是否影响各成分的药动学还不清楚。基于中药复方的整体性[17-19],本实验建立了脑缺血大鼠血浆中AST Ⅳ,Rg1,Rb1,R1同时测定的LC-MS/MS方法,通过专属性、线性关系、精密度、回收率实验充分验证此分析方法的可靠性,并运用此方法对脑缺血大鼠血浆中的黄芪和三七主要有效成分进行定量分析,获得被测成分在脑缺血大鼠体内的药动学参数变化,以阐明AST Ⅳ和PNS配伍协同增效抗缺血性脑损伤的作用机制。
局灶性脑缺血再灌注大鼠模型是评价药物对脑缺血再灌注损伤常用的模型,与人类脑梗死发病情况类似[20]。脑缺血后由于脑组织缺血缺氧,细胞损伤坏死,出现相应的形态损伤和功能异常,因此,用神经功能评分和病理形态学指标可评价其抗脑缺血的效应。研究结果表明,脑缺血再灌注后,大鼠神经功能障碍明显,神经功能学评分显著增高。与模型组比较,AST Ⅳ组、PNS组、AST Ⅳ和PNS配伍低、高剂量组神经功能障碍减轻,神经功能学评分显著降低,且配伍低剂量组神经功能学评分显著低于药物单用组。表明AST Ⅳ和PNS配伍能协同改善脑缺血再灌注损伤大鼠的神经功能缺失,改善脑组织功能。TTC染色和HE染色结果表明,局灶性脑缺血再灌注后,大鼠脑组织出现梗死灶,细胞损伤明显。与模型组相比,各用药组脑梗死面积缩小,神经细胞形态改变均得到一定的改善,细胞损伤数量减少。AST Ⅳ和PNS配伍低剂量组较单用组比较,脑梗死面积缩小明显,细胞损伤显著减轻。提示AST Ⅳ和PNS配伍能协同延缓并减轻脑细胞的死亡,改善神经细胞的形态结构。从而从药效学角度证明,AST Ⅳ和PNS配伍可以缩少脑梗死体积,减轻脑缺血后的病理形态学改变,减轻神经功能缺失症状。AST Ⅳ和PNS配伍可增强抗大鼠脑缺血再灌注损伤的作用。
藥动学结果表明,AST Ⅳ和PNS配伍给药后,AST Ⅳ的Cmax显著增加,CLz减小,AUC显著增大。由此可见,配伍显著影响了AST Ⅳ在脑缺血再灌注大鼠体内的药代动力学行为,使其吸收程度增加,体内的清除减慢,从而使其在血液中的浓度升高,生物利用度增加。AST Ⅳ和PNS配伍给药后,3个皂苷类成分的AUC均显著升高,MRT0-t增大,CLz减小,Vz/F减少,且Cmax显著升高。表明配伍给药后,3个皂苷类成分在体内的吸收程度增加,停留时间变长,清除速度减慢,生物利用度显著增加。提示AST Ⅳ和PNS配伍后能够增加有效成分的吸收程度,增加药物在脑缺血大鼠体内的含量,延长药物的作用时间,提高生物利用度,从而达到增效的目的。
综上所述,AST Ⅳ和PNS配伍具有增强抗脑缺血再灌注损伤的作用,其机制可能与二者配伍后,促进有效成分在体内的吸收,延长药物的滞留时间,增加生物利用度,增强和延长药效有关。从药效学和药动学角度揭示了黄芪和三七有效组(成)分配伍治疗脑缺血的合理性。
[参考文献]
[1] Savitz S I, Caplan L R. Vertebrobasilar disease[J]. New Engl J Med, 2005, 352(26): 2618.
[2] Kang X Q, Fan Z C, Zhang Z Q, et al. Simultaneous determination of three Aconitum alkaloids in six herbal medicines by high-performance liquid chromatography[J]. J Chromatogr Sci, 2010, 48:860.
[3] Wang X, Zhang A, Sun H, et al. Future perspectives of Chinese medical formulae: chinmedomics as an effector[J]. OMICS J Radiol, 2012(16): 414.
[4] Huang X P, Tan H, Chen B Y, et al. Astragalus extract alleviates nerve injury after cerebral ischemia by improving energy metabolism and inhibiting apoptosis[J]. Biol Pharm Bull, 2012, 35(4): 449.
[5] Ng T B. Pharmacological activity of sanchi ginseng (Panax notoginseng)[J]. Pharm Pharmacol, 2006, 58(8): 1007.
[6] Li H, Deng C Q, Zhang S P, et al. Total saponins of Panax notoginseng modulate the expression of caspases and attenuate apoptosis in rats following focal cerebral ischemia reperfusion[J]. J Ethnopharmacol, 2009, 121(3): 412.
[7] Huang X P, Ding H, Yang X Q, et al. Synergism and mechanism of astragaloside Ⅳ combined with ginsenoside Rg1 aganist autophagic injury of PC12 cells induced by oxygen glucose deprivation/reoxygenation[J]. Biomed Pharmacother, 2017, 89: 124.
[8] Huang X P, Ding H, Lu X D, et al. Effects of the combination of the main active components of astragalus and Panax notoginseng on inflammation and apoptosis of nerve cell after cerebral ischemia-reperfusion[J]. Am J Chinese Med, 2015, 43(7): 1419.
[9] Hang X P, Ding H, Wang B, et al. Effects of the main active components combinations of Astragalus and Panax notoginseng on energy metabolism in brain tissues after cerebral ischemia-reperfusion in mice[J]. Pharmacogn Mag, 2015, 11(44): 732.
[10] Huang X P, Qiu Y Y, Wang B, et al. Effects of astragaloside Ⅳ combined with the active components of Panax notoginseng on oxidative stress injury and Nrf2/HO-1 signaling pathway after cerebral ischemia-reperfusion in mice[J]. Pharmacogn Mag, 2014, 10(40): 402.
[11] 顾振, 韩群颖. 大鼠短暂性局灶性脑缺血模型改进的制作方法[J]. 南京医科大学学报: 自然科学版, 2001, 21(6): 513.
[12] Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery ocelusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84.
[13] 杨铭, 林海燕, 傅志泉. 黄芪注射液联合血塞通治疗气虚血瘀型急性脑梗死临床疗效观察[J]. 中华中医药学刊, 2017, 23(5): 1077.
[14] 李行良. 黄芪注射液与血塞通注射液联合治疗急性脑梗死的疗效观察[J]. 中医临床研究, 2011, 3(9): 32.
[15] 冯崇廉, 林素贞, 傅智丽, 等. 黄芪注射液联合血塞通粉针治疗缺血性脑卒中临床研究[J]. 长春中医药大学学报, 2011, 27(6): 924.
[16] 任周新, 李丽, 李君, 等. 黄芪总皂苷合三七总皂苷对实验性脑缺血再灌注脑水肿和脂质过氧化的抑制作用[J]. 中华中医药学刊, 2008, 26(11): 2486.
[17] Zhang A, Sun H, Wang P, et al. Future perspectives of personalized medicine in traditional Chinese medicine: a systems biology approach[J]. Complement Ther Med, 2012, 20: 93.
[18] Sun H, Wu F, Zhang A, et al. Pharmacokinetic study of schisandrin,schisandrol B, schisantherin A, deoxyschisan-drin, and schisandrin B in rat plasma after oral administration of Shengmaisan formula by UPLC-MS[J]. J Sep Sci, 2013, 36: 485.
[19] Yin Q, Sun H, Zhang A, et al. Pharmacokinetics and tissue distribution study of scoparone in rats by ultraperformance liquid-chromatography with tandem high-definition mass spectrom-etry[J]. Fitoterapia, 2012, 83: 795.
[20] Xu L, Fagan S C, Waller J L, et al. Low dose intravenous minocycline is neuroprotective after middle cerebral artery occlusion-reperfusion in rats[J]. BMC Neurol, 2004, 4: 7.
[責任编辑 张燕]
