分布于西藏地区的鼠尾草属植物化学成分研究进展
2017-10-28符佳杨龙飞梁峻铭徐玲赵刚付强
符佳+杨龙飞+梁峻铭+徐玲+赵刚+付强
[摘要] 鼠尾草属Salvia是唇形科中最大的一属,全世界约有1 000余种。我国鼠尾草属植物资源丰富,分布于全国各地,尤以西南为最多。该属植物含有多种类型的化学成分,主要类型有倍半萜类、二萜类、三萜类和酚性类化合物等。为了更好的开发利用西藏地区鼠尾草属植物,该文将对分布于西藏地区鼠尾草属植物的化学成分进行综述。
[关键词] 西藏; 鼠尾草属; 化学成分
[Abstract] Salvia is the largest genus of Labiatae family, and there are more than 1 000 species around the world. Our country is rich in the resources of Salvia plants. The plants of this genus contain multiple chemical components, including sesquiterpenoids, diterpenoids, triterpenoids and phenols, et al. In order to develop better Tibetan plants of Salvia genus, this article reviewed and summarized the constituents from Tibetan Salvia genus.
[Key words] Tibet; Salvia; chemical constituents
唇形科鼠尾草属Salvia包括大约1 000余种植物,占全科植物总数的20%,广泛分布于全球各地温带、亚热带和热带地区。我国鼠尾草属植物有83种,25个变种,9个变型,可供药用的有30余种,多以根、根茎或全草入药[1]。我国现存最早的中药学著作《神农本草经》中就有对鼠尾草属植物丹参的药用记载。藏药著作《晶珠本草》和《藏药志》也收载了鼠尾草属植物甘西鼠尾草和黄花鼠尾草。该属植物药用价值巨大,各国学者开展了广泛的化学成分和药理活性研究,并发表了多篇综述报道[2-5]。随着国家对藏医药事业发展的支持力度不断增大,不少学者对分布于西藏地区的鼠尾草属植物资源情况和化学成分进行了调查和研究,但至今未见到相关研究成果的综述报道。为了更好的开发利用相关植物资源,本文对分布于西藏地区鼠尾草属植物的化学成分研究报道进行综述。
1 种属与分布
我国鼠尾草属植物有83种,25个变种,9个变型。主要分布于四川、山东、河北、河南、江苏、云南、安徽、山西、陕西、江西以及湖南等海拔120~4 500 m的山地丘陵地区。西藏地区鼠尾草属植物共12种[1,6],其中研究文献报道的有7种,包括:绒毛鼠尾草S. castanea Diels f. tomentosa Stib.、粘毛鼠尾草S. roborowskii Maxim、甘西鼠尾草S. przewalskii Maxim、栗色鼠尾草S. castanea Diels、三叶鼠尾草S.trijuga Diels、荔枝草S.plebeia R. Br.、黄鼠狼花S.tricuspis Franch.。
2 化学成分研究
分布于西藏地区鼠尾草属植物化学成分主要有倍半萜类,二萜类,三萜类和酚性类等,前人研究共分离鉴定了187个化合物,其中倍半萜类化合物34个,二萜类化合物79个,三萜类化合物20个,酚性类化合物49个,其他类化合物5个。
2.1 倍半萜类
鼠尾草属植物中倍半萜类化合物主要存在于挥发油和地上部分中,主要包括吉玛烷型和桉烷型。倍半萜类化合物有镇静作用,可缓解焦虑,改善由此引起的头痛或其他病痛;调节月经周期及缓解痛经;增加记忆力,治疗老年人记忆减退 [7],还能显著抑制革兰阳性菌和革兰阴性菌引起的感染,治疗胃肠气胀、消化不良、喉头炎、咽炎、牙龈炎、口腔炎、舌炎[8]等疾病。
2.1.1 吉玛烷型 吉玛烷型倍半萜是一类具有十元环体系的倍半萜。从西藏地区鼠尾草属植物中分离得到的吉玛烷型倍半萜化合物共19个。化合物名称见表1,化学结构见图1。
2.1.2 桉烷型 Dai 等[13-14]從荔枝草基生叶中分离得到了4个桉烷型倍半萜类化合物,分别命名为plebeiafuran(31)和plebeiolide A~C(32~34),并研究发现化合物plebeiafuran和plebeiolide C对脂多糖诱导的RAW264.7细胞一氧化氮(NO)生成具有一定的抑制作用。从西藏地区鼠尾草属植物中分离得到的桉烷型倍半萜化合物共13个。化合物名称见表2,化学结构见图2。
2.2 二萜类
鼠尾草属植物富含二萜类化合物,在萜类中占90%以上。二萜类化合物具有抗炎、抑菌、抗氧化、对癌细胞有显著细胞毒性等药理活性[17-21]。
2.2.1 松香烷型 从西藏地区分布的鼠尾草属植物中分离得到的二萜类化合物主要为松香烷型二萜,共分离得到60个,化合物名称见表3,化学结构见图3。
2.2.2 其他二萜 Garcia-Alvarez M等[48]从荔枝草中分离得到1个克罗烷型化合物epoxysalviacocin(95)。Xu等[49]从甘西鼠尾草中分离得到1个二萜二聚体化合物przewalskone(96),该化合物是由2个萜类单元通过hetero-Diels-Alder反应而形成。化合物名称见表4,化学结构见图4。
2.3 三萜类endprint
鼠尾草属植物中三萜类化合物主要有羽扇豆烷型、齐墩果烷型、乌苏烷型。其药理作用有抗菌、防腐及促进伤口愈合,对肿瘤细胞具有较好的抑制作用[53]等。
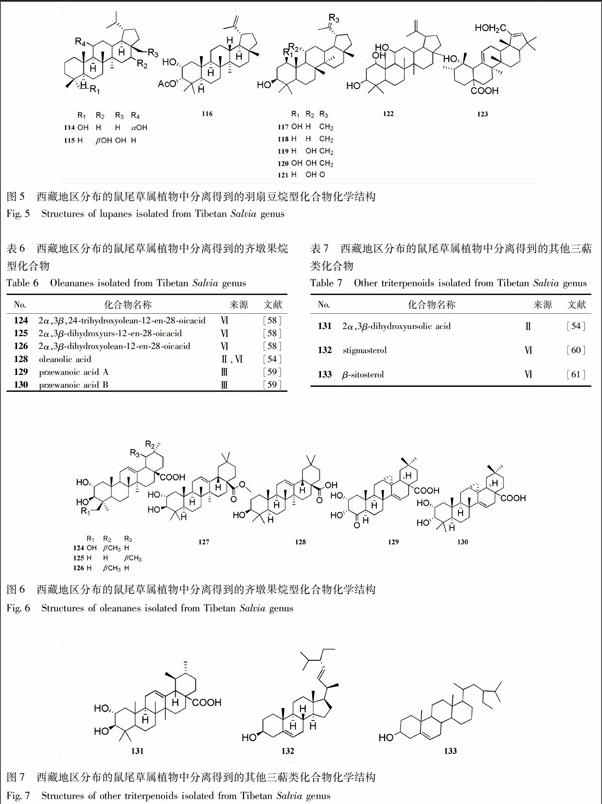
2.3.1 羽扇豆烷型 化合物名称见表5,化学结构见图5。
2.3.2 齐墩果烷型 从西藏地区分布的鼠尾草属植物中分离得到的齐墩果烷型化合物较少。化合物名称见表6,化学结构见图6。
2.3.3 其他三萜 化合物名称见表7,化学结构见图7。
2.4 酚性化合物
鼠尾草属植物中酚性化合物以黄酮类成分为主。该类化合物具有减轻缺血缺氧所致管血内皮损伤,促进血管内皮增生,改善缺血缺氧所致的心肌细胞损伤,抗动脉粥样硬化,抑制血小板聚集和抗血栓形成,抗炎、降血糖、抗脂质过氧化和清除自由基等作用[62-63]。
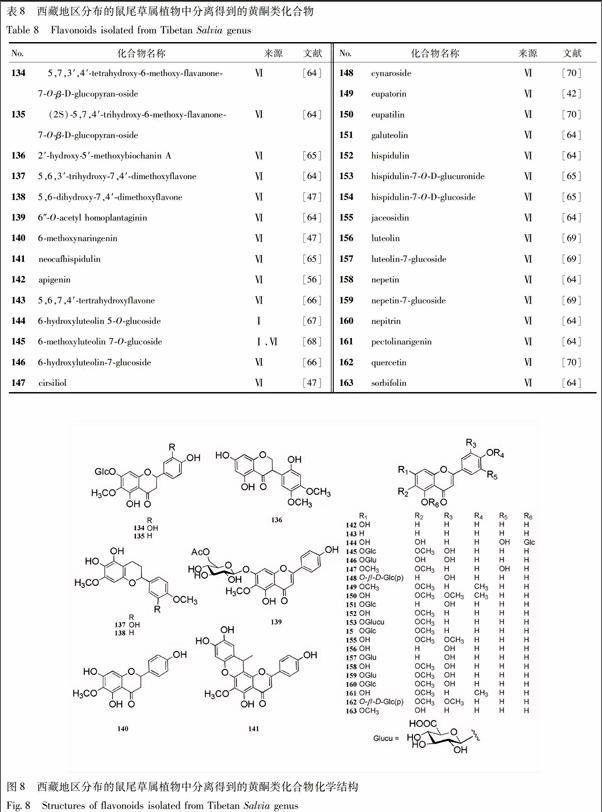
2.4.1 黄酮类 从西藏地区分布的鼠尾草属植物中分离得到的黄酮类化合物以黄酮衍生物为主,少量为异黄酮、二氢黄酮等成分。化合物名称见表8,化学结构见图8。
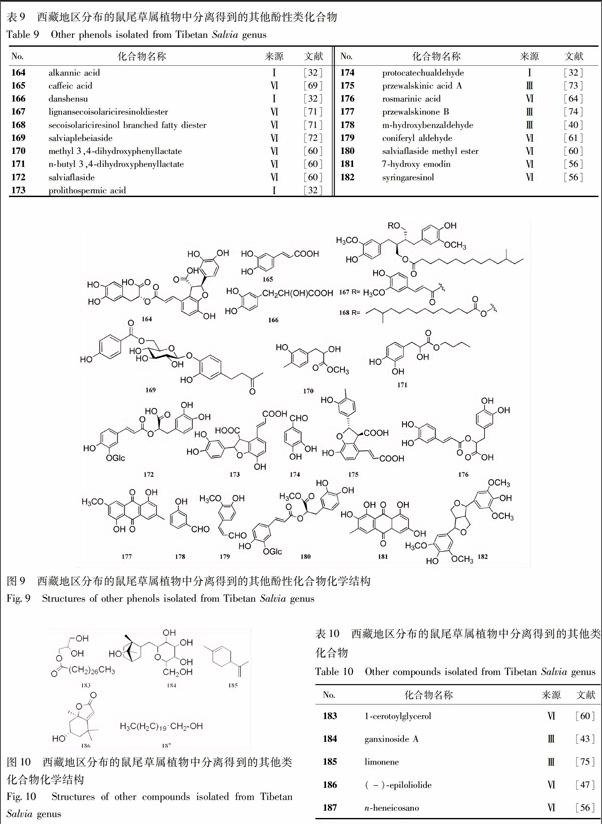
2.4.2 其他酚性类 西藏地区分布的鼠尾草属植物中的酚性化合物除黄酮类外,还有小分子酚酸、醛类等化合物,化合物名称见表9,化学结构见图9。
2.5 其他类
从西藏地区分布的鼠尾草属植物中分离得到了5个其他类型的化合物。化学名称见表10,化学结构见图10。
3 讨论
丹参是常用药材,除入载《中国药典》的鼠尾草属植物丹参被全国使用外,还有甘西鼠尾草等9种鼠尾草属植物被地方或民间常作“丹参”使用[76]。在西藏地区也有多种鼠尾草属植物被藏族人民作为药材使用,例如《藏药志》收载的甘西鼠尾草和黄花鼠尾草的干燥全草就作为藏药“吉子青保”,用于治疗黄疸性发烧、肝热等症[77]。广泛分布于西藏林芝地区的绒毛鼠尾草在藏医里用于心悸、心烦失眠、肝脾肿大等症的治疗[78]。然而受历史、地域、经济、文化等因素制约,还存在药材基源混乱、药效物质不清楚等问题,制约了西藏鼠尾草属植物的临床应用和开发。因此,整理归纳西藏地区鼠尾草属植物资源和药效物质研究成果尤为必要,对后续开发也具有重要意义。
近年来,绒毛鼠尾草就成为了西藏地区药材资源研究开发的新热點。绒毛鼠尾草是我国西藏特有的物种资源,集中生长分布在西藏林芝地区,且资源蕴藏量较大,估算在5 000 t以上[79]。有学者对绒毛鼠尾草中的活性成分进行定性和定量分析,发现绒毛鼠尾草和丹参所含有的次生代谢产物具有高度相似性,共发现了8个共有活性成分,包括丹参酮IIA和隐丹参酮等脂溶性二萜醌类,迷迭香酸和咖啡酸等水溶性酚酸类,且绒毛鼠尾草中隐丹参酮等二萜醌类含量显著高于丹参[80]。药理研究发现隐丹参酮及其同系物具有预防和延缓老年痴呆,减轻高血氨症及肝性脑病作用,为进一步开发绒毛鼠尾草提供了依据[81,82]。目前,绒毛鼠尾草已经被西藏自治区食品药品监督管理局收录到地方药材标准,并命名为“藏丹参”。更为重要的是已有相关单位开展绒毛鼠尾草的规范化种植技术研究,为藏丹参药材的持续开发奠定了基础[78]。
[参考文献]
[1] 中国科学院中国植物志编委会. 中国植物志. 66卷[M]. 北京: 科学出版社, 1977: 192.
[2] Wu Y B, Ni Z Y, Shi Q W, et al. Constituents from Salvia species and their biological activities[J]. Chem Rev, 2012, 112(11): 5967.
[3] 张宝宝, 聂诗琪, 梁敬钰, 等. 鼠尾草属植物的化学成分及药理活性研究进展[J]. 海峡药学, 2014, 26(11): 1.
[4] 彭勍, 刘建勋. 鼠尾草属植物化学成分及生物活性研究的新进展[J]. 中国中药杂志, 2015, 40(11): 2096.
[5] Jassbi A R, Zare S, Firuzi O, et al. Bioactive phytochemicals from shoots and roots of Salvia species[J]. Phytochemistry, 2016, 15: 289.
[6] 中国科学院青藏高原综合科学考察队. 西藏植物志. 4卷[M]. 北京: 科学出版社, 1983: 179.
[7] Hazn edaroglu M Z, Karab ay N U, Zeybek U. An tibacterial activity of Salvia tomentosa essential oil[J]. Fitoterapia, 2001, 72(7): 9.
[8] Hanes K R. Antidepres sant effects of the herb Salvia divinorum: a case report[J]. J Clin Psychopharmacol, 2001, 21(6): 634.
[9] Li Y, Wu Y Q, Du X, et al. Germacrane sesquiterpene Esters from Salvia roborowskii[J]. Planta Med, 2003, 69(8): 782.
[10] Liu Y, Li C, Shi J G, et al. Two new sesquiterpenes from Salvia roborowskii Maxim.[J]. Helv Chim Acta, 2009, 92(2): 335.endprint
[11] Xu G, Peng L Y, Li X L, et al. New sesquiterpenoids from Salvia castanea Diels f. tomentosa[J]. Helv Chim Acta, 2005, 88(8): 2370.
[12] Xu G, Peng L Y, Hou A J, et al. Isolation, structural elucidation, and chemical transformation of interconvertible 8,12-hemiketal germacranolide sesquiterpenoids from Salvia castanea Diels f. tomentosa Stib[J]. Tetrahedron, 2008, 64(40): 9490.
[13] Dai Y Q, Liu L, Xie G Y, et al. Four new eudesmane-type sesquiterpenes from the basal leaves of Salvia plebeia R. Br[J]. Fitoterapia, 2014, 94: 142.
[14] Jang H J, Oh H M, Hwang J T, et al. Eudesmane-type sesquiterpenoids from Salvia plebeia inhibit IL-6-induced STAT3 activation[J]. Phytochemistry, 2016, 130: 335.
[15] Xu G, Peng L Y, Shen X L, et al. Interconvertible eudesmanolides containing a 6,12-hemiketal function from Salvia castanea Diels f. tomentosa Stib[J]. Helv Chim Acta, 2010, 93(9): 1773.
[16] Cao S Y, Ke Z L, Xi L M. A new sesquiterpene lactone from Salvia plebeian[J]. J Asian Nat Prod Res, 2013, 15(4): 4047.
[17] Miura K, Kikuzaki H, Nakatani N. Antioxidant activity of chemical components from sage(Salvia officinalis L.) and thyme(Thymus vulgaris L.) measured by the oil stability index metbod[J]. J Agric Food Chem, 2002, 50(7): 1845.
[18] Chen X, Ding J, Ye Y M. et al. Bioactive abietane and secoabietane dierpenoids from Salvia prionitis[J]. J Nat Prod, 2002, 65(7): 1016.
[19] Chang J, Xu J, Li M. et al. Novel cytotoxie secoabietane rearranged diterpenoids from Salvia prionitis[J]. Planta Med, 2005, 71(9): 861.
[20] 王潮臨. 丹参对外周血中性粒细胞和单核细胞的调整作用[J]. 广西医科大学学报, 1997, 14(3): 9.
[21] 薛明, 汉卿, 史彦斌, 等. 鼠尾草二萜醌及其衍生物的抗菌构效关系研究[J]. 中国农业科学, 2000, 33(3): 88.
[22] Jiang H L, Wang X Z, Xiao J, et al. New abietane diterpenoids from the roots of Salvia przewalskii[J]. Tetrahedron, 2013, 69(32): 6687.
[23] Don M J, Shen C C, Syu W J, et al. Cytotoxic and aromatic constituents from Salvia miltiorrhiza[J]. Phytochemistry, 2006, 67(5): 497.
[24] Ikeshiro Y, Hashimoto I, Iwamoto Y, et al. Diterpenoids from Salvia miltiorrhiza[J]. Phytochemistry, 1991, 30(8): 2791.
[25] 杨立新, 李杏翠, 刘超, 等. 甘西鼠尾草中化学成分研究[J]. 药学学报, 2011, 46(7): 818.
[26] M G AI-Hazimi H, A Miana G, M S H Deep. Terpenoids from Salvia lanigera[J]. Phytochemistry, 1987, 26(4): 1091.
[27] Xu G, Peng L Y, Zhao Y, et al. Two new icetexane diterpenoids from Salvia przewalskii[J]. Chem Pharm Bull, 2005, 53(12): 1575.endprint
[28] Zhang B B, He B Q, Sun J B, et al. Diterpenoids from Saliva plebeia R. Br. and their antioxidant and anti-inflammatory activities[J]. Molecules, 2015, 20(8): 14879.
[29] Ulubelen A, Miski M, Mabry T J. A new diterpene acid from Salvia tomentosa[J]. J Nat Prod, 1981, 44(1): 119.
[30] Pan Z H, Li Y, Wu X D, et al. Norditerpenoids from Salvia castanea Diels f. pubescens[J]. Fitoterapia, 2012, 83(6): 1072.
[31] Pan Z H, Wang Y Y, Li M M, et al. Terpenoids from Salviatrijuga[J]. J Nat Prod, 2010, 73(6): 1146.
[32] 曲貴武, 岳喜典, 安凤山, 等. 绒毛鼠尾草化学成分的研究[J]. 中国中药杂志, 2012, 37(13): 1985.
[33] 王洪庆, 杨立新, 陈晓燕, 等. 甘西鼠尾草根化学成分研究[J]. 中药材, 2015, 38(6): 1197.
[34] Lin F W, G.Damu A, Wu T S. New abietane diterpene alkaloids possessing an oxazole ring from Salvia trijuga[J]. Heterocycles, 2006, 68(1): 159.
[35] Pan Z H, Cheng J T, He J, et al. Splendidins A-C, three new clerodane diterpenoids from Salvia splendens[J]. Helv Chim Acta, 2011, 94(3): 417.
[36] Pan Z H, He J, Li Y, et al. Castanolide and epi-castanolide, two novel diterpenoids with a unique seco-norabietane skeleton from Salvia castanea Diels f. pubescens Stib.[J]. Tetrahedron Lett, 2010, 51(38): 5083.
[37] Xu G, Peng L Y, Tu L, et al. Three new diterpenoids from Salvia przewalskii Maxim[J]. Helv Chim Acta, 2009, 92(2): 409.
[38] Xu G, Hou A J, Wang R R, et al. Przewalskin A: a new C23 terpenoid with a 6/6/7 carbon ring skeleton from Salvia przewalskii Maxim[J]. Org Lett, 2006, 8(20): 4453.
[39] Kawazoe K, Yamamoto M, Takaishi Y, et al. Rearranged abietane-type diterpenes from Salvia dichroantha[J]. Phytochemistry, 1999, 50(3): 493.
[40] 朱路平, 向城, 庄文婷, 等. 甘西鼠尾草化学成分研究[J]. 天然产物研究与开发, 2013, 25: 785.
[41] Nagy G, Günther G, Máthé I, et al. Diterpenoids from Salvia glutinosa, S. austriaca, S. tomentosa and S. verticillata roots[J]. Phytochemstry, 1999, 52(6): 1105.
[42] Gu L W, Weng X C. Antioxidant activity and components of Salvia plebeia R.Br. — a Chinese herb[J]. Food Chem, 2001, 73(3): 299.
[43] 杨阳, 吴志军, 杨颖博, 等. 甘西鼠尾草中三个新的萜类化合物[J]. 高等学校化学学报, 2011, 32(6): 1318.
[44] Xue Y, Wu Y, Zhu H, et al. Salviprzols A and B, C21- and C22-terpenoids from the roots of Salvia przewalskii Maxim[J]. Fitoterapia, 2014, 99: 204.
[45] Ohsaki A, Kawamata S, Ozawa M, et al. Salviskinone A, a diterpene with a new skeleton from Salvia przewalskii[J]. Tetrahedron Lett, 2011, 52: 1375.
[46] Lu X Z, Luo H W, Niwa M. Trijuganone A and B: two new phenanthrenequinones from roots of Salvia trijuga[J]. Planta Med, 1990, 56(1): 87.endprint
[47] 亢文佳, 富艳彬, 李达翃, 等. 荔枝草的化学成分研究[J]. 中草药, 2015, 46(11): 1589.
[48] Garcia-Alvarez M, Hasan M, Michavila A, et al. Epoxysalviacoccina, neo-clerodane diterpenoid from Salvia plebeian[J]. Phytochemistry, 1985, 25(1): 272.
[49] Xu G, Yang X W, Wu C Y, et al. Przewalskone: a cytotoxic adduct of a danshenol type terpenoid and an icetexane diterpenoid via hetero-Diels-Alder reaction from Salvia przewalskii[J]. Chem Commun, 2012, 48:4438.
[50] Pan Z H, He J, Li Y, et al. Castanolide and epi-castanolide, two novel diterpenoids with a uniqueseconorabietane skeleton from Salvia castanea Diels f. pubescens Stib[J]. Tetrahedron Lett, 2010, 51(38): 5083.
[51] Xu G, Hou A J, Zheng Y T, et al. Przewalskin B, a novel diterpenoid with an unprecedented skeleton from Salvia przewalskii Maxim[J]. Org Lett, 2007, 9(2): 291.
[52] Zheng H B, Zhang T, Row K H, et al. Tricuspone, a rearranged diterpenoid from Salvia tricuspis[J]. Bull Korean Chem Soc, 2012, 33(4): 1360.
[53] Farimania M M, Moghaddamb F M, Esmaeili M A, et al. A lupane triterpenoid and other constituents of Salvia eremophila[J]. Nat Prod Res, 2012, 26(21): 2045.
[54] 劉勇, 宋雷, 把文娟, 等. 粘毛鼠尾草三萜类化学成分的研究[J]. 华西药学杂志, 2014, 9(6): 642.
[55] Jiang T F, Lv Z H, Wang Y H, et al. On-line concentration by field-enhanced sample injection with reverse migrating micelles in micellar electrokinetic capillary chromatography for the analysis of triterpenoids from traditional Chinese medicine[J]. Anal Chem, 2010, 65(9): 945.
[56] 刘慧清, 王国凯, 林彬彬, 等. 荔枝草全草乙醇提取物的化学成分分析[J]. 植物资源与环境学报, 2013, 22(2): 111.
[57] 鲁学照, 罗厚蔚. 三叶鼠尾草的化学研究[J]. 中国中药杂志, 1996, 21(7): 424.
[58] 孙启文, 吴松, 柳航, 等. 荔枝草的化学成分及药理作用研究新进展[J]. 中国药师, 2014, 17(3): 481.
[59] Wang N, Niwa M, Luo H W. Triterpenoids from Salvia przewalskii[J]. Phytochemistry, 1988, 27(1): 299.
[60] 刘丽, 戴轶群, 谢国勇, 等. 荔枝草根的化学成分研究[J]. 中国药学杂志, 2014, 49(16): 1393.
[61] Weng X C, Wang W. Antioxidant activity of compounds isolated from Salvia plebeian[J]. Food Chem, 2000, 71(4): 489.
[62] Moharrama F A, Marzouk M S, El-Shenawy S M, et al. Polyphe-nolic profile and biological activity of Salvia splendens leaves[J]. J Pharm Pharmacol, 2012, 64: 1678.
[63] 李佑生, 马字澄, 王文健. 丹酚酸的心血管系统药理作用研究进展[J]. 中西医结合心脑血管病杂志, 2006, 4(9): 791.
[64] Jin M R, Xu H, Duan C H, et al. Two new flavones from Salvia plebeian [J]. Nat Prod Res, 2015, 29(14): 1315.
[65] Weng X, Wang W. Antioxidant activity of compounds isolated from Salvia plebeian[J]. Food Chem, 2000, 71(4): 489.endprint
[66] Ren D B, Qin Y H, Yun Y H, et al. Separation of nine compounds from Salvia plebeia R.Br. using two-step high-speed counter-current chromatography with different elution modes[J]. J Sep Sci, 2014, 37(16): 2118.
[67] Ulubelen A, Miski M, Mabry T J. Further flavones and triterpenes and the new 6-hydroxyluteolin 5-β-D-glucoside from Salvia tomentosa[J]. J Nat Prod, 1981, 44(5): 586.
[68] Ulubelen A, Miski M, Neuman P, et al. Flavonoids of Salvia tomentosa(Labiatae)[J]. J Nat Prod, 1979, 42(3): 261.
[69] Jin X F, Lu Y H, Wei D Z, et al. Chemical fingerprint and quantitative analysis of Salvia plebeia R.Br. by high-performance liquid chromatography[J]. J Pharm Biomed Anal, 2008, 48(1): 100.
[70] Nugroho A, Kim M Y, Choi J, et al. In vivo sedative and gastroprotective activities of Salvia plebeian extract and its composition of polyphenols[J]. Arch Pharm Res Vol, 2012, 35(8): 1403.
[71] Plattner R D, Powell R G. A secoisolariciresinol branched fatty diester from Salvia plebeia seed[J]. Phytochemistry, 1978, 17(1): 149.
[72] Wu Y B, Ni Z Y, Shi Q W, et al. Constituents from Salvia species and their biological activities[J]. Chem Rev, 2012, 112(11): 5967.
[73] Liu C Y, Jin Y H, Yu H S, et al. Preparation of przewalskinic acid A from salvianolic acid B using a crude enzyme from an Aspergillus oryzae strain [J]. J Ind Microbiol Biotechnol, 2014, 41: 887.
[74] Lu X Z, Xu W H, Naoki H. Anthraquinones from Salvia przewalskii[J]. Phytochemistry, 1992, 31(2): 708.
[75] Li B, Zhang C L, Peng L, et al. Comparison of essential oil composition and phenolic acid content ofselected Salvia species measured by GC-MS and HPLC methods[J]. Ind Crop Prod, 2015, 69: 329.
[76] 白楠. 川滇產多种鼠尾草数属植物质量品质评价研究[D]. 成都: 四川大学, 2007.
[77] 中国科学院西北高原生物研究所. 藏药志[M]. 西宁: 青海人民出版社, 1991: 93.
[78] 蔡丽萍, 吴翠玲, 伍广甜. 西藏地区“林芝丹参”的研究进展[J]. 广东药学院学报, 2007, 23(3): 352.
[79] 叶华谷, 廖文波, 李辉, 等. “林芝丹参”资源调查[J]. 中药材, 2004, 27(11): 809.
[80] Yang D F, Ma P D, Liang X, et al. Metabolic profiles and cDNA-AFLP analysis of Salvia miltiorrhiza and Salvia castanea Diel f. tomentosa Stib[J]. PLoS ONE, 2012, 7(1): 1.
[81] 古练权, 卜宪章, 马林. 用于治疗高血氨症及肝性脑病的含二氢呋喃环结构的丹参酮类化合物:中国,1210025C [P]. 2005-07-13.
[82] 古练权, 卜宪章, 李贵华, 等. 用于预防和延缓早期老年痴呆症的隐丹参酮:中国,1210024C[P]. 2005-07-13.
[责任编辑 丁广治]endprint
