甘草色泽与有效成分含量的相关性研究
2017-10-28马婷婷龚慕辛王智民贺蕊吴莎张村李静李朝霞陆允许永崧
马婷婷+龚慕辛+王智民+贺蕊+吴莎+张村+李静+李朝霞+陆允+许永崧
[摘要] 为探讨甘草色泽与其质量评价的相关性,该研究以精密色差仪和视觉分析仪测定甘草根皮和断面颜色,以HPLC测定甘草药材中6种黄酮类和2种皂苷类成分的含量,采用偏最小二乘回归法对两类数据进行相关分析。结果发现,野生和栽培甘草根皮颜色不存在显著差异,断面颜色存在显著或极显著差异(P<0.05,P<0.01);野生甘草的甘草苷、异甘草苷、异甘草素含量与甘草酸铵、甘草次酸含量显著或极显著高于栽培甘草;相关性结果表明,甘草根皮和断面的颜色均与有效成分含量具有显著或极显著相关性。该研究为传统以甘草色泽评价其质量提供了科学依据,为完善中药材质量评价体系提供新的参考。
[关键词] 甘草; 色泽; 含量测定; 相关性分析
[Abstract] To explore the correlation between color of Glycyrrhiza uralensis and its quality evaluation,the colors of root bark and transverse section were determined by Precision Color Reader and Visual Analyzer,and the contents of six flavonoids and two saponins in G.uralensis were determined by high performance liquid chromatography(HPLC).The partial least squares regression(PLSR)method was employed to correlate the colors with component contents in G.uralensis. The results showed that there were no significant differences in the colors of root bark but significant or very significant differences(P<0.05,P<0.01)in the colors of transverse section between the wild and cultivated G. uralensis. Compared with those in the cultivated G. uralensis, the contents of liquiritin, isoliquiritin isoliquiritigenin and the contents of ammonium glycyrrhizinate, glycyrrhetinic acid were obviously significant or remarkably significant in the wild G. uralensis.The correlation results showed that there was a significant or very significant correlation between the colors and the effective component contents. This study provides a scientific basis to evaluate the quality of G.uralensis by color and a new reference for the traditional evaluation methods for Chinese drugs.
[Key words] Glycyrrhiza uralensis; color; determination; correlation analysis
甘草為豆科植物甘草Glycyrrhiza uralensis Fisch.、胀果甘草G. inflate Bat.或光果甘草G. glabra L.的干燥根和根茎。主产于新疆、内蒙古、甘肃、宁夏等省区,是临床常用的大宗药材。由于掠夺性采挖,甘草野生资源遭到了严重的破坏,栽培甘草目前已经成为甘草药材商品的主要来源[1]。在中药材出口流通领域普遍认为栽培甘草质量不及野生甘草[2]。实际工作中,甘草质量常采用外观评价,以外皮细紧、色红棕、质坚实、体重、断面黄白、粉性足、味甜者为佳[3]。其中,根皮和断面颜色是品质评价最直观的指标。然而,色泽的经验鉴别依赖于人的主观感受,缺乏客观量化指标,传承和应用均存在困难。本文以主产地的野生和栽培乌拉尔甘草为研究对象,采用精密色差仪和视觉分析仪对甘草根皮和断面颜色进行客观的量化分析,采用HPLC对甘草中8种有效成分进行定量分析,将两部分数据采用偏最小二乘回归法进行相关分析,并对相关结果进行比较与验证,探究色泽与有效成分含量的相关性,阐释传统色泽鉴别作为甘草质量评价标准的科学内涵。
1 材料
HP-C220型精密色差仪[汉谱(上海)光电科技有限公司];VA400型IRIS视觉分析仪[ 阿默思(上海)仪器贸易有限公司];Agilent 1100型高效液相色谱仪(四元梯度泵、自动进样器、柱温箱和二极管阵列检测器,Agilent科技有限公司);EYELAN-1100旋转蒸发仪(上海爱朗仪器有限公司);HHS电热恒温水浴锅(上海博讯实业有限公司医疗设备厂出品);VO 400真空干燥箱(德国memmert);DV215CD型电子分析天平(OHAUS CORPORATION,USA);KQ-500E型超声波清洗器(昆山市超声仪器有限公司);电加热套(上海一科仪器有限公司)。
无水乙醇(分析纯)、磷酸(分析纯)购自北京化工厂;乙腈(色谱纯)购自Fisher公司;娃哈哈纯净水。
甘草药材经首都医科大学中医药学院刘长利副教授鉴定均为豆科植物甘草G. uralensis的干燥根及根茎。样品的收集范围覆盖了甘草主产区,共25批样品,详细信息见表1。甘草酸铵(批号110731-201418),甘草次酸(批号110723-201514),甘草苷(批号15082811),甘草素(批号150922),异甘草苷(批号150922),异甘草素(批号150922),甘草查尔酮A(批号150922),光甘草定(批号150922),甘草酸铵和甘草次酸对照品购自中国食品药品检定研究院,其余对照品购自北京世纪奥科生物技术有限公司,对照品经氢谱鉴定结构,同时经210,254,276,360 nm波长下的面积归一化法测定,纯度均大于95%。
2 方法
2.1 颜色测定
2.1.1 精密色差仪
精密色差仪是一种基于CIELAB均匀色空间进行颜色测量的仪器。CIELAB均匀色空间是当前最通用的测量物体颜色的色空间。CIELAB均匀色空间用明度指数L*,色品指数a*,b*三维坐标来表示[4]。L*是明度,0为黑色,100为白色,ΔL*=L*野生-L*栽培,正值表示偏浅,负值表示偏深;a*是红绿轴,+a*表示红色,-a*表示绿色,Δa*=a*野生-a*栽培,正值表示偏红,负值表示偏綠;b*是黄蓝轴,+b*表示黄色,-b*表示蓝色,Δb*=b*野生-b*栽培,正值表示偏黄,负值表示偏蓝。采用精密色差仪测定25批甘草根皮和断面颜色,并计算总色值E*ab,E*ab=[(L*)2+(a*)2+(b*)2]1/2,用来表征野生和栽培甘草的颜色差异。精密色差仪经过标准白板、标准黑腔校正后,每个样品重复测定3次,取平均值。采用SPSS 19.0软件中的两独立样本t检验比较野生和栽培甘草根皮和断面颜色的差异,结果见图1。
2.1.2 视觉分析仪
视觉分析仪是一种采用机器视觉技术将采集得到的中药图像通过RGB色空间来表示的一种测色仪器。该测色仪为图像中每一个像素的RGB分量分配一个8~248的强度值,将红、绿、蓝3个颜色通道以不同强度相互叠加得到多种多样的颜色,并把每一种叠加得到的颜色定义一个色号。各分量的强度值越小,明度越低,强度值越大,明度越高。例如,色号0,R,G,B均为8,颜色为黑色;色号4095,R,G,B均为248,颜色为白色。采用视觉分析仪测定25批甘草根皮和21批甘草断面颜色(有4批甘草饮片较小,视觉分析仪未给出数据),每个样品重复测定3次,取平均值,并对每种样品能检测出的所有色号进行整理,选取能在70%的样品中检测到的色号。甘草根皮筛选出的色号有2422(light brown),2438(light olive brown),2439(grayish yellowish brown),2694(light brown),2695(light reddish brown)和2711(light olive brown);甘草断面筛选出的色号有3784(moderate yellow),3785(pale orange yellow),3801(pale yellow),3802(pale yellow),4057(light yellow),4058(pale orange yellow),4074(pale yellow)和4075(pale yellow),记录这些色号在甘草根皮和断面颜色中所占比例。采用SPSS 19.0软件中的两独立样本非参数检验(Mann-Whitney U秩和检验)比较野生和栽培甘草根皮和断面颜色的差异,见图2。
2.2 含量测定
2.2.1 测定成分的选择
甘草益气补中,扶正固本作用主要与现代药理学研究发现的对消化系统、免疫系统的作用以及抗病毒、抗肿瘤作用有关[5]。这些药理作用的物质基础主要集中于皂苷类化合物甘草酸、甘草次酸以及黄酮类化合物甘草苷、异甘草苷、甘草素、异甘草素、甘草查尔酮A、光甘草定[6-15]等。因此,选择这8种有效成分评价甘草药材质量。
2.2.2 色谱条件
Kromasil C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A)-0.05%磷酸水(B);梯度洗脱0~13 min,17%~18% A;13~15 min,18%~26% A;15~23 min,26%~27% A;23~85 min,27%~70% A。流速为1 mL·min-1;检测波长,时间序列采样0~16 min在276 nm检测甘草苷,16~25 min在360 nm检测异甘草苷,25~57 min在250 nm检测甘草素、异甘草素和甘草酸铵,57~85 min在276 nm检测甘草查尔酮A、光甘草定和甘草次酸;柱温30 ℃;进样量20 μL。
2.2.3 对照品溶液的制备
精密称取甘草苷、异甘草苷、甘草素、异甘草素、甘草酸铵、甘草查尔酮A、光甘草定、甘草次酸8种对照品,用70%乙醇溶解制成含相对应对照品质量浓度为0.400,0.160,0.080 0,0.040,2.00,0.400,0.160,0.100 g·L-1的储备液;取适量各成分储备液,加70%乙醇稀释定容,配制成混合对照品溶液,用70%乙醇稀释成6份不同浓度的混标工作液。
2.2.4 甘草浸膏粉的制备
每种甘草粉碎成粗粉,称取3份,记录每份重量,分别加入10倍量70%乙醇回流1 h,过滤收集滤液;滤渣再分别加入8倍量70%乙醇回流1 h,合并2次滤液,减压浓缩后,水浴蒸发得浸膏,移至真空干燥箱中干燥成浸膏粉,称重,计算出膏率。
2.2.5 供试品溶液的制备
取甘草浸膏粉约50.00 mg,精密称定,加入70%乙醇定容至10 mL量瓶中,复溶,摇匀,0.45 μm微孔滤膜滤过,滤液作为供试品溶液。
2.2.6 测定方法学考察
2.2.6.1 标准曲线及检测限、定量限 取2.2.3项不同浓度的混合对照品溶液及对照品初始混合溶液按2.2.2项色谱条件测定,以峰面积(Y)对质量浓度(X)进行线性回归,按信噪比(S/N)分别约为 3 和 10 时的相应浓度作为检测限(LOD)和定量限(LOQ),见表2,结果表明,在测定范围内各成分线性良好(除甘草苷外的其他成分在样品中含量较低,若使混标溶液中甘草酸铵线性范围的最低点接近定量限,那么其他成分的浓度会在定量限以下,故本文甘草酸铵线性范围的最低点未接近定量限)。
2.2.6.2 精密度试验 取混合对照品溶液,按2.2.2项色谱条件重复测定6次,记录峰面积,计算6次峰面积的相对标准偏差(RSD),结果显示,甘草苷、异甘草苷、甘草素、异甘草素、甘草酸铵、甘草查尔酮A、光甘草定、甘草次酸8种对照品RSD均小于3.0%,表明仪器精密度良好。
2.2.6.3 重复性试验 取W-G2号和C-X2号混合浸膏粉6份,按照2.2.5项方法制备供试品溶液,按2.2.2项色谱条件分别测定,结果显示,各成分含量的RSD均小于3.0%,表明该方法重复性良好。
2.2.6.4 稳定性试验 取W-G2号和C-X2號混合供试品溶液,分别于0,3,6,9,12 h按2.2.2项色谱条件测定,结果显示,各成分峰面积的RSD值均小于3.5%,表明供试品溶液在 12 h 内稳定。
2.2.6.5 加样回收率试验 取已知含量的W-G2号和C-X2号混合浸膏粉6份,每份约25.00 mg,精密称取,分别加入一定浓度的混合对照品溶液5 mL(甘草苷,异甘草苷,甘草素,异甘草素,甘草酸铵,甘草查尔酮A,光甘草定,甘草次酸的质量浓度分别为0.276,0.046,0.006,0.006,0.470,0.008,0.004,0.004 g·L-1),按2.2.5项方法制备供试品溶液,按2.2.2项色谱条件测定,计算各成分回收率,结果显示,各成分的平均回收率在93.21%~104.9%,RSD均小于5.3%,符合分析要求,见表3。
2.2.7 含量测定
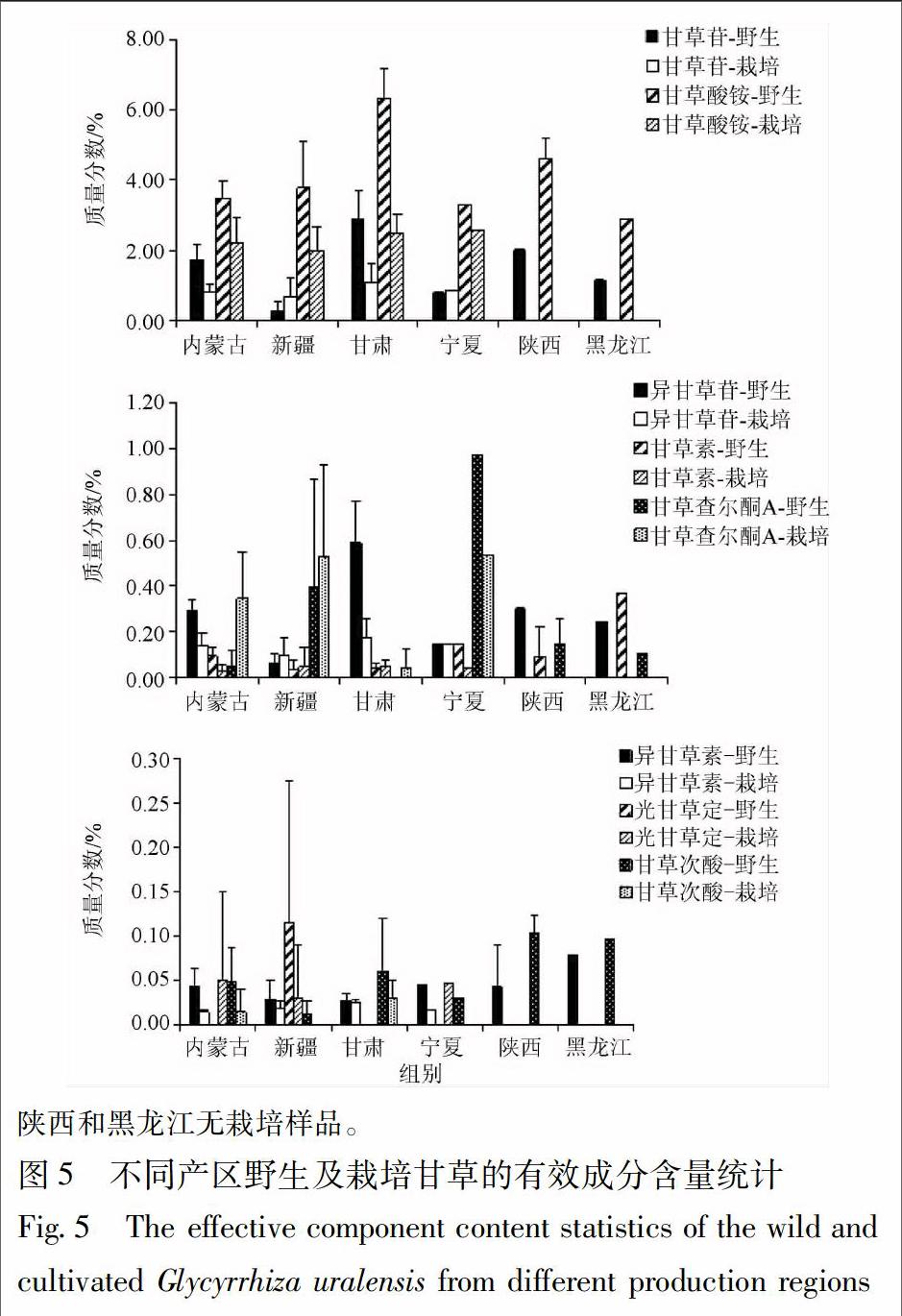
将制备的供试品溶液,按2.2.2项色谱条件测定,色谱图见图3,根据线性回归方程计算甘草药材中8种有效成分的含量。采用SPSS 19.0软件中的两独立样本t检验比较野生和栽培甘草中有效成分的含量,见图4;统计不同产区野生和栽培甘草中各有效成分的含量,见图5。
2.3 色泽与有效成分含量的相关性分析
偏最小二乘回归法是一种多元统计分析方法。
当自变量较多且自变量间存在着多重共线性(一些自变量或全部自变量之间有近似线性关系)时,会使求得的回归系数不稳定且难于解释。偏最小二乘回归法可利用对系统中的数据进行分解和筛选的方式,提取对因变量解释性最强的综合变量,剔除多重相关信息和无解释意义的信息,从而克服了变量多重共线性在系统建模中的不良作用[16]。本试验采用minitab 17.1软件中的偏最小二乘回归法进行甘草根皮和断面颜色与8种有效成分含量的相关性分析,依次选择【统计】→【回归】→【偏最小二乘】,以表征颜色的各指标作为响应(因变量),以8种有效成分作为模型(自变量),点击【选项】,选择【逐一剔除法】交叉验证,点击【确定】后软件自动进行回归分析。根据得到的相关系数,评价8种有效成分与整体颜色的相关性。
2.3.1 相关性研究
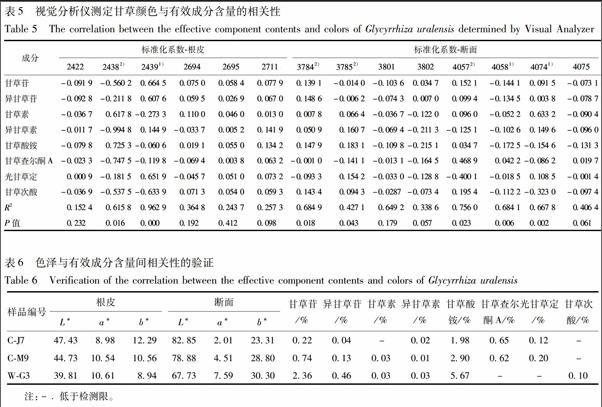
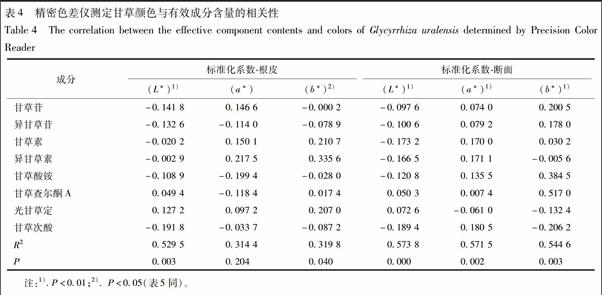
将精密色差仪测定的外观颜色指标L*,a*,b*及视觉分析仪测定后筛选出的色号与甘草中甘草苷、异甘草苷、甘草素、异甘草素、甘草酸铵、甘草查尔酮A、光甘草定和甘草次酸含量进行相关性分析,结果见表4,5。
2.3.2 相关性验证
另取3种样品编号为C-J7,C-M9,W-G3的甘草按2.1.1项方法对甘草根皮和断面颜色进行测量并对成分含量高低进行预测;按2.2.4,2.2.5项方法制备供试品溶液,按2.2.2项色谱条件测定,计算甘草药材中8种有效成分的含量,结果见表6。
3 结果与讨论
3.1 颜色测定
由图1可知,野生与栽培甘草根皮L*,a*,b* 和E*ab 无差异,表明野生和栽培甘草根皮颜色无明显区别。野生与栽培甘草断面E*ab值存在差异(P<0.05),表明两者的断面颜色有区别。其中,野生甘草L*值小于栽培甘草(P<0.01)、b*值大于栽培甘草(P<0.05),综合这2个颜色参数表明野生甘草的断面颜色更黄。
由图2可知,野生与栽培甘草根皮的2439,2694 2个色号的差异具有一定趋势(P<0.1),其他色号无差异。但这2个色号所占比例在野生与栽培甘草中的大小趋势相反,这可能是导致色差仪测定的野生与栽培甘草根皮颜色没有区别的原因。野生甘草断面色号3784(moderate yellow,R232+G200+B136)所占的比例大于栽培甘草(P<0.05),差异具统计学意义;3785(R232+G200+B152)所占的比例有大于栽培甘草的趋势,但差异无统计学意义(P<0.1),其他色号无差异。野生甘草断面色号4075(pale yellow,R248+G232+B184)所占的比例小于栽培甘草(P<0.05),差异具有统计学意义;4058(R248+G216+B168),4074(R248+G232+B168)所占的比例有小于栽培甘草的趋势,但差异无统计学意义。根据色号的RGB值可知,4075,4058,4074 3个色号明度高于3784,3785 2个色号。综合2组色号的结果表明野生甘草的断面颜色更黄,与精密色差仪测定结果一致,并筛选出了存在差异的色号。
3.2 含量测定
由图4可知,野生甘草中甘草苷、异甘草苷、异甘草素含量显著高于栽培甘草(P<0.05),甘草酸铵、甘草次酸含量极显著高于栽培甘草(P<0.01)。由图5可知,光甘草定在内蒙古、新疆和宁夏甘草中检测出,在内蒙古和宁夏样品中仅存在于栽培甘草中,在新疆野生和栽培甘草中都检测出,分析可能这3个产地的栽培甘草存在杂交现象,在甘肃采集的样本中未检出光甘草定。野生甘草中,甘肃甘草苷,甘草酸铵,异甘草苷含量较高,新疆甘草苷,异甘草苷,甘草次酸含量较低;栽培甘草中,甘肃甘草苷,异甘草苷,甘草次酸含量较高,新疆甘草苷,异甘草苷含量较低。
3.3 色泽与有效成分含量的相关性分析
3.3.1 精密色差仪与化学测定结果相关性
甘草根皮颜色L*值与有效成分含量具有极显著相关性(P<0.01),与光甘草定、甘草查尔酮A含量呈正相关,与甘草次酸、甘草苷、异甘草苷、甘草酸铵、甘草素、异甘草素含量呈负相关,见表4。根皮的a*与有效成分含量的相关性不具有统计意义。根皮的b*与有效成分含量具有显著相关性(P<0.05),与异甘草素、甘草素、光甘草定、甘草查尔酮A含量呈正相关,与甘草次酸、异甘草苷、甘草酸铵、甘草苷含量呈负相关,表明根皮颜色越黄,甘草次酸、异甘草苷、甘草酸铵、甘草苷含量越低。综合根皮L*,a*与有效成分的相关性结果认为,甘草根皮红色越深,甘草次酸、甘草苷、异甘草苷、甘草酸铵、甘草素、异甘草素含量越高。
甘草断面颜色L*,a*,b*与有效成分含量具有极顯著相关性(P<0.01)。其中,断面L*与光甘草定、甘草查尔酮A含量呈正相关,与甘草次酸、甘草素、异甘草素、甘草酸铵、异甘草苷、甘草苷含量呈负相关;断面b*与甘草查尔酮A、甘草酸铵、甘草苷、异甘草苷、甘草素含量呈正相关,与甘草次酸、光甘草定、异甘草素含量呈负相关。综合断面L*值,b*值与有效成分的相关性结果表明,甘草断面越黄,则甘草酸铵、甘草查尔酮A、甘草苷、异甘草苷、甘草素的含量越高。
3.3.2 视觉分析仪与化学测定结果相关性
甘草根皮颜色2438,2439 2个色号与有效成分含量具有显著相关性(P<0.05)。其中,2438与甘草酸铵、甘草素含量呈正相关,与异甘草素、甘草查尔酮A、甘草苷、甘草次酸、异甘草苷、光甘草定含量呈负相关;2439与甘草苷、光甘草定、异甘草苷、异甘草素含量呈正相关,与甘草次酸、甘草素、甘草查尔酮A、甘草酸铵的含量呈负相关;其他色号与有效成分含量的相关性不具有统计意义。上述结果表明,与2438,2439 2个色号相关的多数成分,其正负相关性相反,这可能是导致精密色差仪测定的甘草根皮a*值与有效成分含量的相关性不显著的原因,见表5。
甘草断面颜色3784,3785,4057,4058,4074共5个色号与有效成分含量具有显著相关性(P<0.05)。其中,3784与异甘草苷、甘草酸铵、甘草次酸、甘草苷、异甘草素、甘草素含量呈正相关,与光甘草定、甘草查尔酮A含量呈负相关;3785与甘草酸铵、异甘草素、光甘草定、甘草次酸、甘草素含量呈正相关,与甘草查尔酮A、甘草苷、异甘草苷含量呈负相关;4057与甘草查尔酮A、甘草次酸、甘草苷、异甘草苷、甘草素、甘草酸铵含量呈正相关,与光甘草定、异甘草素含量呈负相关;4058与甘草查尔酮A含量呈正相关,与甘草酸铵、甘草苷、异甘草苷、甘草次酸、异甘草素、甘草素、光甘草定含量呈负相关;4074与甘草素、异甘草素、光甘草定、甘草苷、异甘草苷含量呈正相关,与甘草次酸、甘草酸铵、甘草查尔酮A含量呈负相关。
3784,3785属于中黄色色号,4058,4074属于浅黄色色号,结合正负相关性及标准化系数大小可看出,中黄色色号主要与甘草酸铵、甘草苷、异甘草苷含量呈显著正相关,而淡黄色色号整体与这3种有效成分呈显著负相关。甘草断面越黄,则中黄色色号所占比例越大,淡黄色色号所占比例越小,即可推测出甘草酸铵、甘草苷、异甘草苷含量越高,与精密色差仪测定断面颜色与有效成分的相关性结论相符,并筛选出了与有效成分含量具有相关性的色号。
3.3.3 相关性验证
由表6可知,根皮L*越小,甘草苷、异甘草苷、甘草酸铵含量越高,甘草素、异甘草素、甘草次酸含量有升高趋势;根皮b*越小,甘草苷、异甘草苷、甘草酸铵含量越高,与上述结论一致。断面L*值越小、b*值越大(断面越黄),甘草苷、异甘草苷、甘草酸铵越高,其它成分趋势不明显,与上述结论可吻合。本研究的结论可作为评价甘草质量的参考。
4 结论
传统经验鉴别是长期以来实践经验的总结,依据药材本身所表现出来的色彩、质地、气味等特征来判断药材是否优质,采收加工是否适宜,以此来判断药材的真伪优劣,从而阐明其本质,即“辨状论质”[17]。中药色泽作为传统经验鉴别的重要特征之一,是受内在物质基础和外界环境因子等多种因素影响而呈现出来的,能够反映药材中化学成分的含量,避免化学成分测定受限以及单一成分无法表征药材整体质量的问题。自古以来人们就依靠实践经验总结出了根据颜色来鉴别中药质量的方法,即“辨色论质”[18]。
本研究采用2种测色仪器测定甘草根皮和断面颜色后,主要采用了精密色差仪测定所得的结论,利用视觉分析仪对结果进行验证,并筛选出了野生甘草和栽培甘草具有差异的色号。这两种仪器基于不同的理论对颜色进行表征,所得数据有不同的应用意义,且各具优势。精密色差仪得到的是样品的整体颜色信息,参数少便于分析,但缺点是表述颜色的数据不够精细和可视化;而视觉分析仪可将样品的颜色分解为具体色号并得到该色号比例,每种色号对应一组RGB值,通过这3个值可合成具体颜色,使结果更加直观。试验结果表明,应用这2种仪器测定甘草颜色除了可对化学成分含量的高低进行预测外,还建立了2种测色仪的数据相关分析的方法,发现两者的结论可相互验证,说明了建立的方法是可行的。本文研究结果与传统经验鉴别对甘草质量评价相一致,为传统颜色鉴别作为甘草质量评价标准提供了科学依据,为建立甘草外观颜色从主观经验转向客观量化的评价模式奠定基础。
[参考文献]
[1] 魏胜利,王文全,王海,等. 我国中西部地区甘草资源及其可持续利用的研究[J]. 中国中药杂志,2003,28(3):202.
[2] 魏胜利,王文全,王继永,等.我国不同产区野生与栽培甘草的甘草酸含量及其影响因子的初步研究[J].中国中药杂志,2012,37(10):1341.
[3] 康廷国.中药鉴定学[M].北京:中国中医药出版社,2011:31.
[4] 武兵.CIELAB均匀色空间在印刷中的应用[J].印刷质量与标准化,2003(5):15.
[5] 孙建宁.中药药理学[M].北京:中国中医药出版社,2014:286.
[6] Honda H,Nagai Y,Matsunaga T,et al.Isoliquiritigenin is a potent inhibitor of NLRP3 inflammasome activation and diet-induced adipose tissue inflammation[J].J Leukocyte Bio,2014,96(6):1087.
[7] Kolbe L,Immeyer J,Batzer J,et al.Anti inflammatory efficacy of licochalcone A:correlation of clinical potency and in vitro effects[J].Arch Derm Res,2006,298(1):23.
[8] Chen H J,Kang S P,Lee I J,et al.Glycyrrhetinic acid suppressed NF-κB activation in TNF-α-induced Hepatocytes[J].J Agr Food Chem,2014,62(3):618.
[9] Wang X Y,Lin J C,Chen T L,et al.Metabolic profiling reveals the protective effect of diammonium glycyrrhizinate on acute hepatic injury induced by carbon tetrachloride[J].Metabolomics,2011,7(2):226.
[10] Sun Y X,Tang Y,Wu Ai L,et al.Neuroprotective effect of liquiritin against focal cerebral ischemia/reperfusion in mice via its antioxidant and antiapoptosis properties[J].J Asian Nat Prod Res,2010,12(11/12):1051.
[11] Meng X Y,Yang S B,Pi Z F,et al.An investigation of the metabolism of liquiritin and the immunological effects of its metabolites[J].J Liq Chromatogr R T,2012,35(11):1538.
[12] Lee K K,Omiya Y,Yuzurihara M,et al.Antispasmodic effect of shakuyakukanzoto extract on experimental muscle cramps in vivo:role of the active constituents of Glycyrrhizae Radix[J].J Ethnopharmacol,2013,145(1):286.
[13] Feng Y C,Chih W K,Chai C L,et al.Water extract of licorice had anti-viral activity against human respiratory syncytial virus in human respiratory tract cell lines[J].J Ethnopharmacol,2013,148(2):466.
[14] 马淼,周旭莉,户元林,等.乌拉甘草有效有效成分对人体4种肿瘤细胞增殖与凋亡的影响[J].时珍国医国药,2008,19(1):9.
[15] Vaya J,Belinky P A,Aviram M.Antioxidant constituents from licorice roots:isolation,structure elucidation and antioxidative capacity toward LDL oxidation [J].Free Radic Biol Med,1997,23(2):302.
[16] 武嬌.偏最小二乘回归模型及其在教育统计中的应用[D].西安:陕西师范大学,2002.
[17] 谢宗万.中药品种传统经验鉴别“辨状论质”论[J].时珍国药研究,1993,5(3):19.
[18] 徐曼菲,吴志生,刘晓娜,等.从辨色论质谈中药质量评价方法[J].中国中药杂志,2016,41(2):180.
[责任编辑 丁广治]
