药物—油相性质对药物纳米晶自稳定Pickering乳液构建的影响研究
2017-10-28王帆王帅易涛张继芬
王帆+王帅+易涛+张继芬

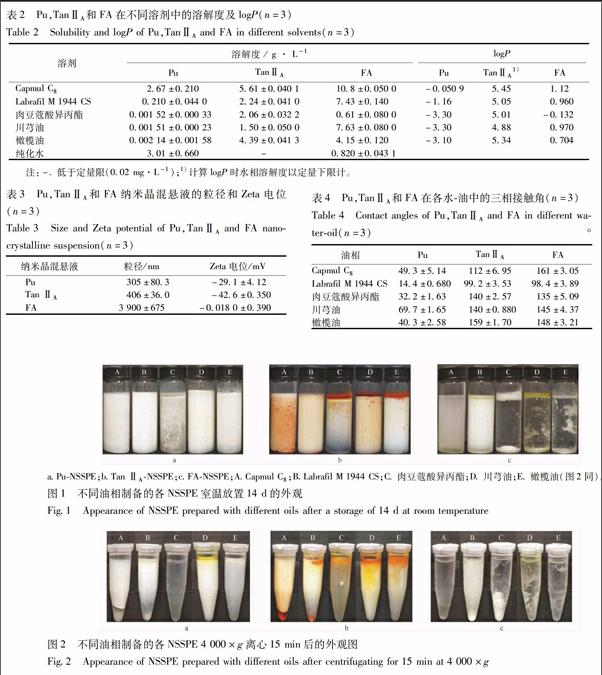
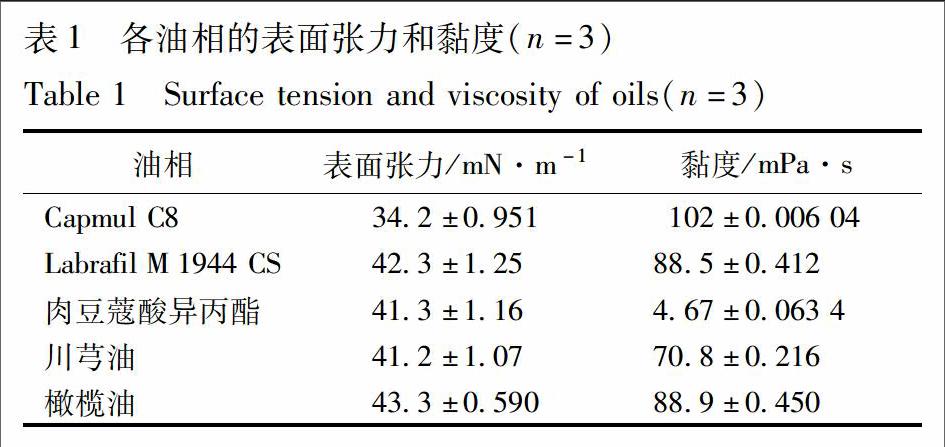
[摘要] 探究药物及油相性质对药物纳米晶自稳定Pickering乳液(nanocrystalline self-stabilized Pickering emulsions,NSSPE)成型与稳定的影响。分别以葛根素、丹参酮ⅡA和阿魏酸3种难溶性中药成分自身纳米晶为固体微粒,以Capmul C8、Fabrafil M 1944 CS、肉豆蔻酸异丙酯、川芎油、橄榄油为油相,高压匀质法制备NSSPE。以室温静置14 d 后NSSPE的外观、离心稳定性、乳滴粒径变化以及乳液层药物含量变化为指标对NSSPE进行评价。分析油相的性质(表面张力、黏度)、药物的性质(表面能、油水分配系数、纳米晶粒径、Zeta电位及药物-水-油的三相接触角)等对NSSPE成型与稳定的影响。以阿魏酸纳米晶为固体微粒制备的5种油相的样品,成乳性和稳定性均明显差于葛根素和丹参酮ⅡA;阿魏酸纳米晶的粒径高达3.90 μm,极显著高于葛根素的305 nm和丹参酮ⅡA的406 nm(P<0.05);阿魏酸纳米晶的Zeta电位为-0.018 0 mV,极显著低于葛根素的-29.1 mV和丹参酮ⅡA的-42.6 mV(P<0.05)。以肉豆蔻酸異丙酯为油相制备的3种药物的样品均不成乳状;肉豆蔻酸异丙酯的黏度为4.67 mPa·s,极显著低于其余各油(P<0.01)。以川芎油为油相制备的葛根素-NSSPE成乳性和稳定性最好;葛根素在川芎油-水中的接触角为69.7°,接近90°,且显著高于其余各接触角。药物为丹参酮ⅡA时,Capmul C8和Labrafil M 1944 CS制备的NSSPE稳定性最好,其接触角分别为99.2°和112°,较其余油相更近接90°。油相的黏度、药物纳米晶粒径、Zeta电位及三相接触角对NSSPE成型与稳定有较大影响;而油相的表面张力、药物的表面能和油水分配系数可能与NSSPE的构建不相关。
[关键词] Pickering乳液; 葛根素; 丹参酮ⅡA; 阿魏酸; 纳米晶; 自稳定
[Abstract] To investigate the effects of drug and oil properties on the formation and stability of drug nanocrystalline self-stabilizied Pickering emulsions (NSSPE). Three insoluble Chinese medicine components (puerarin, tanshinone ⅡA and ferulic acid) were selected as model drugs, and Capmul C8, Fabrafil M 1944 CS, isopropyl myristate, Pzechwan Lovage Rhizome oil, and olive oil were used as oil phase. NSSPEs were developed by high pressure homogenization method and were evaluated for their appearance, centrifugal stability, droplet size and drug content changes in emulsion layer after storing at room temperature for 14 d. Then the properties of the oil (surface tension and viscosity) and properties of the drugs (surface energy, oil-water partition coefficient, size and Zeta potential of nanocrystalline and drug-water-oil contact angle) on the formation and stability of NSSPE were analyzed. The emulsification property and stability of five samples prepared with ferulic acid nanocrystals and different oils were significantly lower than those of puerarin and tanshinone ⅡA; the particle size of ferulic acid nanocrystals was 3.90 μm, extremely higher than 305 nm of puerarin and 406 nm of tanshinone ⅡA (P<0.05); the zeta potential of ferulic acid nanocrystals was -0.018 0 mV, significantly lower than -29.1 mV of puerarin and -42.6 mV of tanshinone ⅡA (P<0.05). Three samples prepared with isopropyl myristate and different drugs were not emulsions and the viscosity of isopropyl myristate was 4.67 mPa·s, significantly lower than that of the other oils (P<0.01). Puerarin-NSSPEs prepared with Pzechwan Lovage Rhizome oil showed best emulsification property and stability; the contact angle of puerarin in Pzechwan Lovage Rhizome oil-water was 69.7°, close to 90°, significantly higher than other contact angles. NSSPEs made by tanshinone ⅡA-Capmul C8-water, tanshinone ⅡA-Labrafil M 1944 CS-water showed highest stability, with a contact angle of 99.2° and 112° respectively, more close to 90° than other oils. The results indicated that viscosity, size and Zeta potential of nanocrystalline and three-phase contact angle had great influence on the formation and stability of NSSPE; surface tension of oil, surface energy of drug and oil-water partition coefficient may not be related to the construction of NSSPE.
[Key words] Pickering emulsions; puerarin; tanshinone ⅡA; ferulic acid; nanocrystalline; self-stabilized
传统的Pickering乳液是一种通过固体微粒,如二氧化硅[1]、纤维素[2-3]、蛋白[4-5]等吸附在乳滴的油水界面而起到稳定作用的乳液。药物纳米晶自稳定Pickering乳液(nanocrystalline self-stabilized Pickering emulsions,NSSPE)是以难溶性药物自身纳米晶为固体微粒制备的Pickering乳液,由课题组率先提出[6]。该乳液系统仅由水、油和难溶性药物3种物质组成,药物部分分布于油/水相,部分吸附于乳滴的油水界面,具有較高的安全性和载药量。
课题组分别以水飞蓟宾[7]和葛根素[8]为模型药物,以Capmul C8和川芎油-Fabrafil M 1944 CS (9∶1)为油相,成功构建了NSSPE。激光共聚焦显微镜、扫描电镜、荧光显微镜等表征证实,难溶性药物纳米晶可以吸附于乳滴的油水界面,阻止乳滴的合并,稳定乳液。大鼠灌胃给予水飞蓟宾和葛根素的NSSPE,AUC较原料药分别提高3.8倍[9]和2.6倍[10]。可见,NSSPE有望成为一种难溶性药物的口服新载体。然而,该载体能否适用于所有的难溶性成分?对不同难溶性药物而言,如何构建稳定的NSSPE?药物和油相的哪些性质对NSSPE成型与稳定有重要影响?这些问题都有待探讨。
本研究以通脉方中的3种难溶性成分葛根素(puerarin,Pu)、丹参酮ⅡA(tanshinone ⅡA,Tan ⅡA)和阿魏酸(ferulic acid,FA)为固体微粒,分别以Capmul C8、Fabrafil M 1944 CS、肉豆蔻酸异丙酯、川芎油、橄榄油5种油为油相,制备NSSPE,探讨药物和油相性质对NSSPE成型与稳定的影响,为成功构建NSSPE,拓宽其在中药制剂中的应用提供参考。
1 材料
FA2004A电子天平(1/1万,上海精天电子仪器有限公司);FA25高速剪切机(上海弗鲁克流体机械制造公司);AH100D高压均质机(加拿大ATS工业系统有限公司);光学生物显微镜(集成Cool SNAP Photomerics光学采集系统,OPTEC奥特光学公司);佳能IXUS1100HS数码相机(佳能中国有限公司);Zetasizer Nano ZS纳米粒度及Zeta电位分析仪(英国马尔文仪器公司);Agilent 1200高效液相色谱系统(美国Agilent公司);G16-WS高速离心机(长沙湘仪离心机仪器有限公司);SHA-C恒温振荡器(常州澳华仪器有限公司);JC2000C接触角测量仪(上海中晨数字技术设备有限公司);SV-10正弦波振动式粘度计(AD公司,日本)。
Pu原料药(质量分数98%,四川玉鑫药业有限公司,批号140602);Tan ⅡA原料药(质量分数95%,西安鸿生生物技术有限公司,批号140804);阿魏酸(质量分数98%,上海迈瑞尔化学技术有限公司,批号ZL091015G);单辛酸甘油酯(Capmul C8,美国阿比泰克公司);油酸聚乙二醇甘油酯(Labrafil M 1944 CS,法国佳法赛试剂有限公司);川芎油、橄榄油(江西雪松天然药用油有限公司);肉豆蔻酸异丙酯、正十六烷(上海阿拉丁生化科技股份有限公司);甲醇(色谱纯,Spectaum 公司);乙腈(色谱纯,Adamas 公司);其余试剂均为分析纯。
2 方法
2.1 药物-油相性质的测定
2.1.1 油相的表面张力 采用接触角测量仪中的悬滴法测量各油相的表面张力。
2.1.2 油相的黏度 取各油相适量置于测量杯中,25 ℃下用黏度计直接测量黏度。
2.1.3 药物的表面能 用红外压片机以20 MPa的压力分别将0.1 g Pu,Tan ⅡA,FA原料药压制成直径约为10 mm,厚度约为0.5 mm的圆形片状,置于玻片上,接触角测量仪分别测量滴加甘油和正十六烷时的接触角,用Owens法计算表面能。
2.1.4 药物的溶解度及logP 取Capmul C8、 Fabrafil M1944 CS、肉豆蔻酸异丙酯、川芎油、橄榄油和纯化水于EP管中,分别加入过量的药物,涡旋混合2 min,25 ℃恒温振荡72 h,1万 r·min-1离心10 min,取上清液,0.45 μm的微孔滤膜过滤,采用HPLC测定药物含量,计算药物溶解度和logP。色谱条件如下:色谱柱均为SilGreen GH0525046 C18A色谱柱(4.6 mm×250 mm,5 μm),流速均为1 mL·min-1,柱温均为30 ℃。Pu的流动相为水-乙腈(15∶85),检测波长为250 nm;Tan ⅡA的流动相为水-乙腈(25∶75),检测波长为270 nm;FA的流动相为0.5%的冰醋酸水溶液-甲醇(65∶35),检测波长为321 nm。
2.1.5 药物纳米晶的性质 分别称取Pu 0.2 g,Tan ⅡA 0.04 g及FA 0.2 g,置于烧杯中,加入纯化水36 mL,搅拌,19 000 r·min-1高剪切2 min,80 MPa高压匀质5 min,得药物纳米晶混悬液。用纳米粒度及Zeta电位分析仪测量纳米晶的粒径和Zeta电位。
2.1.6 药物-油-水的三相接触角 用红外压片机以20 MPa的压力分别将0.1 g Pu,Tan ⅡA以及FA原料药压制成直径约为10 mm,厚度约为0.5 mm的圆形片状,置于透明的正方体容器中,分别加入3 mL油相,用接触角测量仪向药片上滴加3 μL纯化水,测量三相接触角。
2.2 NSSPE的制备
分别以Campul C8、Fabrafil M 1944 CS、肉豆蔻酸异丙酯、川芎油和橄榄油为油相,以Pu,Tan ⅡA以和FA为纳米晶,高压匀质法制备NSSPE。操作如下:称取一定量的药物置于烧杯中,加入36 mL纯化水,搅拌,19 000 r·min-1高剪切2 min,80 MPa高压匀质5 min,制得纳米晶混悬液。再量取4 mL油相,加入高压匀质机中,80 MPa高压继续匀质2 min,即得。Pu,Tan ⅡA及FA的用量分别为乳液总体积的0.50%,0.10%,0.50%。
2.3 NSSPE的评价
2.3.1 稳定指数的测定 取新制备的样品22 mL,装于25 mL玻璃瓶中,室温避光静置,分别于0时刻和14 d,观察乳液外观状态。记录乳液层高度,按下式计算稳定指数(stability index,SI)[11]:SI=Ht/H0。H0指0時刻的乳液层高度,Ht指放置14 d后的乳液层高度。出现明显絮凝或凝固现象时,稳定指数为0。
2.3.2 离心稳定性 取1 mL新制备出的样品于1.5 mL的离心管中,4 000×g离心15 min,观察是否有分层、沉淀等现象。
2.3.3 乳滴粒径 乳液室温避光静置,分别于0时刻和14 d,取样品1滴,均匀涂于玻片上,光学显微镜观察乳滴形态,集成Cool SNAP Photomerics光学采集系统拍摄照片,并用USB2.0 Gamer软件计数200个乳滴的粒径,按下式计算平均体积径(d43 d)[12-13]。每份样品重复3次,取平均值。
d43 d=di4di3
2.3.4 乳液层的药物含量 分别取0时刻、离心后及放置14 d时乳液层部分(为保证均匀性,分别在乳液层的上部、中部和下部各取一个点),氯仿-甲醇(2∶1)溶解,甲醇定容,0.22 μm的微孔滤膜过滤后,HPLC按2.1.4项下的色谱条件测定药物含量。含量下降率=(1-Ct/C0)×100%。C0指0时刻乳液层药物含量,Ct放置14 d或离心后的乳液层药物含量。
3 结果
3.1 药物-油相的性质
3.1.1 油相的表面张力及黏度 各油相的表面张力及黏度见表1。
用SPSS软件进行单因素方差分析事后检验,各油的表面张力分成了2组:第一组为Labrafil M 1944 CS、肉豆蔻酸异丙酯、川芎油和橄榄油,表面张力在41~44 mN·m-1;第二组为Capmul C8,表面张力为34.2 mN·m-1,极显著低于第一组(P<0.01);油相的黏度分为4组:Capmul C8>Labrafil M 1944 CS、橄榄油>川芎油>肉豆蔻酸异丙酯,各组间均有极显著性差异(P<0.01)。
3.1.2 药物的表面能 悬滴法测得Pu,Tan ⅡA和FA的表面能分别为(59.13±1.90),(23.1±4.50),(46.87±2.21) mN·m-1,用SPSS软件进行单因素方差分析检验,3个药物的表面能之间均有极显著性差异(P<0.01)。
3.1.3 药物的溶解度及logP Pu,Tan ⅡA和FA在各溶剂中的溶解度及logP见表2。
3.1.4 药物纳米晶的性质 Pu,Tan ⅡA及FA纳米晶混悬液的粒径及Zeta电位见表3。用SPSS软件进行单因素方差分析事后检验,Pu和Tan ⅡA纳米晶的粒径无显著差异,但均显著小于FA(P<0.05);Pu,Tan ⅡA及FA纳米晶,两两之间的Zeta电位均有显著性差异(P<0.05)。
3.1.5 三相接触角 药物-水-油的三相接触角结果见表4。用SPSS软件进行单因素方差分析事后检验发现,①油相一致而药物不同时,仅Tan ⅡA,FA在Labrafil M 1944 CS-水、肉豆蔻酸异丙酯-水和川芎油-水中的三相接触角无显著性差异,其余各组接触角之间均有极显著差异(P<0.01)。②药物一致而油相不同时,接触角与油相的关系随药物而异:对于Pu,Labrafil M 1944 CS<肉豆蔻酸异丙酯<橄榄油 3.2 不同药物-油相制备的NSSPE的性质 3.2.1 样品外观变化及稳定指数 不同药物-油相制备的各样品室温放置14 d的外观见图1,稳定指数见表5。结果显示:①对于Pu,Labrafil M 1944 CS和川芎油制备的样品室温放置14 d后仍然具有较好的乳液性质,稳定指数均高于0.900;Capmul C8、肉豆蔻酸异丙酯和橄榄油制备的样品出现了絮凝现象。②对于Tan ⅡA,Capmul C8,Labrafil M 1944 CS和川芎油制得的样品室温放置14 d后乳液层性质还较好,稳定指数均高于0.900,肉豆蔻酸异丙酯和橄榄油制备的样品室温放置14 d后底部出现清亮的水层,稳定指数分别为0.571和0.804。③对于FA,仅Labrafil M 1944 CS制备的样品室温放置14 d还具有一定的乳液性质,此时乳液的稳定指数为0.860,其余各样品均不成乳状。 3.2.2 离心稳定性 不同油相制备的各样品4 000×g离心15 min后的外观见图2。可见,①对于Pu,Capmul C8,Labrafil M 1944 CS和川芎油制备的样品离心后虽均有油相和药物析出,但仍具有较好的乳层;肉豆蔻酸异丙酯和橄榄油制备的样品离心后不成乳状,样品变清亮;②对于Tan ⅡA,Capmul C8,Labrafil M 1944 CS和川芎油制备的样品离心后均有油相和药物析出,但乳液层性质较好,肉豆蔻酸异丙酯制备的样品变清亮,橄榄油制备的样品居于两者之间;③对于FA,仅Labrafil M 1944 CS制备的样品具有一定的乳液性质,其余样品均变得清亮。
3.2.3 乳滴粒径 各样品 0时刻及室温放置14 d的乳滴粒径见表5。由表可知,①Labrafil M 1944 CS为油相制备的Pu,TanⅡA和FA的样品放置14 d后,乳滴粒径均显著变大(P<0.05),分别为0时刻的11.5,1.59,3.00倍。② 川芎油制备的Pu,Tan ⅡA的样品放置14 d后的乳滴粒径均显著减小(P<0.05),分别为0时刻的57.5%和39.2%。③ 对于TanⅡA,Capmul C8、肉豆蔻酸异丙酯和橄榄油制备的样品放置14 d后仍呈乳状,乳滴粒径分别为0时刻的12.8%,47.9%,159%。
3.2.4 乳液层的药物含量 各样品 0时刻、室温放置14 d及以4 000×g离心15 min后乳液层药物含量变化见表6。可知,①在各油相中,川芎油制备的Pu和Tan ⅡA的样品乳层药物含量下降相对最少;其余各样品放置14 d或以4 000×g离心15 min后乳液层药物损失严重,含量下降率都高于川芎油;②整体而言,Pu为纳米晶制备的样品乳层药物含量下降率低于Tan ⅡA和FA。
4 讨论
4.1 模型药物和油相的选择
研究的模型药物源于通脉复方。该方由葛根、川芎、丹参配伍组成,具有活血通脉的功效。现有研究证实,通脉方中的难溶性药效成分主要有Pu,Tan ⅡA和FA等。这3种成分分别属于黄酮类、二萜醌类及有机酸类,水中溶解度分别为3.01 g·L-1、低于0.02,0.82 g·L-1,油(正辛醇)水分配系数分别0.38,2.38,1.26,pKa分别为7.4,6.84,4.99。这3种成分在分子结构、脂溶性、荷电性各方面都不同,具有一定的代表性。考虑到课题研究的最终目标是构建通脉复方的NSSPE新制剂,故选用这3种成分为模型药物,进行NSSPE构建机制的研究。
考察的油相选择了Campul C8,Fabrafil M 1944 CS,肉豆蔻酸异丙酯,川芎油和橄榄油。其中,Campul C8、肉豆蔻酸异丙酯和橄榄油均为乳液常用的油相[9,14-15],分别含有8,14,18个碳;Fabrafil M 1944 CS为油酸聚乙二醇甘油酯,在自乳化体系中可用作油相,同时是一种性能优良的液体增溶剂和吸收促进剂,可能会促进模型药物的口服吸收。川芎油为通脉方中川芎的挥发油,具有镇痛、镇静、改善血管功能、保护神经细胞等药理作用的药理作用,对通脉方的疗效有一定贡献。因此,研究选择了这5种油作为油相。
4.2 NSSPE制备工艺条件的选择
在制备NSSPE时,参照文献[16],选择了目前Pickering乳液最常用的制备方法:先将固体微粒分散于水相,超声或高压匀质形成纳米分散液,再加入油相,高剪切后高压乳匀,即得。根据预实验结果,油水体积比定为1∶9。由于Pu,Tan ⅡA和FA在水中的溶解度差异较大,Pu在水中微溶,FA在水中为极微溶解,而Tan ⅡA在水中几乎不溶或不溶。通过溶解度计算可知,Pu,Tan ⅡA和FA在油-水混合体系中的最大溶解量分别为2.98,0.56,1.82 g·L-1,为保证有非溶解状态的药物纳米晶存在并便于比较,将Pu和FA的投药量定为5.00 g·L-1,Tan ⅡA的投药量定为1.00 g·L-1。
4.3 药物性质对NSSPE成型与稳定的影响
研究结果显示,以FA纳米晶为固体微粒制备的5种油相的样品,成乳性和稳定性均明显差于Pu和TanⅡA:除Fabrafil M 1944 CS外,其余油相制备的样品放置14 d均不成乳状。比较Pu,Tan ⅡA和FA的性质,发现:① FA的logP和表面能介于Pu和Tan ⅡA之间,在各油-水中的三相接触角接近Tan ⅡA,由此推测表面能、logP和三相接触角的差异不是FA纳米晶难以稳定Pickering乳液的关键原因。②FA纳米晶的粒径达到3.90 μm,远高于Pu和Tan ⅡA(300~400 nm);Zeta电位接近于0,说明几乎不带电荷,而Pu和Tan ⅡA均带有大量负电荷,Zeta电位分别为-29.1,-42.6 mV。由此推测,FA纳米晶的大粒径和弱电荷可能是其不能稳定Pickering的关键因素。由此推测,Pickering乳液的成型和稳定与纳米晶的粒径和电荷密切相关。这一结果也与文献报道一致。Duffus L J等[17]以多糖和黄酮类颗粒为固体微粒制备Pickering乳液,发现微粒粒径在200 nm~1 μm是形成稳定的Pickering乳的重要条件。一般而言,随着固体微粒的粒径减小,其表面积显著增大,有利于增强其在油水界面的吸附能力;固体颗微粒的粒径越小,在油水界面形成的膜越紧密,刚性阻隔作用越强,有利于乳滴的稳定[18]。Nawaz等[19]以水杨酸修饰的二氧化钛纳米粒为固体微粒制备Pickering乳液,证实,微粒的Zeta电位较高时,乳滴的Zeta电位也就较高,乳滴之间的静电斥力作用强,可阻碍乳滴的合并,有利于乳液的稳定。
4.4 油相性质对NSSPE成型與稳定的影响
肉豆蔻酸异丙酯为油相制备的3个药物的样品稳定性均不好,放置14 d或离心后均变清亮,不呈乳状。分析油相各性质,肉豆蔻酸异丙酯的表面张力与川芎油、Labrafil M 1944 CS和橄榄油均无显著性差异,故表面张力应该不是其无法成乳的关键因素;而肉豆蔻酸异丙酯的黏度极小,仅为4.67 mPa·s,接近于水的黏度(约为1 mPa·s,25 ℃),极显著低于另外4种油相(70.0~102 mPa·s),由此推断,肉豆蔻酸异丙酯极低的黏度可能是导致其无法成乳的重要因素之一。
4.5 油水分配系数对NSSPE成型与稳定的影响
Luo等[20]以十四烷作油相,以一系列不同油水分配系数的黄酮类化合物为固体微粒制备Pickering乳液。研究发现,山柰酚-7-新橘皮糖苷和山柰酚-3-芸香糖苷的logP接近,分别为-0.53,-0.57,前者形成的乳液在1 h内油相和水相完全分离,但后者形成的乳液较好,储存1周后无油相析出;山柰酚香豆酰基葡萄吡喃糖苷和4,5,7-三羟黄烷酮的logP也相近,但4,5,7-三羟黄烷酮未能形成乳液,而山柰酚香豆酰基葡萄吡喃糖苷形成的乳液储存1周后,仅顶部有少量的油相析出。证实,油水分配系数与Pickering乳液的形成无关。
本研究也得到相同的结果。Pu在川芎油-水和橄榄油-水的logP接近,分别为-3.30,-3.10,但橄榄油制备的乳液以4 000×g离心后变清亮,而川芎油制备的样品仍具有较好的乳层。Tan ⅡA在Capmul C8-水和橄榄油-水的logP也相近,但橄榄油制备的样品离心后几乎变得清亮,Capmul C8制备的样品乳层仍较好。具有相近油水分配系数的药物-油相组合,制得的样品稳定性差异很大,说明logP不是影响Pu-NSSPE和TanⅡA-NSSPE成乳性的关键因素。
4.6 三相接触角对NSSPE成型与稳定的影响
据文献[21]报道,固体微粒的油水接触角需在30°~150°才能形成Pickering乳液。接触角越接近90°,越易形成稳定的乳液;当用强疏水性或亲水性微粒作乳化剂时,不能形成稳定的乳液[22]。Pu在川芎油-水、Capmul C8-水和橄榄油-水中的接触角均在30~150°,制备的样品在0时刻均有较好的乳液性质。川芎油制备的样品14 d后的稳定指数为0.970,乳滴粒径略有下降,乳液层药物含量为0时刻的93.9%,说明稳定性较好,这可能与其69.7°的接触角有关。但橄榄油和Capmul C8制备的样品14 d后出现Pu絮状物,这可能是因为其接触角较小,仅为49.3°,40.3°,Pu纳米晶不能紧密吸附于橄榄油-水和Capmul C8-水的界面,易解吸附并自身聚集成絮状物。Pu在Labrafil M 1944 CS-水中的接触角只有14.4°,但成乳性也较好,这可能与Labrafil M 1944 CS自身有一定的弱乳化性有关。尽管如此,其较小的接触角仍然导致部分Pu解吸附,乳液层药物含量仅为0时刻的53.4%,同时乳滴合并严重,放置14 d的后乳滴粒径增大为0时刻的11.5倍。
药物为Tan ⅡA时,Capmul C8和Labrafil M 1944 CS制备的乳液稳定性最好,14 d时稳定指数均为0.964;川芎油次之,稳定指数均为0.929,橄榄油最差,稳定指数均仅0.804。这可能与其三相接触角有关,Tan ⅡA在Capmul C8-水和Labrafil M 1944 CS-水中的接触角接近90°,分别为99.2°,111°,因此乳液稳定性最好;在川芎油-水中的接触角为140°,在橄榄油-水中的接触角最大,为159°,所以乳液稳定性较差。
4.7 小结
影响NSSPE成型与稳定的因素较多,有油相的黏度,油相自身的乳化性,药物纳米晶的粒径和电荷,以及药物-油-水的三相接触角等,且其成乳性并不是由某一种因素决定的。FA纳米晶的大粒径和弱电荷导致NSSPE成乳困难,但当油相为Labrafil M 1944 CS时,Labrafil M 1944 CS自身的弱乳化性仍使制备的样品具有一定的成乳性。Tan ⅡA在肉豆蔻酸异丙酯-水中的接触角为140°,在30°~150°范围内,理论上可以成乳,但肉豆蔻酸异丙酯4.67 mPa·s的低黏度又使得无法形成稳定的NSSPE。可见,NSSPE的成型和稳定是多种影响因素综合作用的结果。
[参考文献]
[1] Spomenka S, He H, Yunmei S, et al. An oral delivery system for indomethicin engineered from cationic lipid emulsions and silica nanoparticles [J]. J Control Release, 2010, 143(3): 367.
[2] Laudina J Duffus, Jennifer E Norton, Paul Smith, et al. A comparative study on the capacity of a range of food-grade particles to form stable O/W and W/O Pickering emulsions [J]. J Colloid Interface Sci, 2016, 473: 9.
[3] Low L E, Tey B T, Ong B H, et al. Palm olein-in-water Pickering emulsion stabilized by Fe3O4-cellulose nanocrystal nanocomposites and their responses to pH [J]. Carbohyd Polym, 2017, 155: 391.
[4] Wang L J, Yin S W, Wu L Y. Fabrication and characterization of Pickering emulsions and oil gels stabilized by highly charged zein/chitosan complex particles (ZCCPs) [J]. Food Chem, 2016, 213: 462.
[5] Wu J D, Shi M X, Li W. Pickering emulsions stabilized by whey protein nanoparticles prepared by thermal cross-linking [J]. Colloid Surface B, 2015, 127: 96.
[6] 易濤, 刘川. 水飞蓟宾纳米晶自稳定Pickering乳液及其制备方法, 中国:103877021 A [P]. 2014.
[7] 张继芬, 刘川, 张焦. 水飞蓟宾纳米晶自稳定Pickering 乳液的制备及评价 [J]. 药学学报, 2016, 51 (5): 813.
[8] 张焦,王帆,王计瑞. 葛根素纳米晶自稳定Pickering 乳液的制备可行性研究 [J]. 中草药, 2017, 48(1):75.
[9] Yi T, Liu C, Zhang J F. et al. A new drug nanocrystal self-stabilized Pickering emulsion for oral delivery of silybin [J]. Eur J Pharm Sci, 2017, 96: 420.
[10] 张焦. 葛根素纳米晶自稳定Pickering乳液的研究 [D]. 重庆: 西南大学药学院,2017.
[11] Xiao J, Wang X A, Gonzalez A J P, et al. Kafirin nanoparticles-stabilized Pickering emulsions: microstructure and rheological behavior [J]. Food Hydrocolloid, 2016, 54: 30.
[12] Hu Z, Sarah Ballinger, Robert Pelton,et al. Cranston surfactant-enhanced cellulose nanocrystal Pickering emulsions [J]. J Colloid Interface Sci, 2015, 439:139.
[13] Mwangi W W, Ho K W, Ooi C W, et al. Facile method for forming ionically cross-linked chitosan microcapsules from Pickering emulsion templates [J]. Food Hydrocolloid, 2016, 55: 26.
[14] Whitby C P, Khairul Anwar H, Hughes J. Destabilising Pickering emulsions by drop flocculation and adhesion [J]. J Colloid Interface Sci, 2016, 465: 158.
[15] He Y Q, Wu F, Sun X Y, et al. Factors that affect pickering emulsions stabilized by graphene oxide [J]. ACS Appl Mater Inter, 2013, 5(11): 4843.
[16] Li M, Ma Y, Cui J, et al. Whey-protein-stabilized nanoemulsions as a potential delivery system for water-insoluble curcumin [J]. LWT - Food Sci Technol, 2014, 59(1): 49.
[17] Duffus L J, Norton J E, Smith P, et al. A comparative study on the capacity of a range of food-grade particles to form stable O/W and W/O Pickering emulsions [J].J Colloid Interface Sci, 2016, 473: 9.
[18] LI C, Li Y X, Sun P D, et al . Pickering emulsions stabilized by native starch granules [J]. Colloid Surf A, 2013, 43: 142.
[19] Nawaz M, Miran W, Jang J, et al. Stabilization of Pickering emulsion with surface-modified titanium dioxide for enhanced photocatalytic degradation of Direct Red 80 [J]. Catal Today, 2017, 282: 38.
[20] Luo Z, Murray B S, Yusoff A, et al. Particle-stabilizing effects of flavonoids at the oil-water interface [J]. J Agric Food Chem, 2011(59): 2636.
[21] Rayner M, Marku D, Eriksson M, et al. Biomass-based particles for the formulation of Pickering type emulsions in food and topical applications [J]. Colloid Surf A, 2014, 458: 48.
[22] Chevalier Y, Bolzinger M A. Emulsions stabilized with solid nanoparticles: Pickering emulsions [J]. Colloid Surf A, 2013, 439(2): 23.
[責任编辑 孔晶晶]
