原生质体诱变选育高产多糖荷叶离褶伞菌株
2017-10-27周霞张尧张成霞
周霞 张尧 张成霞
摘要:研究了菌龄、渗透压稳定剂、酶系统、酶解时间等条件对荷叶离褶伞原生质体制备的影响,通过紫外线诱变技术筛选得到1株高产多糖的菌株。结果表明,原生质体制备最适菌龄为4 d,渗透压稳定剂为06 mol/L甘露醇,使用1%溶壁酶+1%蜗牛酶组合在30 ℃酶解25 h,原生质体产量可达138×107个/mL,再生率为127%。经诱变、筛选和遗传稳定性分析,获得1株多糖含量较出发菌株提高3449%的突变菌株。
关键词:荷叶离褶伞;原生质体;紫外诱变;多糖
中图分类号: S6461036文献标志码:
文章编号:1002-1302(2017)16-0126-03
收稿日期:2017-02-27
基金项目:江苏省泰州市农业科技支撑计划(编号:TN201514)。
作者简介:周霞(1983—),女,江苏泰州人,硕士,讲师,主要从事园林园艺专业的遗传育种、栽培和食用菌栽培等教学与科研。Tel:(0523)86158388;E-mail:694416747@qqcom。
荷叶离褶伞(Lyophyllum decastes),隶属于伞菌目(Agaricales)白蘑科(Tricholomataceae)离褶伞属(Lyophyllum),是一种十分珍贵的野生食药兼用菌,它口感鲜美,富含丰富的矿物质、维生素和氨基酸等营养物质。鹿茸菇为其商品名,是由于它的菌伞酷似我国名贵的中药材鹿茸切片而得名,除了外观与鹿茸相似外,据国内相关文献报道,它还具有多重药用功效。多糖是荷叶离褶伞的主要有效成分,目前正成为国内外众多学科领域研究的热点之一[6-8]。本研究通过紫外线诱变原生质体技术[9-12]选育出高产多糖的荷叶离褶伞菌株。
1材料与方法
11材料
111菌种荷叶离褶伞供试菌种(中国微生物菌种保藏管理委员会普通微生物中心,菌种保藏号CGMCC No1518,菌株号ZY48-1,专利号:ZL2005100964050。)
112培养基菌丝固体培养基(PDA)、菌丝液体培养基(PGA)、原生质体再生培养基(马铃薯200 g、蔗糖20 g、蛋白胨2 g、酵母粉2 g、K2HPO4 15 g、MgSO4·7H2O 15 g、琼脂2%、水1 000 mL、06 mol/L甘露醇稳渗剂)。
12试验方法
121菌丝体培养及生长曲线
刮取培养好的斜面菌种放入盛有10 mL无菌水的小三角瓶中,内置碎玻璃,充分振荡,吸取2 mL菌丝悬液于盛有50 mL液体培养基的250 mL三角瓶中,25 ℃、120 r/min培养数天。3次重复,每隔1 d将菌丝体于60 ℃烘干至恒质量,绘制生长曲线。
122原生质体制备
将培养好的菌丝置于离心管中,4 000 r/min 离心20 min,弃去上清液,用稳渗剂洗涤3 次,按200 mg/mL比例加入酶液,30 ℃酶解数小时,得纯化原生质体,整个过程在无菌条件下进行,用血球计数板计数计算原生质体产量。
123原生质体制备条件
在同等条件下分别研究酶系统、酶解时间、渗透压稳定剂种类、菌龄等条件对原生质体制备的影响。酶系统:2%溶壁酶、2%纤维素酶、2%蜗牛酶、1%溶壁酶+1%纤维素酶、1%溶壁酶+1%蜗牛酶、1%纖维素酶+1%蜗牛酶。酶解时间为1、2、3、4、5 h。渗透压稳定剂:06 mol/L 的硫酸镁、甘露醇、蔗糖、葡萄糖。菌龄:分别取菌龄2、4、6、8、10、12 d的菌丝体制备原生质体并计数。
124原生质体再生
用渗透压稳定剂将纯化的原生质体稀释并涂布原生质体再生培养基平板,25 ℃培养,8~10 d后观察原生质体的再生情况。同时用无菌水涨破原生质体后作为对照,消除非原生质体所形成的菌落带来的误差。
125原生质体紫外线诱变
无菌条件下,将制备好的原生质体稀释至104个/mL,取5 mL于9 cm无菌培养皿内,用磁力搅拌器使原生质体悬液保持均匀。在预热稳定的15 W紫外灯下距离30 cm处分别照射0、10、20、30、40、50、60、80、100 s,每组2个重复。吸取原生质体悬液200 μL,涂布再生培养基,25 ℃避光培养,计菌落数,绘制荷叶离褶伞原生质体紫外线诱变剂量效应曲线,计算原生质体紫外线诱变的半致死剂量,并确定诱变剂量。
126高产多糖突变菌株的筛选
以半致死剂量诱变荷叶离褶伞原生质体,挑取优先再生、生长最旺盛的菌落进行拮抗试验(3点接种法),初步筛选出40株诱变菌株。在此基础上,分别将出发菌株和诱变菌株接入100 mL液体培养基中,25 ℃、120 r/min振荡培养6 d,测定培养液多糖含量(苯酚-硫酸法[12]),进一步筛选多糖产量高的菌株。
127遗传稳定性分析
将高产多糖诱变菌株连续转接10代,均进行摇瓶培养,取第1、3、5、6、7、8、9、10代分别测定菌丝多糖含量。
2结果与分析
21菌丝生长曲线
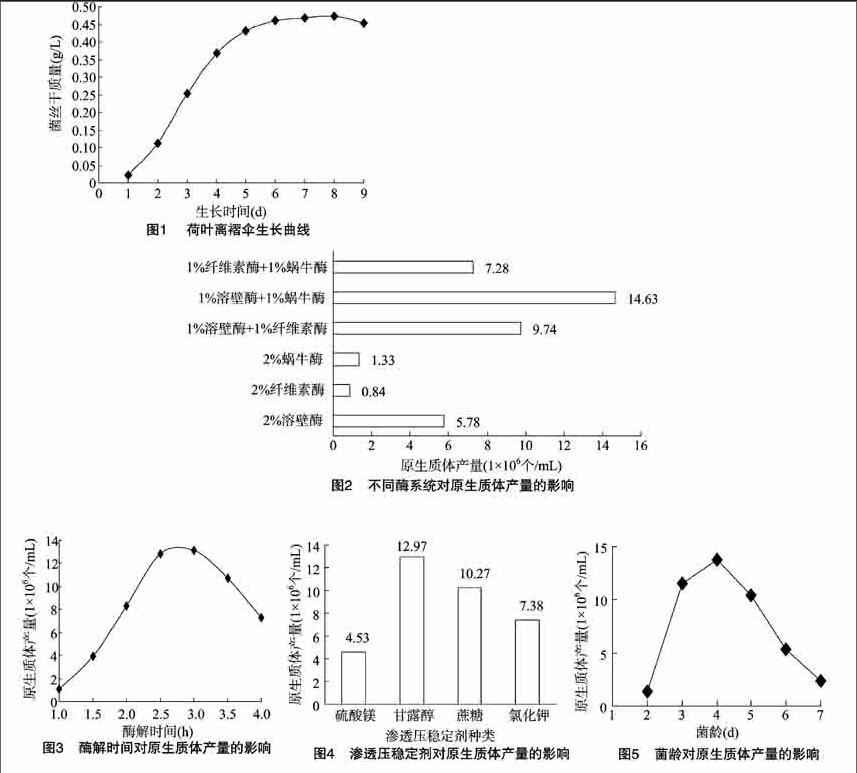
(0472 g/L),8 d以后曲线呈下降趋势。根据生长曲线,初步确定菌龄在对数期4 d时进行原生质体制备。
22不同酶系统对原生质体产量的影响
使用3种单一酶和3种酶组合,30 ℃条件下对培养4 d的菌丝酶解2 h。从图2可以看出,选用不同种类或组合的脱壁酶对原生质体产量的影响较大,在供试的6种酶解液中,使用酶组合进行脱壁的效果要显著优于使用单一酶。其中1%溶壁酶+1%蜗牛酶组合原生质体产量最高,达1463×106个/mL;2%纤维素酶(84×105个/mL)原生质体产量最低。
23酶解时间对原生质体产量的影响
使用1%溶壁酶+1%蜗牛酶组合,30 ℃条件下对培养4 d 的菌丝分别酶解1、2、3、4、5 h。从图3可以看出,酶解时间在10~25 h范围内,原生质体产量迅速提高,在3 h时达到最大(131×107个/mL),随后产量逐渐下降。故最适酶解时间为25 h。
24渗透压稳定剂对原生质体产量的影响
分别使用06 mol/L硫酸镁、甘露醇、蔗糖、氯化钾作为渗透压稳定剂,1%溶壁酶+1%蜗牛酶组合酶解,30 ℃条件下对培养4 d的菌丝酶解25 h制备原生质体并计数。从图4可以看出,同等条件下,06 mol/L的甘露醇作為渗透压稳定剂原生质体产量最高,为13×107个/mL,其次是蔗糖和氯化钾,硫酸镁作为渗透压稳定剂产量最低,故荷叶离褶伞原生质体制备的最适渗透压稳定剂为 06 mol/L 甘露醇。
25菌龄对原生质体产量的影响
分别取菌龄2、3、4、5、6、7 d的菌丝体同等条件下制备原生质体并计数。从图5可以看出,培养4 d时原生质体产量最高,达138×107个/mL,培养时间超过4 d后,原生质体产量逐渐下降,故最佳菌龄为培养4 d,与图1生长曲线基本吻合。
26原生质体再生
以06 mol/L甘露醇作为渗透压稳定剂,25 ℃培养,在第9天出现再生菌落,再生率为127%。
27原生质体紫外线诱变
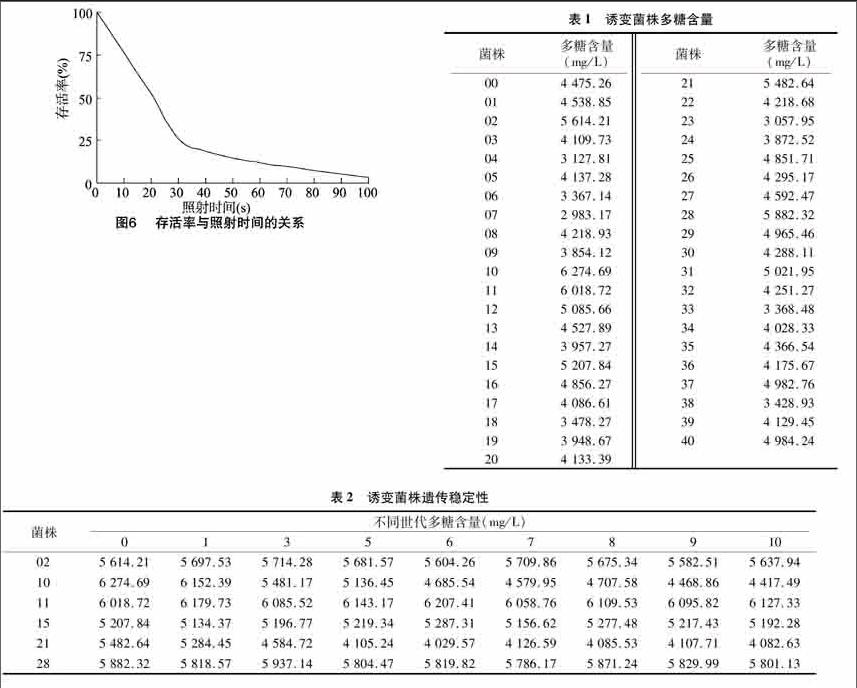
荷叶离褶伞紫外线诱变剂量效应曲线见图6,由此计算半致死率照射剂量约为20 s。
28高产多糖突变菌株的筛选
根据拮抗反应和菌落生长状况,在紫外线照射时间为 20 s 的平板上筛选出20株菌落形态无明显变化,生长速度较快的突变菌株。以原始出发菌株为对照,测定其多糖含量,结果见表1。筛选出6株诱变菌株,分别为菌株02、10、11、15、21、28。
29遗传稳定性分析
将6株诱变菌株连续转接10代,测定菌丝多糖含量,结果见表2。10号诱变菌株虽然多糖含量最高,但遗传稳定性不好,11号菌株遗传稳定性好,且多糖含量也高,较出发菌株提高了3449%。
3结论与讨论
荷叶离褶伞原生质体制备最佳条件为:菌龄4 d,用 06 mol/L 甘露醇作为渗透压稳定剂,1%溶壁酶+1%蜗牛酶组合30 ℃酶解25 h,原生质体产量达138×107个/mL,再生率达127%。原生质体紫外线诱变半致死剂量为20 s,根据拮抗反应和菌落生长状况,筛选出40株诱变菌株,从中选出6株多糖含量较高的菌株,通过遗传稳定性分析,获得1株多糖含量为6 01872 mg/L的诱变菌株,较原始出发菌株多糖含量提高3449%。
影响原生质体释放的因素有很多[13-15],本试验通过对荷叶离褶伞原生质体的制备条件的研究,明确了摇瓶发酵条件下,菌龄、渗透压稳定剂、酶系统、酶解时间等条件对原生质体产量的影响,其中酶系统的选择对原生质体产量影响较大,采用复合酶的效果要显著优于使用单一酶进行酶解。紫外线诱
注:表中00号为出发菌株。
变原生质体育种技术是一种简单、有效的育种技术,但经紫外线照射后,原生质体的再生一般比较困难,给育种工作带来一定麻烦。本试验经过多次重复大量的诱变工作,筛选到1株高产多糖的菌株。
参考文献:
上海农业科学院食用菌研究所中国食用菌志[M]北京:中国林业出版社,1991
席亚丽,茆爱丽,王晓琴,等 荷叶离褶伞子实体、菌丝体及发酵液蛋白质营养价值评价[J] 菌物学报,2010,29(4):603-607
[3]闫肃 荷叶离褶伞子实体化学成分与生物活性研究[D] 长春:吉林农业大学,2014
[4]魏雨恬,冯娜,张劲松,等 荷叶离褶伞子实体有机溶剂萃取物的化学成分和抗肿瘤活性[J] 食用菌学报,2016,23(2):70-74
[5]Ukawa Y,Ito H,Hisamatsu M Antitumor effects of(1→3)-beta-D-glucan and(1→6)-beta-D-glucan purified from newly cultivated mushroom,Hatakeshimeji(Lyophyllum decastes Sing)[J] Journal of Bioscience and Bioengineering,2000,90(1):98-104
[6]张春梅,宋海,魏生龙荷叶离褶伞菌丝体多糖的提取及还原力的研究[J] 中国食用菌,2012,31(6):44-48
[7]王晓琴,曹礼,郑秀芳,等 荷叶离褶伞多糖的提取工艺及其抑菌作用的研究[J] 中国食品工业,2009(12):51-53
[8]国外医药编辑部 培养荷叶离褶伞得到的蛋白多糖作肿瘤细胞免疫增强药物[J] 国外医药:植物药分册,1992,7(3):141
[9]朱芬,陈军,师亮,等 灵芝三萜高产菌株原生质体紫外诱变选育[J] 南京农业大学学报,2008,31(1):37-41
[10]许梅 高产多糖大球盖菇菌株原生质体诱变选育及其抗氧化能力研究[D] 泰安:山东农业大学,2007
[11]张卉,李长彪,陈明波,等 原生质体紫外诱变选育姬松茸新菌株[J] 微生物学杂志,2004,24(6):56-57
[12]王晓琴,张芬琴,魏生龙,等 荷叶离褶伞菌丝体深层发酵及胞内外多糖含量的变化[J] 中国酿造,2011,30(5):56-58
[13]董汪洋,王郑隆,杨云乔,等 杏鲍菇的菌株筛选与原生质体制备条件优化[J] 浙江农业学报,2015,27(5):782-786
[14]谭文辉,李燕萍,许杨 微生物原生质体制备及再生的影响因素[J] 现代食品科技,2006,22(3):263-265
[15]詹萍,苏龙,周乃东 红酵母原生质体制备和再生条件研究[J] 安徽农业科学,2010,38(3):1154-1155
