中药川贝含药血清对支气管平滑肌细胞及血管内皮细胞生长因子的影响
2017-10-25周福波翟凤国杨旭东张羽飞
周福波+翟凤国+杨旭东+张羽飞
[摘要] 目的 观察中药川贝含药血清对支气管平滑肌细胞(BSMC)增殖,管道形成及血管内皮细胞生长因子(VEGF)表达的影响。 方法 卵蛋白(OVA)复制哮喘小鼠模型,制备川贝含药血清。体外培养BSMC,随机分为空白血清组,低剂量组和高剂量组。检测BSMC增殖率,管道形成长度,VEGF及VEGF mRNA的表达。 结果 与空白血清组比较,低剂量组和高剂量组显著降低BSMC增殖,管道形成长度,VEGF和VEGF mRNA的表达(P < 0.05)。 结论 中药川贝含药血清可抑制BSMC增殖,管道形成长度,其机制可能与其抑制VEGF的表达有关。
[关键词] 川贝;哮喘;支气管平滑肌细胞;血管内皮生长因子
[中图分类号] R285 [文献标识码] A [文章编号] 1673-7210(2017)09(b)-0013-04
Effects of Bulbus Fritillariae Cirrhosae medicated serum on bronchial smooth muscle cells and vascular endothelial growth factor
LI Houzhong1 LIU Li2 HUANG Wei3 ZHOU Fubo1 ZHAI Fengguo1 YANG Xudong1 ZHANG Yufei4
1.Pharmacology Teaching and Research Section, Mudanjiang Medical University, Heilongjiang Province, Mudanjiang 157011, China; 2.Department of Recovery, Hongqi Hospital Affiliated to Mudanjiang Medical University, Heilongjiang Province, Mudanjiang 157011, China; 3.Academic Administration, Mudanjiang Medical University, Heilongjiang Province, Mudanjiang 157011, China; 4.Medical Research Center, Mudanjiang Medical University, Heilongjiang Province, Mudanjiang 157011, China
[Abstract] Objective To investigate the effect of Bulbus Fritillariae Cirrhosae medicated serum on the proliferation of the bronchial smooth muscle cells (BSMC), the tube formation and the expressions of vascular endothelial growth factor (VEGF) in BSMC. Methods The murine were sensititized and challenged with ovalbumin (OVA) to establish asthma model and Bulbus Fritillariae Cirrhosae medicated serum was prepared. The BSMC were cultured in vitro and randomly divided into the blank serum group, the low dose group and the high dose group. The proliferations of BSMC, the lengths of the tube formation, the expressions of VEGF and VEGF mRNA were detected. Results Compared with the blank serum group, the proliferations of BSMC, the lengths of the tube formation, the expressions of VEGF and VEGF mRNA of the low dose group and the high dose group were increased significantly (P < 0.05). Conclusion Bulbus Fritillariae Cirrhosae medicated serum can inhibit the proliferations of BSMC and the lengths of the tube formation, and the possible mechanisms may be related to reduce the expressions of VEGF.
[Key words] Bulbus Fritillariae Cirrhosae medicated serum; Asthma; Bronchial smooth muscle cells; Vascular endothelial growth factor
支氣管哮喘简称哮喘,是一种呼吸系统的常见的慢性炎症疾病,其病理特点表现为气道炎症导致持续性气道高反应性及可逆性气流阻塞。而气道重塑是哮喘的重要特征,与哮喘的反复发作和迁延不愈密切相关[1-2]。目前临床上常用的抗炎药,如糖皮质激素,白三烯受体拮抗药等,能迅速控住气道炎症,效果良好,但是仍然存在一些弊端,如停药后的复发,长期用药导致全身或局部的不良反应等[3-4]。endprint
川贝为临床常用中药,有化痰止咳、清热散结、润肺之功效,多用于热痰、燥痰、肺虚劳嗽、久嗽、痰少咽燥、痰中带血等[5]。本研究前期实验表明,川贝对哮喘模型小鼠具有很好的保护作用[6-8]。本研究旨在前期研究基础上,继续探讨观察川贝含药血清对支气管平滑肌细胞(BSMC)增殖和管道形成及VEGF的影响,探讨其可能作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性BALB/C小鼠30只,6~8周龄,由哈尔滨医科大学动物实验中心提供,实验动物合格证号为:P00102008,实验动物使用许可证号:SYXK(黑)2008-033。本实验通过哈尔滨医科大学动物实验伦理委员批准。
1.1.2 中药川贝粉的制备 中药川贝粉由牡丹江医学院药理学实验室制备。制备后的细粉用洁净的塑料袋分装成1 kg/袋备用。参照唐德才等[9]主编的《中药学》所载成人所用剂量为3~6 g/d,根据动物体表面积等效剂量计算方法,计算小鼠给药剂量18.0 mg/kg为高剂量组,9.0 mg/kg为低剂量组。临用时,分别称取川贝粉18 mg,9 mg各溶于生理盐水5 mL制成混悬液,现用现配。
1.2 实验方法
1.2.1 药物血清制备 将18只小鼠按随机数字表法分为对照组,高剂量组和低剂量组,每组各6只。小鼠预先禁食12 h后,高剂量组,低剂量组分别按照18.0 mg/kg,9.0 mg/kg剂量给予川贝粉灌胃给药,正常组给予等体积的生理盐水,每天 2次,连续3 d。末次给药后,无菌条件下自心脏采血,离心血清(3000 r/min,4℃,20 min),血清经56℃、30 min灭活,0.22 μm微孔滤膜过滤除菌后分装,于-20℃冷藏备用。
1.2.2 模型建立 健康清洁级BALB/C小鼠12只,采用OVA制备哮喘小鼠模型。共制备成功10只。
1.2.3 BSMC分离培养 小鼠哮喘模型建立后,处死小鼠,取出肺组织,分离肌层剪碎,用0.25%胰蛋白酶,38.5℃水浴消化2 h左右。1000 r/min离心5 min后,弃上清。加入含10% 胎牛血清的RPMI1640的培养基,在20%O2、5%CO2、37℃培养箱培养,每2~3天换液1次,14 d左右90%细胞融合后,传代培养,实验选用2~5代细胞。
1.2.4 BSMC分组及干预 按1×104个/孔接种于96孔板,培养24 h后,分别给予中药川贝低、高剂量含药血清。另设空白血清对照组,给予正常组血清干预,各组设6个复孔。同时换用含体积分数10%胎牛血清的RPMI1640培养基继续培养24 h后,进行后续实验。
1.2.5 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)检测BSMC增殖率 分组及给药情况同1.2.4。每孔加入MTT溶液(5 g/L))20 μL,培养4 h,弃去上清液,每孔加入DMSO 150 μL,振荡10 min。Rayto RT-6100酶标仪于570 nm波长处测定OD值。Graphpad 5.0计算抑制率。抑制率(%)=(1-OD给药组/OD空白血清组)×100%,取6孔平均值。
1.2.6 管道形成实验 分组及给药情况同1.2.4。冰上預冷微量移液枪头和96孔板。在每个孔内缓慢加入50 μL Matrigel胶,然后培养30 min。BSMC用RPMI1640培养液稀释细胞至1×105个细胞/孔接种于96孔板中,培养18 h。每个孔取上、下、左、右、中5个区域。每个区域随机取1张图片,在奥林巴斯倒置相差显微镜观察并采集图像,通过随机携带的cellsens standard 软件图形软件计算管道形成的总长度(单位mm)。取6孔平均值。
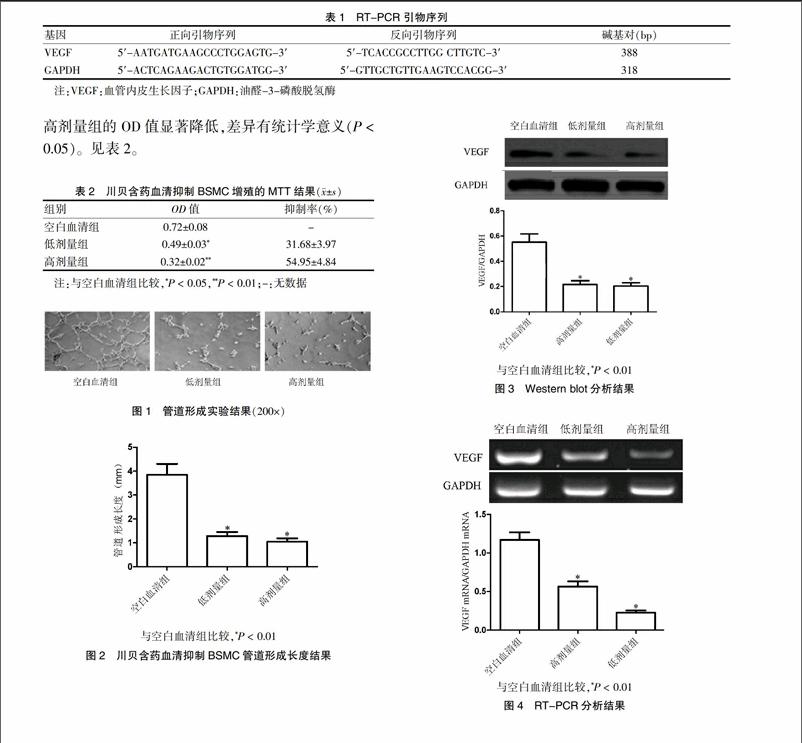
1.2.7 蛋白质印迹法(Western blot)分析 分组及给药情况同1.2.4。提取总蛋白,BCA法测定总蛋白浓度。取30 μg蛋白进行凝胶电泳。当电泳完成后,电转至0.45 μm PVDF膜上,5%脱脂奶粉封闭1 h。分别加入鼠抗人VEGF多克隆抗体(1∶1000稀释)孵育过夜。加入辣根过氧化物酶标记的羊抗鼠IgG(1∶2000稀释)二抗孵育2 h。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参。ECL化学发光试剂显色,Bio-Rad凝胶成像系统对各组条带进行计值及统计分析。每份样品设6个平行孔。
1.2.8 逆转录-聚合酶链反应法(RT-PCR)分析 分组及给药情况同1.2.4。Trizol试剂提取总RNA,检测RNA纯度,按照RT-PCR试剂盒进行反转录反应,合成单链的cDNA。cDNA 产物保存在-20℃。利用PubMed查找相关基因序列,并利用引物合成软件Primer Premier 5.0设计引物。RT-PCR反应体系:体积为25 μL;反应程序为:94℃变性45 s,55℃退火40 s,72℃延伸60 s,共30个循环,最后72℃延伸5 min。每个样本以内参基因GAPDH调整。取目的基因与内参基因扩增产物各5 μL,扩增产物行1.5%琼脂糖凝胶电泳,凝胶成像分析仪测定扩增产物条带灰度并计算两者的比值作为基因的相对表达量。每份样品检测6次。引物序列见表1。
1.3 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 川贝含药血清对BSMC增殖的影响
MTT结果显示,与空白血清组比较,低剂量组和高剂量组的OD值显著降低,差异有统计学意义(P < 0.05)。见表2。
2.2 川贝含药血清对BSMC管道形成长度的影响
管道形成实验结果显示,空白血清组可见较多管状结构,并且互相连接呈现出三维网状的特征结构,低剂量组和高剂量组可见多数的散在的BSMC,仅见极少数的线状结构,未见明显的管腔结构(图1)。经计算,与空白血清组比较,低剂量组和高剂量组的管道形成长度显著降低,差异有高度统计学意义(P < 0.01)。见图2。endprint
2.3 川贝含药血清对BSMC VEGF相对表达的影响
Western blot分析结果显示,与空白血清组比较,低剂量组和高剂量组的BSMC VEGF的相对表达显著降低,差异有高度统计学意义(P < 0.01)。见图3。
2.4 川贝含药血清对BSMC VEGF mRNA相对表达的影响
RT-PCR分析结果显示,与空白血清组比较,低剂量组和高剂量组的BSMC VEGF mRNA的相对表达显著降低,差异有高度统计学意义(P < 0.01)。见图4。
3 讨论
长期以来,研究者一直将气道炎症作为哮喘发生机制的研究重点,然而气道重塑在哮喘的发病过程中具有同样的重要作用。气道重塑以气道慢性炎症为发生基础,为炎症慢性发展的必然结果,被认为是哮喘防治的新靶点[10-11]。气道重塑是慢性哮喘的重要病理特征。哮喘小鼠支气管黏膜下、肺泡壁、肺间质胶原大量沉积,气道壁明显增厚,气道阻力增加,从而肺纖维化进程加剧,最终导致肺功能降低[12]。在气道受累组织可以发现BSMC的体量增加,包括BSMC的数目明显增多,体积显著增大,这个过程可以增强气道重塑过程[13-14]。本研究证实,川贝含药血清可有效抑制BSMC的增殖,提示川贝含药血清可抑制哮喘的气道重塑。
本研究在证实川贝含药血清可有效抑制BSMC的增殖的同时,也证实了川贝含药血清还具有抑制BSMC管道形成的能力。目前对于管道形成能力的机制研究提示,VEGF是重要影响因素[15]。研究表明,在哮喘患者气道VEGF呈高表达,并且其表达的水平与气道壁的厚度呈正相关,这提示在哮喘气道重塑过程中VEGF发挥了重要作用[16-17]。也有研究表明,VEGF具有促进内皮细胞增殖、增加微血管通透性、促进血管生成和成熟的功能,是作用最强的促血管生长因子,且VEGF参与哮喘气道重塑中平滑肌细胞增殖,是气道重塑的指标之一[18-20]。哮喘模型小鼠经VEGF受体抑制剂治疗后,支气管平滑肌增厚程度显著减轻,改善气道重塑状态。本研究也证实,川贝含药血清可显著降低VEGF和VEGF mRNA的表达。以上结果提示,川贝含药血清抑制哮喘气道重塑的机制可能与其抑制VEGF的表达有关。
综上所述,中药川贝含药血清可有效抑制BSMC增殖和管道形成,从而改善气道重塑状态,其机制可能与其抑制VEGF的表达有关。至于是否存在其他机制,如是否与基质金属蛋白酶-2(MMP-2)、MMP-9、基质金属蛋白酶组织抑制剂-1(TIMP-1)有关,本研究将继续探讨。
[参考文献]
[1] Habibovic A,Hristova M,Heppner DE,et al. DUOX1 mediates persistent epithelial EGFR activation, mucous cell metaplasia, and airway remodeling during allergic asthma [J]. JCI Insight,2016,1(18):e88811.
[2] Mohammadian M,Sadeghipour HR,Kashani IR,et al. Evaluation of simvastatin and bone marrow-derived mesenchymal stem cell combination therapy on airway remodeling in a mouse asthma model [J]. Lung,2016,194(5):777-785.
[3] Park CS. Size of inhaled corticosteroid and small airway inflammation in asthma [J]. Allergy Asthma Immunol Res,2017,9(2):99-100.
[4] Leaker BR,O'Connor B,Singh D,et al.The novel inhaled glucocorticoid receptor agonist GW870086X protects against adenosine-induced bronchoconstriction in asthma [J]. J Allergy Clin Immunol,2015,136(2):501-502.
[5] 邱彦,刘静,段靖,等.川贝水煎物对大鼠肺气肿治疗作用研究[J].解放军药学学报,2014,30(4):317-320.
[6] 李厚忠,齐敏,张羽飞.中药川贝对哮喘大鼠NO、TNF -α、MDA浓度和SOD活力及支气管平滑肌炎症反应的影响[J].中医药学报,2013,41(4):64-67.
[7] 李厚忠,任公平,张羽飞.中药川贝对哮喘模型小鼠肺水肿和支气管炎症的影响[J].中医药信息,2014,31(6):19-22.
[8] 李厚忠,任公平,张羽飞.中药川贝对哮喘模型小鼠VEGF和HIF-1α表达的影响[J].中医药信息,2014,31(4):23-26.
[9] 唐德才,吴庆光.中药学[M].3版.北京:人民卫生出版社,2016.
[10] Choi J,Choi BK,Kim JS,et al. Picroside II Attenuates airway inflammation by downregulating the transcription factor GATA3 and Th2-related cytokines in a mouse mo?鄄del of hDM-induced allergic asthma [J]. PLoS One,2016, 21(11):e0167098.endprint
[11] Grenier PA,Fetita CI,Brillet PY. Quantitative computed tomography imaging of airway remodeling in severe asthma [J]. Quant Imaging Med Surg,2016,6(1):76-83.
[12] 孙妍,王金荣,韩秀珍,等.布地奈德对慢性支气管哮喘小鼠肺组织HIF-1α和VEGF表达及气道重塑的影响[J].中国当代儿科杂志,2012,14(8):622-627.
[13] 陈培芬,邱智辉,黄国华,等. Anti-miR-145促进人气道平滑肌细胞增殖及骨桥蛋白合成[J].南方医科大学学报,2015,35(7):1073-1075.
[14] 肖琳,石昭泉,李兵,等.YKL-40调控支气管上皮分泌IL-8 对支气管平滑肌细胞增殖和迁移的影响[J].中国免疫学杂志,2014,30(12):1591-1595.
[15] 张清平,梅鑫,柯超,等. Notch1 通路与胶质瘤细胞管道形成能力相关性研究[J].中国神经精神疾病杂,2017, 43(2):116-119.
[16] Manthei DM,Schwantes EA,Mathur SK,et al. Nasal lavage VEGF and TNF-α levels during a natural cold predict asthma exacerbations [J]. Clin Exp Allergy,2014,44(12): 1484-1493.
[17] Pei QM,Jiang P,Yang M,et al. Roxithromycin inhibits VEGF-induced human airway smooth muscle cell proliferation:opportunities for the treatment of asthma [J]. Exp Cell Res,2016,347(2):378-384.
[18] 陈静,程羽,夏永辉,等.四物汤及活血、养血药对慢性阻塞性肺疾病气道重塑及黏膜免疫的影响[J].中国医药导报,2017,14(7):8-12.
[19] 劉彩霞,景卫利,程雪,等.异丙托溴铵对小儿哮喘患者白细胞介素13、转化生长因子β1及血管内皮生长因子表达的影响[J].中国医药导报,2016,13(18):149-153.
[20] 宫晓丹,丁雁启,宫冰,等.血管内皮生长因子在哮喘小鼠的表达及细辛脑的干预作用[J].中华临床医师杂志:电子版,2017,11(4):612-615.
(收稿日期:2017-06-11 本文编辑:李岳泽)endprint
