聚乙二醇化脂质体多柔比星联合异环磷酰胺治疗晚期转移性软组织肉瘤
2017-10-25张晓伟王惠杰吴向华罗志国
刘 欣,张晓伟,王惠杰,吴向华,罗志国
复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海200032
聚乙二醇化脂质体多柔比星联合异环磷酰胺治疗晚期转移性软组织肉瘤
刘 欣,张晓伟,王惠杰,吴向华,罗志国
复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:软组织肉瘤一旦出现远处转移,预后极差,中位生存时间不到1年。多柔比星联合异环磷酰胺(ifosfamide,IFO)(AI方案)是晚期软组织肉瘤常用的一线联合治疗方案。聚乙二醇脂质体多柔比星(pegylated liposomal doxorubicin,PLD)活性成分为盐酸多柔比星,药物包裹在脂质体中,可减少多柔比星的临床毒性反应。该研究探讨PLD联合IFO治疗晚期转移性软组织肉瘤的临床疗效和安全性。方法:选取晚期转移性软组织肉瘤患者25例,使用PLD联合IFO方案,PLD剂量30 mg/m2,静脉滴注,第1天;IFO剂量1.8 g/m2,静脉滴注,第1~5天;美司钠360 mg/m2,用IFO时0、4和8 h,21 d为1个周期。结果:所有患者化疗1~8个周期,中位周期数4。25例患者中部分缓解9例(36%),疾病稳定12例(48%),疾病进展4例(16%),疾病控制率(完全缓解+部分缓解+疾病稳定)为84%(21/25)。中位无进展生存时间为7.3个月(95%CI:4.6~10.0个月)。由于失访病例较多,中位总生存时间未随访到。化疗后3/4级不良反应包括白细胞下降(20%)、粒细胞下降(28%)、贫血(4%)和呕吐(4%)。只有1例患者治疗过程中予以减量。结论:临床应用PLD联合IFO方案治疗晚期转移性软组织肉瘤疗效确切,且毒性反应较轻,值得进一步深入研究。
聚乙二醇化脂质体多柔比星;异环磷酰胺;晚期;转移性;软组织肉瘤
DOI: 10.19401/j.cnki.1007-3639.2017.09.002
软组织肉瘤是一类起源于软组织及内脏器官的间质组织恶性肿瘤,可发生于人体的各个部位。软组织肉瘤的发病率约占所有成人恶性肿瘤的1%,儿科恶性肿瘤的15%[1]。外科手术切除是治疗软组织肉瘤的基石,但由于软组织肉瘤常易发生全身播散,即使早期亦可见到肺脏转移,除孤立的肺转移灶仍主张手术切除外,其余皆需药物治疗,特别是治疗局部晚期或转移性软组织肉瘤,全身系统性化疗是临床应用的主要手段[2]。
软组织肉瘤一旦出现远处转移,预后极差,中位生存时间不到1年。临床研究结果显示,多柔比星(doxorubicin,ADM)是治疗软组织肉瘤的基础和标准药物,在ADM的基础上联合异环磷酰胺(ifosfamide,IFO)(AI方案)可提高有效率达35%。AI方案是晚期软组织肉瘤常用的一线联合治疗方案[3-6]。
聚乙二醇脂质体多柔比星(pegylated liposomal doxorubicin,PLD)活性成分为盐酸多柔比星。聚乙二醇化脂质体表面含有亲水聚合物甲氧基聚乙二醇,这些线性排列的基团从脂质体表面形成一层保护膜,以减少脂类双分子层与血浆组分之间的相互作用,逃避人体免疫系统识别,可延长ADM在血液循环中的时间。药物包裹在脂质体中,可通过肿瘤新生血管,进入肿瘤细胞产生靶向杀伤作用,减少非特异性地分配到正常组织,降低游离药物的血浆浓度峰值水平,从而减少ADM的临床不良反应[7-11]。2013版NCCN指南已将PLD列入肉瘤单药治疗方案中。现将复旦大学附属肿瘤医院收治的25例采用PLD联合IFO方案一线治疗晚期转移性软组织肉瘤的结果报告如下。
1 资料和方法
1.1 一般资料
2013年11 月—2015年12月经病理诊断确诊,于复旦大学附属肿瘤医院治疗不可手术切除、复发或转移性软组织肉瘤患者25例,其中男性13例,女性12例;年龄20~68岁,中位年龄46岁;东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分小于等于1,血尿常规、肝肾功能及心电图均正常,无重要脏器严重合并症,所有病例均有可测量病灶。病理类型包括:未分化肉瘤9例(36%),滑膜肉瘤8例(32%),脂肪肉瘤2例(8%),平滑肌肉瘤1例(4%),上皮样肉瘤1例(4%),促结缔组织增生性细胞瘤1例(4%),恶性周上皮样细胞瘤1例(4%),恶性周围神经鞘瘤1例(4%),纤维黏液肉瘤1例(4%)。原发病灶位于四肢和躯干部位者16例(64%),位于体腔者9例(36%)。单纯局部复发3例(12%),远处转移22例(88%)。22例转移患者中同时转移患者8例,异时转移患者14例。肺转移患者13例(52%),肝转移患者3例(12%),骨转移患者5例(20%),淋巴结转移患者6例(24%)。大于等于3个器官和(或)部位转移患者有8例(32%)。25例患者的具体基线临床特征见表1。

表 1 患者基线特征Tab. 1 Baseline characteristics of patients[n(%)]
25例患者中,23例在化疗前接受超声心动图检查,左心射血分数值均正常。13例(52%)患者治疗前接受全身PET/CT检查。7例(28%)患者治疗过程中使用了长效升白针,其中5例为初级预防,2例为次级预防。
1.2 治疗方法
将PLD 30 mg/m2溶于250 mL 5%葡萄糖溶液,于化疗第1天静脉滴注,化疗前0.5 h保持10滴/min,IFO每天1 800 mg/m2,静脉滴注,连续5 d;美司钠360 mg/m2,用IFO时0、4和8 h,21 d为1个周期,化疗结束后常规复查血常规、肝肾功能及心电图,共完成6~8个周期。
1.3 疗效评价
按实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST 1.1)分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD);按美国国立癌症研究所不良反应评价标准(National Cancer Institue-Common Terminology Criteria for Adverse Events,NCI-CTC 4.0)评定不良反应。以CR+PR计算有效率(response rate,RR),以CR+PR+SD计算疾病控制率(disease control rate,DCR)。化疗2个周期后临床获益病例可继续按原方案化疗,继续每2个周期化疗后评价1次疗效和不良反应,直至6~8个周期化疗结束,治疗期间若出现PD则调整方案。自开始化疗到患者出现肿瘤进展或死亡的具体时间为无进展生存时间(progression free survival,PFS)。
1.4 统计学处理
应用SPSS 15.0软件对相关数据进行统计学分析。
2 治疗结果
2.1 客观疗效
所有病例均完成1~8个周期化疗,中位周期数为4个周期。25例患者中,无CR患者,PR 9例(36%),SD 12例(48%),PD 4例(16%)。RR为36%(9/25),DCR为84%(21/25)。9例未分化肉瘤患者中,3例PR(33.3%),4例SD(44.4%),2例PD(22.2%),DCR为77.8%。8例滑膜肉瘤患者中,5例PR(62.5%),3例SD(37.5%),DCR为100%。具体临床疗效见表2。

表 2 临床疗效Tab. 2 Clinical e ffi cacy[n(%)]
中位随访时间为17.7个月。中位PFS为7.3个月(95%CI:4.6~10.0个月)。9例未分化肉瘤患者中,中位PFS为8.0个月(95%CI:2.8~13.1个月,图1)。8例滑膜肉瘤患者中,中位PFS为9.6个月(95%CI:5.5~13.7个月)。截至2017年4月,有7例患者仍生存,10例患者失访,因此中位总生存时间无法计算。
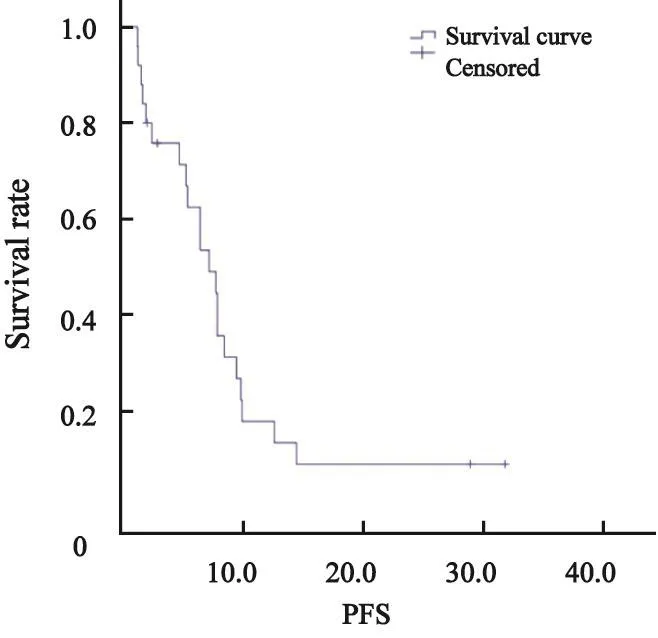
图 1 患者中位PFSFig.1 The median PFS of the patients
2.2 不良反应
本研究中PLD联合IFO治疗晚期转移性软组织肉瘤不良反应可耐受,无治疗相关性死亡发生。3/4级不良反应包括白细胞下降(5/25,20%)、粒细胞下降(7/25,28%)、贫血(1/25,4%)和呕吐(1/25,4%),未出现粒缺性发热。1/2级不良反应包括血小板下降、恶心、便秘、脱发、口腔黏膜炎、手足综合征、乏力、过敏反应、头晕、心律失常等。心律失常包括1级房性早搏1例(4%),1级室性早搏2例(8%),1级窦性心动过速2例(8%)。所有患者中只有1例患者治疗过程予以减量,原因为4级粒细胞下降。所有患者的具体不良事件见表3。

表 3 不良反应Tab. 3 Adverse events[n(%)]
2.3 随访
目前所有患者已完成全部化疗周期,最长随访时间为38个月。截至2017年4月,有7例患者生存,10例患者失访。后续治疗中,9例患者后续治疗不详,1例患者未接受后续治疗。6例患者接受了二线化疗,其中SD 2例,PD 3例,1例疗效不详。4例患者后续接受了放疗。1例恶性血管周上皮样细胞肿瘤患者后续接受了依维莫司治疗,疗效PR,PFS为10个月。
3 讨 论
本研究用PLD代替传统AI方案(ADM联合IFO)中的ADM,一线治疗晚期转移性软组织肉瘤,这在国内尚无报道。结果显示,该方案RR为36%,中位PFS为7.3个月,并且安全性良好,值得进一步研究。
EORTC软组织和骨肉瘤组开展的一项Ⅱ期临床研究显示,ADM联合IFO(ADM 50 mg/m2,第1天,IFO 5 g/m224 h输注,每3周重复)一线治疗晚期软组织肉瘤的RR为35%,中位至疾病进展时间为29周(6.7个月),中位生存时间为58周,骨髓抑制为其剂量限制性毒性,73%的患者化疗后出现3/4级白细胞下降[12]。Edmonson等[5]进行的随机对照Ⅲ期研究显示,在晚期软组织肉瘤的一线治疗中,ADM单药(80 mg/m2,第1天,每3周重复)治疗的RR为20%,ADM联合IFO(ADM 30 mg/m2,第1~2天,IFO 3 750 mg/m2,第1~2天,每3周重复)治疗的RR为34%(P=0.03)。ADM联合IFO组3度以上骨髓抑制的发生率为80%,治疗相关性死亡的比例为3.4%(3/88),死亡原因包括1例血小板下降引起的胃肠道出血,1例呼吸骤停,1例心肺骤停。其他不良反应主要为严重的恶心和呕吐(18%)。
上述临床研究可以看出,ADM联合IFO引起的严重骨髓抑制等不良反应,限制了其在临床中的应用。ADM还可引起累积性不可逆的心脏毒性,导致心肌纤维损伤,表现为左心射血分数下降、充血性心力衰竭等,并且这种风险化疗结束后数年仍可发生[13-14]。Nielsen等[15]进行了PLD联合IFO一线治疗晚期转移性软组织肉瘤的Ⅰ期临床研究,入组了28例患者,结果显示,剂量限制性毒性主要为骨髓抑制和过敏反应,未观察到大于1度的手足综合征,该研究推荐PLD联合IFO一线治疗晚期转移性软组织肉瘤的剂量为PLD 30 mg/m2,第1天,IFO 3 g/m2,第1~3天,每3周重复。基于这项研究结果,本研究旨在探索用PLD代替AI方案中的ADM,能否降低不良反应、提高治疗疗效。
本研究中联合方案的剂量为PLD 30 mg/m2,第1天,IFO 1.8 g/m2,第1~5天,每3周重复。结果显示,在晚期或转移性软组织肉瘤的一线治疗中,PLD联合IFO的疗效与传统AI方案相似,而严重骨髓抑制、恶心呕吐等不良反应明显降低。Ⅱ期研究中AI方案的缓解率为22%~41%,随机对照Ⅲ期研究显示,AI方案的缓解率为34%,中位至疾病进展时间为6~7个月。本研究中PLD联合IFO方案的RR为36%,中位PFS为7.3个月,与上述AI方案疗效相似。遗憾的是由于失访患者较多,中位生存时间未随访到。不良反应方面,综合多项临床研究,AI方案的不良反应主要包括严重的骨髓抑制、胃肠道反应、脱发和心脏毒性。AI方案引起3/4级白细胞下降的比例为73%~80%,3/4级血小板下降的比例为6%左右,3/4级恶心和呕吐的发生率为18%,3/4级神经系统毒性的比例为2%(主要表现为意识水平降低,与IFO有关),脱发的发生率在80%左右。心脏不良事件的发生率为6.4%,其中3级心脏不良事件的比例为2%,治疗相关性死亡的比例为3%左右[4-6,12,16-17]。而本研究中PLD联合IFO方案严重骨髓抑制和胃肠道反应的发生率明显降低,3/4级白细胞下降的比例为20%,3/4级恶心呕吐的比例仅为4%,并且未出现粒缺性发热、3/4级血小板下降和治疗相关性死亡。本研究25例患者中未观察到心脏毒性、肺炎等严重非血液学毒性。由于随访时间较短,远期心脏毒性尚不能评估。与AI方案相比,PLD联合IFO方案特别的毒性是口腔黏膜炎和手足综合征,发生率均为8%,为1/2级,不影响临床治疗。
本研究还观察到一个疗效比较好的亚组,在滑膜肉瘤患者中,PLD联合IFO治疗的RR高达62.5%,DCR为100%,中位PFS为9.6个月。滑膜肉瘤约占软组织肉瘤的10%,与其他软组织肉瘤相比,好发于中青年人,原发肿瘤更多见于四肢,患者的一般状况更好,对全身治疗更敏感,预后更好[18]。Edmonson等[5]进行的随机对照Ⅲ期研究中亚组分析也显示,ADM联合IFO治疗组8例滑膜肉瘤患者中,RR达到88%,而在ADM单药治疗组的5例滑膜肉瘤患者中,RR只有20%(P=0.02)。这提示IFO在滑膜肉瘤的治疗中可能是一个很重要的药物。随后Edmonson等[4]又开展了一项ADM联合IFO治疗滑膜肉瘤的Ⅱ期临床研究,结果显示,在12例滑膜肉瘤患者中,RR为42%,并没有达到预期的研究终点。而本研究结果提示滑膜肉瘤对PLD联合IFO化疗敏感性较高,值得进一步研究。
目前PLD治疗软组织肉瘤尚缺乏随机对照的Ⅲ期临床研究,但已有多项Ⅱ期研究结果报道。EORTC软组织和骨肉瘤组开展的一项Ⅱ期临床研究入组了94例初治晚期软组织肉瘤患者,随机分配到PLD组(50 mg/m2,第1天,每4周重复)或ADM组(75 mg/m2,第1天,每3周重复),结果显示,PLD组和ADM组,缓解率分别为10%和9%,3/4级粒细胞下降的比例分别为6%和77%,粒缺性发热的比例分别为16%和2%,2/3级脱发的比例分别为6%和86%。PLD主要的不良反应为手足皮肤反应,3/4级的比例为20%[19]。这项研究结果显示,PLD与ADM治疗的有效率相近,但骨髓抑制、脱发的比例明显降低,因此2013版NCCN指南已将PLD列入软组织肉瘤单药治疗方案中。
希腊肿瘤协作组开展的PLD联合紫杉醇一线治疗晚期软组织肉瘤的Ⅱ期临床研究,入组了42例患者,接受PLD 45 mg/m2(第1天)联合紫杉醇150 mg/m2(第1天)化疗,每4周重复。结果显示RR为16%,中位至疾病进展时间为5.7个月,中位总生存时间13.2个月。安全性良好,3/4级不良反应包括粒细胞下降(17%)、贫血(15%)、神经毒性(5%)和手足皮肤反应(9%),没有治疗相关性死亡[20]。
根据以上多项临床试验结果和本研究结果,PLD联合IFO方案一线治疗晚期或转移性软组织肉瘤疗效确切,且不良反应明显低于传统AI方案。但目前尚缺乏设计良好的前瞻性Ⅱ期或Ⅲ期临床研究,值得我们临床和基础去进一步研究探索。
[1] CORMIER J N, POLLOCK R E. Soft tissue sarcomas[J].CA Cancer J Clin, 2004, 54(2): 94-109.
[2] HARRIS S J, BENSON C, JONES R L. Current and advancing systemic treatment options for soft tissue sarcomas[J].Expert Opin Pharmacother, 2015, 16(13): 2023-2037.
[3] LINCH M, MIAH A B, THWAY K, et al. Systemic treatment of soft-tissue sarcoma-gold standard and novel therapies[J]. Nat Rev Clin Oncol, 2014, 11(4): 187-202.
[4] EDMONSON J H, RYAN L M, FALKSON C I, et al. PhaseⅡ study of ifosfamide+doxorubicin in patients with advanced synovial sarcomas (E1793): a trial of the Eastern Cooperative Oncology Group[J]. Sarcoma, 2003, 7(1): 9-11.
[5] EDMONSON J H, RYAN L M, BLUM R H, et al. Randomized comparison of doxorubicin alone versus ifosfamide plus doxorubicin or mitomycin, doxorubicin, and cisplatin against advanced soft tissue sarcomas[J]. J Clin Oncol, 1993,11(7): 1269-1275.
[6] SANTORO A, TURSZ T, MOURIDSEN H, et al. Doxorubicin versus CYVADIC versus doxorubicin plus ifosfamide in first-line treatment of advanced soft tissue sarcomas: a randomized study of the European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group[J]. J Clin Oncol, 1995, 13(7): 1537-1545.
[7] GABIZON A, SHMEEDA H, BARENHOLZ Y.Pharmacokinetics of pegylated liposomal Doxorubicin: review of animal and human studies[J]. Clin pharmacokinet, 2003,42(5): 419-436.
[8] UZIELY B, JEFFERS S, ISACSON R, et al. Liposomal doxorubicin: antitumor activity and unique toxicities during two complementary phase Ⅰ studies[J]. J Clin Oncol,1995, 13(7): 1777-1785.
[9] RAHMAN A M, YUSUF S W, EWER M S. Anthracyclineinduced cardiotoxicity and the cardiac-sparing effect of liposomal formulation[J]. Int J Nanomedicine, 2007, 2(4):567-583.
[10] KAMINSKAS L M, MCLEOD V M, KELLY B D, et al. A comparison of changes to doxorubicin pharmacokinetics,antitumor activity, and toxicity mediated by PEGylated dendrimer and PEGylated liposome drug delivery systems[J]. Nanomedicine, 2012, 8(1): 103-111.
[11] O’BRIEN M E, WIGLER N, INBAR M, et al. Reduced cardiotoxicity and comparable efficacy in a phase Ⅲ trial of pegylated liposomal doxorubicin HCl (CAELYX/Doxil) versus conventional doxorubicin for first-line treatment of metastatic breast cancer[J]. Ann Oncol, 2004, 15(3): 440-449.
[12] SCHUTTE J, MOURIDSEN H T, STEWART W, et al.Ifosfamide plus doxorubicin in previously untreated patients with advanced soft tissue sarcoma. The EORTC Soft Tissue and Bone Sarcoma Group[J]. Eur J Cancer, 1990, 26(5):558-561.
[13] CARVALHO F S, BURGEIRO A, GARCIA R, et al.Doxorubicin-induced cardiotoxicity: from bioenergetic failure and cell death to cardiomyopathy[J]. Med Res Rev, 2014,34(1): 106-135.
[14] SMITH L A, CORNELIUS V R, PLUMMER C J, et al.Cardiotoxicity of anthracycline agents for the treatment of cancer: systematic review and meta-analysis of randomised controlled trials[J]. BMC cancer, 2010, 10: 337.
[15] NIELSEN O S, REICHARDT P, CHRISTENSEN T B, et al.Phase 1 European Organisation for Research and Treatment of Cancer study determining safety of pegylated liposomal doxorubicin (Caelyx) in combination with ifosfamide in previously untreated adult patients with advanced or metastatic soft tissue sarcomas[J]. Eur J Cancer, 2006, 42(14): 2303-2309.
[16] LOEHRER P J Sr, SLEDGE G W Jr, NICAISE C, et al.Ifosfamide plus doxorubicin in metastatic adult sarcomas:a multi-institutional phase Ⅱ trial[J]. J Clinical Oncol,1989, 7(11): 1655-1659.
[17] CANTWELL B M, CARMICHAEL J, GHANI S, et al. A phaseⅡ study of ifosfamide/mesna with doxorubicin for adult soft tissue sarcoma[J]. Cancer Chemother Pharmacol, 1988,21(1): 49-52.
[18] VLENTERIE M, LITIERE S, RIZZO E, et al. Outcome of chemotherapy in advanced synovial sarcoma patients: review of 15 clinical trials from the European Organisation for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group;setting a new landmark for studies in this entity[J]. Eur J Cancer, 2016, 58: 62-72.
[19] JUDSON I, RADFORD J A, HARRIS, et al. Randomised phase Ⅱ trial of pegylated liposomal doxorubicin (DOXIL/CAELYX) versus doxorubicin in the treatment of advanced or metastatic soft tissue sarcoma: a study by the EORTC Soft Tissue and Bone Sarcoma Group[J]. Eur J Cancer, 2001,37(7): 870-877.
[20] BAFALOUKOS D, PAPADIMITRIOU C, LINARDOU H, et al. Combination of pegylated liposomal doxorubicin (PLD)and paclitaxel in patients with advanced soft tissue sarcoma:a phase II study of the Hellenic Cooperative Oncology Group[J]. Br J Cancer, 2004, 91(9): 1639-1644.
LUO Zhiguo E-mail: luozhiguo88@163.com
Background and purpose: Patient with metastatic soft tissue sarcoma has a poor prognosis with median survival time of less than 1 year. Doxorubicin combined with ifosfamide (IFO) (AI regimen) is frequently used in the first-line treatment for patients with metastatic soft tissue sarcoma. Pegylated liposomal doxorubicin (PLD) is the liposomal formulation of doxorubicin and has exhibited less toxicity. Therefore our study was aimed to evaluate the efficacy and safety of PLD combined with IFO as the first-line treatment for patients with advanced or metastatic soft tissue sarcoma (STS). Methods: A total of 25 chemotherapy-naive patients with advanced or metastatic STS were enrolled in this study between November 2013 and December 2015. All patients
treatment of PLD 30 mg/m2, d1, plus IFO 1.8 g/m2, d1-5, repeatedly every 21 days. Results: All patients received 1-8 cycles of treatment,at a median of 4 cycles. Among 25 patients, partial response was observed in 9 patients (36%), stable disease (SD)was observed in 12 patients (48%) and progressive disease (PD) in 4 patients (16%). The disease control rate (DCR,CR+PR+SD) was 84%. The median progression-free survival (PFS) was 7.3 months (95%CI, 4.6 to 10.0 months). The grade 3/4 toxicities included leukopenia (20%), neutropenia (28%), anemia (4%) and vomiting (4%). Conclusion:Combination therapy comprising PLD and IFO was effective and well tolerated as first-line treatment for patients with advanced or metastatic STS, which warrants further research.
Pegylated liposomal doxorubicin; Ifosfamide; Advanced; Metastatic; Soft tissue sarcoma
R738.6
:A
:1007-3639(2017)09-0687-06
Pegylated liposomal doxorubincin combined with ifosfamide as first-line treatment for patients with advanced or metastatic soft tissue sarcoma LIU Xin, ZHANG Xiaowei, WANG Huijie, WU Xianghua,LUO Zhiguo (Department of Medical Oncology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
罗志国 E-mail:luozhiguo88@163.com
2017-03-10
2017-06-20)
