MST4通过激活MAPK-ERK信号通路调节炎症因子释放促进肝癌的侵袭和转移的机制研究
2017-10-25林镇海闫士灿张洁筠
林镇海,闫士灿,张洁筠,王 鲁,潘 奇
1.复旦大学附属肿瘤医院肝脏外科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属华山医院普通外科,上海 200040;
3.复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
MST4通过激活MAPK-ERK信号通路调节炎症因子释放促进肝癌的侵袭和转移的机制研究
林镇海1,闫士灿2,张洁筠3,王 鲁1,潘 奇1
1.复旦大学附属肿瘤医院肝脏外科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属华山医院普通外科,上海 200040;
3.复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:丝氨酸/苏氨酸蛋白激酶4(mammalian Ste20-like kinase 4,MST4)促进肿瘤的侵袭和转移,前期研究发现,MST4可以通过上皮间质转化促进肝癌细胞的侵袭和转移。该研究旨在探讨MST4通过激活丝裂原活化蛋白激酶信号通路-细胞外信号调节激酶(mitogen-activated protein kinaseextracellular signal-regulated kinase,MAPK-ERK)信号通路影响炎症因子释放调节炎症微环境,促进肝癌的侵袭和转移。方法:采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)方法对MST4高表达的肝癌细胞中白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和趋化因子2(CC chemokine ligand-2,CCL2)的转录水平进行检查,通过蛋白[质]印迹法(Western blot)和酶联免疫吸附测定法(enzyme-linked immune sorbent assay,ELISA)研究MST4对肝癌细胞分泌炎症因子IL-1β、IL-6、TNF-α和CCL2蛋白量的表达及活性的影响。结果:MST4高表达的肝癌细胞,其IL-1β、IL-6、TNF-α和CCL2的转录水平、蛋白水平和分泌水平显著高于MST4低表达的肝癌细胞系(P<0.05)。同时发现MST4可以通过改变ERK磷酸化的水平,促进细胞因子释放的改变。结论:MST4可以通过MAPK-ERK信号通路活化完成对肿瘤细胞分泌炎症因子的调节,促进炎症因子的分泌,增强肝癌细胞侵袭和转移的能力。
丝氨酸/苏氨酸蛋白激酶4;肝癌;炎症因子;侵袭和转移
DOI: 10.19401/j.cnki.1007-3639.2017.09.001
肝癌是我国最常见的恶性肿瘤之一,其发病率居全球肿瘤发病率第5位,死亡率居男性肿瘤的第2位[1]。虽然以手术为中心的肝癌治疗取得一定成效,但复发和转移仍然是肝癌疗效的瓶颈。近年,多项研究证实肿瘤微环境成分可以预测并影响肝癌术后的复发和转移[2],提示肝癌细胞与癌周微环境相互作用的研究可能为解决肝癌治疗瓶颈提供突破点。
丝氨酸/苏氨酸蛋白激酶4(mammalian Ste20-like kinase 4,MST4)是常见的哺乳动物生发中心激酶类成员。研究发现MST4可促进肿瘤的生长、侵袭和转移[3-8]。我们在前期研究中发现,MST4可提示肝癌的不良预后,进一步研究发现,MST4可以激活丝裂原活化蛋白激酶信号通路(mitogen-activated protein kinase,MAPK)信号通路诱导肝癌细胞上皮间质转化(epithelial-mesenchymal transitional,EMT)转化促进肝癌恶性度增高[9]。最新研究发现,MST4还可以调节炎症因子的分泌[10]。而研究发现炎症微环境中可以通过许多炎性细胞因子,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)、趋化因子2(CC chemokine ligand-2,CCL2)、转化生长因子、血管内皮生长因子及黏附分子等,直接影响肿瘤的发生、发展、侵袭和转移[11]。提示MST4可能通过调节免疫微环境因子的途径促进肝癌的侵袭和转移。本研究旨在通过检测MST4对肝癌细胞分泌炎症因子IL-1β、IL-6、TNF-α和CCL2的影响,探讨MST4通过调节癌旁微环境中炎症因子的表达促进肝癌恶性行为的机制。
1 材料和方法
1.1 细胞株
人肝癌细胞系MHCC97H由复旦大学肝癌研究所保存和培养。
1.2 试剂
高糖DMEM培养液购自美国Gibco-BRL公司,特级胎牛血清(40 nm过滤)购自美国Hyclone公司,0.25%胰蛋白酶和0.02%EDTA消化液购自美国Gibco公司,MST4(rabbit,polyclonal,1∶500)购自美国Proteintech公司,细胞总蛋白和核蛋白抽提试剂盒购自美国Millipore公司,蛋白[质]印迹法(Western blot)试剂盒购自美国Millipore公司,大鼠抗细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)多克隆抗体、大鼠抗人磷酸化ERK(p-ERK)多克隆抗体购自美国Santa Cruz公司,辣根过氧化物酶标记的羊抗大鼠IgG购自上海康成生物工程有限公司,实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)逆转录试剂盒和SYBR Premix Ex TaqTM试剂盒购自日本Toyobo公司。引物由生工生物工程(上海)股份有限公司设计合成,IL-1β、IL-6、TNF-α和CCL-2酶联免疫吸附测定法(enzyme-linked immuno sorbent assay,ELISA)试剂盒购自英国Abcam公司,磷酸化ERK抑制剂PD98095等其他各种化学试剂均为国产分析纯。
1.3 实验方法
1.3.1 细胞培养和细胞总蛋白抽提
MHCC97H肝癌细胞系分为三组[9],分别为对照组MHCC97H-WT、高表达组MHCC97H-MST4和低表达组MHCC97H-KD,用含10%胎牛血清的高糖DMEM培养液于37 ℃、CO2体积分数为5%的培养箱内传代培养,每隔3 d传代1次。将对数生长期的MHCC97H细胞分组,进行后续Western blot和ELISA实验。按照试剂盒说明抽提细胞总蛋白,采用Bradford法测定蛋白浓度。
1.3.2 RTFQ-PCR检测
RTFQ-PCR检测各组细胞中的炎症基因IL-1β、IL-6、CCL2和TNF-α表达,并且以GAPDH基因为管家基因。实验方法按说明书操作。各引物的序列见表1。
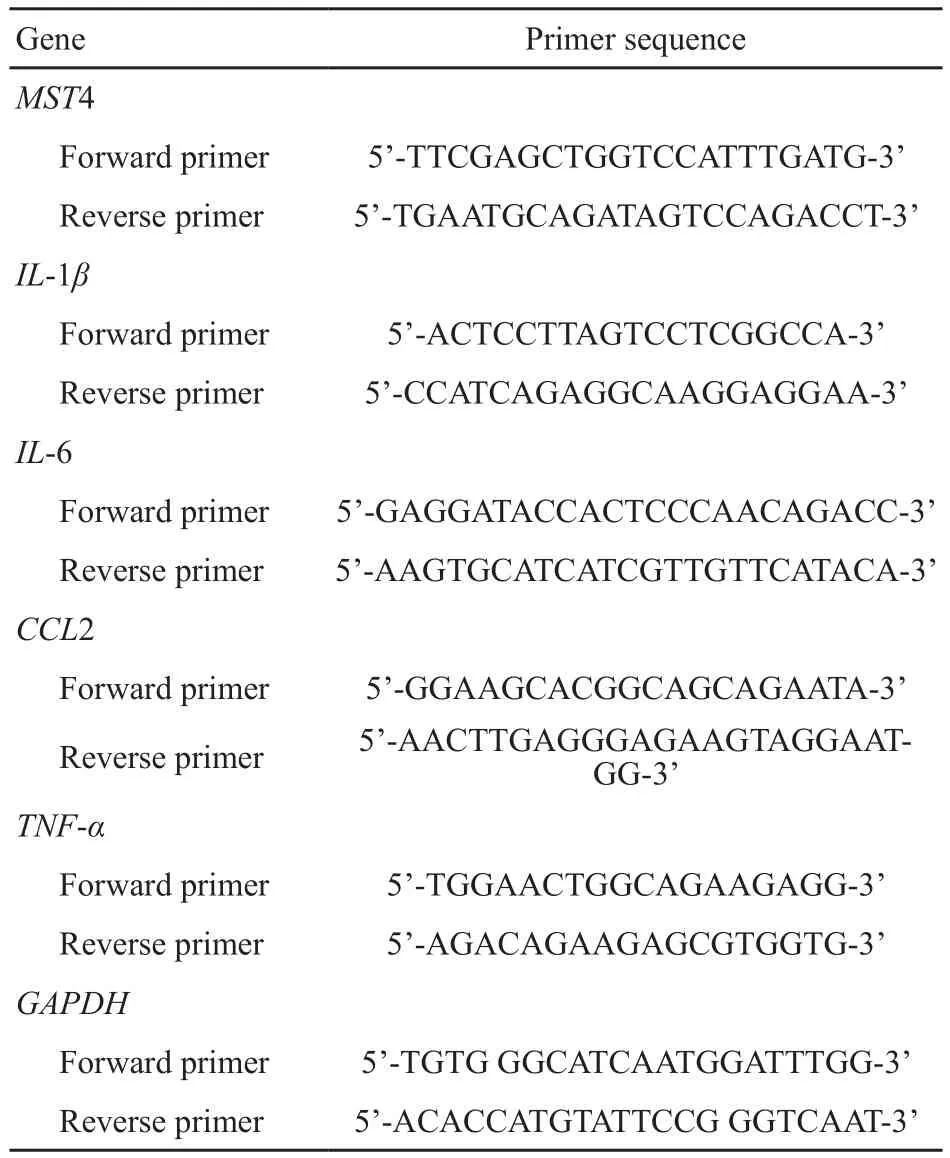
表 1 引物序列图Tab. 1 Primer sequence
1.3.3 Western blot检测ERK和p-ERK的表达水平
取20 mg总蛋白经12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳后转移至聚偏氟乙烯膜,用5%脱脂奶粉室温封闭2 h,加入一抗,4 ℃温育过夜,次日用洗膜缓冲液洗膜后加入荧光标记的二抗(1∶10 000稀释),室温温育1 h。曝光显色。
1.3.4 ELISA法检测MST4表达上调对MHCCH97H分泌炎症因子IL-1β、IL-6、TNF-α和CCL-2的影响
取对数生长期的MHCC97H细胞培养上清液,调整细胞密度为2×105个/mL,接种于96孔板,每孔100 μL,37 ℃温箱温育贴壁4 h后,设空白组、MHCC97H-MST4组(MST4转染高表达组)、MHCC97H-KD组(MST4转染干扰siRNA族)和PD98095组(MST4转染高表达组+每孔浓度40 μmol/L,5 μL),每组6个复孔,培养24 h后,用ELISA试剂盒检测上清液中IL-1β、IL-6、TNF-α和CCL-2的水平(PD98095为ERK磷酸化抑制剂)。
1.3.5 统计学处理
2 结 果
2.1 RTFQ-PCR检测结果
RTFQ-PCR检测发现,高表达MST4的MHCC97H肝癌细胞株比低表达MST4的MHCC97H肝癌细胞株中炎症因子IL-6、IL-1β、TNF-α和CCL2的转录水平显著升高,差异有统计学意义(P<0.05,图1)。
2.2 ELISA检测结果
ELISA检测发现,高表达MST4的MHCC97H肝癌细胞株比低表达MST4的MHCC97H肝癌细胞株中炎症因子IL-6、IL-1β、TNF-α和CCL2的分泌量增多,差异有统计学意义(P<0.05,图2)。
2.3 Western blot检测结果
Western blot检测发现,MST4高表达的MHCC97H细胞株中p-ERK表达量增高,差异有统计学意义(P<0.05)。利用p-ERK抑制剂可以有效抑制下游IL-6、IL-1β、TNF-α和CCL2的转录水平和分泌量,差异有统计学意义(P<0.05,图3)。
2.4 使用信号通路抑制剂对炎症因子分泌的ELISA检测结果
ELISA检测发现高表达MST4的MHCC97H肝癌细胞株比野生的肝癌MHCC97H细胞株中炎症因子IL-6、IL-1β、TNF-α和CCL2的分泌量增多,利用PD98095抑制ERK的磷酸化,可以明显抑制MHCC97H细胞对炎症因子的分泌,差异有统计学意义(P<0.05,图4)。
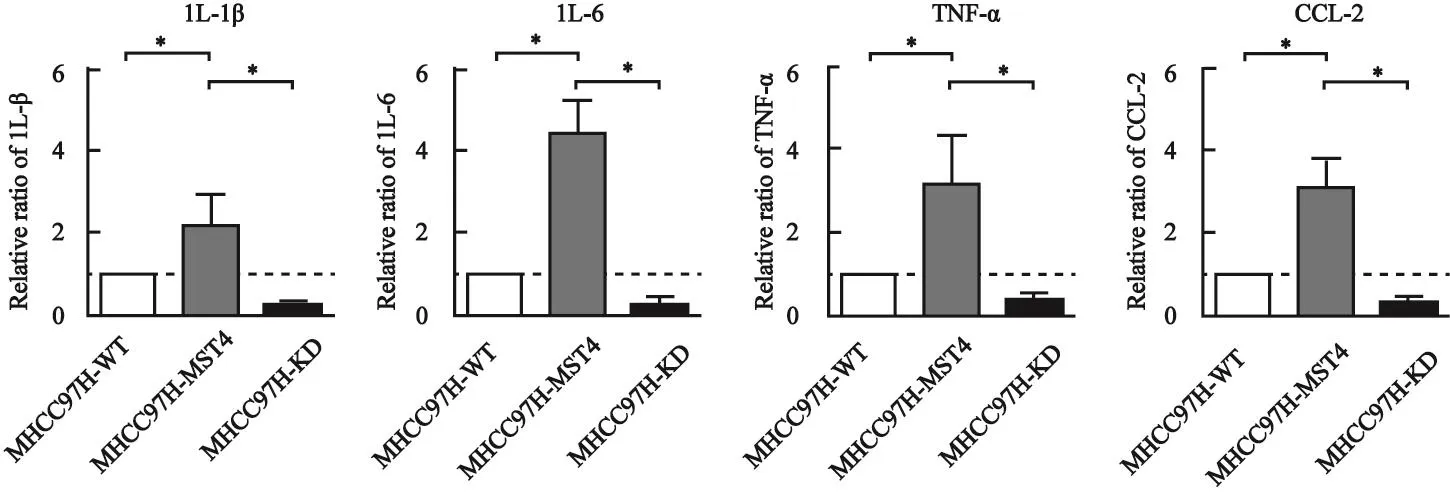
图 1 RTFQ-PCR检测高表达MST4和低表达MST4的MHCC97H肝癌细胞株中炎症因子IL-6、IL-1β、TNF-α和CCL2的转录水平Fig. 1 The transcription level of the inflammatory cytokines IL-6, IL-1β, TNF-α and CCL2 in the high MST4 expression and the low MST4 expression of MHCC97H hepatocellular carcinoma cell lines detected by RTFQ-PCR
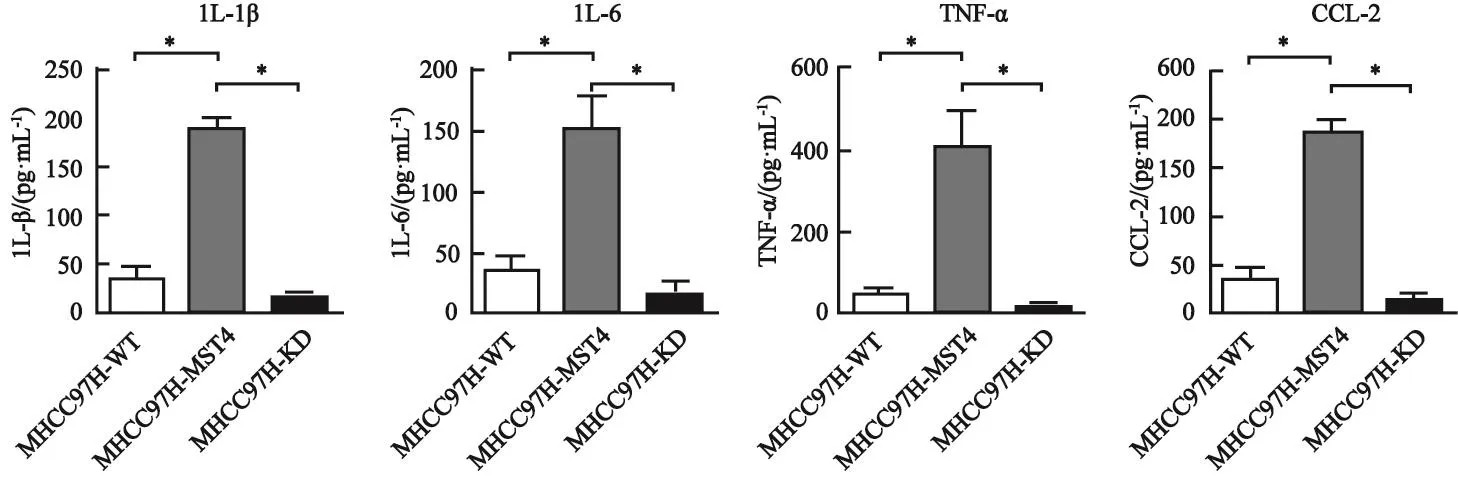
图 2 ELISA检测高表达MST4和低表达MST4的MHCC97H肝癌细胞株中炎症因子IL-6、IL-1β、TNF-α和CCL2的分泌量Fig. 2 The secretion of the inflammatory cytokines IL-6, IL-1β, TNF-α and CCL2 in the high MST4 expression and the low MST4 expression of MHCC97H hepatocellular carcinoma cell lines detected by ELISA
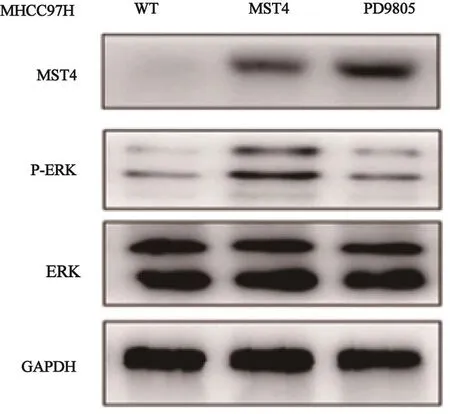
图 3 Western blot检测结果Fig. 3 Result of Western blot detection
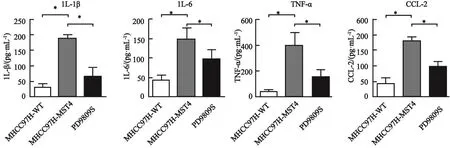
图 4 ELISA检测MHCC97H肝癌细胞株中炎症因子IL-6、IL-1β、TNF-α和CCL2的分泌量Fig. 4 The secretion of the inflammatory cytokines IL-6, IL-1β, TNF-α and CCL2 in the MHCC97H hepatocellular carcinoma cell lines detected by ELISA
3 讨 论
MST4属于常见的哺乳动物生发中心激酶类成员,可促进细胞的生长和转化,参与细胞骨架重排、形态形成、细胞凋亡及分化等细胞活动[12]。在乳腺癌和前列腺癌的中,高表达的MST4与侵袭性和恶性程度密切相关[13]。我们在前期研究中发现,MST4可以激活MAPK信号通路诱导肝癌细胞EMT转化促进肝癌恶性度增高,更重要的是其对肝癌的不良预后具有很好地提示作用[9]。本研究在前期研究结果的基础上,首次有针对性地聚焦于MAPK信号通路下游的炎症因子转录和分泌。通过体外实验,利用RTFQ-PCR、ELISA和Western blot技术从不同层面和角度进行分析研究,发现MST4可以通过激活MAPK-pERK信号通路促进肝癌细胞中炎症因子IL-6、IL-1β、TNF-α和CCL2的转录水平上调,进而使得肝癌细胞对IL-6、IL-1β、TNF-α和CCL2的分泌增加。为明确其机制,我们利用MAPK-pERK信号通路活化的抑制剂对进行MST4高表达的肝癌细胞进行干预,发现阻断MAPK-pERK信号通路后,肝癌细胞中IL-6、IL-1β、TNF-α和CCL2的转录及分泌水平均下调。提示MAPK-pERK信号通路的激活与MST4调节肝癌细胞炎症因子分泌密切相关。
ERK是MAPK家族中研究最广泛的蛋白激酶之一。ERK磷酸化后成为有活性的蛋白激酶,可调节细胞的多种功能,包括细胞增殖、分化、凋亡和衰老,还能调节炎症因子的产生和分泌[14-15]。炎症因子与肝癌发生、发展存在密切关系。肿瘤细胞的侵袭、转移过程中,炎症因子可激活炎症细胞和肿瘤细胞,对于维持慢性炎症、促进肿瘤细胞进展与增殖、抑制免疫介导的肿瘤监视具有非常重要的作用。在众多因子中,IL-1、IL-6、TNF-α及CCL2的研究较为深入,是公认的促癌炎症因子。在具有肝炎背景的肝恶性肿瘤的研究中,无论是乙肝或是丙肝引起的肝硬化肝癌患者其体内细胞因子如IL-6、TNF-α及IL-1β的表达均高于正常人群,由此认为这些炎症因子的分泌失调促进肝癌的早期发生、发展[16]。有动物模型研究进一步证实,在肝炎转基因小鼠HCC模型中,TNF-α和IL-1β的表达水平明显增高[17-18]。对临床肝癌、肝硬化和健康人群中血清IL-6的研究发现,肝癌患者的血液中IL-6水平显著高于肝硬化和正常人群[19]。Wang等[20]在临床肝癌病例蛋白芯片的研究中发现,血清CCL2的变化与肝癌高度相关,并且认为CCL2可作为甲胎蛋白的补偿标志物从而协助预测肝癌的预后。上述研究都从现象方面对炎症因子IL-1β、IL-6、TNF-α及CCL2与肝癌发生、发展的相关性进行证实,而机制研究则进一步说明其促进肝癌侵袭和转移的作用。在肿瘤的发展中,TNF-α可以通过激活细胞核因子-κB促进肝癌细胞增殖[21]。IL-6、TNF-α和IL-1β在细胞研究中证实可以促进肝细胞肝癌细胞的生长和侵袭。有研究发现,CCL2可以通过诱导并激活肿瘤相关巨噬细胞促进肝细胞肝癌的增殖、侵袭和转移[22]。因此,IL-1β、IL-6、TNF-α及CCL2等炎症因子对于肝癌的恶性行为具有显著的促进作用。
本研究通过干扰和上调肝癌细胞系MHCC97H中MST4表达的增高从而促进了炎症因子IL-1β、IL-6、TNF-α及CCL2的转录和分泌的水平,进一步研究发现MST4可以通过MAPKERK信号通路活化完成对肿瘤细胞分泌炎症因子的调节。为MST4促进肝癌侵袭和转移的研究提供新的理论依据。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] BERASAIN C, CASTILLO J, PERUGORRIA M J, et al.Inflammation and liver cancer: new molecular links [J].Ann N Y Acad Sci, 2009, 1155(1): 206-221.
[3] LING P, LU T J, YUAN C J, et al. Biosignaling of mammalian Ste20-related kinases [J]. Cell Signal, 2008, 20(7): 1237-1247.
[4] DELPIRE E. The mammalian family of sterile 20p-like protein kinases [J]. Pflugers Arch, 2009, 458(5):953-967.
[5] DAN I, WATANABE N M, KUSUMI A. The Ste20 group kinases as regulators of MAP kinase cascades [J]. Trends Cell Biol, 2001, 11(5): 220-230.
[6] HAO W, TAKANO T, GUILLEMETTE J, et al. Induction of apoptosis by the Ste20-like kinase SLK, a germinal center kinase that activates apoptosis signal-regulating kinase and p38 [J]. J Biol Chem, 2006, 281(6): 3075-3084.
[7] NICKE B, BASTIEN J, KHANNA S J, et al. Involvement of MINK, a Ste20 family kinase, in Ras oncogene-induced growth arrest in human ovarian surface epithelial cells [J].Mol Cell, 2005, 20(5): 673-685.
[8] RECORD C J, CHAIKUAD A, RELLOS P, et al. Structural comparison of human mammalian ste20-like kinases [J].PLoS One, 2010, 5(8): e11905.
[9] LIN Z, WANG L, ZHANG J, et al. MST4 promotes hepatocellular carcinoma epithelial-mesenchymal transition and metastasis via activation of the p-ERK pathway [J]. Int J Oncol, 2014, 45(2): 629-640.
[10] ZHOU Z. The kinase MST4 limits inflammatory responses through direct phosphorylation of the adaptor molecule TRAF6[J]. Nat Immunol, 2015, 16(3): 246-257.
[11] GRIVENNIKOV S I, GRETEN F R, KARIN M. Immunity,inflammation, and cancer [J]. Cell, 2010, 140(6): 883-899.
[12] SHI Z, JIAO S, ZHANG Z, et al. Structure of the MST4 in complex with MO25 provides insights into its activation mechanism[J]. Structure, 2013, 21(3): 449-461.
[13] SUNG V, LUO W, QIAN D, et al. The Ste20 kinase MST4 plays a role in prostate cancer progression[J]. Cancer Res,2003, 63(12): 3356-3363.
[14] CAI L, WANG Z, MEYER J M, et al. Macrophage SR-BI regulates LPS-induced pro-inflammatory signaling in mice and isolated macrophages [J]. J Lipid Res, 2012, 53(8):1472-1481.
[15] ARTHUR J S, LEY S C. Mitogen-activated protein kinases in innate immunity [J]. Nat Rev Immunol, 2013, 13(9): 679-692.
[16] HSIA C Y, HUO T I, CHIANG S Y, et al. Evaluation of interleukin-6, interleukin-10 and human hepatocyte growth factor as tumor markers for hepatocellular carcinoma[J].Eur J Surg Oncol, 2007, 33(2): 208-212.
[17] LAU C K, YANG Z F, LAM S P, et al. Inhibition of Stat3 activity by YC-1 enhances chemo-sensitivity in hepatocellular carcinoma[J]. Cancer Biol Ther, 2007, 6(12): 1900-1907.
[18] LIN L, AMIN R, GALLICANO G I, et al. The STAT3 inhibitor NSC 74859 is effective in hepatocellular cancers with disrupted TGF-beta signaling[J]. Oncogene, 2009, 28(7):961-972.
[19] WANG Y C, XU G L, JIA W D, et al. Estrogen suppresses metastasis in rat hepatocellular carcinoma through decreasing interleukin-6 and hepatocyte growth factor expression[J].Inflammation, 2012, 35(1): 143-149.
[20] WANG W W, ANG S F, KUMAR R, et al. Identification of serum monocyte chemoattractant protein-1 and prolactin as potential tumor markers in hepatocellular carcinoma[J].PLoS One, 2013, 8(7): e68904.
[21] TSUTSUMI T, SUZUKI T, MORIYA K, et al. Alteration of intrahepatic cytokine expression and AP-1 activation in transgenic mice expressing hepatitis C virus core protein[J].Virology, 2002, 304(2): 415-424.
[22] TACKE F. Targeting hepatic macrophages to treat liver diseases [J]. J Hepatol, 2017, 66(6): 1300-1312.(收稿日期:2017-03-01 修回日期:2017-07-02)
PAN Qi E-mail: drpanqi@163.com
Background and purpose: It has been reported that mammalian Ste20-like kinase 4 (MST4)promotes the invasion and metastasis of tumors. In the previous research, we found that MST4 promoted invasion and metastasis of liver cancer through epithelial-mesenchymal transition. In this study, we explored the effect of MST4 on promoting the invasion and metastasis of hepatocellular carcinoma (HCC) cells by activating MAPK-ERK signaling path way and inflammatory factors. Methods: We used real-time fluorescence quantitative polymerase chain reaction(RTFQ-PCR) to detect the transcription of IL-1β, IL-6, TNF-α and CCL2 in different HCC cell lines expressing MST4 differently. Then we studied the different secretion of IL-1β, IL-6, TNF-α and CCL2 in cells using Western blot and enzyme-linked immunosorbent assay (ELISA). Results: The RNA transcription and protein translation levels of IL-1β,IL-6, TNF-α and CCL2 were significantly higher in HCC cell line with high expression of MST4 than those in the HCC cell line with lower expression of MST4 (P<0.05). We found that MST4 could change the level of phosphorylation of ERK to promote secretion of inflammatory cytokines. Conclusion: High expression of MST4 can upregulate the secretion of inflammatory factors (IL-1β, IL-6, TNF-α and CCL2) in HCC cells and enhance the ability of invasion and metastasis of HCC cells, through activating the MAPK-ERK signaling pathway.
Mammalian Ste20-like kinase 4; Hepatocellular carcinoma; Inflammatory factors; Invasion and metastasis
R735.7
:A
:1007-3639(2017)09-0681-06
MST4 upregulates secretion of in fl ammatory factors via activation of MAPK-ERK signaling pathway and promotes invasion and metastasis of hepatocellular carcinoma LIN Zhenhai1, YAN Shican2,ZHANG Jieyun3, WANG Lu1, PAN Qi1(1. Department of Hepatic Surgery, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032,China; 2. Department of General Surgery, Huashan Hospital of Fudan University, Shanghai 200040, China;3. Department of Medical Oncology, Fudan University Shanghai Cancer Center, Department of Oncology,Shanghai Medical College, Fudan University, Shanghai 200032, China)
国家自然科学基金青年项目(81602100);上海市自然科学基金面上项目(12ZR1406200);复旦大学附属肿瘤医院院级基金(2015-2017)。
潘 奇 E-mail:drpanqi@163.com
