靶向趋化因子受体4(CXCR4)分子成像研究
2017-10-25曹学良姜廷军赵长久
曹学良 ,付 鹏 ,姜廷军 ,栾 厦 ,赵长久
(1.哈尔滨医科大学附属第四医院,黑龙江 哈尔滨 150001;2.哈尔滨医科大学第一临床医学院,黑龙江 哈尔滨 150001)
◁影像技术学▷
靶向趋化因子受体4(CXCR4)分子成像研究
曹学良1,付 鹏2,姜廷军1,栾 厦1,赵长久1
(1.哈尔滨医科大学附属第四医院,黑龙江 哈尔滨 150001;2.哈尔滨医科大学第一临床医学院,黑龙江 哈尔滨 150001)
目的:探讨99mTc标记针对靶向趋化因子受体4(CXCR4)mRNA的小干扰RNA(Small interference RNA,siRNA)分子探针用于乳腺癌荷瘤裸鼠基因显像的价值。方法:以双功能螯合剂HYNIC为螯合物对以CXCR4 mRNA某段序列为靶点的siRNA及人无关基因序列为靶点的对照siRNA进行99mTc标记,对其标记率、放化纯及稳定性进行分析。30只乳腺癌荷瘤裸鼠,建立的人乳腺癌MDA-MB-231裸鼠肿瘤模型,随机分成3组(每组10只),分别进行99mTcO4-、99mTc-HYNIC-siRNA(干扰组)和99mTc-HYNIC-siRNA(对照组)肿瘤显像。测量并计算每个时间点的(T/M)的比值。所得测量数据使用方差分析和两样本t检验进行统计分析。结果:干扰组的99mTc标记率为(61.26±2.47)%,对照组的99mTc标记率为(60.85±2.76)%。干扰组和对照组经纯化后,放化纯均达90%以上。干扰组和对照组分别溶于37℃的PBS和正常人新鲜血清中30 min和120 min后,性质保持稳定。注射不同探针后 1 h,4 h及 10 h时, 干扰组 T/M 比值分别为 3.486±0.145、4.574±0.222和 6.608±0.366; 对照组分别为 1.286±0.189、1.348±0.204 和 1.354±0.238;游离99mTcO4-组分别为 1.317±0.164、1.322±0.159 和 1.401±0.145,在每个成像时间点,3 组之间出现的T/M比值差异有统计学意义。干扰组在1 h、4 h、10 h各时间点的T/M比值与对照组及游离99mTcO4-组之间相比有差异,并且差异均有统计学意义 (t对照=29.20、33.84、38.07, t游离=31.29、37.61、41.86,P 均<0.01), 而对照组各时间点的 T/M 比值与游离99mTcO4-组差异均无统计学意义(t=0.392、0.318、0.533,P均>0.05)。结论:以99mTc标记的siRNA探针可特异性聚集于乳腺癌荷裸鼠肿瘤模型的肿瘤组织,为特异性诊断乳腺癌提供了一种新的方法。
乳腺肿瘤;放射性核素显像
Fire等[1]于1998年首次证实了mRNA可被同源靶双链小RNA分子诱导降解,使其表达基因沉默,这种现象称 RNA干扰 (RNA interference,RNAi)。现在RNAi技术已成为基因水平科研和治疗中重要技术之一。小干扰RNA(Small interfering RNA,siRNA)具有强大的基因靶向能力和沉默作用,是RNAi中的关键因素[2-3]。但是将siRNA直接应用于体内研究时,siRNA往往会因脱靶效应或者转运不良不能发挥基因沉默效应。放射性示踪技术安全可靠、探测灵敏高、分辨率好,可以用于大型动物。因此构建一种基于siRNA的放射性标记方法就变得十分有意义,放射性显像及治疗结合siRNA的基因沉默效应可达到显像、放射治疗及基因干扰的三重效果。
靶向趋化因子受体4(Chemokine receptor 4,CXCR4)属于G蛋白偶联受体超家族,在多种肿瘤组织和正常组织中均有表达,且其在肿瘤组织中的表达明显高于正常组织[4]。CXCR4与其配体CXCL12相结合后,可以激活相关下游信号通路并产生某些化学因子对肿瘤细胞的增殖、侵袭和远处转移等生物过程产生重要影响[5-6]。在多种人乳腺癌细胞系中CXCR4均有不同程度的表达,因此它是乳腺癌分子显像的新靶点。本研究选取人CXCR4 mRNA的siRNA序列,探讨CXCR4 siRNA分子探针用于乳腺癌荷瘤裸鼠基因显像的可能性。
1 材料和方法
1.1 实验材料
1.1.1 主要试剂
CXCR4小干扰RNA:CXCR4小干扰RNA的正义链及反义链均为含有21个碱基的序列,干扰组CXCR4 正义链序列:5’-GGGACUAUGACUCCAUGAATT-3’, 反 义 链 序 列 :5’ -UUCAUGGAGUCAUAGUCCCTT-3’,对照组 CXCR4正义链序列:5’-UUCUCCGAACGUGUCACGUTT-3’,反义链序列:5’-ACGUGACACGUUCGGAGAATT-3’, 在反义链的5’端连接一个6碳己基和氨基伯胺结构,作为与HYNIC耦联的基团,其3’端连接2个用于提高反义结合活性的脱氧胸腺核苷酸d(TT)结构。siRNA链购自上海吉玛公司,全程2’-甲氧基修饰;HYNIC购于上海吉尔生化有限公司;99mTcO4-来自于中国原子能科学研究院同位素所提供的99Mo-99mTc发生器;L15细胞培养基、脂质体2000、琼脂糖购自美国Invitrogen 公司;二甲基甲酰胺(DMF)、TRICINE、氯化亚锡购自美国Sigma公司;γ放射免疫计数器,购于中国科技大学创新股份有限公司。
1.1.2 主要材料
乳腺癌MDA-MB-231细胞,由哈尔滨医科大学附属四院中心实验室提供;SephadexTMG25凝胶层析柱及Sep-Pak C18反相层析柱购自美国Waters公司;SPECT:NM signature E.CAM Duet Camera,B,自于 Siemens公司;NU/NU 品系裸鼠(SPF 级别,雌性,6~8 周龄,体质量 18~22 g)购买于北京维通利华实验动物技术有限公司 (许可证编号:SCXK(京)2012-0001)。
1.1.3 主要仪器
MyCycler PCR仪购自美国Bio-Rad公司;半干式蛋白质电转膜仪、水平电泳仪购自北京六一仪器厂;γ放射免疫计数器购于中国科技大学创新股份有限公司;紫外分光光度计购自北京鑫科奥商贸有限公司。
1.2 实验方法
1.2.1 siRNA的设计与合成
本研究中siRNA靶点设计针对CXCR4 mRNA的核苷酸。其反义链的5’端连接一个6碳己基和氨基伯胺结构,作为与HYNIC耦联的基团,其3’端连接2个用于提高反义结合活性的脱氧胸腺核苷酸d(TT)结构。干扰组CXCR4反义链序列:5'-UUCAUGGAGUCAUAGUCCCTT-3’, 正义链序列:5’-GGGACUAUGACUCCAUGAATT-3’,siRNA 链购自上海吉玛公司,全程2’-甲氧基修饰。合成后使用HPLC进行纯化减压离心干燥。-20℃可保存6月。
1.2.2 siRNA与HYNIC的耦联及99mTc标记
先用乙腈10 mL及三蒸水20 mL预处理Sep-Pak C18反相层析柱。然后将HYNIC溶于纯的DMF 中,浓度为 10 mg/mL,取 siRNA 5 OD(165 μg),以25 mmol/L碳酸氢盐缓冲液(pH 8.5)溶解,终浓度为 5 μg/μL。 按照 siRNA:HYNIC=1∶20 的摩尔比例,振荡条件下,将HYNIC溶液逐滴加入siRNA中,室温条件60 min,用蒸馏水稀释至1 mL,经Sep-Pak C18反相柱纯化。99mTc标记用10mL 25mM碳酸氢铵溶液、10 mL含5%乙腈的25 mM碳酸氢铵溶液、10 mL 5%乙腈水溶液洗及1 mL 30%乙腈水溶液进行洗脱。收集流出液,8滴每管,80管,紫外分光光度计测定每管在260 nm处的吸光度,合并峰管,按每管10μg分装(1OD=33μg),-20℃储存备用。
将10μg siRNA-HYNIC溶于50μL浓度25mmol/L的碳酸氢盐缓冲液,加入 100 μL Tricine(7 mg/mL)、10 μL SnCl2(1 mg/mL)和99mTcO4-(185 MBq)混匀。室温条件60 min。以生理盐水作为洗脱液,用Sephadex G25凝胶层析柱纯化,收集滴出液,每管6滴,共80管,测量各管的放射性计数及各管在260nm处吸光度。干扰组CXCR4 siRNA与对照组siRNA均按照上述方法进行HYNIC耦联和99mTc标记。各取5 OD (165 μg)未耦联HYNIC的干扰组CXCR4 siRNA与对照组siRNA,与上述步骤相同,分别进行99mTc标记,使用Sephadex G25层析柱纯化分析。
1.2.3 标记物特性分析
放射性化合物的标记率:干扰组CXCR4 siRNA和对照组CXCR4 siRNA标记后,生理盐水洗脱,G25凝胶层析柱纯化,收集液体约60管,计算两种化合物的标记率。标记率=第一个峰的放射性计数/(60管的总放射性计数+凝胶层析柱的放射性计数)。
标记后化合物的稳定性:1.0 μg/mL99mTc标记的CXCR4 siRNA分别溶解于正常人血清和PBS中,经过30 min、120 min后Sep-Pak C18小柱纯化,收集流出管,γ计数仪检测放射性计数,描绘相应曲线图,观察放射峰出现的位置有无改变。
放射性化学纯度分析:分别标记10 μg干扰CXCR4 siRNA与对照CXCR4 siRNA,应用纸层析的方法进行放射性化学纯度分析。固定相为新华一号试纸,双扩展剂则选择丙酮和生理盐水,测定方法采用分段测量法。
1.2.4 脂质体包裹99mTc标记的CXCR4 siRNA
取99mTc-HYNIC-siRNA 10 μg 溶于 250 μL 无血清的L15培养基,室内常温静置5 min。5 μL lipofectamin 2000加入无血清 L15培养液250 μL。将两部分液体混合并轻轻混匀,室内常温静置20min。对照组按上述同样方法进行脂质体包裹。
1.2.5 乳腺癌裸鼠模型的建立
处于对数生长期的人乳腺癌MDA-MB-231细胞按细胞传代的方法制成单细胞悬液,应用细胞计数板计数,计算四角大方格内总细胞数。细胞/mL=(4大格细胞总数/4)×104。以无血清L15培养液将细胞浓度调节为106~107/mL用于实验。于裸鼠右下肢外侧皮下接种肿瘤细胞悬液0.2 mL,接种后小鼠饲养于无菌环境,观察肿瘤的生长情况,待瘤体直径长至约1~2 cm时,用于实验。
1.2.6 显像研究
将30只成瘤乳腺癌裸鼠随机 (简单随机抽样)分成3组,每组10只裸鼠,分别经尾静脉注射脂质体包裹的游离99mTcO4-、干扰组99mTc-HYNIC-siRNA和对照组99mTc-HYNIC-siRNA(剂量均为7.4 MBq)。小鼠以质量分数5%的水合氯醛麻醉后固定,采用低能准直器,能峰值140 keV,256×256矩阵,20%窗宽,于注射不同显像剂1 h、4 h及10 h分别采集裸鼠静态显像图像。以ROI技术测量各时间点的肿瘤及对侧肌肉放射性计数,并计算其比值(T/M)。
1.3 统计学处理
使用GraphPad Prism 5软件对数据进行分析,计量数据以经±s表示,P<0.05时差异有统计学意义。
2 结果
2.1 99mTc标记产物的标记率及其特性
产物的标记率:标记率=第一个峰的放射性计数/(60管的总放射性计数+凝胶层析柱的放射性计数)。未耦联HYNIC的干扰组siRNA和对照组siRNA 的99mTc标记率分别为(4.91±2.58)%和(4.82±3.09)%,耦联HYNIC后干扰组99mTc-HYNIC-CXCR4 siRNA 的标记率为(61.26±2.47)%(n=5),对照组99mTc-HYNIC-CXCR4 siRNA的标记率为(60.85±2.76)%(n=5)。结果表明 HYNIC能够显著提高siRNA的放射性标记率。干扰组99mTc-HYNIC-siRNA和对照组99mTc-HYNIC-siRNA放化纯皆达90%以上。
标记后化合物的稳定性:标记的CXCR4 siRNA在正常人血清和PBS中经过30 min、120 min后,通过C18小柱进行纯化,据观察放射性曲线图,并未见放射峰位置的变化(图1)。这一结果证实,标记产物稳定性好。
2.2 乳腺癌裸鼠模型的建立
接种乳腺癌细胞的裸鼠在无菌环境下饲养3~4周,待瘤体增大直径达1~2 cm时,处死取肿瘤组织行HE染色。光学显微镜下可见大小不一、异型性明显的肿瘤细胞,病理性核分裂象明显。
2.3 荷瘤裸鼠模型的显像结果
经尾静脉注射脂质体包裹的游离99mTcO4-、干扰组99mTc-HYNIC-siRNA和对照组99mTc-HYNIC-siRNA(剂量均为7.4 MBq)的荷乳腺癌裸鼠,以质量分数5%水合氯醛麻醉,于注射显像剂后1 h、4 h及10 h分别采集背侧静态图像。以ROI技术测量各时间点的肿瘤与对侧肌肉放射性计数并计算其比值。注射干扰组99mTc-HYNIC-siRNA的裸鼠,1 h后,可见肿瘤部位有放射性聚集,4 h及10 h肿瘤显像更清晰,T/M比值逐渐增加,分别为 3.486±0.145、4.574±0.222 和 6.608±0.366; 而对照组99mTc-HYNIC-siRNA及99mTcO4-组在注射后1 h、4 h及10 h时肿瘤部位皆显像不清;对照组99mTc-HYNIC-siRNA,1 h、4 h、10 h T/M 比值分别为 1.286±0.189、1.348±0.204 和 1.354±0.238;99mTcO4-组 1 h、4 h、10 h T/M比值分别为 1.317±0.164、1.322±0.159 和 1.401±0.145,在每个成像时间点,3组T/M比值差异有统计学意义 (F1=570.2,F4=903.1,F10=1294,P 均<0.01)。在各显像时间点干扰组的T/M比值均明显高于游离99mTcO4-和对照组,差异均有统计学意义(t对照=29.20、33.84、38.07,t游离=31.29、37.61、41.86,P 均 <0.01);而对照组99mTc-HYNIC-siRNA的T/M比值与游离99mTcO4-组间的差异无统计学意义 (t=0.392、0.318、0.533,均 P>0.05)。荷瘤鼠显像图见图 2。3 组数据间对比显像折线图见图3。
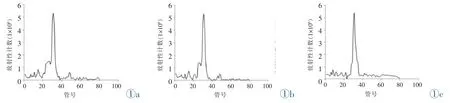
图1 99mTc-CXCR4-siRNA分别在血清和PBS中孵育前后经C18反相层析柱分析的放射性分布曲线图。图1a为孵育前,图1b为在血清中孵育120 min,图1c为在PBS中孵育120 min。Figure 1.Radioactivity distribution curve of99mTc-CXCR4-siRNA analyzed by C18 reverse-phase column before and after incubation in serum and PBS,respectively.Figure 1a:before incubation,Figure 1b:120 min in serum,Figure 1c:120 min in PBS.
3 讨论
趋化因子受体4(Chemokine receptor 4,CXCR4)起初因其在胚胎器官的发生、免疫功能和T淋巴细胞迁移等方面的重要作用而为人所熟知[7]。CXCR4是一种细胞膜受体,可结合G蛋白并具有趋化性[8],它在白细胞和某些上皮细胞表面正常表达,而在多种肿瘤细胞表面则过度表达,如神经母细胞瘤、乳腺癌、前列腺癌、卵巢癌、黑素瘤、肾癌等[9],且其表达水平的高低与肿瘤细胞的增殖、血管生成和远处转移密切相关。许多研究表明,在乳腺癌、前列腺癌、肺癌、胰腺癌和非霍奇金淋巴瘤等进展到远处转移的过程里CXCR4有着至关重要的影响[10]。
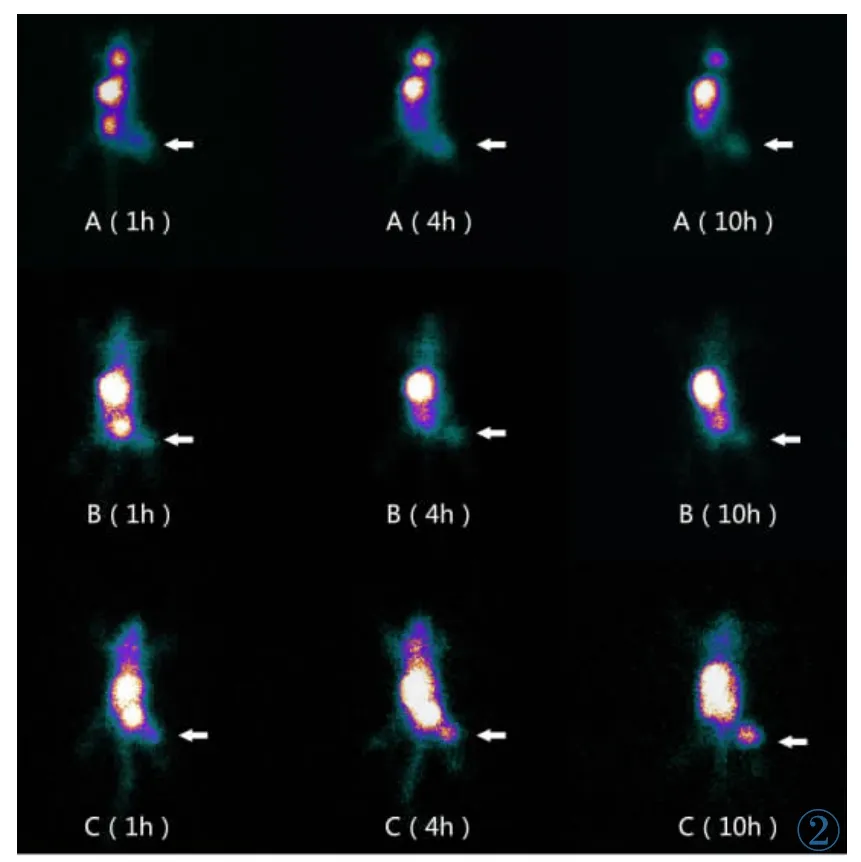
图2 荷乳腺癌裸鼠经尾静脉注射游离99mTcO4-及脂质体包裹的99mTc-HYNIC-siRNA显像图。尾静脉注射后1 h,4 h及10 h,A,B,C分别为游离99mTcO4-组,对照组99mTc-HYNIC-siRNA及干扰组99mTc-HYNIC-siRNA,箭头示肿瘤部位Figure 2. Imaging of99mTcO4-and liposomally encapsulated 99mTc-HYNIC-siRNA in nude mice bearing breast cancer via the tail vein.99mTcO4-,99mTc-HYNIC-siRNA and99mTc-HYNIC-siRNA(control group),respectively,at 1 h,4 h and 10 h after tail vein injection.Arrows show tumor location.

图3 荷乳腺癌裸鼠经尾静脉注射游离99mTcO4-及脂质体包裹的99mTc-HYNIC-siRNA显像,3组数据间对比显像折线图。干扰组(红色)、对照组(紫色)、游离 99mTcO4-组(蓝色)。Figure 3. Imaging of99mTcO4-and liposomally encapsulated 99mTc-HYNIC-siRNA in nude mice bearing breast cancer via the tail vein.line chart of three groups of data.Interference group(red),control group(purple),free99mTcO4-group(blue).
肿瘤的基因表达成像是使用放射性核素标记分子探针,在mRNA或蛋白质的水平上,在活体内无创性地探测特定肿瘤基因产物表达情况的一种显像方法。siRNA显像就是以放射性核素标记的siRNA作为示踪剂进行核素显像,以碱基互补配对原则为基础,使siRNA与目的基因特异性地结合,在整体水平上实现针对病变组织特定基因表达的动态监测,从而达到在基因水平早期、定性诊断疾病的目的[11-12]。因此本实验选取CXCR4作为靶基因来研究人乳腺癌基因显像。本实验选取与其相一致的针对CXCR4 CXCR4-370的siRNA,正义链序列为5’GGGACUAUGACUCCAUGAATT3’,反义链序列为5’UUCAUGGAGUCAUAGUCCCTT3’。本实验中在反义链的5’端连接一个6碳己基和氨基伯胺结构,作为与HYNIC耦联的基团,其3’端连接2个用于提高反义结合活性的脱氧胸腺核苷酸d(TT)结构。全程 2’-甲氧基修饰[13-14]。
在活体组织复杂的生理环境下,合成的siRNA探针是否能够在肿瘤组织中特异性聚集关系到显像的成败[15]。本实验结果显示,标记的CXCR4 siRNA在正常人血清和PBS中经过120 min后,经过纯化后未见放射峰位置的变化,说明标记产物稳定性好,未降解分离。
荷乳腺癌裸鼠SPECT显像结果显示:脂质体包裹的干扰组探针在肿瘤病灶内能够特异聚集并且随时间的延长逐渐清晰,T/M比值随之增加,而对照探针组在肿瘤病灶内放射性分布稀疏,游离99mTcO4-组,从图像中可见核素在裸鼠甲状腺组织中大量浓聚,而肿瘤部位放射性分布稀疏,与干扰探针组相对比,进一步说明肿瘤部位的核素聚集为干扰探针的特异性引起,而非核素的非特异性聚集所致。实验结果,脂质体包裹的干扰组探针裸鼠显像无甲状腺显影,更说明合成的分子探针纯度高,特异性好。
综上所述,使用HYNIC作为螯合剂标记后的探针不仅在体外能保持稳定,而且脂质体包裹的分子探针能够在荷乳腺癌裸鼠的肿瘤区特异性浓聚,该探针有望成为一种乳腺癌诊断敏感的示踪剂用于乳腺癌患者的无创性早期诊断。
[1]Fire A,Xu SQ,Montgomery MK,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[2]张超,庞全海.siRNA与miRNA在生物体基因调控中沉默机制的比较[J]. 中国生物化学与分子生物学报,2012,28(5):393-398.
[3]崔照琼,张彦,李艳琼.RNAi技术应用新进展[J].安徽医药,2012,(3):283-285.
[4]Vindrieux D,Escobar P,Lazennec G. Emerging roles of chemokines in prostate cancer[J].Endocrine-related Cancer,2009,16(3):663-673.
[5]Han TT,Fan L,Li J,et al.Role of chemokines and their receptors in chronic lymphocytic leukemia:Function in microenvironment and targeted therapy[J].Cancer Biol Ther,2013,15(1):0-1.
[6]Burger JA,Kipps TJ.CXCR4:a key receptor in the crosstalk between tumor cells and their microenvironment[J].Blood,2006,107(5):1761-1767.
[7]Caruz A,Samsom M,Alonso JM,et al.Genomic organization and promoter characterization of human CXCR4 gene[J].FEBS Lett,1998,426(2):271-278.
[8]Hamm HE.The many faces of G protein signaling[J].J Biol Chem,1998,273:669-672.
[9]Keeley EC,Mehrad B,Strieter RM.CXC chemokines in cancer angiogenesis and metastases[J].Adv Cancer Res,2010,106:91-111.
[10]Tietz O,Kamaly N,Smith G,et al.Design,synthesis and in vitro characterization of fluorescent and paramagnetic CXCR4-targeted imaging agents[J].Am J Nucl Med Molecular Imaging,2013,3(4):372-383.
[11]吴琼,张月红,付鹏,等.99Tcm标记MDM2反义寡核苷酸对人前列腺癌细胞目的基因表达的影响 [J].中华核医学与分子影像杂志,2014,34(2):125-129.
[12]张月红,赵长久,吴琼,等.小鼠双微体扩增基因反义探针用于荷人前列腺癌裸鼠的显像研究 [J].中华核医学与分子影像杂志,2014,34(1):48-52.
[13]康磊,王荣福,闫平,等.99mTc标记的小干扰RNA探针的制备及稳定性评价[J]. 核化学与放射化学,2010,32(6):348-353.
[14]Fu P,Tian L,Cao X,et al.Imaging CXCR4 Expression with99mTc-Radiolabeled Small-Interference RNA in Experimental Human Breast Cancer Xenografts[J].Molecular Imaging Biol,2016,18(3):353-359.
[15]McManus MT,Petersen CP,Haines BB,et al.Gene silencing using micro-RNA designed hairpins[J].Rna,2002,8(6):842-850.
The molecular imaging research of chemokine receptor 4(CXCR4)
CAO Xue-liang1,FU Peng2,JIANG Ting-jun1,LUAN Sha1,ZHAO Chang-jiu1
(1.The Fourth Hospital of Harbin Medical University,Harbin 150001,China;2.The First Hospital of Harbin Medical University,Harbin 150001,China)
Objective:To investigate the possibility of using small interference RNA(siRNA)targeting human chemokine receptor 4(CXCR4)radiolabeled with99mTc for diagnosing human breast cancer.Methods:Small interference RNA targeted to CXCR4 mRNA and negative control siRNA were synthesized and radiolabeled by99mTc with the bifunctional chelator HYNIC.The labeling efficiency,radiochemical purity and stability were investigated.Animal models of nude mice bearing human breast cancer MDA-MB-231 were established,divided them into three groups,10 mice in each group.99mTcO4-,99mTc-HYNIC-siRNA(interference group),99mTc-HYNIC-siRNA(negative control group)were separately injected through tail vein to the three groups.After99mTcO4-,99mTc-HYNIC-siRNA(interference group),99mTc-HYNIC-siRNA(negative control group)were introduced into these animal models,tumor images were acquired with SPECT,the ratio of T/M was calculated.The data were analyzed by two-sample t test and analysis of variance.Results:The labeling efficiency of siRNA(interference group)and siRNA(negative control group)were(61.26±2.47)%and(60.85±2.76)%respectively.The radiochemical purities were both above 90%.Incubated in fresh human serum and PBS for 30 min and 120 min at 37℃,respectively,probes’ properties remained stable in 2 hours.At 1,4 and 10 h after injection of different probes,the T/M ratios of99mTc-HYNIC-siRNA(interference group)were 3.486±0.145,4.574±0.222 and 6.608±0.366,and that of99mTc-HYNIC-siRNA(negative control group)were 1.286±0.189,1.348±0.204 and 1.354±0.238,with99mTcO4-group 1.317±0.164,1.322±0.159 and 1.401±0.145 respectively,and there were statistically significant differences in different groups at every time spots.The ratios of T/M in99mTcO4-group and99mTc-HYNIC-siRNA(negative control group)were significantly lower than those in99mTc-HYNIC-siRNA(interference group)at 1,4,10 h respec-tively(tcontrol=29.20,33.84 and 38.07,99mTcO4-=31.29,37.61 and 41.86,all P<0.01),and the T/M ratios at 1 h,4 h,10 h of99mTc-HYNIC-siRNA(negative control group)and99mTcO4-groups were not significantly different(t=0.392,0.318 and 0.533,all P>0.05).Conclusions:The99mTc-HYNIC-siRNA(interference group)could specificity accumulated in breast cancer tissue.The imaging with99mTc-HYNIC-siRNA may be a promising method for diagnosis of breast cancer.
Breast neoplasms;Radionuclide imaging
R737.9;R817.4
A
1008-1062(2017)05-0363-05
2016-07-28;
2016-08-24
曹学良(1988-),男,河北唐山人,医师。 E-mail:caoxueliang0451@163.com
赵长久,哈尔滨医科大学附属第四医院核医学科,150001。E-mail:13904606820@163.com
黑龙江省自然科学基金(面上项目)(H2015066)。
