一种鉴定山杨性别的SSR分子标记的筛选1)
2017-10-24王洪梅李春明白卉周志军王艳敏
王洪梅 李春明 白卉 周志军 王艳敏
(黑龙江省林业科学研究所,哈尔滨,150081)
一种鉴定山杨性别的SSR分子标记的筛选1)
王洪梅 李春明 白卉 周志军 王艳敏
(黑龙江省林业科学研究所,哈尔滨,150081)
为了对山杨的幼苗进行早期的性别鉴定,通过寻找与杨属性别染色体相关的分子标记,试着鉴定山杨的雌雄。采用SSR结合BSA技术对96个山杨个体(雌性各48个)进行性别差异标记的筛选,发现1对引物(BPCA90)在雄基因池扩增出差异条带。利用引物BPCA90检测待测样品的微卫星标记基因型,若检测得到长度约550 bp的单一片段为雄性,未检测到长度约550 bp的单一片段为雌性,从而完成对山杨的雌雄性别的鉴别。整个鉴定过程操作简单,方法鉴别率为100%,且得到条带结果清晰、鉴定过程特异性高、重复性好、稳定性强。
山杨;性别鉴定;SSR
山杨(Populusdavidiana. Dode)是我国广泛分布的乡土树种之一[1],属于白杨派山杨组,是重要先锋树种和山地造林树种。山杨材质优良,早期速生,是东北林区主要采伐树种。由于幼叶呈粉红色至鲜红色,山杨也可作为观赏树种[2]。因为山杨雌株飞絮不适合城乡绿化,所以绿化品种应选择山杨雄株。但是,山杨早期性别通过外部形态特征很难进行鉴定,只有在花果期才能进行准确的性别鉴定。本研究利用的SSR分子标记技术,通过寻找与杨属性别染色体相关的分子标记,鉴定山杨的雌雄,为山杨早期性别鉴定及育种工作提供辅助手段,缩短山杨绿化新品种的选育周期。此外,山杨幼株的性别鉴定有助于对山杨种群的性比格局及空间分布[3]、山杨性别因素对植株径向生长及气候因子关系的影响等问题的辅助研究[4]。本研究成果已申请专利并授权。
1 材料与方法
样本采集:96个山杨(雌雄各48个体)采自黑龙江省林口县青山林场的山杨种源家系保存林,摘取新鲜、无病虫害短枝的第一片幼嫩叶片,注明性别,用冰盒带回实验室用于DNA提取。
DNA提取:采用北京庄盟国际生物基因科技有限公司生产的ZP309-3植物基因组DNA提取试剂盒提取杨树总DNA,在1%琼脂糖凝胶中电泳检测其DNA样品的浓度和纯度。用ddH2O稀释至50 mg/L左右。
BSA基因池的建立:根据混合分离群体分析法(BSA)原理[5],随机选择雌雄个体各10个,各吸取20 μL DNA溶液混匀,组成雌雄基因池。
SSR引物的筛选与合成:根据文献查找与杨属性别相关的SSR分子标记的引物共26对。其中ORPM_206、ORPM_276、PMGC_2702、ORPM_432与黑杨(PopulusnigraL.)性别相关的4对SSR引物来源于[16];GCPM_79、GCPM_249、GCPM_1917、GCPM_249、GCPM_2319、GCPM_604、GCPM_4063、GCPM_1278、GCPM_1131、GCPM_4000、GCPM_831、ORPM_277、ORPM_263、GCPM_2829、ORPM_433、GCPM_204、GCPM_2803与杨属(Populus)性染色体相关的17对引物来源于[7];BPGGG82、BPCA90、BPTG50、BPTTG60、BPTC66与欧洲山杨(Populustremula)×美洲山杨(Populustremuloides)性染色体相关的5对引物来源于[8]。所有引物由上海生工生物工程公司合成。
PCR及电泳:PCR反应总体系为25 μL,含有10×Buffer 2.5 μL,MgCl2(25 mmol/L)1.5 μL,dNTPs(10 mmol/L) 0.25 μL,上、下游引物(10 μmol/L)各0.5 μL,Taq酶0.5 U,模板DNA 50 ng左右。PCR反应程序为94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,30个循环,最后72 ℃延伸7 min。扩增产物经3%琼脂糖凝胶电泳分离,于0.5 mg/L EB染色,凝胶成像仪拍摄保存。
差异条带的筛选与验证:采用26对SSR引物对所构建的山杨雌雄基因池进行PCR扩增,分析扩增产物的SSR电泳图谱,初步查找雌雄两个群体的差异性条带,对有差异的引物按照上述PCR条件对构建雌雄基因池的10个山杨个体进行PCR扩增,分析有差异的等位基因片段在个体上具体的扩增情况,对差异条带进行24个山杨个体的验证,然后用其余的72个个体进行同样的操作,进一步验证该引物鉴定山杨雌雄的准确率。
2 结果与分析
2.1 BSA分池PCR扩增结果
用26对微卫星引物对所构建的雌雄基因池进行PCR扩增,扩增产物用3%琼脂糖凝胶电泳检测。结果表明,26对引物中,发现有2对(BPTG50和BPCA90)引物扩增出的差异条带均出现在雄性基因池里,部分电泳结果如图1。
随机选取山杨雌雄植物各5株用这两个差异引物(BPTG50和BPCA90)做进行一步个体分析。结果发现,引物BPCA90在雌雄个体上出现差异,若检
测得到长度为550 bp的单一片段为雄性,未检测到550 bp的单一片段为雌性,如图2。
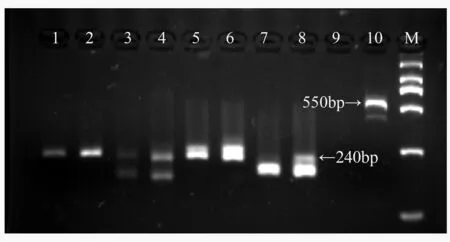
1、2道为引物GCPM_2829,3、4道为引物BPTC66,5、6道为引物BPTTG60,7、8道为引物BPTG50,9、10道为引物BPCA90;1、3、5、7、9为雌性基因池,2、4、6、8、10为雄性基因池;M.DS 2 000。
图1部分引物对山杨雌雄基因池筛选结果

泳道1~5.雌性个体;6~10.雄性个体;M.DS 2000;箭头是雄性特异片段。
图2引物BPCA90对山杨单株DNA扩增的结果
2.2 差异等位基因片段在山杨个体中的验证
将BSA池中筛选到的1对引物首先在构建基因池的24个个体中进行PCR扩增,并对24个山杨(雌雄各12个个体)个体进行验证,能100%的区别山杨雌雄个体,若检测得到长度为550 bp的单一片段为雄性,未检测到550 bp的单一片段为雌性。如图3,1~12个雌性个体在这个位点上没有条带,13~24个雄性个体上都出现了条带。

M.DS 2000分子标记;1~12为雌性个体;13~24为雄性个体。
进一步对余下的72个山杨雌雄个体进行验证,结果发现,引物BPCA90的差异条带在所有的雌性个体中未扩增出来,而在所有的雄性个体中都扩增出来,与第一轮的24个山杨个体验证的结果相同(图4)。
3 讨论
本研究所使用的引物来源于参考文献[8],该文主要研究了欧洲山杨和美洲山杨杂交的连锁群XIX的基因图谱和性连锁SSR标记的鉴别。选取欧洲大叶杨的SSR标记对130个欧洲山杨和美洲山杨的杂交株的连锁群XIX进行基因图谱的制作。该文主要提供了一种杨树杂交株性连锁群XIX的基因图谱的制备方法,SSR引物在该文中的作用是为了实现遗传图谱的制作,该文主要研究的是雄性和雌性植株性遗传图谱上性基因的位置关系,SSR标记的使用是为了实现基因更精准的定位,文中并没有公开其中哪些或那对引物能够用于杨树性别的鉴定。本研究利用该文提供的引物(BPCA90)进行PCR反应,若检测得到长度约550 bp的单一片段,则为雄性,若未检测到长度约550 bp的单一片断,则为雌性。本研究将引物BPCA90F和BPCA90R应用于山杨性别的鉴定中,该方法具有鉴别率100%、快速、稳定等优点,实现了山杨雌雄幼株性别的鉴定。


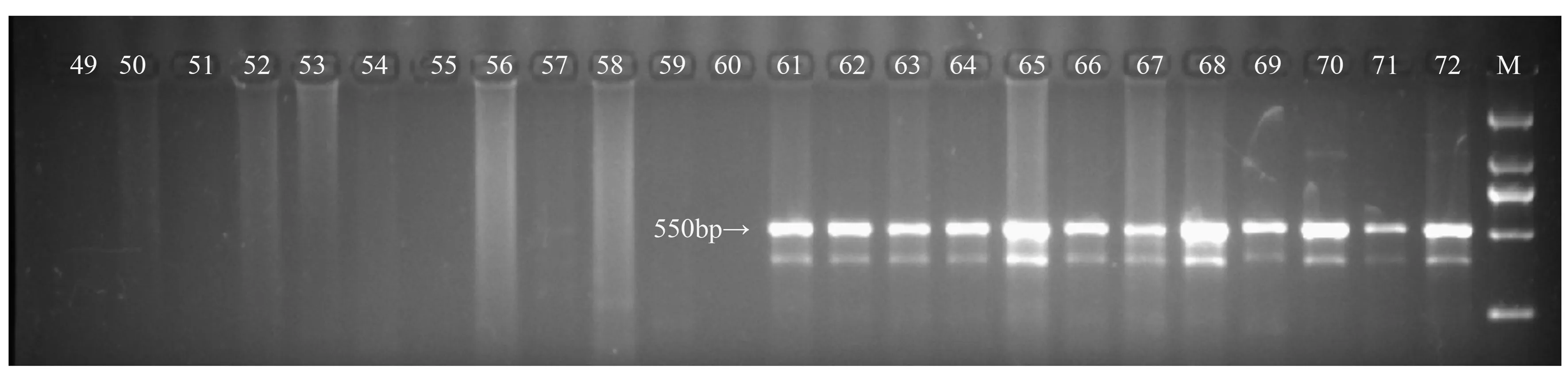
M.DS 2000分子标记;1~12为雌性个体;13~24为雄性个体;25~36为雌性个体;37~48为雄性个体;49~60为雌性个体;61~72为雄性个体。
目前为止,用微卫星DNA序列标记进行雌雄异株早期性鉴定的研究还比较少。Parasnis et al.[9]用微卫星(GATA)4探针鉴定了番木瓜1个5kb的特异条带仅出现在雄株中,表明微卫星标记可以鉴定番木瓜的雌雄,并发现SSR标记进行早期性别鉴定的准确率达到100%,与本研究在文献[8]中找到的与山杨性染色体相关的SSR标记所获得鉴定准确率达到100%的结果是一致的。最近,表达序列标签(EST)为SSR标记的开发提供了一个巨大的有价值的来源,避免了传统SSR引物在开发时费用高的问题。EST-SSR标记保守性质与基因组SSR标记相比在物种之间具有更高通用性[10]。林开勤等[11]利用140对EST-SSR引物筛选出了1个与杜仲雄株性别相关的引物EST-Eu059,邓传良等[12]利用EST-SSR引物序列从菠菜雄性基因组中扩增出一条分子量为200b左右的特异性条带,与本研究在雄性山杨中发现特异性条带是一致的,说明利用基于表达序列标签(EST)开发SSR引物进行植物性别鉴定是可行的。齐凤慧等利用EST-SSR引物序列经3轮筛选,选出2对引物用于200棵水曲柳雌雄鉴定,雌雄差异率分别64.5%和89.5%[13],雌雄辨别率没用达到100%,可能需要进一步开发SSR引物,研究雄性和雌性植株性遗传图谱上性基因的位置关系,实现基因更精准的定位。随着SSR标记的开发成本的降低,利用SSR引物对雌雄植株的性染色体进行更精准定位,只要引物确定,其性别早期鉴定结果是极为稳定和可靠的,这一方法可以应用于多年生经济物种的早期性别鉴定。
4 结论
本研究筛选出了一个与山杨雄株性别相关的SSR标记BPCA90,该引物正向序列为5′-CCTAGCCTTCATTCTCATTCAGC-3′,反向序列为5′-GGTTGCTAGTCAGCTTCTTACC-3′。应用该标记能够在山杨开花前检测其性别,整个操作简便快捷,鉴别率为100%,且得到条带结果清晰、特异性高、重复性好、稳定性强,为山杨雌、雄植株的合理利用提供了技术保障,从而提高山杨资源利用率。
[1] 刘培林,赵吉恭.山杨良种选育[M]//林业部科技司编.阔叶树遗传改良.北京:科学技术文献出版社,1991.
[2] 周以良,童世林,聂绍荃.黑龙江树木志[M].哈尔滨:黑龙江科学技术出版社,1986.
[3] 潘春芳,赵秀海,夏富才,等.长白山山杨种群的性比格局及其空间分布[J].生态学报,2011,31(2):297-305.
[4] 高露双,赵秀海,王晓明,等.雌雄异株植物山杨的气候响应差异[J].应用生态学报,2014,25(7):1863-1869.
[5] ICHELMORE R W, PARAN I, KESSELI R V. Identification of markers linked to disease resistance genes by bulked segregant analysis: a rapid method to detect markers in specific genomic regions by using segregating populations[J]. Proc Nati Acad Sci USA,1991,88(21):9828 -9832.
[6] AUDET M, JOR G E, PAOLUCCI I, et al. Genetic linkage maps ofPopulusnigraL. including AFLPs, SSRs, SNPs and sex trait[J]. Tree Genet Genomes,2008,4(1):25-36.
[7] YIN T, DIFAZIO S P, GUNTER L E, et al. Genome structure and emerging evidence of an incipient sex chromosome inPopulus[J]. Genome Res,2008,18(3):422-430.
[8] PAKUL B, GROPPE K, MECUCCI F, et al. Genetic mapping of linkage group XIX and identification of sex-linked SSR markers in aPopulustremula×Populustremuloidescross[J]. Can J For Res,2011,41(2):245-253.
[9] PARASNIS A S, RAMAKRI S W, CHOWDARI K V, et al. Microsatellite (GATA)n reveals sex-specific differences in Papaya[J]. Theor Appl Genet,1999,99(6) :1047-1052.
[10] GUPTA P K, RUSTGI S, SHARMA S, et al. Transferable EST-SSR markers for the study of polymorphism and genetic diversity in bread wheat[J]. Mol Genet Genomics,2003,270(4):315-323.
[11] 林开勤,赵德刚,李岩,等.杜仲性别相关EST-SSR标记的开发[J].林业科学,2016,52(10):146-152.
[12] 邓传良,高俊,曹莹,等.菠菜性别相关EST-SSR标记的开发及应用[J].基因组学与应用生物学,2012,31(5):467-472.
[13] 齐凤慧,孙宏冉,詹亚光.EST-SSR标记在水曲柳雌雄鉴定中的应用[J].西北植物学报,2015,35(3):472-479.
ScreeningSSRMarkersforSexIdentificationinPopulusdavidianaDode
//Wang Hongmei, Li Chunming, Bai Hui, Zhou Zhijun, Wang Yanmin
(Forestry Research Institute of Heilongjiang Province, Harbin 150081, P. R. China)
In order to identify the sex inPopulusdavidianaDode seedlings, we identified male and female ofP.davidianaDode by searching sex chromosome-correlated markers inPopulus. Microsatellites combined with bulked segregation analysis (BSA) were used to screen the gender differences of 96 individuals (48 for male and female each) inP.davidianaDode, specific DNA fragments of male gene pool were amplified by 1 pairs of primers (BPCA90). A specific fragment of about 550 bp was obtained from the male plant through nested PCR using primer BPCA90 to amplify the genomic DNA abstracted from the leaves of male and female trees. The whole appraisal process operation simple, the method accuracy was 100%, and bands are clear with appraisal process high specificity, good repeatability, and strong stability.
PopulusdavidianaDode; Sex identification; SSR
1)黑龙江省森林工业总局应用研究项目(sgzjY2014007)。
王洪梅,女,1979年9月生,黑龙江省林业科学研究所,副研究员。E-mail:wanghm1979@126.com。
李春明,黑龙江省林业科学研究所,副研究员。E-mail:lichunming_lcm@163.com。
2017年4月13日。
责任编辑:潘 华。
S792.11
//Journal of Northeast Forestry University,2017,45(10):17-19,29.
1)河南省基础与前沿项目(162300410157);河南省教育厅重点研究项目(17A21005)。
第一作者简介:张少伟,男,1981年10月生,中国林业科学研究院林业研究所,博士研究生;现工作于河南农业职业学院园艺园林学院,讲师。E-mail:hncazsw@126.com。
