长柱金丝桃ISSR-PCR反应体系的建立与优化1)
2017-10-24王丽俊王霞
王丽俊 王霞
(吉林农业科技学院,吉林省·吉林市,132101)
长柱金丝桃ISSR-PCR反应体系的建立与优化1)
王丽俊 王霞
(吉林农业科技学院,吉林省·吉林市,132101)
为筛选可用于长柱金丝桃遗传分析的最适ISSR-PCR反应体系,采用正交试验对影响ISSR-PCR反应的5个重要因素(Taq DNA聚合酶、dNTPs、Mg2+、引物和模板DNA浓度)进行4水平正交优化,并对退火温度、循环次数进行筛选。结果表明,20 μL ISSR-PCR最佳反应体系包括Taq DNA聚合酶1.0 U、dNTPs 0.2 mmol·L-1、Mg2+3.0 mmol·L-1、引物0.4 μmol·L-1、DNA模板40 ng,对ISSR-PCR反应的影响程度由大到小为:Taq DNA聚合酶、引物、Mg2+、dNTPs、DNA模板;引物UBC822的最佳退火温度52.7 ℃,最佳循环次数41,利用优化的反应体系从61条引物中筛选出12条稳定性好、多态性高的引物,验证试验表明优化的反应体系具有较高的稳定性。
长柱金丝桃;ISSR反应体系;正交试验;引物筛选
长柱金丝桃(HypericumlongistylumOliv.)为藤黄科金丝桃属植物,俗称湖南连翘、黄海棠、红旱莲等,其花色金黄,植株秀丽,广泛分布于我国内蒙古、东北、黄河、长江、珠江流域以及朝鲜、日本等地。研究发现,长柱金丝桃富含金丝桃苷、山奈酚、槲皮素、金丝桃素、黄酮类化合物等生物活性物质,具有抗菌消炎、镇静止痛、止咳祛痰、抗抑郁、抗癌等功效[1-2]。研究长柱金丝桃种质资源的遗传多样性是对其进行种质资源保护、优良品种选育的前提和基础,目前,对长柱金丝桃的研究主要集中在药理和化学分析方面,关于遗传学方面的研究尚未见报道。
简单序列重复区间扩增(ISSR)分子标记,由简单重复序列(SSR)标记技术发展而来[3],主要用于检测2个SSR间DNA序列的多态性,其基本原理是在SSR的3’或5’端锚定1~4个随机碱基,并以此为引物进行PCR扩增,由于SSR序列广泛分布于基因组的不同位置,因此1条ISSR引物可以扩增出多条DNA片段。ISSR分子标记结合了随机扩增多态性DNA(RAPD)的优点,同时克服了RAPD、SSR、限制性片段长度多态性(RFLP)等技术的缺点,不需要预先知道靶标DNA序列,具有高效、快速、稳定、易操作、成本低等优点,目前已广泛用于指纹图谱构建、亲缘关系鉴定、种质资源遗传多样性分析等领域[4-7]。建立并优化长柱金丝桃的ISSR-PCR反应体系是进行ISSR遗传分析的前提和基础。本研究利用正交试验筛选长柱金丝桃ISSR-PCR的最佳反应体系,并在此基础上,进一步筛选退火温度、循环次数和引物,最终获得优化的长柱金丝桃ISSR-PCR反应体系。
1 材料与方法
供试长柱金丝桃分别采自吉林市船营区锅顶山、左家自然保护区、磐石市牛心镇兴隆村,依次标记为GD、ZJ、XL,材料用液氮保存带回实验室,在冰箱中-20 ℃储存备用。
dNTPs、Taq DNA聚合酶、DL2000 DNA Marker、琼脂糖等均购自上海生工生物工程有限公司,ISSR引物由上海生工生物工程有限公司合成。
基因组DNA的提取:采用CTAB法提取长柱金丝桃基因组DNA[8-9],用1%琼脂糖凝胶电泳和检测基因组DNA的质量,用核酸分析仪(BIOSPEC-NANO)检测DNA的浓度和纯度,并将基因组DNA质量浓度调整为50 mg/L,-20 ℃贮存备用。
ISSR-PCR正交试验设计:按照L16(45)正交设计表,对影响反应体系的Taq DNA聚合酶、dNTPs、Mg2+、引物和模板DNA质量浓度5个主要因素进行4水平正交试验(见表1)。以ZJ为模板,以UBC822为引物,采用20 μL的ISSR-PCR反应体系,体系中除了含有考察的5个组分外,还含有1×PCR buffer和ddH2O。扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,52 ℃退火50 s,72 ℃延伸2 min,43个循环;72 ℃再延伸10 min;4 ℃保温。PCR产物用2%的琼脂糖凝胶电泳进行检测分析,根据电泳条带的数量、清晰度寻找最佳反应条件。
ISSR-PCR反应体系的进一步优化:采用正交试验筛选的最佳反应体系,进一步筛选退火温度和循环次数。
引物筛选:根据哥伦比亚大学(UBC)设计的ISSR引物序列[10],从61条引物中筛选适合长柱金丝桃ISSR-PCR反应的引物。
体系稳定性验证:采用上述筛选的最优反应体系,利用引物UBC842、UBC834对3份长柱金丝桃DNA样品进行PCR扩增,检测反应体系的稳定性。
2 结果与分析
2.1 基因组DNA质量检测
基因组DNA电泳图如图1所示,3个样品的DNA条带明亮清晰,无弥散现象,紫外分光光度法检测发现,所有基因组DNA的A260与A280比值均在1.74~1.89的范围内,说明得到的DNA纯度较高,基本上无RNA、多糖、酚类等杂质,质量较好,符合ISSR-PCR分析的要求。
2.2 ISSR反应的正交优化
正交试验结果如图2所示,16个组合都有扩增产物,组合1、2、3、7、16扩增条带少,亮度低,扩增效果较差;组合4、6、8、9、10、11、12、13、14、15扩增的条带较多,但部分条带较弱且不清晰;组合5扩增效果最好,条带清晰明亮,多态性高。参照何正文等[11]的评分规则,对16个组合进行1~16计分,条带数越多、亮度越大、清晰度越好的组合得分越高,最高得分为16,最低得分为1,得分进行极差分析(见表1和表2),可知各因素对长柱金丝桃ISSR反应的影响程度从大到小依次为Taq DNA聚合酶、引物、Mg2+、dNTPs、DNA模板。综上,长柱金丝桃ISSR-PCR的最佳反应体系为:Taq DNA聚合酶1.0 U、DNA模板40 ng、dNTPs 0.2 mmol·L-1、Mg2+浓度3.0 mmol·L-1、引物0.4 umol·L-1。
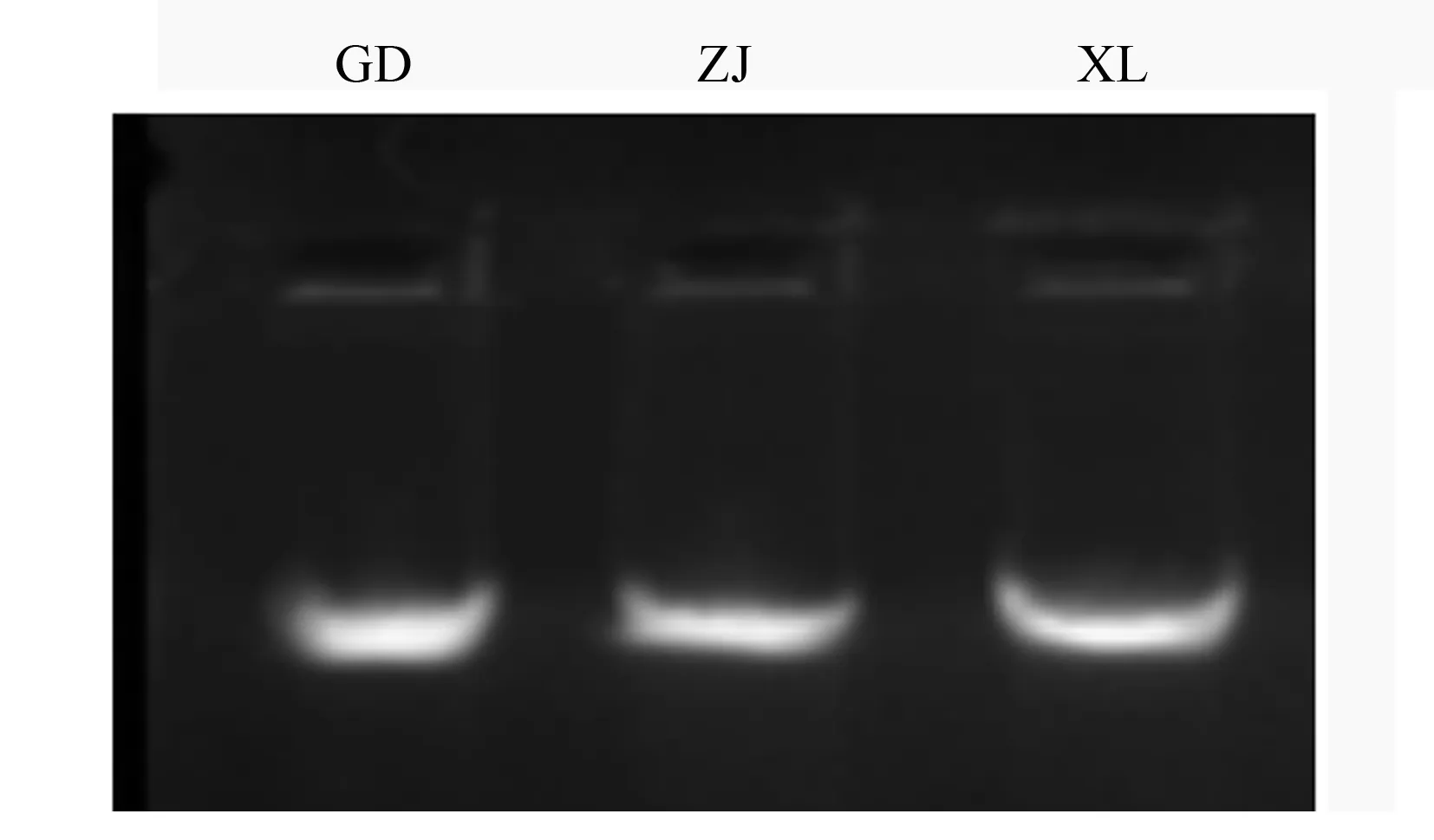
图1 基因组DNA电泳结果

处理组号TaqDNA聚合酶活/UdNTPs浓度/mmol·L-1DNA模板质量/ng引物浓度/μmol·L-1Mg2+浓度/mmol·L-110.500.2035.000.201.5020.500.3040.000.302.0030.500.4045.000.402.5040.500.5050.000.503.0051.000.2040.000.403.0061.000.3035.000.502.5071.000.4050.000.202.0081.000.5045.000.301.5091.500.2045.000.502.00101.500.3050.000.401.50111.500.4035.000.303.00121.500.5040.000.202.50132.000.2050.000.302.50142.000.3045.000.203.00152.000.4040.000.501.50162.000.5035.000.402.00

表2 ISSR-PCR正交试验结果极差分析
2.3 退火温度的确定
根据引物UBC822的DNA熔解温度(Tm值),将退火温度设为43.5、45.3、47.3、48.6、49.7、51.3、52.7、54.3、55.7、57.0 ℃共10个梯度,筛选最佳退火温度。扩增结果如图3所示,在43.5~51.3 ℃的温度范围内,随退火温度升高,扩增条带逐渐清晰,条带增多,退火温度为52.7 ℃时,条带多且清晰,扩增效果最好;之后随退火温度升高,条带数减少,甚至无扩增条带。因此,引物UBC822的最佳退火温度为52.7 ℃。
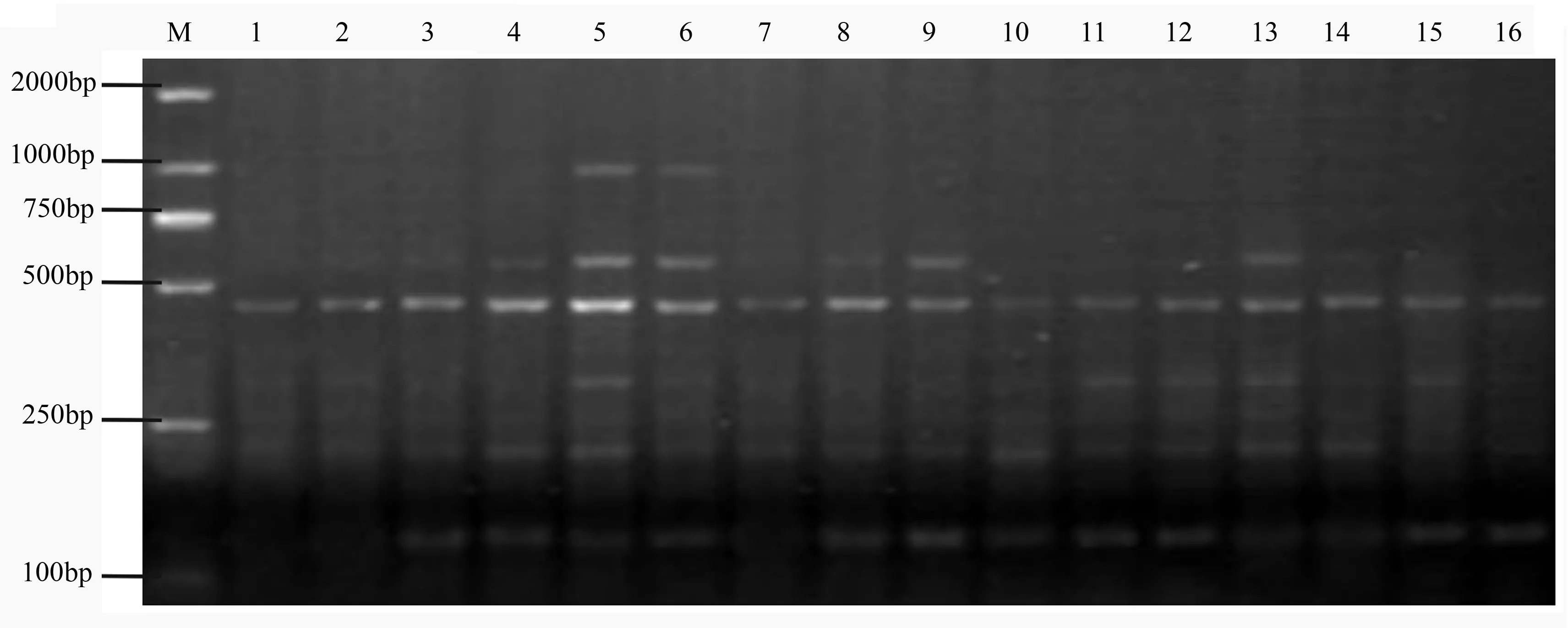
M为DL2000 DNA marker;从左到右为1~16处理组合编号。

M为DL2000 DNA Marker;1~10退火温度依次为43.5、45.3、47.3、48.6、49.7、51.3、52.7、54.3、55.7、57.0 ℃。
图3不同退火温度的ISSR-PCR扩增结果
2.4 循环次数的确定
选用最佳反应体系和最适退火温度,将循环次数设为30、33、36、39、41共5个梯度,筛选最佳循环次数,结果如图4所示,随循环次数增加,条带数量增多,亮度增强,循环次数为41时,条带清晰明亮且数量多,扩增效果最好。因此,最佳循环次数为41。

M为DL2000 DNA Marker;1~5循环次数依次为30、33、36、39、41次。
图4不同循环次数的ISSR-PCR扩增结果
2.5 引物筛选
利用优化的ISSR-PCR反应体系,从61条引物中筛选出12条适合长柱金丝桃的ISSR引物(表3),这些引物的扩增条带清晰、明亮,多态性好,退火温度在49.5~54.3 ℃范围内,平均退火温度为52.88 ℃。
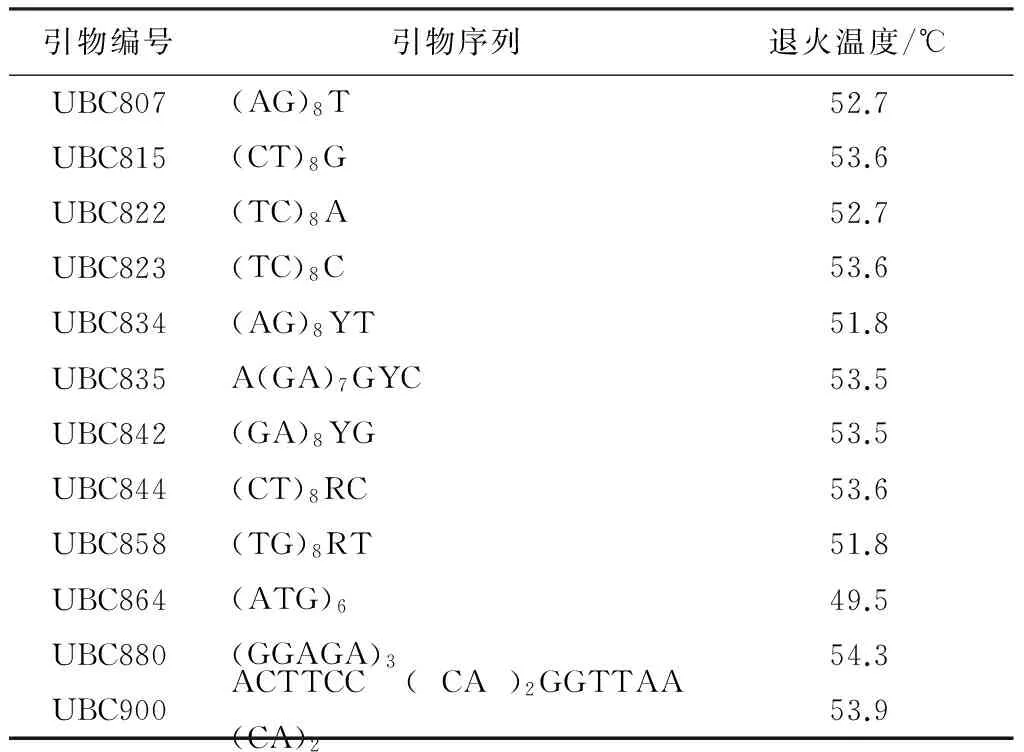
表3 筛选的ISSR引物及其退火温度
注:R=A/G;Y=C/T。
2.6 长柱金丝桃ISSR-PCR反应体系验证
采用引物UBC842、UBC834对筛选的最佳ISSR-PCR反应体系进行验证,结果如图5所示,2种引物对3份长柱金丝桃样品的扩增条带多态性高、重复性好,说明该ISSR-PCR反应体系稳定可靠。
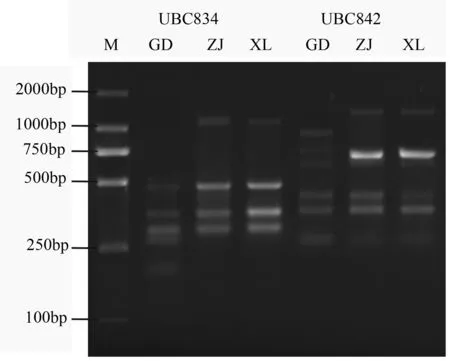
M为DL2000 DNA Marker;泳道2~4是引物UBC834,泳道5~7是引物UBC842。
图5引物UBC834和UBC842的ISSR反应结果
3 结论与讨论
ISSR分子标记技术操作方便、成本低廉、稳定性高,常被用于遗传多样性分析、遗传图谱构建以及种属间的分子鉴定等研究领域,但是其反应结果受诸多种因素的影响,如引物、DNA模板和dNTPs作为PCR反应的原材料,其浓度过低会降低扩增速率,浓度过高则会增加错配率。适量的Mg2+是Taq DNA聚合酶发挥作用所必需的,一般Mg2+浓度过低会使Taq DNA聚合酶活性降低甚至完全丧失,导致PCR产量下降,Mg2+浓度过高则会降低PCR反应的特异性。因此建立并优化ISSR-PCR反应体系具有重要意义。本试验针对影响ISSR-PCR反应的5个重要因素进行4水平正交优化,发现Taq DNA聚合酶和引物浓度是影响ISSR反应的主要因素,dNTPs和Mg2+次之,模板浓度的影响最弱,与田艳伶[12]的研究结果不一致(dNTPs>模板DNA>Mg2+>Taq酶>引物)。长柱金丝桃20 μL ISSR-PCR最佳反应体系包括Taq DNA聚合酶1.0 U、dNTPs 0.2 mmol·L-1、Mg2+3.0 mmol·L-1、引物0.4 μmol·L-1、DNA模板40 ng,与乌腺金丝桃(Taq DNA聚合酶含量为1.0 U、dNTPs 0.2 mmol·L-1、Mg2+2.0 mmol·L-1、引物0.4 μmol·L-1、DNA模板45 ng)[13]、菜薹(Taq DNA聚合酶1.0 U、dNTPs 250 μmol·L-1、引物0.25 μmol·L-1、Mg2+2.5 mmol·L-1、模板DNA 30 ng)[14]的最佳反应体系相似,与贯叶连翘(20 μL ISSR-PCR反应体系中包括Mg2+1.2 mmol·L-1、Taq DNA聚合酶50 U·mL-1、DNA模板20 ng·μL-1、dNTPs浓度250 μmol·L-1、引物浓度0.75 μmol·L-1)[15]、翼梗五味子(Taq DNA聚合酶1.0 U、Mg2+1.50 mmol·L-1、模板DNA40 ng、dNTPs 0.25 mmol·L-1、引物0.5 μmol·L-1)[16]、栝楼(DNA模板30 ng、Mg2+2.0 mmol·L-1、dNTPs 0.3 mmol·L-1、引物0.5 μmol·L-1、Taq DNA聚合酶0.5 U)[17]等的ISSR-PCR最佳反应体系相差较大。
循环次数和退火温度同样会影响ISSR-PCR的扩增结果,循环次数直接影响扩增产物量,试验发现最佳循环次数为41次,与地枫皮的最佳循环次数(40次)[18]相近。退火温度一般由引物的Tm值决定,因此不同引物的退火温度不同,温度过低往往会出现非特异性条带,温度过高则会因退火不彻底或不成功,使特异性条带减弱甚至消失,试验中发现筛选的12条ISSR引物的退火温度在49.5~54.3 ℃范围内,与优化大旗瓣凤仙引物退火温度(48~52 ℃)[19]相似。利用优化的反应体系,随机筛选引物UBC842和UBC834对3份长柱金丝桃样品进行验证试验,结果表明该反应体系重现性好、稳定性高,为后续长柱金丝桃种质的遗传多样性分析、种质资源保存和良种繁育等奠定基础。
[1] 姜英子,王科斯,金慧颖,等.延边地区长柱金丝桃中4种酮类成分的含量测定[J].延边大学学报(自然科学版),2014,40(2):182-185.
[2] 杨连荣,张哲锋,齐乐辉,等.长柱金丝桃抗抑郁作用有效部位的实验研究[J].哈尔滨商业大学学报(自然科学版),2010,26(1):4-5,25.
[3] ZIETKIEWICZ E, RAFALSKI A, LABUDA D. Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J]. Genomics,1994,20(2):176-183.
[4] 马丽,郝兆祥,周玉亮,等.果用石榴品种的ISSR遗传多样性分析[J].北方园艺,2016(21):106-110.
[5] 王书珍,查三省,程呈,等.杜鹃花ISSR-PCR反应体系的建立和优化[J].北方园艺,2015(14):111-114.
[6] 李钰莹,董宽虎.山西白羊草种质资源遗传多样性的ISSR分析[J].草业学报,2014,23(1):217-222.
[7] LU J J, ZHAO H Y, SUO N N, et al. Genetic linkage maps of Dendrobium moniliforme and D. officinale based on EST-SSR, SRAP, ISSR and RAPD markers[J]. Scientia Horticulturae,2012,137(1):1-10.
[8] 何钢,朱丽芳,梁文斌,等.仙茅根茎DNA的提取及其ISSR-PCR反应体系的优化[J].经济林研究,2016,34(1):33-39,44.
[9] 陈河龙,高建明,张世清,等.剑麻ISSR反应体系的建立及其优化[J].贵州农业科学,2015,43(2):20-23.
[10] 张青林,罗正荣.ISSR及其在果树上的应用[J].果树学报,2004,21(1):54-58.
[11] 何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
[12] 田艳伶,李志辉,杨模华,等.钩栗ISSR-PCR反应体系的建立与优化[J].中南林业科技大学学报,2015,35(2):32-37.
[13] 王霞,徐济责,王欢,等.乌腺金丝桃ISSR反应体系的构建及其遗传多样性分析[J].北方园艺,2017(5):96-101.
[14] 冒维维,马金骏,薄天岳,等.正交设计优化菜薹ISSR反应体系研究[J].分子植物育种,2006,4(6):137-141.
[15] 冯俊姣,何苗,联想.贯叶连翘ISSR-PCR反应体系的建立与条件优化[J].安徽农业科学,2012,40(36):17525-17527.
[16] 吴生,熊宇婷,谢砚,等.正交设计优化翼梗五味子ISSR-PCR反应体系[J].中草药,2011,42(5):976-979.
[17] 李慧慧,朱玉球,斯金平,等.栝楼ISSR-PCR体系的正交优化[J].生物技术,2009,19(6):38-41.
[18] 唐辉,陈宗游,史艳财,等.正交设计优化地枫皮ISSR-PCR反应体系[J].中草药,2013,44(5):610-615.
[19] 赵博,李景剑,符支宏,等.正交设计优化大旗瓣凤仙ISSR-PCR反应体系[J].南方农业学报,2014,45(2):184-188.
EstablishmentandOptimizationofISSR-PCRReactionSystemforHypericumlongistylumOliv.
//Wang Lijun, Wang Xia
(College of Jilin Agriculture Science And Technology, Jilin 132101, P. R. China)
The five important factors (Taq DNA polymerase, Mg2+, dNTPs, primers and DNA template concentration) of ISSR-PCR reaction were studied to establish the suitable reaction system by orthogonal experiments, and then the annealing temperature and cycles were optimized. The results showed that 20 μL ISSR-PCR optimal reaction system including 1.0 U Taq DNA polymerase, 0.2 mmol·L-1dNTPs, 3.0 mmol·L-1Mg2+, 0.4 μmol·L-1primers and 40ng DNA template, the descending degree of impact on the ISSR-PCR reaction was Taq DNA polymerase, primer, Mg2+, dNTPs, and DNA template. The best annealing temperature and cycle times of primer UBC822 were 52.7 ℃ and 41, and 12 stability, and high polymorphic primers were selected from 61 primers. The optimal reaction system showed a very stable result.
HypericumlongistylumOliv.; ISSR Reaction System; Orthogonal Experiment; Primer Selection
S567.239
1)国家级大学生科技创新项目(201611439018);吉林省大学生科技创新项目(吉农院合字(2016)第051号)。
王丽俊,女,1992年6月生,吉林农业科技学院生物工程学院,本科生。E-mail:1457908100@qq.com。
王霞,吉林农业科技学院生物工程学院,讲师。E-mail:wangxhangj@126.com。
2017年3月22日。
责任编辑:潘 华。
//Journal of Northeast Forestry University,2017,45(10):13-16.
