维族不同年龄段非综合征性耳聋的MT-RNR1基因检测分析
2017-10-24彭博,张劲*,于勐
彭 博,张 劲*,于 勐
(1.石河子大学医学院,新疆 石河子 832000;2.新疆维吾尔自治区人民医院耳鼻喉诊疗中心,新疆 乌鲁木齐 830000)
维族不同年龄段非综合征性耳聋的MT-RNR1基因检测分析
彭 博1,张 劲2*,于 勐2
(1.石河子大学医学院,新疆 石河子 832000;2.新疆维吾尔自治区人民医院耳鼻喉诊疗中心,新疆 乌鲁木齐 830000)
目的探讨不同年龄段维族NSHI患者的MT-RNR1基因突变及听力表型特点。方法 选取2012年6月~2016年6月来自全新疆各地的维吾尔族非综合征性耳聋(NSHI)患者487例,将487例受检者按发病、就诊年龄分为成人组(>18岁)、未成年组(0~18岁),从所有受检者口中取得粘膜拭子进行MT-RNR1基因筛查,结合听力学检测结果,对比各组MT-RNR1基因阳性率的检出情况。结果 此次检测共发现MTRNR1基因突变者34人,总突变率6.98%,其中与耳聋相关的热门基因位点A1555G、961DelT/InsC有阳性结果,未检测到C1494T、T1095C;不同发病年龄组中和不同就诊年龄组中,成人组与未成年组间、未成年组内各细分组间的检出阳性率比较无统计学差异(P>0.05);不同耳聋程度的各组检出的阳性率比较也无统计学差异(P>0.05)。结论 初步判断MT-RNR1并非维族听力损害的主要遗传分子学病因,建议临床医生在面对已有先证者的维族母系家族成员患者时均应筛查易感基因。
维吾尔族;非综合征性耳聋;MT-RNR1
先天性耳聋是耳鼻喉科常见的遗传病之一,常染色体隐性遗传占总发生率的75%以上,而其中NSHI占遗传性耳聋的80%左右。其严重影响个人的生活、就业竞争能力,给整个社会带来极大的负担。相关研究表明,NSHI患者主要受到遗传因素的影响[1],目前绝大多数耳聋相关基因突变位点均位于MT-RNR1、GJB2和SLC26A4三大基因上。维吾尔族拥有独特的遗传背景,研究不同听损程度、不同年龄段维族NSHL患者的MT-RNR1突变结果,可以有针对性的为该地区耳聋病的临床分子学诊疗制定策略。
1 资料与方法
1.1 一般资料
选取2012年6月~2016年6月来自全新疆各地的维吾尔族非综合征性耳聋(NSHI)患者487例,男性274名,女性213名,年龄最大者46岁,年龄最小者4个月。所有患者均经专科检查及听力学检查被确诊为NSHI,均签署知情同意书。
1.2 方法
1.2.1 基因样本提取方法
严格遵循中优集团DNA样本采集带的使用要求,从患者清洁后的口腔中取得粘膜拭子。按程序保存,使用硅胶吸附法提取目标DNA后将样本送至中优细胞分子遗传学检测中心进行下一步测序。
1.2.2 基因测序
利用Primer3设计的引物对MT-RNR1基因片段上的961-1555位点进行PCR扩增,纯化后的产物利用ABI3130XL测序仪进行测序及收集数据,用软件Chromas查阅测序检测结果。
1.2.3 听力学检测
所有受检者均在新疆自治区人民医院耳鼻喉诊疗中心门诊的听力室接受检查。计算每位受检者0.5kHz、1.0kHz、2.0kHz、4.0kHz的听阈,以平均听阈划分听力损失程度,双耳听阈不同者以较轻一侧为准。
1.2.4 分组
将患者按发病年龄、就诊年龄分组:>18岁为成人组、0~18岁为未成年组,未成年组细分:0~3岁为婴幼儿组、3~6岁为学龄前组、6~12岁为学龄组、青春12~18岁为期组。根据WHO标准将所有受检者按平均听阈分类:①26dB≤轻度耳聋≤40dB;②41dB≤中度耳聋≤70dB;③71dB≤重度耳聋≤90dB;④极重度耳聋≥91dB分组。排除听力正常者。
1.3 统计学分析
使用SPSS 17.0统计学软件对此次研究结果进行统计学分析,用皮尔逊、连续性校正的卡方或Fisher确切概率法进行检验,P<0.05为差异有统计学意义。
2 结 果
2.1 基因突变阳性检出情况
MT-RNR1基因突变者34人,检出总突变率6.98%,包括:2例A1555G、2例961DelT/InsC、3例T1005C、4例A1041G、1例A1585G、1例A1008G、8例G1438A、1例G1442A、2例G1462A、4例T1107C、3例T1119C、1例G1462T,另有1例T1107C+C1048T、1例T1107C+G1438A。与耳聋发病相关的线粒体基因突变仅检出A1555G、961DelT/InsC及T1005C,三者总阳性率1.43%。
2.2 不同发病年龄组的阳性检出情况
成年组中检出1人携带有A1555G线粒体基因突变,其余474人均在未成年组。成年组阳性率7.69%,未成年组1.27%,最小理论频数T=0.18<1,Fisher计算P=0.174>0.05,成年组和未成年组间、未成年组各细分组间的检出率对比无统计学差异。详见表1。
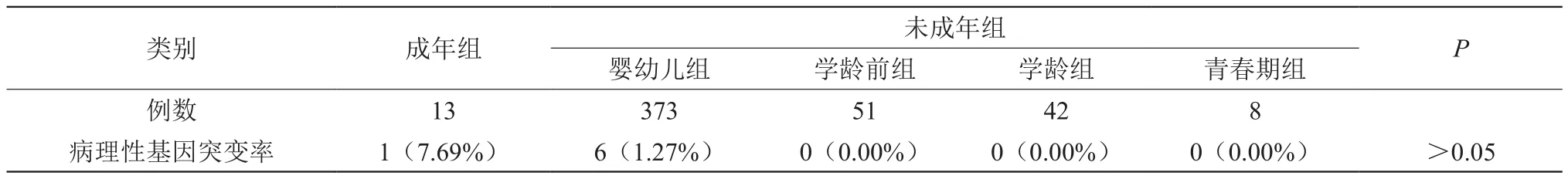
表1 不同发病年龄组间病理性基因突变阳性率的比较 [n(%)]
2.3 不同就诊年龄组的阳性检出情况
成年组就诊的32名患者中检出各1例A1555G与T1005C,其余5例在未成年组。未成年就诊者中,婴幼儿组A1555G、961DelT/InsC及T1005C各检出1例;学龄前组中各检出1例961DelT/InsC、T1005C;在学龄组及青春期组均无病理性基因阳性发现。成年组阳性率6.25%,未成年组1.10%,最小理论频数T=0.45<1,Fisher计算P=0.071>0.05无统计学差异。成年组与未成年组间、未成年组内各细分组对比,检出率差异无统计学意义。
2.4 不同听力损失组的阳性检出情况
听力损失轻度4人,中度53人,重度80人,极重度350人;极重度者中检出27例突变(包括1例A1555G、2例961DelT/InsC、2例T1005C),重度者中有4例突变(1例T1005C),3名中度听损者被检出突变(1例A1555G),轻度患者中未检出阳性结果。各组间对比无统计学差异。
3 讨 论
我国是一个耳聋大国,听力言语残疾人口接近3000万,居各类残疾之首。耳聋会给任何年龄段人群带来巨大的负面影响,给社会增加沉重的负担。通过加强公共环境管理和普及健康理念,环境因素在耳聋发病中所起的作用逐渐减小,遗传因素则越来越受到大家的重视。随着对GJB2、SLC26A4、MT-RNR1三大致聋基因的研究进一步深入,不同的核基因与线粒体基因突变位点在听力损害发病过程中所发挥的作用被逐步证实。
本次在维族NSHL患者中仅检测到三个病理性基因。其中A1555G自1993年被Prezant首次报道与耳聋存在密切关系后,世界各地均有相关研究支持该结论。维吾尔族人群受地域及独特历史文化背景的影响,经济、医疗、文化等水平偏低,对听力损害关注度低、氨基糖苷类抗生素使用率偏高。有研究表明,氨基糖苷类抗生素通过作用在类似于MT-RNR1编码12SrRNA二级结构的16SrRNA解码区,使携带该类突变基因的人群因内耳毛细胞氧代谢障碍而出现严重的不可逆性听力损害[2]。近年来一些研究对961DelT/InsC的致聋性提出了质疑,认为961DelT/InsC是一个与AAID相关性不明确的位点,而T1005C则在有关研究中被提及与AAID发病相关[3]。因此表明,NSHL通过基因筛查可以部分明确病因,为优生优育及用药指导提供帮助。
本次研究的维族耳聋线粒体基因阳性检出率较全国平均水平偏低,初步判断MT-RNR1并非维吾尔族耳聋的主要遗传分子学病因。临床医生应对所有已有先证者的母系家族成员患者建议行易感基因筛查。
[1] 张小芳.非综合征性耳聋的研究进展[J].医学综述,2013,19(1):120-123.
[2] 王 芳.线粒体DNA突变与遗传性聋[J].听力学及言语疾病杂志,2016,24(4):405-409.
[3] 王 校.乌鲁木齐人群药物性耳聋患者MT-RNR1基因突变频谱分析[J].中国优生优育,2014,20(8):546-50.
R764.43
B
ISSN.2095-8242.2017.041.8095.02
张 劲
本文编辑:王雨辰
