传感器在毒品检测中的应用研究
2017-10-24张凌燕王凯莉
张凌燕, 王凯莉
(1.西南政法大学, 重庆 401120; 2.重庆市高等学校物证技术工程研究中心, 重庆 401120)
传感器在毒品检测中的应用研究
张凌燕1,2, 王凯莉1
(1.西南政法大学, 重庆 401120; 2.重庆市高等学校物证技术工程研究中心, 重庆 401120)
毒品定性定量分析结果是毒品犯罪分子定罪量刑的重要依据之一。如何对海量的毒品进行快速灵敏的检测一直是缉毒部门面临的难题。目前毒品检测的方法较多,但这些方法最大的缺点是单个样品检测周期长,不能对大批样品进行高通量的检测,并且或存在仪器设备昂贵、或存在需对样品进行预处理、或存在不能定量分析等弊端。近些年,国内外对新型毒品检测方法进行了研究,如利用悬臂梁、石英晶振、表面等离子共振、荧光、电流等对毒品进行检测的传感器。这些传感器能快速、灵敏且高通量的对毒品进行定性定量检测,为毒品检测提供了新的方向与思路。
传感器; 毒品检测; 综述
0 引言
毒品问题现已成为重大的社会问题之一,毒品检测技术的研究与发展迫在眉睫。气相色谱- 质谱联用被广泛应用于毒品的检测,但由于需要对样品进行纯化和衍生等前处理,使之更适合应用于实验室。因此,寻找具有低检测限、无需对样品进行预处理、且能进行批量检测的新方法尤为重要。石英晶振型、电流型、荧光型等传感器具有特异性、可携带性、快速及低成本等优点,是很好的替代检测方法。本文综述了国内外悬臂梁、石英晶振型、表面等离子共振型、荧光型、电流型等传感器在毒品检测中的应用与进展。
1 悬臂梁毒品检测传感器
You-Chen Tsenge等[1]依据悬臂梁检测原理研究了一种新型甲基苯丙胺(MA)传感器。该传感器利用自组装原理以巯基丙胺及戊二醛缩合的物质为交联剂,将甲基苯丙胺抗体anti-MA固定在金及钛混合压电晶片上,并将晶片固定于十字支架的悬臂梁上。氦氖激光器、光学杆杠、四象限探测器组成该装置的光学检测系统。其原理是当待测物中的MA抗原与固定在悬臂梁上的抗体结合后,会导致悬臂梁弯曲变形并产生共振频率,此时待测物的量可由四象限探测器检测反射激光的变化确定。该传感器对MA抗原的检测范围为3.4×10-11~3.4×10-10mol/L,由于线性范围窄,且装置复杂,故未有更深入的报道。
2 石英晶振型毒品检测传感器
石英晶振微天平传感器由于成本低廉、结构简单,是一种具有潜力的应用仪器。Thomas Frisk[2]实验小组设计了一种可在普通环境中进行液体样品吸附及传输的微机械界面的石英晶体可卡因传感器。如图1所示,该传感由2 cm×1 cm硅片、聚四氟乙烯塑胶入口连接管、不锈钢管硅胶管等形成检测池的底部,其中,作为敏感元件的硅片表面呈现出50 μm高的柱状微阵列分布特点,与可以与电路融为一体的硅组合成的微机械界面,消除了重复加样时的机械冲击对石英晶振荡频率产生的影响。分别将可卡因抗体、海洛因抗体固定在此柱状微结构的硅片薄膜上,在非密闭环境下,含有可卡因或海洛因等抗原的液体通过反应池时,与固定的抗体发生特异性结合,薄膜质量由此变化,引起石英晶振固有频率变化,根据待测品标准品的含量与频率信号变化绘制标准曲线,即可求出待测可卡因或海洛因的浓度。该传感器检测时间短,机器的体积和质量小,成本降低,具有制成便携式仪器的可能。但由于其稳定性易受测试环境的影响,故近些年对其的研究报道也较少。
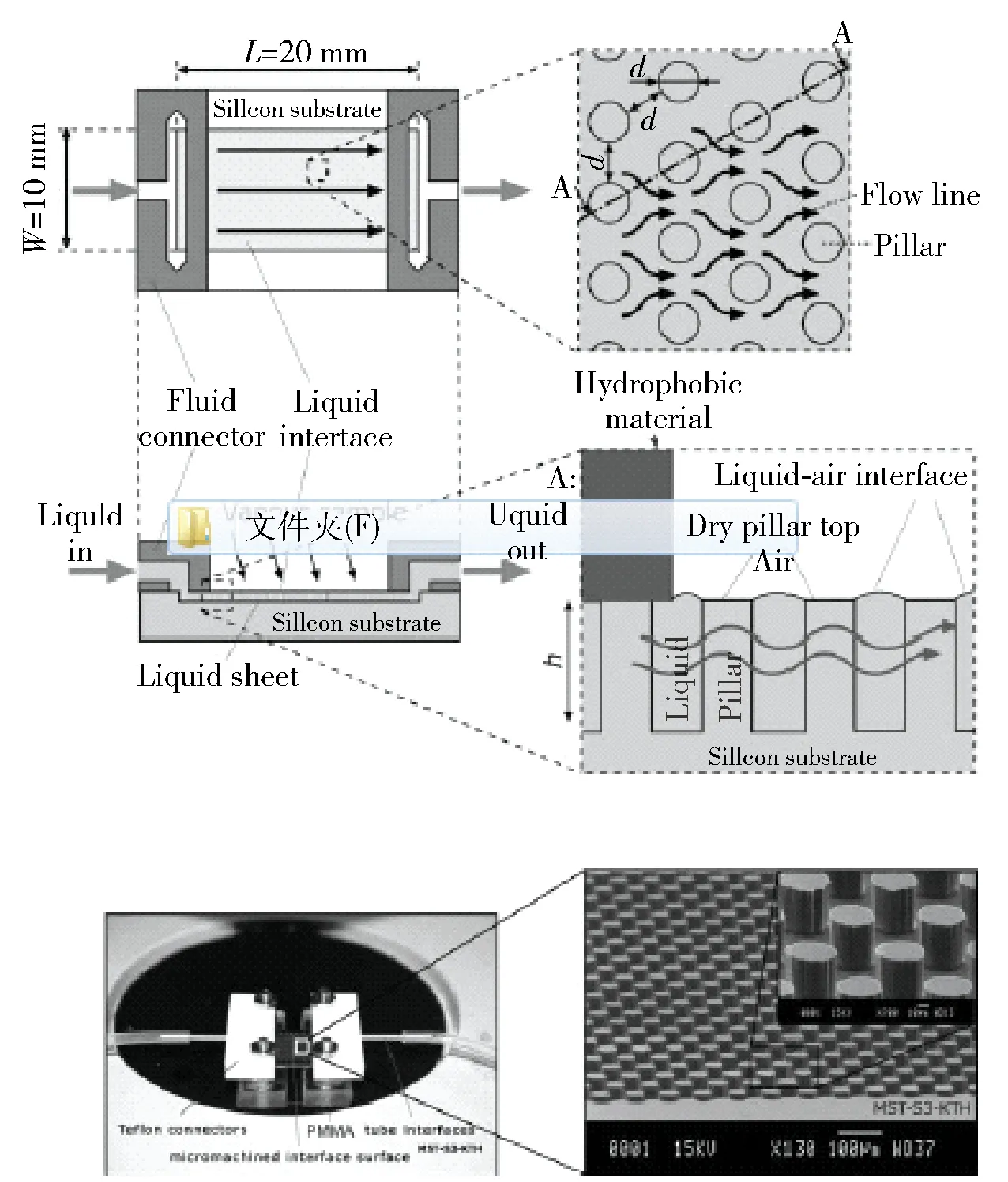
图1 传感器的俯视图(顶部)和剖视图(中部)[2]
3 表面等离子共振型毒品检测传感器
利用牛血清白蛋白(BSA)的吸附作用,MA-BSA的结合物可以物理吸附于传感器的金薄片上,当含有anti-MA的溶液流过此金薄片时,MA-BSA与anti-MA发生免疫结合,金薄片上的表面等离子体共振信号随结合anti-MA浓度的增加而增加,当加入的待测物含MA时,MA将与固定于金薄片上MA-BSA竞争结合anti-MA,使得能与金薄片上MA-BSA结合的anti-MA减少,导致表面等离子体共振(SPR)信号明显降低,该信号的变化与待测物中MA在6.7×10-13~6.7×10-9mol/L范围内呈线性关系。由于是物理吸附,该传感器稳定性差[3]。
Paul P. Dillon等[4]将酶免法与SPR传感器结合用于吗啡-3-葡萄糖醛酸苷(M3G)检测,该方法首先利用酶免法对系列参数进行优化,然后用SPR技术对M3G进行定量检测。第一步:将M3G(抗原)与卵清蛋白形成的共轭物包被微孔板,然后加入抗体和M3G标准品的混合液,此时,M3G标准品能够抑制抗体与微孔板上固定的M3G抗原的结合,该反应完成后,再加入酶标记的羊抗兔二抗与固定的剩余的M3G结合,通过检测标记酶的光信号对固定在微孔板上M3G及抗体的量等参数进行优化。第二步:将M3G与卵清蛋白作为抗原以优化条件后修饰芯片表面,然后加入优化了量的抗体及M3G标准品(或抗体及M3G待测品),从而对M3G进行定量分析。实验证明,对本实验装置的芯片再生后,可重复使用50~60次,对尿液中M3G的检测范围为3.4×10-12~2.2×10-10mol/L,且变异系数范围为1.48%~11.24%。
在IngerVikholm-Lundin小组[5]的研究报道中,抗3,4-亚甲基二氧甲基苯丙胺(anti-MDMA)被分割为带有巯基的菠萝蛋白酶的Fab片段。利用巯基与金的作用,可将该片段直接固定于金片上,再利用抗原抗体的结合,将BSA修饰的MDMA作为抗原固定于金片上(A~D),如图2所示。当溶液中有anti-MDMA时,其与固定在金片上的抗原结合(E),然而,当溶液中通入含MDMA的待测品时,该anti-MDMA又脱离金片,成为自由抗体而与待测品中的MDMA结合(F),利用表面等离子共振的变化可以观察此抗原抗体的结合及解离过程,如图2所示,从而可定量检测出MDMA,该传感器的检测下限可达1.4×10-10mol/L。
4 荧光型毒品检测传感器
Laura Asturias-Arribas等[6]把单克隆吗啡抗体(吗啡单抗)包被的聚合物珠子置于嵌在发光体/检测器里的流通池中,将荧光素结合的吗啡作为荧光素标记半抗原(即荧光素标记的吗啡),采用一步法荧光免疫分析原理。稀释的尿液样品与荧光素标记的吗啡混合后,通过流通池中抗体包被的珠子,如果样品中有非标记的吗啡,将与荧光素标记的吗啡竞争结合抗体。当标记的吗啡与抗体结合后,珠子表面发射出可被连续检测到的荧光,如果与抗体结合的待测物多,则与该抗体结合的荧光素标记的吗啡就少,故通过检测荧光信号的变化就能确定待测物的量。实验证明,荧光素标记的吗啡与吗啡抗体的结合在数分钟内达到稳定,且离解平衡常数为2.3×10-10。该方法对M3G的检测范围为7.0×10-13~1.8×10-10mol/L,分析灵敏度为7.0×10-13mol/L,分析时间为每个样品3 min。

图2 表面等离子共振型毒品检测传感器工作原理示意图
近年来,将适配体用于荧光传感器的研究较多,将4-氨基苯磺酸以电化学氧化方法结合在石蜡灌注的石墨电极表面,然后利用磺酸基团结合被三(2,2′-联吡啶)钌(Ⅱ)标记的适配体,从而制备了可卡因电化学发光传感器[7]。当溶液中有可卡因存在时,其与适配体特异结合,导致三(2,2′-联吡啶)钌(Ⅱ)发生荧光淬灭,电化学发光的能力降低,该荧光减少的值与可卡因成比例。该传感器用于可卡因检测时,检测下限可达1.0×10-11mol/L。此外,该适配体可卡因电化学发光传感器展现出高的再生性能(再生7次,RSD=2.8%)及长期储存稳定性(21天后仍能保持初始荧光的96.8%)。
2011年,Cai Qinhong等人曾报道了一种用于检测可卡因的电化学荧光三明治免疫传感器[8]。该传感器是将一个单一适配体分成两个可以独自折叠且可以分别与靶目标结合的片段,其中一个片段作为捕获探针固定于金电极表面,而另一个片段作为检测探针则用掺杂纳米硅的三(2,2′-联吡啶钌)标记,由于捕获探针与检测探针两个片段之间不易发生反应,带荧光的片段不能结合在电极上,故电化学荧光信号很弱。然而当待测溶液中有可卡因时,其可诱发两个片段发生强烈结合,从而使三(2,2′-联吡啶钌)固定在电极上,使电化学荧光信号明显增强,如图3所示,增强的电化学荧光度与可卡因浓度的对数在1.0×10-9~1.0×10-11mol/L范围内呈正比关系,如图3所示,检测浓度下限为3.7×10-12mol/L。
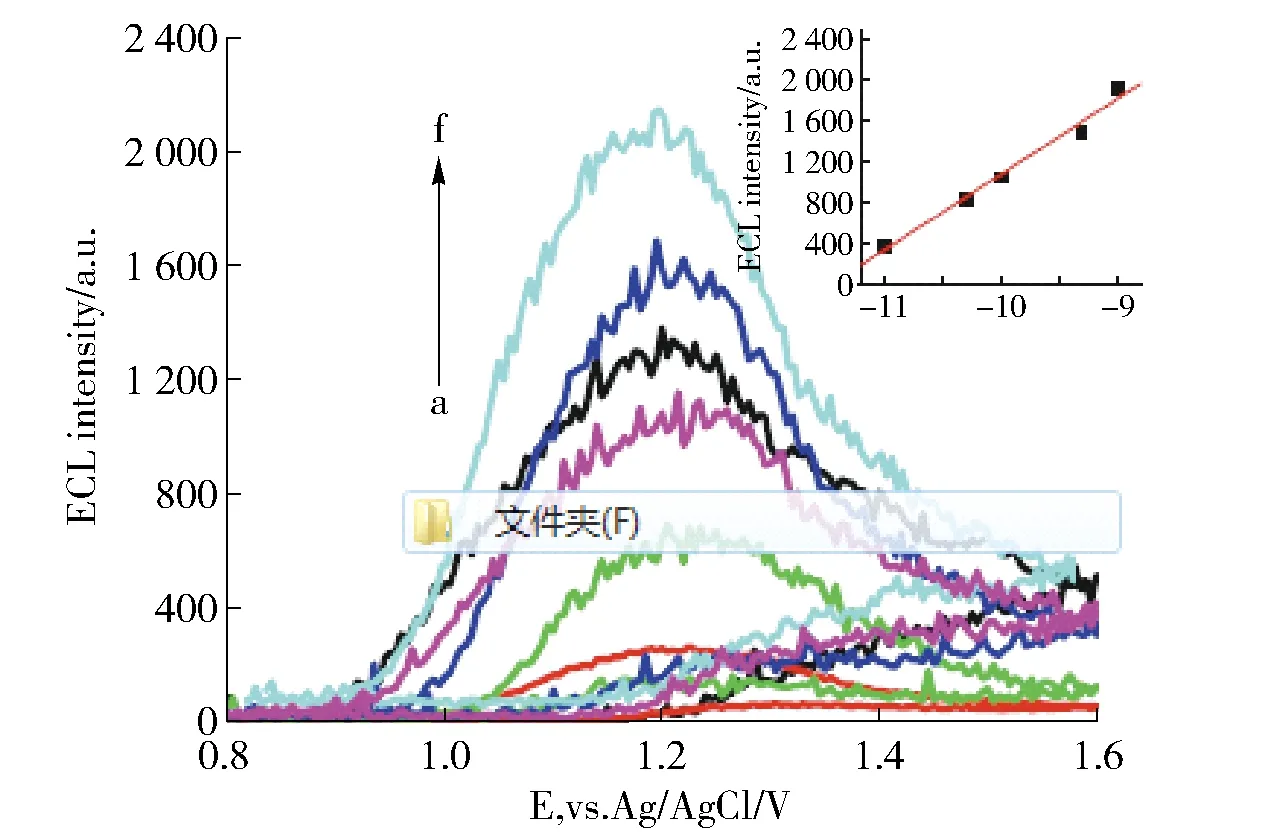
图3 电化学荧光度与可卡因浓度关系[8]
2-氨基-5,6,7-三甲基-1,8-萘啶(ATMND)是一种荧光小分子物质。当可卡因适体MNS-4.1与ATMND非特异性结合时,会导致其荧光猝灭。然而当溶液中存在可卡因时,可卡因会取代ATMND而与核酸适体发生特异性结合,释放出的ATMND在溶液中发射荧光而产生一个陡峭的荧光数值。在此基础上改变MNS-4.1的序列,组装成新的可卡因适体(38-GC),它具有降低背景噪声、提高信号等优点。使用38-GC制备的新传感器,可以在几秒内检测到浓度低至6.6×10-10mol/L的可卡因,在未稀释的唾液、尿液和血清样品中检测限分别为1.0×10-5mol/L、1.8×10-5mol/L和3.6×10-5mol/L。检测限比基于目标诱导构象变化法的适配体可卡因传感器低50倍[9]。
5 电流型传感器
5.1 一次性电流型传感器
为了满足广大基层检验人员以及大批量检测的需要,有必要研究一次性电流型传感器。常见毒品摇头丸主要由亚甲二氧基苯丙胺和与甲基苯丙胺衍生物组成,其中甲基苯丙胺衍生物有3,4-亚甲二氧基苯(MDA)、3,4-亚甲基二氧甲基苯丙胺(MDMA)以及3,4-亚乙基二氧甲基苯丙胺(MDMA)。通过单克隆技术制备的亚甲二氧基苯丙胺和甲基苯丙胺抗体(anti-MA)可用于亚甲二氧基类相似物的测定,Deirdre B等[10]使用一次性碳丝网印刷电极和辣根过氧化物酶标记的电流型免疫传感器可检测唾液和尿液中摇头丸的成分。该传感器含一个特殊的抗MDA-BSA抗体,该抗体仅对MDA、MDMA等成分发生特异性反应,用四甲基联苯胺(TMB)作为酶的底物,在+100 mV vs时以Ag/AgCl为参比电极,检测碳丝网印刷电极上氧化产物从而定量分析待测物。结果表明,MDA的标准曲线在3.0×10-12~2.0×10-9mol/L浓度范围内呈线性关系,在唾液和尿液中检测限分别为1.8×10-12mol/L和2.0×10-13mol/L。该传感器操作简便,无需对血样、唾液或尿液样本进行稀释即可检测。
Laura Asturias-Arribas等[11]报道了碳纳米管修饰电极的一次性电流型传感器。然而,该一次性传感器易受到可待因、对乙酰氨基酚或者咖啡因的影响,他们的氧化峰可能会重叠而导致假阳性。针对这一问题有两种方案。第一种方案是使用未经修饰的丝网印刷碳电极,用偏最小二倍回归分析用来解决伏安信号的重叠,第二方案是用碳纳米管修饰一次性碳传感器,用最小二倍回归法对可卡因产生的伏安电流进行定量计算,在可卡因浓度范围为10~155 μmol·L-1时呈比例关系,重现性为5.6%(RSD,n=7)。这两个方案都已成功应于可卡因的纯度的评价,具有巨大的发展潜力和广阔的应用前景。此外,Lindy Murphy等[12]也报道了丝网印刷电极制备的一次性传感器,该一次性传感器可以直接用于唾液中盐酸安非他明的检测,其检测浓度下限可达2.2×10-9mol/L。
5.2 再生型电流型传感器
吸附型传感器很难防止产生假阳性,由此极大限制了其在复杂样品(如血液)中的应用,而抗原抗体特异性免疫反应或基于核酸适配体构型变化的电流型传感器能与目标物质高特异性、高选择性地结合,从而避免假阳性。与抗体相比,核酸适配体能够识别与之相对应的靶分子,并形成高亲和力的靶分子-适配体复合物。Brian R. Baker[13]实验小组报道了一种适配体可卡因电流型生物传感器。该传感器首先在金电极上自组装一层烷基硫醇,通过其醇基将被亚甲蓝标记的适配体固定在电极上。在缺乏靶目标时,标记的适配体仅有三分之一保持完整的双链状态,剩余的三分之二均是展开的单链。当溶液中有可卡因靶目标存在时,适配体与可卡因形成了三向连接构象结合物,使亚甲蓝暴露于溶液中,电极还原峰电流显著增加。实验中选用了分别称为A1、A2、A3、A4的适配体,结果表明A1与A4适配体修饰的电极均能检测人唾沫及其他复杂且易受污染的样品中的可卡因,其检测浓度下限为5.0×10-4mol/L。此外,该E-AB传感器具有检测时间短,电极易通过简单的洗涤再生利用,无酶标记故寿命长等优点。
H.Tom. Soh[14]研究小组利用微流体技术,研制了微流体E-AB传感器检测系统。与传统的庞大设备相比,微流体技术在物质运输和扩散方面更具优势,精细加工允许其在微型化流动池中进行多电极精确组合,可同时对多个样品进行检测。该检测系统由液体输入、电极基体、液体输出3部分组成,其中电极基体由1支铂参比、1支铂对电极和3支经同一种适配体修饰的金工作电极呈线排列而成。当存在可卡因时,适配体与可卡因形成三元复合物,电子媒介体亚甲蓝与电极的距离缩短,电子转移速度由此加快,还原峰电流增大,增加的还原峰电流与血液中的可卡因在1.0×10-5~1.0×10-4mol/L范围内呈线性关系。该系统的优点在于可流动注射样品,故可实时、在线检测可卡因,且3支工作电极可以同时对同一浓度样品进行3次平行检测,从而分析标准偏差。此外,可同时对多个样品进行检测,提高检测效率。
然而,在上述报道中,适配体与靶分子仅是1∶1结合,限制了信号进一步放大,从而影响了检测灵敏度,因此,需要对检测系统进行放大信号或者降低背景的处理。随着研究的深入,发现核酸释放能够提高电化学检测灵敏度,但该研究面临的新问题是由于空间位阻的影响,阻止DNA从核酸释放中脱离。于是Tang Dianping[15]小组经过试验选择了纳米磁性石墨烯作为平台,制备了硫堇和二茂铁作为标记且利用核酸释放能进行电化学分析检测的多通路适配体传感器。纳米磁性石墨烯具有磁晶各向异性、良好导电、大的比表面积及二维结构等性能,可以吸附大量适配体。由于核酸酶及芳香化合物的作用,二茂铁标记的三磷酸腺苷适配体(Fc-P1)与硫堇标记的可卡因适配体(Th-P2)被非特异结合在纳米磁性石墨烯表面。固定在电极上的Th-P2和Fc-P1分别出现在不同的峰电位。当待测物中三磷酸腺苷(ATP)、可卡因(cocaine)与相应的Fc-P1和Th-P2反应后形成了ATP/Fc-P1、cocaine/Th-P2复合物,该复合物中的cocaine、ATP阻碍了纳米磁性石墨烯对适配体的吸附,从而使ATP/Fc-P1、cocaine/Th-P2复合物脱离纳米磁性石墨烯,而脱离纳米磁性石墨烯后的ATP/Fc-P1、cocaine/Th-P2复合物能够被DNase I剥离出cocaine和ATP,这些剥离出的cocaine和ATP能够再次进攻纳米磁性石墨烯上的适配体,导致电极电流显著减少,此电流的变化与cocaine和ATP呈定量关系。该传感器对cocaine、ATP的检测浓度下限分别可达1.5 pM和0.1 pM,而且该方法有望制成E-AB传感阵列,为大批量检测临床或法庭科学中的可卡因毒品的检测提供可能。
Ali A. Ensafi等[16]研究了基于聚二烯丙基二甲基铵分散多壁碳纳米管修饰的石墨电极为工作电极的可待因、吗啡生物电流型传感器。该研究利用差分脉冲伏安技术检测电化学氧化信号来检测电流,但可待因和吗啡的峰电流位置区别不明显,当DNA存在时,可待因峰电位负移,吗啡峰电位正移,二者的峰电位截然不同,从而可对两者进行有效区分。实验证明,该传感器对血浆、尿液样本以及药物制剂中可卡因和吗啡的检测浓度下限分别为1.4×10-4mol/L和1.5×10-4mol/L。
Laura Asturias-Arribas等[17]用乙酰胆碱酶与丝网印刷碳电极、四硫富瓦烯共同制备的电极,当待测样品中有硫代乙酰胆碱时,电极的电流响应显著增加。然而,将可待因加入硫代乙酰胆碱中,可待因对乙酰胆碱酯酶有抑制作用,会导致对硫代乙酰胆碱的催化作用降低,电流降低,其中该电流的变化与可待因成比例关系。该传感器对可待因的检测浓度下限可达2.0×10-5mol/L。
生物酶作为催化剂制备的传感器,利用酶放大电信号的特点可提高其检测灵敏度。但酶易失活,酶标记电流型传感器的使用寿命较短。因此需寻找可以替代生物酶的人工酶。Zhang Lingyan[18]等以普鲁士蓝和anti-MA修饰电极,利用具电子媒介体及催化功能的普鲁士蓝催化过氧化氢的能力,显著增强了电极电流,提高了检测灵敏度。当待测液中的甲基苯丙胺(MA)与抗体结合后,电极上的电流信号减弱,减弱的电流与抗原成比例。实验证明,该传感器操作简单、使用寿命长、灵敏度好,且对MA的检测浓度范围为1.0×10-8~5.0×10-6mol/L。此外,Satoshi Arimoto等[19]报道了二茂铁衍射物(CocAP-Fc)共聚DNA适配体修饰金电极的传感器,其检测原理为电极表面的CocAP-Fc对可卡因分子进行识别,并与之发生免疫结合,从而导致电极的构象变化。如图4所示,对该电极进行热处理(70 ℃加热5 min)后,传感器的氧化电流随待测液中的可卡因浓度的增加而增加。

图4 CocAP-Fc共聚DNA适配体修饰电极的传感器对可卡因的测定[19]
最新研究发现可卡因和吗啡在双链DNA上能够产生构象变化,且这些构像变化会导致这两种化合物产生不同的电化学氧化信号。Nada F. Atta等[20]报道的三明治电流型传感器,不但可以检测人尿液中的吗啡,还可以同时检测抗坏血酸和尿酸。
6 发展前景和展望
传感器技术现被应用于许多领域,在法庭科学领域中也有所应用,如传感器检测技术已被应用于机场安检的爆炸物检测。但是该技术仍然存在着诸多弊端,若要在法庭科学领域进行广泛应用需要进一步的研究。虽然当前对于传感器技术的研究仍处于基础性、应用性阶段,但是由于其具有低检测限、批量化、高通量、检验灵敏度高等优点,传感器技术在法庭科学技术研究领域中将有更广阔的应用前景。
[1] TSENG Y C,CHANG J S,LIN S,et al.3,4-Methylenedioxymethylamphetamine detection using a microcantilever-based biosensor[J].Sensors & Actuators A Physical,2012,182(8):163-167.
[2] FRISK T,RONNHOLM D,VAN D W,et al.A micromachined interface for airborne sample-to-liquid transfer and its application in a biosensor system[J].Lab on A Chip,2006,6(12):1504-1509.
[3] SAKAI G,NAKATA S,UDA T,et al.Highly selective and sensitive SPR immunosensor for detection of methamphetamine[J].Electrochimica Acta,1999,44(21-22):3849-3854.
[4] DILLON P P,DALY S J,MANNING B M,et al.Immunoassay for the determination of morphine-3-glucuronide using a surface plasmon resonance-based biosensor [J].Biosensors & Bioelectronics,2003,18(2-3):217-227.
[5] VIKHOLM-LUNDIN I,AUER S,HELLGREN A C.Detection of 3,4-methylenedioxymethamphetamine(MDMA, ecstasy) by displacement of antibodies[J].Sensors & Actuators B Chemical,2011,156(1):28-34.
[6] ELDEFRAWI M E,AZER N L,NATH N,et al.A sensitive solid-phase fluoroimmunoassay for detection of opiates in urine[J].Applied Biochemistry and Biotechnology,2000,87(1):25-35.
[7] SUN B,QI H,MA F,et al.Double covalent coupling method for the fabrication of highly sensitive and reusable electrogenerated chemiluminescence sensors[J].Analytical Chemistry,2010,82(12):5046-5052.
[8] CAI Q,CHEN L,LUO F,et al.Determination of cocaine on banknotes through an aptamer-based electrochemiluminescence biosensor[J].Analytical &Bioanalytical Chemistry,2011,400(1):289-294.
[9] RONCANCIO D,YU H,XU X,et al.A label-free aptamer-fluorophore assembly for rapid and specific detection of cocaine in biofluids[J].Analytical Chemistry,2014,86(22):11100-11106.
[10] BUTLER D,PRAVDA M,GUILBAULT G G.Development of a disposable amperometric immunosensor for the detection of ecstasy and its analogues using screen-printed electrodes[J].Analytica Chimica Acta,2006,556(2):333-339.
[11] ASTURIAS-ARRIBAS L,ALONSO-LOMILLO M A,DOMINGUEZ-RENEDO O,et al.Sensitive and selective cocaine electrochemical detection using disposable sensors[J].Analytica Chimica Acta,2014,834(1):30-36.
[12] BARTLETT C A,TAYLOR S,FERNANDEZ C,et al.Disposable screen printed sensor for the electrochemical detection of methamphetamine in undiluted saliva[J]. Chemistry Central Journal,2016,10(3):1-9.
[13] BAKER B R,LAI R Y,WOOD M C,et al.An Electronic Aptamer-Based Small-Molecule Sensor for the Rapid, Label-Free Detection of Cocaine in Adulterated Samples and Biological Fluids[J].Journal of the American Chemical Society,2006, 128(10):3138-3139.
[14] SWENSEN J S,XIAO Y,FERGUSON B S,et al.Continuous, Real-Time Monitoring of Cocaine in Undiluted Blood Serum via a Microfluidic, Electrochemical Aptamer-Based Sensor[J]. Journal of the American Chemical Society,2009, 131(12):4262-4266.
[15] TANG D,TANG J,LI Q,et al.Ultrasensitive aptamer-based multiplexed electrochemical detection by coupling distinguishable signal tags with catalytic recycling of DNase I[J].Analytical Chemistry,2011,83(19):7255-7259.
[16] ENSAFI A A,HEYDARI-BAFROOEI E,REZAEI B.Different interaction of codeine and morphine with DNA: a concept for simultaneous determination[J].Biosensors & Bioelectronics,2013,41(1):627-633.
[17] ASTURIAS-ARRIBAS L,ALONSO-LOMILLO M A,DOMINGUEZ-RENEDO O,et al.Screen-printed biosensor based on the inhibition of the acetylcholinesterase activity for the determination of codeine[J].Talanta,2013,111:8-12.
[18] ZHANG L Y,LIU Y J.Label-free amperometric immunosensor based on prussian blue as artificial peroxidase for the detection of methamphetamine[J].2014,806:204-209.
[19] ARIMOTO S,SHIMONO K,YASUKAWA T,et al.Improvement of Electrochemical Response of Cocaine Sensors Based on DNA Aptamer by Heat Treatment[J].Analytical Sciences: the International Journal of the Japan Society for Analytical Chemistry,2015,32(4):469-472.
[20] ATTA N F,GALAL A,HASSAN S H.Electrochemical Sensor for Morphine Based on Gold Nanoparticles/ Ferrocene Carboxylic Acid/Poly (3,4-Ethylene-Dioxythiophene) Composite[J].International Journal of Electrochemical Science,2015,10(3):2265-2280.
(责任编辑于瑞华)
D918.93
重庆市科委自然科学基金项目(cstc2016jcyjA0503);重庆市教委自然科学基金项目(KJ1500111)。
张凌燕(1971—),女,湖南长沙人,博士,教授。研究方向为物证技术。
