环孢霉素A对小鼠胚胎干细胞向心肌细胞分化的影响及调控机制
2017-10-23颜培实段丽钦毕莎莎王晓旭
颜培实+段丽钦+毕莎莎+王晓旭

[摘要]目的 探讨环孢霉素A(CSA)对小鼠胚胎干细胞(ESCs)向心肌细胞分化的影响及调控机制。方法 应用分阶段胚胎干细胞向心肌细胞的分化系统,设ESCs自发组和CSA诱导组,用细胞免疫组织化学和流式细胞仪(FACS)评估心肌细胞分化率以及计数。细胞免疫化学检测CSA诱导出的心肌细胞标志物的表达。在ES细胞分化的不同阶段添加CSA,观察CSA是否特异地作用于某一特定的分化阶段。分别添加另外一种免疫抑制剂也是钙调磷酸酶抑制剂他克莫司(FK506)和T细胞核因子(NFAT)抑制剂11R-VIVIT,与添加CSA比较,比较各组的心肌细胞分化率。结果 ESCs自发组的心肌细胞分化率为(6.00±0.05)%,CSA诱导组为(60.00±0.08)%,兩组比较,差异有统计学意义(P<0.05),且诱导生成的心肌细胞具备心肌细胞特有的特征。CSA特异性地作用于中胚层干细胞,促进其分化成心肌干细胞;CSA强力促进中胚层干细胞分化成心肌细胞增多,相反分化成的上皮细胞减少;添加FK506和11R-VIVIT后没有出现类似CSA的促心肌分化作用。结论 CSA特异地作用于中胚层干细胞,通过非NFAT径路,能够强力诱导ESCs向心肌细胞分化。
[关键词]环孢霉素A;心肌干细胞;胚胎干细胞;心肌细胞;分化
[中图分类号] R332 [文献标识码] A [文章编号] 1674-4721(2017)09(a)-0004-04
Influence of Cyclosporine A on the differentiation of mouse embryonic stem cells into cardiomyocytes and its regulatory mechanism
YAN Pei-shi DUAN Li-qin BI Sha-sha WANG Xiao-xu
The First Department of Cardiology,Dalian Central Hospital in Liaoning Province,Dalian 116033,China
[Abstract]Objective To explore the influence of Cyclosporine-A (CSA) on the differentiation of mouse embryonic stem cells (ESCs) into cardiomyocytes and its mechanism of regulation.Methods The differentiation system of mouse embryonic stem cells into cardiomyocytes by stages was used,and ESCs spontaneous group and CSA induction group were designed.The differentiation rate and count of cardiomyocytes were evaluated by cell immunohistochemistry and flow cytometry (FACS).The expression of CSA-induced cardiomyocyte markers was detected by cell immunohistochemistry.CSA was added at different stages of ES cell differentiation to observe whether CSA specifically acted on a particular differentiation phase.Another immunosuppressive agent including tacrolimus (calcineurin inhibitor:FK506) or 11R-VIVIT (nuclear factor of activated T cells:NFAT) was separately added in order to compare the differentiation rate of cardiomyocytes among the groups.Results In the ESCs spontaneous group,the differentiation rate of cardiomyocytes was (6.00±0.05)%,and the rate in the CSA-induction group was (60.00±0.08)%,which was displayed a statistical difference (P<0.05).The cardiomyocytes generated from induction possessed the unique characteristics.CSA specifically acted on mesodermal stem cells and promoted the differentiation of these cells into cardiac stem cells.The amount of myocardial cells was increased differentiated from mesodermal stem cells strongly promoted by CSA,while the number into epithelial cells was in decrease.After adding FK506 and 11R-VIVIT,there was no similar effect of CSA on promotion of cardiomyocyte differentiation.Conclusion Cyclosporine-A specifically acts on mesodermal stem cells and can powerfully induce these ESCs into the differentiated cardiomyocytes via non-NFAT pathway.endprint
[Key words]Cyclosporine A;Cardiac stem cells;Embryonic stem cells;Cardiomyocytes;Differentiation
近年胚胎干细胞研究已证实胚胎干细胞能够诱导分化成心肌细胞,移植到体内后可形成心肌组织,这无疑给心肌再生医疗带来了新的希望和选择[1-2]。但是移植心肌细胞的方法一直未完全建立,主要因为目前非常有效和特异地诱导胚胎干细胞向心肌细胞分化扩增方法有限,收集大量移植用的心肌细胞较困难[3]。
有研究报道了一个不同于传统拟胚体的ESCs体外分化系统[4-5],是一个二维细胞培养系统。内皮细胞(血管上皮细胞)、血细胞和血管平滑肌细胞和心肌细胞能够分别系统地从共同的中胚层干细胞诱导出来,即表达Flk1(也是血管内皮生长因子受体2)的细胞。应用这一分化系统还成功确定了Flk1+中胚层干细胞衍生的心肌干细胞群,即FCV细胞群(Flk1+/CXCR4+/血管上皮cadherin-)。
当进行细胞移植研究时,为观察环孢霉素A(Cyclosporine-A,CSA)是否对供体细胞的分化和生长有影响,本研究应用二维ESCs培养系统在体外检测CSA对ESCs向心肌细胞分化的影响。
1试剂与方法
1.1 主要试剂
诺华公司赠送环孢霉素A(CSA),用二甲基亚砜溶解为30 mg/ml,用时使用培养液稀释成1~3 μg/ml。Astellas 公司赠送FK506,用二甲基亚砜溶解为10 mg/ml,用时使用培养液稀释成(10 ng~1 μg)/ml。11R-VIVIT从Calbiochem购买。小鼠E-cadhein Flk1单克隆抗体由日本京都大学赠送。小鼠CD31 和 biotinylated-CXCR4单克隆抗体从BD Pharmingen购买。多克隆兔GFP抗体从MBL购买。小鼠抗心肌肌小节抗体(α-actinin)从Sigma公司购买,单克隆抗肌钙蛋白T(cTnT)抗体从NeoMarkers公司购买。
1.2方法
1.2.1鼠ESCs培养及分化 本研究使用EMG7胚胎干细胞株,因导入了αMHC启动子控制的GFP基因,所以当分化的心肌细胞出现自主搏动时,可在荧光显微镜下观察到心肌细胞的绿色荧光。胚体干细胞的培养方法同前[4]。单纯加培养液的设为对照组(n=5);培养液加入CSA(n=5),即CSA组,在Flk1阳性细胞接种到OP9细胞上时加入CSA。
1.2.2 OP-9细胞的准备 培养方法同前[4]。
1.2.3流式细胞仪分析细胞分化率和分离提纯细胞后计数 经过96~108 h的培养,消化收集细胞,加入APC-Flk1抗体后,用DAPI标记,用流式细胞仪分析Flk1分化率并将Flk1阳性细胞分离出来,继续在OP9细胞上培养2 d,把细胞从培养皿上消化,收集起来,与PE-AVAS12和biotinylated-CXCR4抗体相继结合,再与streptavidin-APC结合,用FACS-Vantage分析FCV阳性率并分离提纯FCV阳性细胞;在OP9细胞上培养6 d,将收集的细胞与抗CD45或CD31抗体结合,用FACS分析血细胞或内皮细胞和GFP阳性的心肌细胞。
1.2.4细胞免疫荧光检测 吸掉培养液,4%多聚甲醛室温固定15 min,冷PBS洗涤2次,加1%BSA室温下封闭30 min。cTnT抗体(1∶2000稀释),α-actinin(1∶200稀释)4℃孵育过夜。翌日,PBS洗涤2次,Alexa546标记的兔抗鼠抗体(1∶200稀释)室温孵育1 h;PBS洗涤后标记0.1 μg/ml DAPI,最后在荧光显微镜下观测。
1.2.5定量分析心肌细胞的分化率 cTnT的荧光强度使用电子CCD相机探测,数据用Image-Pro Plus图像处理软件处理。
1.3统计学处理
采用SPSS 17.0软件对所需数据进行统计学分析,计量资料用x±s表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2结果
2.1 CSA能够促进ESCs向心肌细胞分化
加入CSA后GFP阳性的心肌细胞显著增加。心肌细胞分化率:ESCs自发组为6%,CSA诱导组为60%,两组差异有统计学意义(P<0.05)(图1)。
2.2 CSA作用生成的心肌细胞正常表达标志物
肌钙蛋白T(图2A)和心肌肌小节α-actinin(图2B、C)。
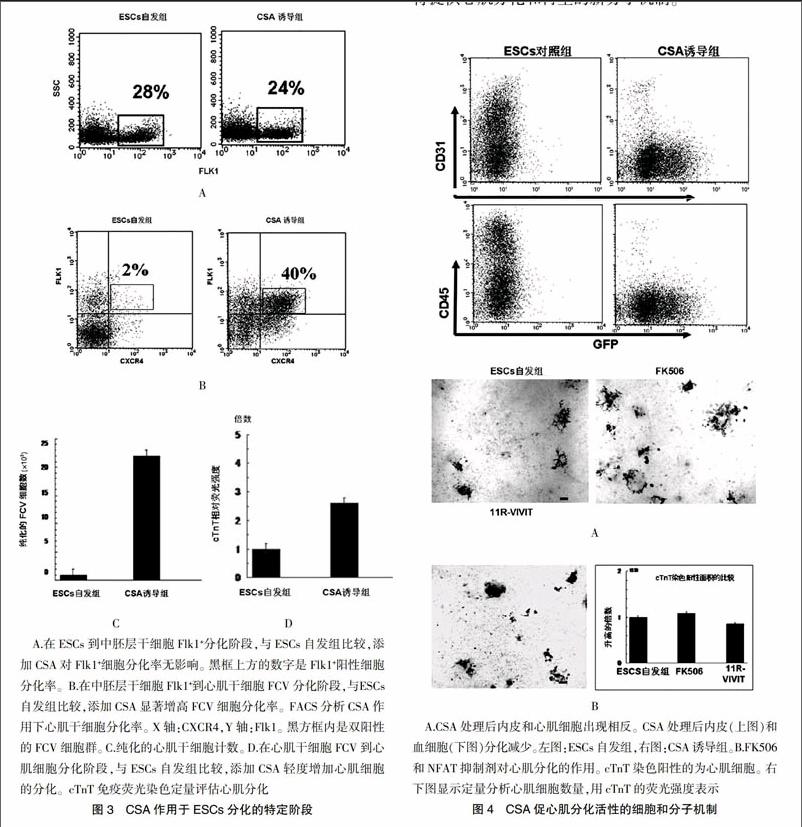
2.3 CSA作用在哪一个分化阶段
CSA对未分化的ES细胞向Flk1+細胞分化过程无任何影响(图3A)。与ESCs自发组比较,CSA作用于Flk1+细胞后,特异地增加FCV细胞10~20倍(图3B),FCV最高分化率达40%,通过FACS计数,产生的FCV细胞数可增加约22倍[ESCs自发组:(0.2±0.001)×103cells/104 Flk1 cells,CSA诱导组:(4.3±0.23)×103cells/104 Flk1 cells,n=12,P<0.01](图3C)。CSA作用于纯化的FCV细胞后,只轻微地增加心肌细胞的生成,与ESCs自发组比较,约2.6倍(图3D),结果表明CSA诱导心肌的这一新活性,限制在中胚层形成后的分化阶段,主要作用于中胚层和心肌干细胞之间的阶段,可有效、特异地诱导扩增心肌干细胞生成。
2.4 CSA这一活性的细胞和分子机制
在FLk-第0~6天添加CSA,强力促进心肌细胞生成,相反上皮细胞或血细胞生成减少(图4A)。CSA和FK506都是钙调磷酸酶抑制剂,通过抑制NFAT起到免疫抑制作用。但是,FK506和一种NFAT抑制剂11R-VIVIT,用我们的分化体系对心肌分化无影响(图4B),说明CSA的促进心肌分化活性应该是不依赖NFAT途径的,说明CSA强力促进心肌分化的活性应该是通过新的机制被激活,它是特异地作用于中胚层细胞,通过NFAT非依赖途径,可特异、有效地扩增心肌干细胞。针对CSA这一活性的确切机制研究将提供心肌分化和再生的新分子机制。endprint
3討论
心血管疾病中心肌梗死严重危害人类健康。发生心肌梗死的心肌组织不能再生,存活心肌组织代偿能力满足不了机体需要时,逐渐导致心脏泵功能衰竭,各种保守治疗不可能从根本上解决问题,心脏移植受方方面面限制,困扰了临床治疗。研究者们必然寻找新的、更有效的治疗方法。随着细胞和组织工程研究的不断发展,干细胞移植技术在治疗心血管疾病中备受瞩目[6-8]。然而,细胞治疗应用于心肌梗死的治疗,确切的作用机制尚未完全阐明,临床应用的有效性和安全性仍然是目前研究者们关注和争论的焦点[9-10]。
研究者们一直试图找到一种体外诱导胚胎干细胞分化为心肌细胞的方法,理想的方法无疑是耗费少,效率和纯度高、产量大,才符合临床应用的要求。本研究应用发现的CSA作用于中胚层的新功能,提出了一种特异有效地从ESCs扩增心肌细胞的方法。免疫抑制剂CSA是一种钙调磷酸酶拮抗剂,能够阻断T细胞内的NFAT的信息通路,从而发挥免疫抑制剂的作用[11]。多项研究还发现CSA参与了许多其他的细胞活动,比如心脏瓣膜的形成[12],心肌肥厚[13]和毛发的生长[14]。国外学者发现CSA作用于拟胚体有微弱地促心肌分化作用[15],能否促心肌细胞分化及进一步的分子机制不清楚。这种不同于拟胚体的分阶段胚胎干细胞分化系统应该能够明确地挖掘出CSA的强力作用于中胚层和新的非NFAT依赖的活性,而这一活性被拟胚体中细胞混合物所掩盖。这种培养系统将有利于应用生化技术筛选小分子化合物,从而发现新的促心肌再生药物。
相对CSA强力促进心肌细胞分化的作用,另一种钙调磷酸酶抑制剂——FK506却没有显现出促心肌分化的活性。FK506通过与FKBP12结合而发挥各种活性,与CSA在结构,结合蛋白和药代学等方面有些不同。未来围绕CSA这一活性的机制研究将有助于揭开心肌分化和再生的分子机制。
CSA具有悠久的临床应用历史,它的安全性已经得到证实[16]。相信不久的将来,应用CSA扩增心肌细胞的方法将会被应用于临床,被广泛用于心肌再生的治疗。
近几年,诱导多功能干细胞(iPS)通过转入特定的转录因子,成功地从人体细胞产生[17-20]。这种CSA介导的心肌分化方法将扩展应用到iPS分化中,将会广泛益于心肌再生的发展。
[参考文献]
[1]Stewart R,Stojkovic M,Lako M.Mechanism of self-renewal in human embryonic stem cells[J].Eur J Cancer,2006,42(9):1257-1272.
[2]Laflamme MA,Murry CE.Regenarating the heart[J].Nat Biotechnol,2005,23(7):845-856.
[3]Kolossov E,Bostani T,Roell W,et al.Engraftment of engineered ES cell-derived cardiomyocytes but not BM cells restores contractile function to the infarcted myocardium[J].J Exp,2006,203(10):2315-2327.
[4]Yamashita JK,Takano M,hiraoka-Kanie M,et al.Prospective identification of cardiac progenitors by a noval single cell-based cardiomyocyte induction[J].FASEB J,2005,19(11):1534-1536.
[5]Yamashita J,Itoh H,Hirashima M,et al.Flk1-positive cells derived from embryonic stem cells serve as vascular progenitors[J].Nature,2000,408(6808):92-96.
[6]Orlic D,Hill JM,Arai AE.Stem cells for myocardial regeneration[J].Circ Res,2002,91(12):1092-1102.
[7]Roell W,Lewaher T,Sasse P,et al.Engraftment of connexin-43 expressing prevents post-infart arrhythmia[J].Nature,2007,450(7171):819-824.
[8]Dove A.Cell-based therapies go live[J].Nat Biotechnol,2002, 20(4):339-343.
[9]Tambara K,Sakakibara Y,Sakaguchi G,et al.Transplanted skeletal myoblasts can fully replace the infarcted myocardium when they survive in the host in large numbers[J].Circulation,2003,108(Suppl 1):II259- II263.
[10]Lyon A,Harding S.The potential of cardiac stem cell therapy for heart failure[J].Curr Opin Pharmacol,2007,7(2):164-170.
[11]Crabtree GR,Olson EN.NFAT signaling:choreographing the social lives of cells[J].Cell,2002,109(Suppl):S67-S79endprint
[12]Ranger AM,Grusby MJ,Hodge MR,et al.The transcription factor NFATc is essential for cardiac valve formation[J].Nature,1998,392(6672):186-190.
[13]de la Pompa JL ,Timmerman LA,Takimoto H,et al.Role of the NFATc transcription factor in morphogenesis of cardiac valves and septum[J].Nature,1998,392(6672):182-186.
[14]Horsley V,Aliprantis AO,Polak L,et al.NFATc1 balances quiescence and proliferation of skin stem cells[J].Cell,2008, 132(2):299-310.
[15]Sachinidis A,Schwengberg S,Hippler-Altenburg R,et al.Identification of small signalling molecules promoting cardiac-specific differentiation of mouse embryonic stem cells[J].Cell Physiol Biochem,2006,18(6):303-314
[16]Oger J.Immunosuppression:promises and failures[J].J Neurol Sci,2007,259(1-2):74-78.
[17]Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J].Cell,2007,131(5):861-872.
[18]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[19]Okita K,Ichisaka T,Yamanaka S.Genaration of germline-competent induced pluripotent stem cells[J].Nature,2007, 448(7151):313-317.
[20]Narazaki G,Uosaki H,Teranishi M,et al.Directed and systematic differentiation of cardiovascular cells from mouse induced pluripotent stem cells[J].Circulation,2008,118(5):498-506.
(收稿日期:2017-02-08 本文編辑:许俊琴)endprint
