氧化应激与胰腺癌的关系
2017-10-23李小成涂经楷龚建平
李小成, 涂经楷, 龚建平
(1 重庆医科大学附属第二医院 肝胆外科,重庆 400010; 2 重庆市第五人民医院 普外科, 重庆 400062)
氧化应激与胰腺癌的关系
李小成1, 涂经楷2, 龚建平1
(1 重庆医科大学附属第二医院 肝胆外科,重庆 400010; 2 重庆市第五人民医院 普外科, 重庆 400062)
胰腺癌早期症状不明显,发现时通常已进展至中晚期。目前晚期胰腺癌主要以化疗为主,但化疗对胰腺癌的有效率较低,给治疗带来了极大的挑战。氧化应激引起的活性氧可损伤DNA、蛋白质和脂质,并产生可改变肿瘤生物学行为的有毒和致突变的代谢产物,使该肿瘤转化为恶性表型。抗氧化剂具有抗癌的保护性作用,为抗氧化应激治疗胰腺癌的药物设计提供了基础。简述氧化应激与胰腺癌相关的分子通路研究进展,以便进一步探索靶向活性氧治疗胰腺癌的新方法。
胰腺肿瘤; 氧化性应激; 综述
胰腺癌的发病率始终呈上升趋势,预计到2020年将成为癌症相关死亡的第二大病因[1]。晚期胰腺癌的治疗主要以基于吉西他滨与其他药物的联合化疗为主,但化疗对胰腺癌治疗的有效率低,研究[2]显示其有效率不足30%,且化疗后5年生存率低,目前尚无有效的治疗方法。据报道[3]氧化应激与癌症的发生有关,并可影响肿瘤微环境,但其确切的关系尚不清楚。氧化应激主要由线粒体过度产生和累积的自由基引起,包括可引起脂质、蛋白质和DNA损伤的活性氧(ROS)[4]。氧化应激可引起脂肪酸过氧化,其代谢物具有非常高的毒性和致突变性,其中最重要的化合物是4-羟基壬烯醛(4-HNE)和丙二醛(MDA)[5]。已有报道[6]抗氧化剂治疗胰腺癌可改善患者预后,氧化应激将为胰腺癌的治疗提供一个新的潜在靶点。
1 胰腺癌相关危险因素
可明显增加胰腺癌发生风险的因素有胰腺癌家族史、慢性胰腺炎、糖尿病、吸烟、大量饮酒及肥胖等。约10%的胰腺癌患者中有相关家族史,某些突变基因的遗传可能是导致有胰腺癌家族史人群中发病率升高的主要原因,然而大多数家族性胰腺癌的遗传基础仍然未知。据统计[7],患有慢性胰腺炎病史20年后,胰腺癌累积发生风险为4%,确诊糖尿病20年者,胰腺癌发生风险则增加30%。但胰腺癌与糖尿病之间的因果关系争议较大,有研究[8]发现在约50%的胰腺癌患者中观察到患有糖尿病,并且大多数为新发糖尿病,故认为糖尿病是胰腺癌的潜在和早期症状。有报道[7],吸烟史超过10年者,发生胰腺癌风险增加75%。另外,肥胖、大量饮酒和某些感染性疾病也被认为与胰腺癌的发生密切相关。
2 氧化应激与胰腺癌
研究[9]显示胰胆管恶性肿瘤的表型与氧化应激条件相关,但具体作用机制还需进一步研究。大多与胰腺癌发病率增加相关的因素也与ROS过表达有关,其中肥胖、吸烟、高酒精摄入和炎症是最相关因素。肥胖相关脂肪细胞可诱导细胞应激,导致脂肪组织产生促炎因子(如IL-8、IL-6或IL-2)、乳酸脱氢酶(LDH)和TNFα,并激活氧化应激[6]。合并吸烟或慢性胰腺炎等多个危险因素将明显增加胰腺癌发病风险,因为吸烟诱导了患者氧化应激,增加DNA损伤和胰腺的癌变风险[10]。高血糖可促进胰腺癌细胞的氧化应激,进而触发胰岛素抵抗的形成,从而增高血胰岛素水平,而高胰岛素可直接或间接促进胰腺癌细胞的生长。
正常情况下ROS和抗氧化剂水平维持在平衡状态,当氧化剂大量产生或积聚时打破平衡,发生氧化应激。肿瘤细胞代谢活性高,可在各种癌症中检测到由氧化应激产生的ROS物质,研究[3]表明ROS可以通过不同的方式促进肿瘤细胞的生长和恶性转化。内部氧化应激的产生依赖于过氧化物酶体等,而烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶是胰腺癌细胞内ROS的主要来源。线粒体是参与氧化应激的主要细胞器[11],这些酶则大多数作用在线粒体中。氧化应激可影响参与若干分子通路的关键信号蛋白,如核因子E2相关因子2(NRF2)、Kelch样环氧氯丙烷相关蛋白1(KEAP1)、哺乳动物雷帕霉素靶点(mTOR)、c-MYC、P53和蛋白激酶C(PKC),以及参与有丝分裂原活化蛋白激酶(MAPK)通路的RAS、RAF、细胞外调节蛋白激酶(ERK1/2)、丝裂原活化蛋白激酶(MEK)、c-Jun氨基末端激酶(JNK)和P38[12-13]。P38作为氧化应激的关键传感器,其氧化还原传感功能对抑制肿瘤生长或促进凋亡至关重要[14]。另外,NRF2是抗氧化反应的主要调节剂。
2.1 活性氧(ROS) ROS参与了生物过程中一些重要信号通路的调节,使肿瘤细胞通过这些通路调节其增殖、凋亡和侵袭性(图1)。ROS在胰腺癌发病中具有双重作用,双重作用的发挥取决于ROS在细胞中的浓度。细胞内轻中度水平ROS可促进癌细胞增殖、侵袭和转移,从而促进癌症进展,而过度生成的ROS却可明显损害癌细胞并导致细胞死亡。炎症诱发的慢性缺氧和ROS累积可增强肿瘤代谢适应、增殖和血管形成[18]。
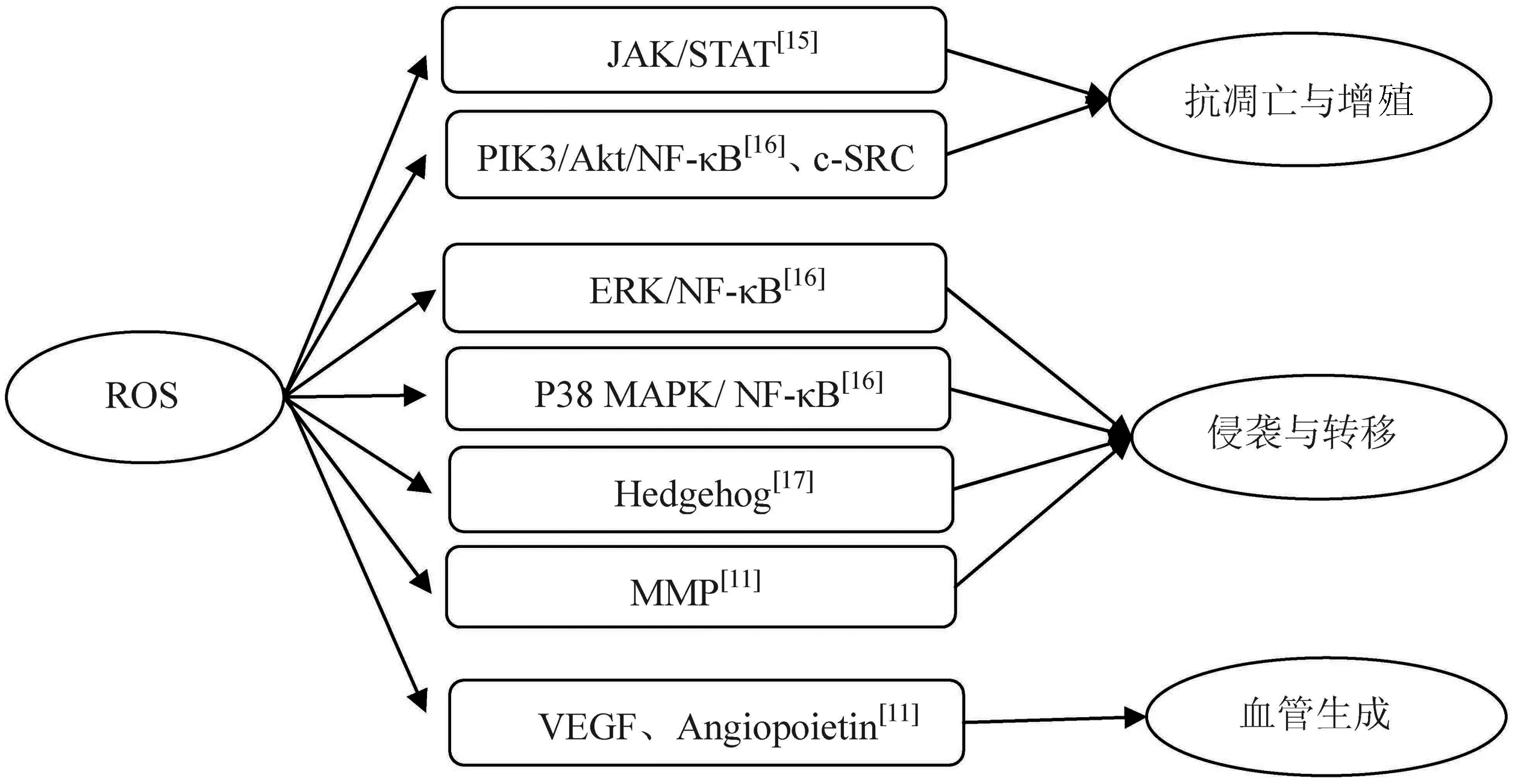
图1 ROS参与相关信号通路的调节
2.2 ROS和microRNA(miRNA) miRNA是由21~24个核苷酸组成的非编码进化保守的小RNA分子,可通过与靶信使RNA(mRNA)结合抑制基因的表达[19]。已有研究[20]证实了几种ROS相关的miRNA与癌症的发展相关。在胰腺癌中,miRNA-155的过表达可抑制FOXO3a,导致超氧化物歧化酶2和过氧化氢酶的降低,并诱导癌细胞中的ROS积聚[21]。miRNA-128a在肿瘤中是下调的,其再表达可使B细胞特异性莫洛尼鼠白血病病毒整合位点1下调而抑制癌细胞增殖,在髓母细胞瘤细胞中可通过增加ROS改变氧化还原平衡[22]。另一项研究[23]显示miRNA-200a和miRNA-141可作为高分化卵巢癌的氧化应激反应调节剂。同样研究[24]发现来源于NADPH氧化酶的ROS,通过调节前列腺癌细胞中的miRNA-21,而参与肿瘤增殖和侵袭性形成。
2.3 胰腺癌中的炎症因子与ROS累积 ROS可诱导促炎细胞因子表达,同时ROS的生成也可通过癌细胞中促炎细胞因子的反馈而加剧[25]。此外,还有许多其他因素可以刺激癌细胞产生ROS,如胰岛素样生长因子1和成纤维细胞生长因子2[14]。细胞因子一般通过调节肿瘤微环境促进胰腺癌进展,有时也可直接作用于癌细胞引起其扩散、侵袭和转移。细胞因子是由白细胞、星状细胞和脂肪细胞产生的,在不同胰腺疾病患者血清中已经检测到与氧化应激相关的几种促炎细胞因子和其他化合物,如IL-2、IL-6、IL-1β、IL-8、TNFα、TGFβ、LDH、4-HNE和MDA[26]。
3 抗氧化应激与胰腺癌
氧化应激的抑制可作为抑制不同类型肿瘤细胞生长的靶点。目前已应用不同试剂中和ROS、氧化应激相关细胞因子和其他促炎因子来降低氧化应激对疾病的影响,用作抗肿瘤治疗的抗氧化药物包括维生素E、维生素C、姜黄素和辅酶Q10等。维生素E包括4种生育酚和其他生育三烯酚的4种亚型,其可抑制突变型KRAS驱动的通路,如MEK/ERK、PIK3/AKT、NF-κB/P65、BCL-XL和胰腺癌中诱导的P27。δ-生育酚可通过升高胰腺癌中CK18的血浆水平激活BAX和半胱天冬酶3而触发凋亡级联反应[27]。一项临床前研究[27]显示,维生素E能够与致癌性KRAS相互作用,因此,维生素E被提出可作为一种抗肿瘤药物。维生素C可在肿瘤细胞外基质中产生H2O2并杀死癌细胞,其作用机制可能是通过下调关键代谢节点,破坏具有KRAS突变体基因型的肿瘤细胞的Warburg效应[28]。研究[29]发现维生素C与吉西他滨和厄洛替尼联合治疗转移性胰腺癌患者不会增加药物毒性,且大部分患者病情稳定。Welsh等[30]也尝试抗坏血酸盐与吉西他滨治疗转移性和淋巴结阳性的胰腺癌患者,并取得了类似的结果。
考虑到胰腺癌的所有类型肿瘤都具有KRAS突变的高发生率,以及50%以上的患者可表现出这种异常[31],KRAS突变已被认为是引发此种类型癌症的关键因素[32]。维生素(如维生素E和维生素C)可通过MAPK或PIK3/AKT抑制突变型KRAS驱动的通路,为尚无有效治疗药物的肿瘤提供了新的治疗策略。抗氧化剂在胰腺癌治疗中的临床应用尚存在较多争论,如单独的抗氧化剂联合使用还是与其他化疗药物联合治疗更能改善患者的生存率有待探讨。尽管临床前研究模型已证明了抗氧化剂的疗效,但临床试验还主要集中在单独使用抗氧化剂或与标准化疗联合使用的安全性评估上。因此,将这些化合物引入常规的临床使用还需进一步的大样本随机对照试验。
4 小结与展望
过度产生或积聚的ROS可对细胞脂质、蛋白质和DNA造成损害,这种损害将导致有毒和致突变的代谢物的产生,从而改变细胞的稳态。癌症是基于DNA畸变引起的肿瘤表型转化,而ROS产物可使肿瘤细胞获得侵袭性和侵袭性表型。因此,氧化应激在胰腺癌细胞的增殖、凋亡、侵袭与进展中发挥了重要作用。维生素具有一定抗癌的保护性作用,并被提出作为新的化疗方法。然而,抗氧化剂作为癌症治疗的有效性尚存在争议,其治疗结果尚不确切。由于抗氧化剂的无毒性和安全性,用抗氧化剂调节癌症中的氧化应激,在未来将是一种潜在的治疗方法。同时,这些分子的研究为今后的抗胰腺癌药物靶点设计提供了基础。
[1] SIEGEL RL, MILLER KD, JEMAL A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30.
[2] CILIBERTO D, BOTTA C, CORREALE P, et al. Role of gemcitabine-based combination therapy in the management of advanced pancreatic cancer: a meta-analysis of randomised trials[J]. Eur J Cancer, 2013, 49(3): 593-603.
[3] SOSA V, MOLINE T, SOMOZA R, et al. Oxidative stress and cancer: an overview[J]. Ageing Res Rev, 2013, 12(1): 376-390.
[4] SCHIEBER M, CHANDEL NS. ROS function in redox signaling and oxidative stress[J]. Curr Biol, 2014, 24(10): r453-r462.
[5] UCHIDA D, TAKAKI A, ISHIKAWA H, et al. Oxidative stress balance is dysregulated and represents an additional target for treating cholangiocarcinoma[J]. Free Radic Res, 2016, 50(7): 732-743.
[6] KARIN M, GRETEN FR. NF-kappaB: linking inflammation and immunity to cancer development and progression[J]. Nat Rev Immunol, 2005, 5(10): 749-759.
[7] KAMISAWA T, WOOD LD, ITOI T, et al. Pancreatic cancer[J]. Lancet (London, England), 2016, 388(10039): 73-85.
[8] BOURSI B, FINKELMAN B, GIANTONIO BJ, et al. A clinical prediction model to assess risk for pancreatic cancer among patients with new-onset diabetes[J]. Gastroenterology, 2017, 152(4): 840-850,e3.
[9] ZHANG Y, YAN W, COLLINS MA, et al. Interleukin-6 is required for pancreatic cancer progression by promoting MAPK signaling activation and oxidative stress resistance[J]. Cancer Res, 2013, 73(20): 6359-6374.
[10] PANG TS, CAO LP, LIN TY, et al. Multiple factor analysis of pancreatic cancer-associated risk factors[J]. Chin J Pract Surg, 2014, 34(10): 962-966.(in Chinese)
庞天舒, 曹利平, 林天宇, 等. 胰腺癌相关危险因素多因素分析[J]. 中国实用外科杂志, 2014, 34(10): 962-966.
[11] NARENDHIRAKANNAN RT, HANNAH MA. Oxidative stress and skin cancer: an overview[J]. Indian J Clin Biochem, 2013, 28(2): 110-115.
[12] MATSUZAWA A, ICHIJO H. Redox control of cell fate by MAP kinase: physiological roles of ASK1-MAP kinase pathway in stress signaling[J]. Biochim Biophys Acta, 2008, 1780(11): 1325-1336.
[13] NGUYEN T, NIOI P, PICKETT CB. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress[J]. J Biol Chem, 2009, 284(20): 13291-13295.
[14] LUO Y, ZOU P, ZOU J, et al. Autophagy regulates ROS-induced cellular senescence via p21 in a p38 MAPKalpha dependent manner[J]. Exp Gerontol, 2011, 46(11): 860-867.
[15] JU KD, LIM JW, KIM KH, et al. Potential role of NADPH oxidase-mediated activation of Jak2/Stat3 and mitogen-activated protein kinases and expression of TGF-beta1 in the pathophysiology of acute pancreatitis[J]. Inflamm Res, 2011, 60(8): 791-800.
[16] CAO L, CHEN X, XIAO X, et al. Resveratrol inhibits hyperglycemia-driven ROS-induced invasion and migration of pancreatic cancer cells via suppression of the ERK and p38 MAPK signaling pathways[J]. Int J Oncol, 2016, 49(2): 735-743.
[17] LI W, CAO L, CHEN X, et al. Resveratrol inhibits hypoxia-driven ROS-induced invasive and migratory ability of pancreatic cancer cells via suppression of the Hedgehog signaling pathway[J]. Oncol Rep, 2016, 35(3): 1718-1726.
[18] ZHANG C, CAO S, TOOLE BP, et al. Cancer may be a pathway to cell survival under persistent hypoxia and elevated ROS: a model for solid-cancer initiation and early development[J]. Int J Cancer, 2015, 136(9): 2001-2011.
[19] YANG YF, TAN XD, ZHOU L, et al. Advances in the study of the relationship between MicroRNA and pancreatic cancer[J]. Chin J Med Offic, 2016, 44(11): 1203-1205. (in Chinese)
杨一帆, 谭晓冬, 周磊, 等. MicroRNA与胰腺癌关系研究进展[J]. 临床军医杂志, 2016, 44(11): 1203-1205.
[20] FAVARO E, RAMACHANDRAN A, MCCORMICK R, et al. MicroRNA-210 regulates mitochondrial free radical response to hypoxia and krebs cycle in cancer cells by targeting iron sulfur cluster protein ISCU[J]. PLoS One, 2010, 5(4): e10345.
[21] WANG P, ZHU CF, MA MZ, et al. Micro-RNA-155 is induced by K-Ras oncogenic signal and promotes ROS stress in pancreatic cancer[J]. Oncotarget, 2015, 6(25): 21148-21158.
[22] VENKATARAMAN S, ALIMOVA I, FAN R, et al. MicroRNA 128a increases intracellular ROS level by targeting Bmi-1 and inhibits medulloblastoma cancer cell growth by promoting senescence[J]. PLoS One, 2010, 5(6): e10748.
[23] MATEESCU B, BATISTA L, CARDON M, et al. miR-141 and miR-200a act on ovarian tumorigenesis by controlling oxidative stress response[J]. Nat Med, 2011, 17(12): 1627-1635.
[24] JAJOO S, MUKHERJEA D, KAUR T, et al. Essential role of NADPH oxidase-dependent reactive oxygen species generation in regulating microRNA-21 expression and function in prostate cancer[J]. Antioxid Redox Signal, 2013, 19(16): 1863-1876.
[25] SRIDHARAN DM, ASAITHAMBY A, BAILEY SM, et al. Understanding cancer development processes after HZE-particle exposure: roles of ROS, DNA damage repair and inflammation[J]. Radiat Res, 2015, 183(1): 1-26.
[26] HOCEVAR BA, KAMENDULIS LM, PU X, et al. Contribution of environment and genetics to pancreatic cancer susceptibility[J]. PLoS One, 2014, 9(3): e90052.
[27] HUSAIN K, CENTENO BA, CHEN D T, et al. Prolonged survival and delayed progression of pancreatic intraepithelial neoplasia in LSL-KrasG12D/+;Pdx-1-Cre mice by vitamin E delta-tocotrienol[J]. Carcinogenesis, 2013, 34(4): 858-863.
[28] CHEN Q, ESPEY MG, SUN AY, et al. Pharmacologic doses of ascorbate act as a prooxidant and decrease growth of aggressive tumor xenografts in mice[J].Proc Natl Acad Sci U S A, 2008, 105(32): 11105-11109.
[29] MONTI DA, MITCHELL E, BAZZAN AJ, et al. Phase I evaluation of intravenous ascorbic acid in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer[J]. PLoS One, 2012, 7(1): e29794.
[30] WELSH JL, WAGNER BA, van′t ERVE TJ, et al. Pharmacological ascorbate with gemcitabine for the control of metastatic and node-positive pancreatic cancer (PACMAN): results from a phase I clinical trial[J]. Cancer Chemother Pharmacol, 2013, 71(3): 765-775.
[31] SHIN SH, KIM SC, HONG SM, et al. Genetic alterations of K-ras, p53, c-erbB-2, and DPC4 in pancreatic ductal adenocarcinoma and their correlation with patient survival[J]. Pancreas, 2013, 42(2): 216-222.
[32] DERAMAUDT T, RUSTGI AK. Mutant KRAS in the initiation of pancreatic cancer[J]. Biochim Biophys Acta, 2005, 1756(2): 97-101.
Associationbetweenoxidativestressandpancreaticcancer
LIXiaocheng,TUJingkai,GONGJianping.
(DepartmentofHepatobiliarySurgery,TheSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China)
Pancreatic cancer (PC) is often asymptomatic in the early stage and most patients have progressed to the advance stage at the time of diagnosis. At present, chemotherapy is mainly used in patients with advanced PC, but PC patients have poor response to chemotherapy, which brings great challenges to the treatment of PC. Oxidative stress-induced reactive oxygen species (ROS) can cause damages in DNA, proteins, and lipids and produce the toxic and mutagenic metabolites that alter the biological behavior of tumor and transform the tumor into a malignant phenotype. Antioxidants have an antitumor effect and provide a basis for the design of anti-oxidative stress drugs for the treatment of PC. This article summarizes the research advances in the molecular pathways associated with oxidative stress and PC, in order to explore new ROS-targeted methods for the treatment of PC.
pancreatic neoplasms; oxidative stress; review
R735.9
A
1001-5256(2017)10-2035-04
10.3969/j.issn.1001-5256.2017.10.040
2017-04-13;
2017-06-12。
李小成(1991-),男,主要从事胰腺癌临床与基础研究。
龚建平,电子信箱: gongjianping11@126.com。
引证本文:LI XC, TU JK, GONG JP. Association between oxidative stress and pancreatic cancer[J]. J Clin Hepatol, 2017, 33(10): 2035-2038. (in Chinese)
李小成, 涂经楷, 龚建平. 氧化应激与胰腺癌的关系[J]. 临床肝胆病杂志, 2017, 33(10): 2035-2038.
(本文编辑:朱 晶)
