我国甘蔗梢腐病2种主要病原菌孢子萌发特性及品种(系)抗性评价
2017-10-20王泽平高轶静段维兴张保青杨翠芳张革民
王泽平,刘 璐,高轶静,罗 霆,段维兴,张保青,杨翠芳,周 珊,张革民
(广西农业科学院甘蔗研究所/中国农业科学院 甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室,广西 南宁 530007)
我国甘蔗梢腐病2种主要病原菌孢子萌发特性及品种(系)抗性评价
王泽平,刘 璐,高轶静,罗 霆,段维兴,张保青,杨翠芳,周 珊,张革民*
(广西农业科学院甘蔗研究所/中国农业科学院 甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室,广西 南宁 530007)
研究国内甘蔗梢腐病两种主要病原菌Fusariumverticillioides和F.proliferatum的分生孢子萌发特性,并对18个代表性甘蔗种质资源进行梢腐病抗性评价,为甘蔗梢腐病综合防控提供参考。结果表明:F.verticillioides在孢子浓度4×106、温度20 ℃、葡萄糖浓度0.02 %、黑暗、pH 6.5、相对湿度80.00 %条件下孢子萌发率最高;F.proliferatum在孢子浓度8×106、温度35 ℃、葡萄糖浓度0.05 %、紫外光、pH 6.5、相对湿度80.00 %条件下孢子萌发率最高。18份参试甘蔗品种(系)中16份属于梢腐病抗性材料,只有GT 37和GT 21表现出明显感病特征。F.verticillioides病原菌分生孢子萌发力和致病性强于F.proliferatum。利用两个病原菌筛选出来的2个感病品种(系)GT 37、GT 21及3个高抗品种(系)Q 202、ROC 1、YT 94-128可作为典型种质材料来进行抗感试验。
甘蔗;梢腐病;致病菌;孢子萌发特性;抗性评价
梢腐病(Pokkah boeng disease)作为一种气传性真菌病害,其侵染甘蔗后会引起叶片褪绿黄化、皱缩扭曲,最终导致植株停止生长或在梢部幼嫩组织上形成顶腐状,从而影响甘蔗产量形成和糖分积累[1]。梢腐病具有发病速度快、传播性强等特点,如不及时控制病害的蔓延,必将严重影响到甘蔗产业的可持续发展。甘蔗梢腐病的病原为镰刀菌[2],深入研究病原菌生物学特性、病害流行学及其侵染模式,对于研发有效的生物、化学及农业等综合防控措施,具有重要意义。目前,国内外已经报道了甘蔗梢腐病存在多种病原,包括F.verticillioides、F.prolifeatum、F.sacchari、F.subglutinan和F.andiyazi等,且不同蔗区的种群及优势种也不同[3-5]。本课题组前期研究也表明我国蔗区梢腐病至少存在F.verticillioides和F.prolifeatum2种病原,前者占主导地位,占200多份病样的80.00 %[6]。鉴于分生孢子萌发率直接影响病原对宿主的侵染成功率以及发病率,故有关温度、相对湿度及光照等环境因素影响病原菌分生孢子萌发的问题一直备受关注[7-9],但甘蔗梢腐病病原菌孢子萌发环境因素的相关研究尚未见报道。因此,本研究拟在室内条件下检测甘蔗梢腐病两种主要致病菌F.verticillioides和F.prolifeatum在不同孢子浓度、温度、光照、pH、葡萄糖浓度以及相对湿度下的孢子萌发特性,明确其接种条件的同时,并对18个代表性甘蔗种质资源进行梢腐病抗性评价。
1 材料与方法
1.1 试验材料
供试梢腐病病原菌菌株F.verticillioides和F.prolifeatum于2011-2012年分离自广西、广东、海南、云南和福建等我国主要蔗区的甘蔗病叶,并经柯赫氏法则鉴定、形态学观察及ITS序列测定和分析。供试18个甘蔗品种分别来源于6个国家和地区,美国 :CP72-1210、CP81-1254和CP89-2143;广西:GT21、GT37和GT42;澳大利亚:Q200、Q202 和Q209;台湾:ROC1、ROC16和ROC22;海南:YC58-14、YC73-512和YC96-45;广东:YT83-271、YT94-128和YT96-86。
1.2 试验方法
1.2.1 分生孢子悬浮液制备 参考Wang等[10]方法进行病原菌分生孢子的培养和收集,将菌株接种于PDA平板上活化,单点中央接种法接种于新的PDA平板,25 ℃培养5 d,用打孔器取5 mm直径的菌碟,在150 mL PDB液体培养液中放入2块,25 ℃条件下,在120 r/min摇床上培养7 d。用2层无菌纱布过滤培养液中的菌丝,将滤液加入到50 mL离心管,2000 r/min离心1 min,倒掉液体,用无菌水将沉淀物悬浮再离心1次,用灭菌水调整孢子浓度为1×106孢子/mL,作为接种体。
1.2.2 环境因素对梢腐病病原菌分生孢子萌发影响的测定 (1)温度对孢子萌发的影响。用移液枪吸取100 μl制好的孢子悬浮液滴在液体PDA 培养基上,振荡摇匀,分别置于15、20、25、30和35 ℃黑暗条件下保湿培养,于2、4、6、8和10 h后镜检其大、小孢子萌发率,每个处理调查100个分生孢子,每个处理3次重复。
(2)相对湿度对孢子萌发的影响。在灭菌后的直径为12 cm的大培养皿中放置1个直径为6 cm的小培养皿,大培养皿里盛2/3皿盐类饱和溶液,将制备好的孢子悬浮液滴一滴于洁净的载玻片上,晾干后迅速置于小培养皿中,用保鲜膜把大培养皿封口并置于相应湿度的培养箱中25 ℃ 黑暗培养,相对湿度分别为45.00 %(饱和碳酸钾溶液)、60.00 %(饱和溴化钠溶液)、70.00 %(饱和碘化钾溶液)、80.00 %(饱和溴化钾溶液)、98.00 %(饱和硝酸镁溶液),每隔24 h 镜检1次孢子萌发率。
(3)pH值对孢子萌发的影响。室温条件下,用 HCL ( 1 mol/L) 和 NaOH ( 1 mol/L) 将 PDA 培养基 pH分别调至 5.5、6.0、6.5、7.0和7.5,室温条件下保湿培养,接种、菌丝生长和孢子萌发测量方法同1.2.2(1)。
(4)不同光照对孢子萌发的影响。室温条件下,将接种好的PDA 培养基置于紫外光(4瓦石英消毒灯,初始光强大约为15μW/cm2)、自然光照和黑暗下进行培养,其他方法同1.2.2(1)。
(5)不同葡萄糖浓度对孢子萌发的影响 。室温条件下,将接种好的PDA 培养基置于不同葡萄糖浓度(0、1 %、2 %和5 %)下进行培养,其他方法同1.2.2(1)。
(6)不同分生孢子浓度对孢子萌发的影响。室温条件下,将接种好的PDA 培养基置于不同分生孢子浓度1×106、2×106、4×106、8×106和16×106下进行培养,其他方法同1.2.2(1)。
1.3 甘蔗抗梢腐病性评价
从国家甘蔗资源圃广西点选取18个甘蔗品种(系),于2015年4月15日分别种植30桶(含3个重复,每个重复10桶;水桶规格:上部直径35 cm,底部直径20 cm,高度30 cm)于玻璃温室内,每桶4个芽。在甘蔗长至5~6叶期(2015年6月2号)时标注待接种蔗株(每个重复30株);采用针刺法进行接种[10],于清晨使用灭菌接种针吸取100 μl孢子液在幼苗基部叶鞘0.5~1.0 cm 处进行注射,接种后遮荫 24 h,25~35 ℃下每隔3 d调查1次,直至病情指数(DSI=[∑(ni×vi)/5N]×100,n代表所在级别样本数,v代表级别,N代表参试总体样本)稳定为止;选取最高病情指数进行梢腐病抗性评价[11]。
1.4 统计分析
孢子萌发率计算方法:孢子萌发率( %)=萌发孢子平均数/(萌发孢子平均数+未萌发孢子平均数)×100。数据采用Excel 2010、DPS 4.0和SPSS 13.0等软件进行统计分析。
2 结果与分析
2.1 不同环境条件对病原菌孢子萌发的影响
从病原菌在不同培养条件下的孢子萌发规律可以看出,F.verticillioides在浓度4×106下萌发率最高,F.prolifeatum在浓度8×106下萌发率最高(图1);病原菌分生孢子在15~35 ℃均可萌发,F.verticillioides最适萌发温度为20 ℃,F.prolifeatum最适萌发温度为35 ℃(图2);病原菌分生孢子在0~0.05 %葡萄糖浓度下均可萌发,F.verticillioides最适培养葡萄糖浓度为0.02 %,F.prolifeatum最适培养葡萄糖浓度为0.05 %(图3);F.verticillioides在黑暗条件下培养其萌发率最高,F.prolifeatum在紫外光条件下培养其萌发率最高(图4);病原菌在pH 5.5~7.5下均可萌发,在pH 6.5时其萌发率最高(图5);80.00 %湿度条件下对病原菌孢子萌发更有利(图6)。此外,从图1~6均可看出,不同培养时间对两种病原菌的孢子萌发都存在显著影响,当培养时间为2~10 h时,时间越长对其孢子萌发越有利。
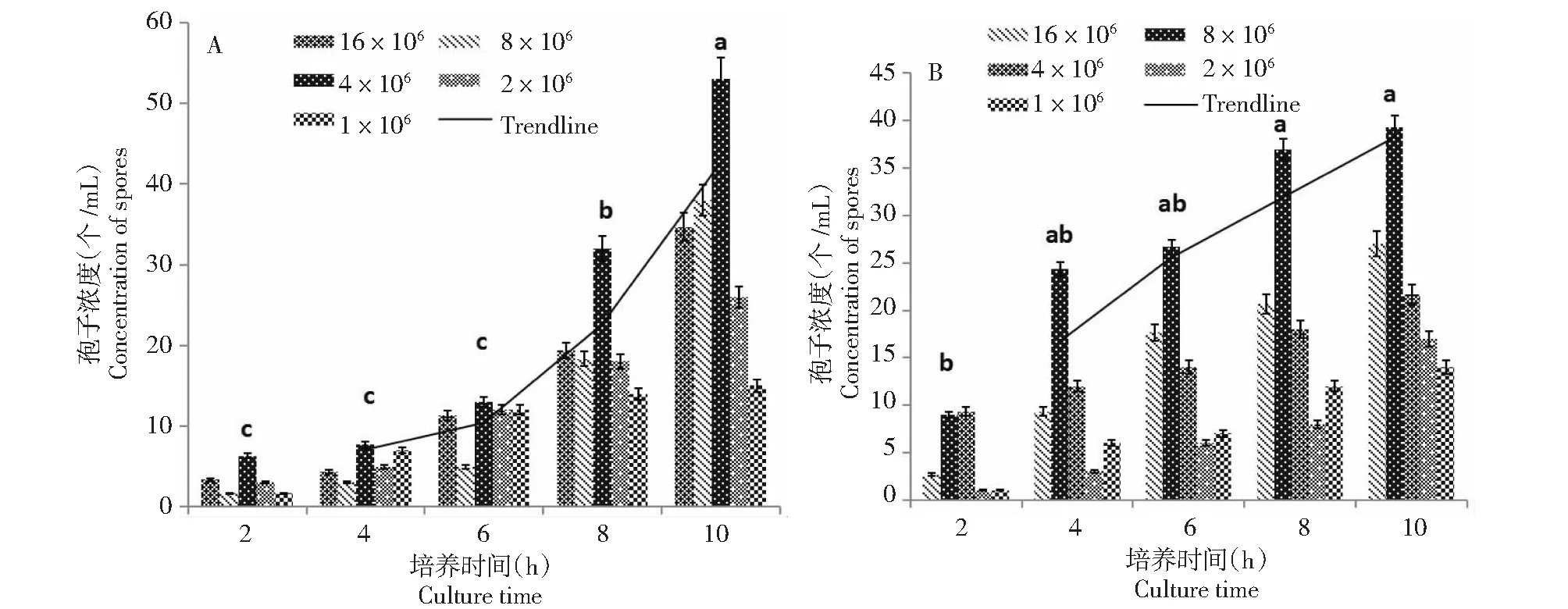
A、B分别代表病原菌F. verticillioides和F. prolifeatum, 不同环境因素中,数据中不同小写字母表示孢子萌发率最高的同等培养条件下不同培养时间之间差异达显著水平(P<0.05),图上直线为各条件下的孢子萌发趋势线,下同A and B represent the F. verticillioides & F. prolifeatum,respectively; The number 1-6 represent the concentration of the conidium, temperature, glucose concentration, light, pH, and relative humidity, respectively; Lowercase letters represent the difference at 5 % significance, the same applies in the below tables; The straight lines on the graph are the trend lines of producing spores under different conditions, the same as below图1 病原菌在不同孢子浓度下的孢子萌发规律Fig.1 The spore production rate of two pathogens under different concentration of the conidium

图2 病原菌在不同温度下的孢子萌发规律Fig.2 The spore production rate of two pathogens under different temperature

图3 病原菌在不同葡萄糖浓度下的孢子萌发规律Fig.3 The spore production rate of two pathogens under different glucose concentration

图4 病原菌在不同光照下的孢子萌发规律Fig.4 The spore production rate of two pathogens under different light

图5 病原菌在不同pH下的孢子萌发规律Fig.5 The spore production rate of two pathogens under different pH

图6 病原菌在不同相对湿度下的孢子萌发规律Fig.6 The spore production rate of two pathogens under different relative humidity
2.2 甘蔗种质资源梢腐病抗性评价
根据甘蔗梢腐病病情指数[10](≤1.0,1.1~5,5.1~10,10.1~15,15.1~20,≥20)将其抗性分成6个等级高抗(HR),抗病(R),中抗(MR),中感(MS),感病(S),高感(HS),从表1可以看出,采用病原菌F.verticillioides接种,高抗7份,抗病5份,中抗4份,感病1份,高感1份,其中Q 202未见明显病症,GT 37和GT 21的病情指数最高;采用病原菌F.prolifeatum接种,高抗11份,抗病3份,中抗3份,感病1份。其中Q 202、ROC 1、YC 58-14、YT 94-128和YT 96-86未见明显病症,而GT 37的病情指数仍明显高于其他材料,被划分为感病等级。通过发病率和病情指数整体评价发现,F.verticillioides致病性要强于F.prolifeatum,参试的18个重要甘蔗品种(系)中16个属于抗梢腐病材料,只有GT 37和GT 21表现出明显感病特征。

表1 参试甘蔗品种(系)接种梢腐病病原菌抗性评价
3 讨 论
3.1 不同培养条件对甘蔗梢腐病病原菌孢子萌发的影响
本研究中孢子浓度试验表明,F.verticillioides孢子萌发的最适浓度为4×106,F.prolifeatum最适浓度为8×106,这表明后者侵染甘蔗导致发病所需病原菌浓度更高,在生产上要提前对F.verticillioides所导致的梢腐病进行防治,趁早降低其病原基数,尤其是宿根蔗和连作地块。
温度试验表明,F.verticillioides孢子萌发最适温度在20 ℃左右,低于F.prolifeatum孢子萌发最适温度35 ℃。有关研究结果表明[12],梢腐病病原菌分生孢子在5~40 ℃内都有分生孢子萌发。与菌丝生长和分生孢子萌发的最适温度相比,适合分生孢子侵染的最佳温度范围要高。我国甘蔗主产区日平均温度多数时间为20~30 ℃,甘蔗叶片表面的实际温度要低于周围空气温度,以至于高温高湿情况下才能发生较重程度的侵染,因此推测在秋冬季节暴发出的梢腐病新症状主要是由F.verticillioides引起,这也跟课题组采样分离结果相吻合。
分生孢子产生菌丝需要营养,葡萄糖作为生物代谢的重要能源和结构物质,可明显促进孢子萌发[13]。葡萄糖试验表明F.verticillioides在低糖条件下更易萌发,表现出更强活性,这表明其在野外生存能力要强于F.prolifeatum。
光照是影响孢子生长、致病性以及防御胁迫的普遍性因子[14]。结果表明,病原菌F.verticillioides在黑暗处理下的孢子萌发情况是最理想的,将其接种时,应注意避免阳光直射,选择背阴处进行,或接种后及时进行遮阴处理,又或者选择在傍晚天黑之前接种;病原菌F.prolifeatum在短时间紫外光照射下萌发更多孢子,表现出正向调控效应,但长时间紫外光照射是有杀菌作用的,说明可能在“黑暗-弱紫外光”交替处理组合下更有利于其孢子萌发,这需要进一步试验来验证。
本研究结果表明pH值也是影响孢子萌发的重要因素,两个致病菌的孢子在弱酸性(pH 6.5)条件下更易萌发,这与其他真菌最适萌发酸碱性条件一致[15]。
湿度处理结果表明分生孢子在45.00 %~98.00 %相对湿度下都能萌发,不同湿度对其萌发率影响也非常显著,80.00 %相对湿度最适宜,这可能是由于分生孢子萌发和侵染的最适相对湿度范围一致,接近饱和湿度条件下不利于菌丝的生长。在我国甘蔗主产区,每年最低相对湿度在45.00 %~80.00 %的时间多于10 d的有近10个月,尤其在5~9月份,相对湿度基本都在60.00 %以上,从而为甘蔗梢腐病病原菌分生孢子的萌发及侵染提供良好的湿度条件,因此,其可能为雨水充足年份比干旱少雨年份发病较重,水田比旱坡地严重的原因。
3.2 甘蔗种质资源梢腐病抗性评价
本研究根据病情指数对18个参试甘蔗材料进行梢腐病抗性评价,在相同环境条件下,F.verticillioides致病性较强,在蔗株体内潜伏期更长,而F.prolifeatum致病性较弱,症状要轻微,这与孢子萌发测定结果一致。有关报道表明镰刀菌产生的镰刀菌酸毒素是一种非寄主专化性毒素[16],这种非寄主抗性在大多数情况下没有病原专一性,并且可以长期保持,这与甘蔗采用针刺法接种100 %感病结果相符,同时也解释了在甘蔗属难以寻找抗原(免疫)的疑问。本次评价筛选出来的抗病品种Q 202、ROC 1、YC 58-14、YT 94-128和YT 96-86具有株型紧凑、叶面积小、易脱叶和晚熟的特性,感病品种GT37和GT21具有早熟、叶面积大、散生和难脱叶的特征,这说明甘蔗抗梢腐病性可能与其株型、纤维素及糖分有一定相关性,可进一步从这方面开展抗病性生理生化机制研究。
4 结 论
本研究结果表明,我国甘蔗梢腐病两种主要病原菌中,F.verticillioides分生孢子萌发力和致病性要强于F.prolifeatum,通过对其分生孢子萌发的最适环境条件的研究,可利于在生产过程中通过控制环境条件来降低该病的发生。同时,筛选出来的感病品种(系)GT 37、GT 21和抗病品种Q 202、YT 94-128等均可作为甘蔗梢腐病抗性评价的典型种质材料。
[1]王泽平,段维兴,李毅杰,等. 甘蔗梢腐病田间抗性评价体系的建立[J]. 华南农业大学学报,2016,37(3): 67- 72.
[2]Khani K T,Ailzadeh A,Nejad R F,et al. Pathogenicity ofFusariumproliferatum,a new causal agent of pokkah boeng in sugarcane[J]. Proceedings of the international society sugracane technology,2013(23):1-5.
[3]Siti N,Nnr A,Azmi A R,et al. Distribution,morphological characterization and pathogenicity ofFusariumsacchariassociated with pokkah boeng disease of sugarcane in Peninsular Malaysia[J]. Pertanika Journal of Tropical Agriculture Science,2008,31(2):279-286.
[4]Govender P,Mcfarlane S A,Rutherford R S.Fusariumspecies causing pokkah boeng and their effect onEldanasaccharinaWalker (Lepidoptera:Pyralidae)[J]. Proceedings of the South African Sugarcane Technology Association,2010(83):267-270.
[5]Mohammadi A,Nejad R F,Mofrad,N N.Fusariumverticillioidesfrom sugarcane,vegetative compatibility groups and pathogenicity[J]. Plant Protection Science,2012,48(3):80-84.
[6]Lin Z Y,Xu S Q,Que Y X,et al. Species-specific detection and identification offusariumspecies complex,the causal agent of sugarcane pokkah boeng in China[J]. PLoS one,2014,9(8):e104195.
[7]陈 雨,张文芝,周明国. 氰烯菌酯对禾谷镰孢菌分生孢子萌发及菌丝生长的影响[J]. 农药学学报,2007,9(3):235-239.
[8]张彩玲,陆宗芳,王永全. 环境因素对尖孢镰刀菌分生孢子萌发的影响[J]. 甘肃农业科技,2008(2):5-8.
[9]黎 倩,黄忠乾,李 伟,等. 两株野生侧耳属菌株鉴定及生物学特性研究[J]. 西南农业学报,2016,29(5):1209-1213.
[10]Wang Z P,Sun H J,Guo Q,et al. Artificial inoculation method of pokkah boeng disease of sugarcane and screening of resistant germplasm resources in subtropical China[J]. Sugar Tech,2016:doi:10.1007/s12355-016-0465-7.
[11]王泽平,陈 奕,孙海军,等. 广西甘蔗主栽品种梢腐病田间抗性初步评价[J]. 热带作物学报,2016,37(5):952- 957.
[12]Alberts J F,van Zyl W H,Gelderblom W C A. Biologically based methods for control of fumonisin-producing fusarium species and reduction of the fumonisins[J]. Frontiers in Microbiology,2016(7):548.
[13]董昌金,赵 斌. 影响丛枝菌根真菌孢子萌发的几种因素研究[J]. 植物营养与肥料学报,2003,9(4):489- 494.
[14]Fuller K K,Ringelberg C S,Loros J J,et al. The fungal pathogen aspergillus fumigatus regulates growth,metabolism,and stress resistance in response to light[J]. mBio,2013,4(2):1-13.
[15]Allen P J. Metabolic Aspects of Spore Germination in Fungi[J]. Phytopathology,1965,3(3):313-342.
[16]Zakaria L,Hsuan H M,Salleh B. Mating populations of fusarium section liseola from rice,sugarcane and maize[J]. Tropical Life Sciences Research,2011,22(2):93-101.
(责任编辑 汪羽宁)
ConidialGerminationofTwoPrincipalPathogenofPokkahBoengDiseaseinChina,andResistanceEvaluationofSugarcaneVarieties
WANG Ze-ping, LIU Lu, GAO Yi-jing, LUO Ting, DUAN Wei-xing, ZHANG Bao-qing, YANG Cui-fang, ZHOU Shan, ZHANG Ge-min*
(Sugarcane Research Institute, Guangxi Academy of Agricultural Sciences/ Sugarcane Research Center, Chinese Academy of Agricultural Science/ Key Laboratory of Sugarcane Biotechnology and Genetic Improvement (Guangxi), Ministry of Agriculture, Guangxi Nanning 530007, China)
This study aims to provide reference for comprehensive prevention and control of pokkah boeng disease based on the conidial sporulation ofF.verticillioidesandF.proliferatumwhich are the most important two pathogens in China and evaluation the resistance of 18 sugarcane germplasm materials. Tested the conidial sporulation of two pathogens in different concentration of spores, temperature, light, pH, glucose concentration, and relative humidity, and further to evaluate the resistance on pokkah boeng disease of 18 representative sugarcane germplasm resources. The conidial yield ofF.verticillioidesin spores concentration was 4×106, temperature 20 ℃, the concentration of glucose 0.02 %, dark, pH 6.5, and relative humidity 80.00 % was the highest respectively, and which ofF.proliferatumin spores concentration 8×106, temperature 35 ℃, glucose 0.05 %, ultraviolet light, pH 6.5, and relative humidity 80.00 % was the highest respectively. 16 of tested sugarcane varieties (or clones) belonged to resistant materials, only 2, i.e., GT 37 and GT 21 showed obvious symptoms.F.verticillioideshad more conidial sporulation and higher pathogenic thanF.proliferatum. The sugarcane varieties (clones) GT 37, GT 21, susceptible to pokkah boeng disease, and Q 202, ROC 1, YT 94-128, resistant to pokkah boeng disease, can be used as the control germplasm materials for resistance screening.
Sugarcane; Pokkah boeng disease; Pathogen;Conidialgermination; Resistance evaluation
1001-4829(2017)3-0595-07
10.16213/j.cnki.scjas.2017.3.020
S566.1
A
2016-11-19
广西自然科学基金项目(2016GXNSFBA380046);广西重点研发计划项目(桂科AB16380126;桂科AB16380157);广西农业科学院基本科研业务专项项目(2015YT04)
王泽平(1983-),男,广西资源人,博士研究生,助理研究员,主要从事甘蔗与梢腐病病原菌分子互作研究工作,E-mail:yaheng830619@163.com,*为通讯作者,E-mail:745784546@qq.com。
