野生柑橘炭疽病鉴定
2017-10-20尹良芬都胜芳蔡明历罗朝喜
尹良芬,都胜芳,蔡明历,罗朝喜
(1.华中农业大学植物科技学院,湖北 武汉 430070;2. 华中农业大学作物学实验教学中心, 湖北 武汉 430070;3. 园艺植物生物学教育部重点实验室,湖北 武汉 430070)
野生柑橘炭疽病鉴定
尹良芬1,2,都胜芳1,3,蔡明历1,2,罗朝喜1,3
(1.华中农业大学植物科技学院,湖北 武汉 430070;2. 华中农业大学作物学实验教学中心, 湖北 武汉 430070;3. 园艺植物生物学教育部重点实验室,湖北 武汉 430070)
本研究对华中农业大学野生柑橘上的病害进行鉴定。运用形态学及ITS序列分析方法对病样进行系统鉴定。结果表明,从发病的野生柑橘枝稍病样上共分离到24个单孢菌株,这些菌株根据形态学及ITS序列分析方法分为3种真菌:①菌落粉红色,长势非常缓慢,孢子镰刀形,ITS序列分析鉴定为砖红镰孢菌Fusariumlateritium;②菌落灰黑色,气生菌丝多,孢子砖格状,ITS序列分析为链格孢菌Alternariaalternata;③菌落灰白色,气生菌丝较少,常产生橙色胶滴和黑色小粒点,分子孢子短杆状,ITS序列分析为胶孢炭疽菌Colletotrichumgloeosporioides。利用健康柑橘枝条对此3种真菌进行回接实验时,接种胶孢炭疽菌的枝条出现了跟采样枝条相同的症状,而且从发病的枝条上又分离到同样的炭疽菌;而接种链格孢及砖红镰孢的枝条不发病。该病害鉴定为胶孢炭疽菌C.gloeosporioides感染引起的炭疽病。
野生柑橘病害;炭疽病;胶孢炭疽菌(Colletotrichumgloeosporioides)
柑橘是世界第一大果树品种,在全球百果中的种植面积和产量均居首位[1]。中国是柑橘生产大国,目前柑橘种植面积、产量均位居世界第一,是我国南方农业经济的一大支柱产业。柑橘炭疽病是世界性分布的病害,在各柑橘产区都有分布。炭疽病主要为害新梢、叶片、花器、幼果、果梗、枝条及引起储藏期蒂腐烂果[2],条件适宜时,可造成田间90 %以上的损失甚至绝收[3]。前人研究结果表明,柑橘炭疽病病原菌为刺盘孢属(炭疽菌属)(Colletotrichum)的3个种,即胶孢刺盘孢(C.gloeosporioides),尖孢刺盘孢 (C.acutatum)和平头炭疽菌(C.truncatum)[2-7]。其中,胶孢刺盘孢(C.gloeosporioides)是我国的优势种群,全国大部分柑橘产区都有分布[2,6-7],尖孢刺盘孢 (C.acutatum)仅在云南、广东的少部分地区有分布,而平头炭疽菌(C.truncatum)目前只在云南的瑞丽有发现[2]。2014年12月在华中农业大学柑橘资源圃上的野生柑橘枝梢上发生一种危害较为严重的病害,需要对其进行鉴定,确定其病原物,为制定高效、安全的防治措施提供依据。通过对该病的症状进行观察、描述,对其病原物进行分离、培养,然后利用形态学及ITS序列分析方法进行鉴定。

图1 枝梢病样Fig.1 Diseased shoot sample
1 材料与方法
1.1 样本采集及症状观察
病害样本于2014年12月采集自华中农业大学校园柑橘园。枝条病样表现为除下部尚有部分保持绿色外,其余部分呈褐色干枯状(图1)。
1.2 菌株分离纯化
切取枝条病样病健交界处组织,自来水冲洗后,用75 %消毒酒精浸泡1 min,重复1次;再用5 %次氯酸钠消毒液浸泡1 min,重复1次; 之后用灭菌水冲洗3次。处理后的病样组织于超净工作台吹干水分后,置于加有青霉素和链霉素的PDA平板(Φ = 90 mm)上,26 ℃培养箱中黑暗培养。
菌株单孢分离则按照Luo等介绍的方法[8]。简而言之:把PDA表面产生的孢子涂抹在新的PDA培养基表面,然后在改造过的COIC XSZ-4G显微镜下利用玻璃针挑取单个孢子放置到新的PDA表面,之后置于培养箱中26 ℃黑暗培养。单个孢子萌发后形成的菌丝移植到PDA斜面培养4到5 d后于4 ℃冰箱中保存备用。
按照上述方法本研究从枝条病样上共分离到24个单孢菌株,编号分别为枝1-1,枝1-2,枝2-1,枝2-2等等。
1.3 菌株的活化
将保存的菌株从冰箱中取出转接于PDA平板上,26 ℃黑暗培养4 d后用接种针挑取边缘的新鲜菌丝转接到新鲜的PDA平板上进行实验。
1.4 菌落形态观察
用打孔器(Φ = 6 mm)从新鲜的菌落边缘打取菌丝块转接于PDA平板的中央,然后放置于培养箱中26 ℃黑暗培养。每个菌株移植3皿,重复1次。之后每天观察并对菌落的直径进行十字交叉测量直到菌丝长满为止。菌落生长速率为每个菌株所移植的2次重复(每次3皿)的平均生长速率,用mm/d表示。
1.5 致病性测定
致病性测定:待接种用的柑橘健康枝条用自来水冲洗后,75 %酒精表面消毒3次,用无菌水冲洗3遍后置于超净工作台中吹干水分。本研究采用2种方法进行接种。①用分生孢子液进行接种:用灭菌毛笔及灭菌水刮洗培养4 d的菌落表面,之后用2层纱布进行过滤,将配制的孢子液(106个/mL)接种到表面划伤过的柑橘枝条上。对照实验则划伤后接种灭菌水。②用菌丝块进行接种:用灭菌打孔器(Φ = 6 mm)从培养4 d的菌落(PDA平板)边缘打取新鲜菌丝块置于表面划伤过的柑橘枝条上(菌丝面朝下)。对照实验则接种没有菌丝的PDA琼脂块(枝条同样进行表面划伤)。接种后的枝条置于塑料盒中,盒子的底部放入润湿的吸水纸以保证近100 %的培养湿度,并盖上保鲜膜。之后把盒子置于26 ℃的人工气候箱中,12 h光照/12 h黑暗交替培养。培养2 d后去掉保鲜膜,改为2层纱布覆盖。
1.6 分生孢子形态学观测
直接挑取PDA表面或者接种病斑表面的分生孢子制作玻片,在光学显微镜(Motic BA200,麦克奥迪公司,武汉)下观察孢子形态及大小。
1.7 基因组DNA的提取
在PDA培养基表面铺1片玻璃纸,接种菌株后置于26 ℃培养箱中黑暗培养数天后收集菌丝。基因组DNA的提取采用植物基因组DNA提取试剂盒进行。具体步骤参见试剂盒使用说明书(Easypure Plant Genomic DNA Extraction Kit ; TransGen Biotech, Beijing, China),最后将提取的基因组DNA溶于100 μl ddH2O中,-20 ℃保存备用。
1.8 代表性菌株ITS序列分析
为了分析菌株间ITS序列的差异,以基因组DNA为模板,使用引物ITS1/ITS4进行PCR扩增反应,特异性扩增出各个菌株的ITS1-5.8S-ITS2区域。实验反应体系为50 μl,成分如下:1× PCR Buffer,200 mM dNTP,Primer ITS1 (0.16 μM),Primer ITS4 (0.16 μM),TaqDNA polymerase (1 U),Genomic DNA (20ng),ddH2O。
之后把上述混合物放入PCR仪中进行扩增反应。
扩增条件:94 ℃ 3 min;30循环,每个循环:94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min;72 ℃ 延伸10 min,之后4 ℃保存。
反应结束后,PCR产物用1 %的琼脂糖胶(AGAROSE G-10, GENE COMPANY, Hong Kong)在0.5倍的TBE缓冲液中电泳1 h(100 v)。经EB染色后,在凝胶成像系统中(Alpha Innotech, Santa Clara, CA,USA)检测目标条带。PCR扩增的ITS片段直接送华大基因进行测序(BGI; 深圳,中国) 。
2 结果与分析
2.1 菌落形态、生长速率及分生孢子等形态学观察
枝梢病样分离菌株根据其菌落及分生孢子形态特征分为3种真菌: ①菌落淡粉红色,气生菌丝白色浓密,生长缓慢 (7.4 mm/d),常产生粉红色色素;分生孢子镰刀形。代表性菌株为枝1-2 (图2A)。② 菌落灰褐色,气生菌丝浓密,生长较快(10.1 mm/d);分生孢子砖格状。代表性菌株为枝2-2 (图2B)。③菌落灰白色,常产生橙色露珠状液滴使之呈红色,气生菌丝灰白色,稀疏,生长最快 (13.5 mm/d);分生孢子短杆状。代表性菌株为枝11-2 (图2C)。
2.2 病原菌的分子生物学鉴定
枝梢病样上分离到的真菌,每种挑取2~4个单孢菌株,提取其DNA进行ITS序列分析。 BLAST比对的结果表明,枝1-2等菌株的ITS序列跟来自云南的砖红镰刀菌(Fusariumlateritium)(登记号FJ459977)完全一致;枝2-2等菌株则跟链格孢菌(Alternariaalternata)ITS序列(登记号KM268870,KR864893,KR094462等)100 %一致;枝11-2及枝15-2等菌株ITS序列跟炭疽菌(Colletotrichumgloeosporioides) (登记号LC052319,KF177688,GU066652等)完全相同。这些分子鉴定结果与观察到的生物学特性相吻合。
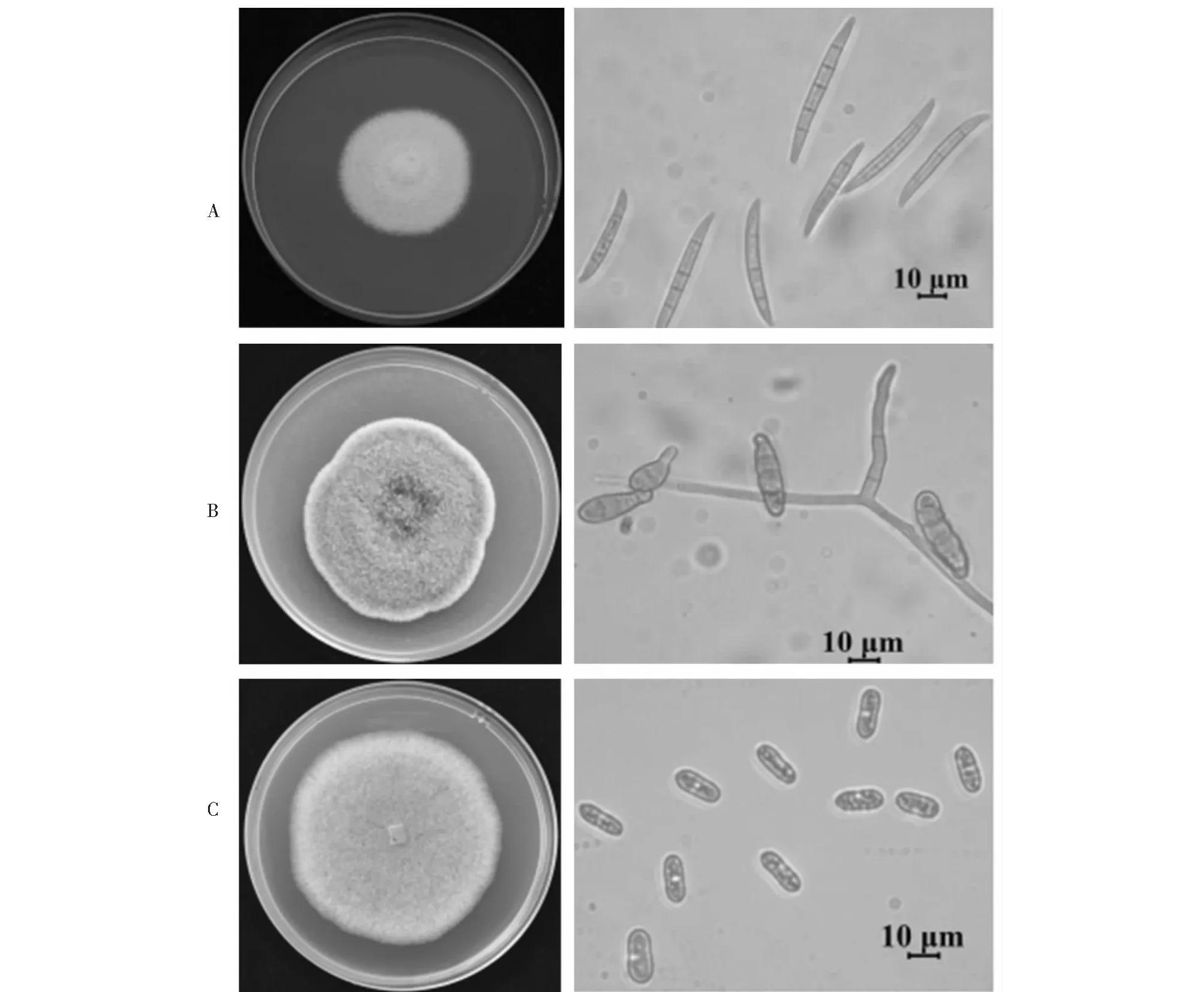
A.枝1-2;B.枝2-2;C.枝11-2A.stem 1-2; B.stem 2-2; C.stem 11-2图2 枝梢病样分离菌株的菌落及分生孢子形态 Fig.2 Colony and conidia morphology of isolates from shoot samples

A.枝11-2;B.枝1-2;C.枝2-2;CK:无菌水A.stem 11-2; B.stem 1-2; C.stem 2-2; CK, sterile water图3 枝梢病样分离菌分生孢子液接种实验Fig.3 Pathogenicity test using conidia suspension

A.枝11-2;B.枝1-2;C.枝2-2;CK:PDAA.stem 11-2; B.stem 1-2; C.stem 2-2; CK, PDA plug图4 枝梢病样分离菌菌丝块接种实验Fig.4 Pathogenicity test using mycelial plugs
2.3 致病性测定
从枝梢病样上共分离到3种真菌,利用分离菌株分生孢子液进行致病性接种,结果表明,接种炭疽菌枝11-2的枝条出现田间病样类似的症状(图3A),并且从发病的接种枝条上又分离到同样的炭疽菌。而接种砖红镰刀菌(枝1-2)(图3B)及链格孢菌(枝2-2)(图3C)则不发病。利用这些菌株的菌丝块进行接种也得到同样的结果(图4A,B,C)。这些结果表明,本研究所采集的柑橘病样为胶孢炭疽菌C.gloeosporioides感染引起的柑橘炭疽病。
3 讨 论
本研究从采集到的柑橘枝梢病样上共分离到3种真菌,分别为:砖红镰刀菌(F.lateritium), 链格孢菌(A.alternata)及炭疽菌(C.gloeosporioides)。镰刀菌Fusarium是一类世界性分布的病原真菌,属于半知菌类, 能侵染多种植物的根、茎、叶及果实而引发腐烂病。而链格孢菌Alternaria是一种常见的半知菌类真菌,包括500多个种,大多数种类兼性寄生于植物上,引起包括黑斑病在内的多种植物病害[9]。张国珍,尹良芬曾报道链格孢菌Alternariapanax引起人参黑斑病[10]。本研究致病性回接实验发现野生柑橘枝条病样上出现的干枯症状及黑色斑点并非镰刀菌及链格孢菌引起的枝干腐烂及黑斑病。
炭疽菌属Colletotrichum真菌也属于半知菌类,常常寄生或者腐生,是一类重要的植物病原真菌,引发多种植物炭疽病。本研究经过致病性回接实验证明,华中农业大学校园野生柑橘枝梢病害是胶孢刺盘孢感染(C.gloeosporioides)引起的炭疽病,而分离到的另外两种真菌链格孢菌及镰刀菌只是柑橘感染炭疽病后腐生上去的杂菌。
柑橘炭疽病是柑橘生产上最为常见的病害,它具有危害时间长和危害范围广的特点,国内大部分柑橘产区都有发生。炭疽菌属(Colletotrichum)的3个种,即胶孢刺盘孢(C.gloeosporioides),尖孢刺盘孢 (C.acutatum)和平头炭疽菌(C.truncatum)都能侵染柑橘导致发病[3-8]。其中,胶孢刺盘孢(C.gloeosporioides)是我国的优势种群,全国大部分柑橘产区均有分布[3,7-8],尖孢刺盘孢 (C.acutatum)仅在云南、广东的少部分地区有分布,而平头炭疽菌(C.truncatum)目前只在云南的瑞丽有发现[3]。本研究所鉴定的炭疽菌属于我国的优势种群胶孢刺盘孢(C.gloeosporioides)。
本研究所报道的柑橘炭疽病在症状上与前人的研究存在差异,如陈国庆等人报道的柑橘枝梢炭疽病症状为枝梢枯死呈深褐色或黑色,潮湿时表面产生橘红色粘质物[2],而本研究的枝枯表现为灰白色干枯,带有黑色斑点,样本保湿培养3 d后表面也不产生橘红色粘质物。造成这种症状不一致的原因大概有如下几种:第一,品种不一样。前人研究针对栽培柑橘,大多是在柑橘挂果季节炭疽病大爆发时采的病样,其症状主要表现在果实、叶片或者嫩梢上,而本研究的对象是野生柑橘,没有挂果,而且叶片上也不表现症状。2007-2009年,云南马关塘坊镇的柑橘发生大面积落叶落果及引起储藏期果实腐烂,张玉洁等人经过鉴定发现该病是由胶孢刺盘孢(C.gloeosporioides)引起的柑橘炭疽病[7]。其次,研究的季节不一样。其他报道的研究对象是春夏季节感病不久的病样,此时病害还比较单一,因其它杂菌造成的复合侵染还比较少;而本研究的对象是冬天的枝梢,由于炭疽病感染造成树势减弱,其它杂菌如链格孢、镰刀菌等滋生造成复杂的复合侵染症状。第三,胶孢刺盘孢(C.gloeosporioides)是我国的优势种群,全国大部分的柑橘产区都有分布。但此种群其实并非一个单一种群,刘开启等人的研究表明胶孢刺盘孢具有复合种(Complex species)和种群集合(Species group)的特点,其种内遗传分化多样[11];陈希芹等人的研究也发现,胶孢炭疽菌在形态特征、致病性、分子遗传水平、营养体亲和群等方面都存在较大的变异[12];而最新的研究表明,我国的胶孢炭疽菌其实是由C.gloeosporioides及C.fructicola组成的复合种群[13]。随着分类方法的进步,也许还能细分为更多的种群。胶孢炭疽菌的复合种群在不同地区,不同寄主上其种群结构是有差异的,因而侵染后所造成的症状也不一致。
4 结 论
本研究针对华中农业大学校园资源品的野生柑橘病害进行鉴定,结果为胶孢炭疽病感染引起的柑橘炭疽病。该研究结果对保护我国野生柑橘资源具有重要意义。同时,该研究对柑橘炭疽病菌种类有了进一步的认识,使防治对象明确化从而能够积极有效地开展防治工作。
[1]何 劲,祁春节. 中外柑橘产业发展模式比较与借鉴[J]. 浙江柑橘, 2009,26(4): 2-9.
[2]陈国庆. 中国炭疽病病原种类及种群遗传多样性研究[D]. 杭州:浙江大学农业与生物技术学院,2010.
[3]段志坤. 柑橘炭疽病及其防治对策[J]. 果农之友,2009(6):29-30.
[4]孙 思,王 军,王胜坤,等. 柑橘炭疽病病原菌分子鉴定的研究进展[J]. 仲恺农业工程学报,2012, 25(1):62-66.
[5]杨友联,刘永翔,刘作易. 炭疽菌属真菌分类学研究进展[J]. 贵州农业科学,2011,39(1): 152-157.
[6]王 震,杨 媚,杨迎青,等. 广东省柑橘炭疽病病原菌的形态与分子鉴定[J].菌物学报,2010,29(4):488-493.
[7]张玉洁,张志信,李红超. 柑橘炭疽病的病原鉴定和综合防治措施[J]. 北方园艺,2011(2):156-159.
[8]Luo C X, Hanamura H, Sezaki H, et al. Relationship between avirulence genes of the same family in rice blast fungus Magnaporthe grisea[J]. Journal of General Plant Pathology, 2002, 68: 300-306.
[9]王洪凯,张天宇,张 猛. 链格孢属真菌分类研究进展[J]. 山东农业大学学报,2001, 32(3):406-410.
[10]张国珍,尹良芬. 人参黑斑病产孢条件的试验研究[J]. 山东农业大学学报,1999, 30:105-108.
[11]刘开启,郭 泺. 果树胶孢炭疽菌的RAPD分析[J]. 仲恺农业技术学院学报,2002,15(4):1-7.
[12]陈希芹. 胶孢炭疽菌的遗传多样性[D]. 成都:四川农业大学,2004.
[13]Huang F, Chen G Q, Hou X, et al. Colletotrichum species associated with cultivated citrus in China[J]. Fungal Diversity, 2013, 61(1): 61-74.
(责任编辑 李 洁)
IdentificationofAnthracnoseonWildCitrus
YIN Liang-fen1,2, DU Sheng-fang1,3, CAI Ming-li1,2, LUO Chao-xi1,3
(1.College of Plant Science and Technology,Huazhong Agricultural University, Hubei Wuhan 430070, China; 2.Experimental and Teaching Center of Crop Science,Hubei Wuhan 430070, China;3. Key Laboratory of Horticultural Plant Biology, Ministry of Education, Hubei Wuhan 430070,China)
This study was carried out to identify the disease on wild citrus in the campus of Huazhong Agricultural University. The samples were collected and pathogens were identified based on the morphology and ITS sequence analysis. In total, 24 single spore isolates were obtained from the diseased shoot samples, and they showed three kinds of morphology and identified as different fungi by ITS analysis. (i)The colony appeared pink and grew slowly, produced falculate conidia, ITS sequence analysis identified it asFusariumlateritium; (ii)The colony appeared grey to black with much aerial mycelia, produced muriform conidia, ITS sequence analysis confirmed it asAlternariaalternata; (iii)The colony appeared grey, less aerial mycelia, often produced orange sticky droplets and small black spots, ITS analysis revealed it asColletotrichumgloeosporioides. Pathogenicity was confirmed by inoculating these three kinds of fungi on healthy citrus stems, as a result, same symptoms as that of original diseased stem samples appeared by inoculatingC.gloeosporioidesbut notF.lateritiumandA.alternata, andC.gloeosporioideswas re-isolated from the inoculated shoot. Therefore, morphology and ITS sequence analysis indicated that the stem disease was citrus anthracnose caused byC.gloeosporioides.
Wild citrus disease;Citrus anthracnose;Colletotrichumgloeosporioides
1001-4829(2017)3-0590-05
10.16213/j.cnki.scjas.2017.3.019
S666
A
2016-04-30
华中农业大学教改项目(201602)
尹良芬(1974-),女,云南罗平人,博士,主要从事核果类果树褐腐病研究及作物病害鉴定工作,E-mail: yh@mail.hzau.edu.cn。
