生物防腐剂的保鲜机理及应用
2017-10-19,,,,,,,,3
, ,, ,,,,,3
(1.江苏省农业科学院农产品加工研究所,江苏南京 210014;2.南京师范大学金陵女子学院食品科学系,江苏南京 210097;3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏南京 210095)
生物防腐剂的保鲜机理及应用
王筱梦1,2,江芸2,孙芝兰1,*,刘芳1,王道营1,张新笑1,诸永志1,徐为民1,3
(1.江苏省农业科学院农产品加工研究所,江苏南京 210014;2.南京师范大学金陵女子学院食品科学系,江苏南京 210097;3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏南京 210095)
食品加工、贮运过程中由微生物引起的腐败变质一直是食品保鲜领域所面临的世界性难题。因化学防腐剂的使用所带来的安全隐患越来越不容忽视,安全、高效的生物防腐剂的开发逐渐成为食品保鲜领域的重点。但生物防腐剂作用靶点相对单一、成本较高一直制约其发展。如何合理组合不同的生物防腐剂,在降低单因素强度的基础上实现多靶点协同攻击腐败菌越来越受重视。本文系统梳理以细胞壁、细胞膜、胞内遗传物质及以革兰氏阴性菌细胞外膜层为损伤目标的生物防腐剂,归纳它们的作用方式和在食品保鲜中的应用效果,并对未来的研究重点进行展望,以期能为生物防腐保鲜剂的精准复配提供理论依据。
生物防腐剂,保鲜机理,保鲜应用
食品加工、贮运过程中极易受到微生物污染而腐败变质,不仅造成资源浪费,而且严重危害消费者的身体健康。如何有效控制微生物腐败是肉品工业需面对的世界性难题。
目前国内外实践中最常用的杀菌方式是高温高压方法[1],杀菌效果稳定,但由于热变性剧烈,导致肉制品肌纤维的断裂而丧失弹性、保水性,破坏乳制品营养成分等。近年来,国内外学者在食品保藏方面做了大量的工作。一方面,发现物理、化学、生物方法如高压脉冲电场、化学防腐剂、细菌素和植物提取物等杀菌或抑菌方法[2],但不同的手段可能仅对某些特定的菌种有效,即使特定的菌种,因某一个单一因素通常只针对一个特定的靶点,强度也势必会增加,因此存在强度与品质、成本的矛盾[3]。另一方面,目前的杀菌手段多数以损伤细胞膜为主,其次细胞壁和胞内物质,细胞壁为多孔的网格结构,小分子物质可以自由出入,较少影响杀菌效果,因而多数杀菌手段对革兰氏阳性菌(G+)有效。而革兰氏阴性菌(G-)细胞壁外包裹着一层厚厚的外膜层,成分主要为脂多糖,从而形成天然屏障,多数杀菌手段无法通过外膜层屏障,因而很难起到杀菌作用[4]。这也是多数杀菌剂对G-作用效果不显著的主要原因,但是食品中主要的腐败菌肠杆菌或假单胞菌都是G-[5],这成为目前防腐剂开发领域普遍遇到的难题。再者,食品中微生物菌相复杂,即使同一厂家不同的生产批次,也会导致微生物菌相差异[6],目前生产厂家多凭经验随机组合各种手段,需多次尝试防腐效果,耗时耗力,也浪费大量的资源。本文希望通过梳理不同生物防腐剂的杀菌机理,为科学合理地由外至内,多靶点精准调控微生物的损伤奠定理论基础。

图1 革兰氏阴性菌与阳性菌细胞壁结构肽聚糖水解酶水解位点[10]Fig.1 Cell wall structure peptidoglycan hydrolase targets of gram negative bacteria and positive bacterial[10]注:1:酰胺酶(N-乙酰胞壁酰基-L-丙氨酸酰胺酶)作用位点;2、3、4:肽链内切酶作用位点;5、6:糖苷酶(5:N-乙酰胞壁酸酶;6:N-乙酰葡萄糖胺酶)作用位点。
1 以细胞壁为损伤目标的生物防腐剂
细胞壁(cell wall)位于细胞的最外层,在维持细胞固有形态、防止细胞在低渗溶液中胀裂、维持细胞完整性等方面起着重要的作用,为微生物抵抗外界环境的第一道屏障[7]。肽聚糖为细菌细胞壁的主要成分,如图1a,在G+中,其占细胞壁干重的50%~80%。肽聚糖是由N-乙酰胞壁酸(MurNAc)和N-乙酰葡糖胺(GlcNAc)交替连接的双糖单位、肽尾和肽桥组成的多层网状结构[8]。肽聚糖水解酶因为能拆散肽聚糖层,造成细胞壁的瓦解成为攻击细胞壁进而杀死微生物的有力武器,在食品防腐保鲜中具有潜在的应用价值[9]。肽聚糖水解酶依据其作用底物的特异性分为四大类型:N-乙酰葡萄糖胺酶、N-乙酰胞壁酸酶、N-乙酰胞壁酸-L-丙氨酸酰胺酶以及内肽酶(图1b)。N-乙酰葡萄糖胺酶和N-乙酰胞壁酸酶统称为糖苷酶,可特异性催化水解双糖单位的β-1,4糖苷键;而N-乙酰胞壁酸-L-丙氨酸酰胺酶催化水解N-乙酰胞壁质酸和肽尾第一个氨基酸之间的酰胺键;内肽酶催化水解肽尾两个氨基酸之间的肽键或者肽桥之间的肽键[10]。肽聚糖水解酶来源广泛,目前研究较深入的为溶菌酶、来源于噬菌体的裂解酶及存在于微生物细胞壁中,在细胞分裂生长过程中水解肽聚糖的酶类等。
1.1溶菌酶
溶菌酶为研究最多并被批准应用于食品防腐的一类肽聚糖水解酶[11]。该酶将细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂,细菌裂解。溶菌酶在室温下可长期保存,在酸性环境中,耐热性好,化学性质稳定,而在碱性环境中该酶的热稳定性较差。溶菌酶可以分为动物源、植物源和微生物源溶菌酶,其来源不同,作用机制也有所不同。动物源溶菌酶包括鸡蛋清溶菌酶及人和哺乳动物溶菌酶。鸡蛋清中溶菌酶含量最高,目前研究和应用也最多。该酶由129个氨基酸组成,相对分子量在14000~18000 Da。其等电点可达10.7,存在4个二硫键,主要为糖苷酶。植物源溶菌酶分子量较大,其溶菌活性小于鸡蛋清溶菌酶,但其对胶体状甲壳质的分解活性远大于蛋清溶菌酶。微生物源溶菌酶除了水解糖苷键、酰胺键和肽键之外,还包括β-1,3、β-1,6-葡聚糖酶、甘露糖酶(主要用于分解酵母细胞的细胞壁)、壳聚糖酶(分解霉菌的细胞壁)。溶菌酶作为一种天然的安全性能很好的防腐剂,已广泛应用于食品防腐、医药制剂、日用化工等行业。Iaconelli等[12]将鸡蛋清溶菌酶应用于奶酪生产中防止由腐败菌造成的后期产气现象。Silvetti[13]将溶菌酶添加到生啤中以延长保质期。Enrique[14]等研究发现溶菌酶保鲜液对南美白对虾致病菌(如溶藻弧菌、溶血性弧菌以及霍乱弧菌)具有明显的抗菌作用,能够有效延长南美白对虾的货架期。G+中细胞壁组分90%为肽聚糖,因而溶菌酶对G+的细胞壁破坏性较强,该酶可水解G+中的枯草杆菌、葡萄球菌、乳酸菌等。G-中肽聚糖含量较少,仅内壁层为肽聚糖,因此溶菌酶对它的细胞壁的破坏力较弱,但部分溶菌酶仍对大肠杆菌、普通变球菌和副溶血性弧菌等G-有一定的溶解作用。除此之外溶菌酶还可与带负电荷的病毒蛋白直接结合,与DNA、RNA、脱辅基蛋白形成复盐,使病毒失活。
1.2噬菌体裂解酶
噬菌体裂解酶是由噬菌体自身基因编码的,在噬菌体释放过程中,水解其宿主菌细胞壁的一类肽聚糖水解酶。一般来说,G+噬菌体裂解酶的结构域相似,由N-端催化结域和C-端结合结构域组成,二者之间由小片段连接。序列分析表明,同一类裂解酶的催化域高度保守,而细胞结合域同源性较低。研究表明,无论在体外还是体内,单独的N-端催化结构域是没有裂解活性的,只有当N端与C端同时存在时才具有催化活性。根据催化结构域的作用位点,裂解酶分为糖苷酶、酰胺酶和内肽酶三类。噬菌体裂解酶一般具有单一的催化位点,但某些噬菌体裂解酶可同时拥有两个甚至三个不同的催化域,如葡萄球菌噬菌体φ11和无乳链球菌噬菌体B30的裂解酶等[15-16]。与G+噬菌体裂解酶不同,G-噬菌体(T4、T7和P22等)所编码的裂解酶通常为球形蛋白,仅有N-端结构域,但其亲和力仍保持较高水平,且具有更广的结合谱,如铜绿假单胞菌噬菌体裂解酶KZ144等。
噬菌体裂解酶作为新型抗菌剂具有其独特的优势。具有较高的特异性,仅攻击其宿主菌或近缘物种,因此该酶不影响寄生在人体中的正常菌群,也不影响其他细胞,不会对动物产生毒副作用;与宿主特异性底物结合,细菌几乎不会产生耐药性;其作为一种酶类制剂,不会对人体产生致病性。鉴于此,噬菌体裂解酶已经成为一种颇具潜力的杀菌剂。目前利用噬菌体裂解酶治疗病原菌感染,尤其抵御耐药性致病菌方面已取得重大进展,而在食品安全控制方面仍处于起步阶段。Zimmer[17]等发现产气荚膜杆菌噬菌体裂解酶Ply3626对多株测试的产气荚膜杆菌具有裂解活性,可作为新型食品防腐剂,用于食品的生物防治。葡萄球菌为引起奶牛乳房炎的致病菌,可引起产奶量下降,严重可使奶牛发病致死。Obeso[18]等构建了重组裂解酶LysH5,该酶在pH7.0,37 ℃条件下,能够快速杀死金黄葡萄球菌,因此可用于乳制品的生物防治。虽然噬菌体裂解酶作为新型抑菌剂有安全、无抗药性产生等优势。但是仍存在杀菌谱窄和杀菌活性低的问题,因此将裂解酶不同结构域组合重排,构建裂解活性提高、裂解谱拓宽的嵌合型杀菌剂,是生物防腐领域新的研究热点。
1.3其它肽聚糖水解酶
除上述两种主要的肽聚糖水解酶,某些微生物合成的细胞壁蛋白也具有肽聚糖水解活性,在细胞的生长、分裂、分离、分化、自溶和细胞壁的翻转等生理功能中发挥重要作用,S层蛋白即为其中之一。S层蛋白(Surface layer)是存在于细菌及古细菌细胞外由蛋白质或糖蛋白质亚单位组成的单分子层晶格状结构。2006年,Ahn[19]等对胞壁质水解酶调节系统cid/lrg调控机制进行研究时,偶然发现炭疽芽孢杆菌的S层蛋白Sap和EA1具有肽聚糖水解酶活性。Acosta[20]等研究发现,嗜酸乳杆菌的S层蛋白能损伤细胞壁,抑制大肠杆菌和芽孢杆菌的生长。作者所在研究室也发现卷曲乳杆菌K313的S层蛋白SlpB可水解腐生葡萄球菌的细胞壁,抑制其生长繁殖,将其应用于肉品保鲜中,可延长货架期,因而具有作为添加剂应用于食品保鲜的潜力。Acosta等通过测定嗜酸乳杆菌的S层蛋白SA的水解产物,发现氨基酸含量增加,推测SA可能为内肽酶。但是S层蛋白对肽聚糖的水解机制及在食品保鲜中的应用潜力还有待进一步研究。
2 以细胞膜为损伤目标的生物防腐剂
细胞膜可防止细胞外物质自由进入胞内,保证细胞内环境的相对稳定,使各种生化反应能够有序运行,为保护细胞的第二道屏障。细胞膜由磷脂双分子层和蛋白质及外表面的糖被(糖蛋白)组成。作为第二道保护屏障,一旦细胞膜受到损伤,胞内物质泄露,细胞无法维持正常的生理代谢,即造成死亡。生物杀菌剂多以损伤细胞膜为目标,其中最具代表性的为细菌素、聚赖氨酸和植物精油。
2.1细菌素
细菌素是细菌代谢过程中合成的具有抑菌性质的多肽类物质。它可以广泛地抑制G+,尤其是抑制单增李斯特菌等腐败菌和病原菌,并可在人体内进行生物降解和消化,对人体健康无害,因而可作为食品添加剂运用到食品保藏过程中。细菌素根据化学结构、稳定性和相对分子质量可以分成4大类[21],第一类细菌素(class I)称为羊毛硫细菌素,是一类小分子的修饰肽,含有羊毛硫氨酸,β-甲基羊毛硫氨酸等非编码氨基酸,可在细胞膜上形成孔道,从而导致细胞膜内外的离子失衡。第二类细菌素(class Ⅱ)是不经修饰的小分子的热稳定肽,相对分子质量小于10 kDa,其抗菌机理同样为使细胞膜形成孔洞,造成胞内物质泄露。第三类细菌素(class Ⅲ)是热不稳定的大分子蛋白,相对分子质量一般大于10 kDa,目前研究并不深入。第四类细菌素(class Ⅳ)能与其他大分子组成复合型的蛋白复合体,需与特定的碳水化合物或类脂结合才能发挥作用。其中第一、二类细菌素由于高活性和专一性已被开发作为食品防腐保鲜剂,应用最广的是第一类中的Nisin。
Nisin由乳酸链球菌产生的由34个氨基酸组成的抑菌肽,为I类细菌素。它是唯一一个被批准应用在食品和饮料中的细菌素。Nisin具有较强的热稳定性,对胰凝乳蛋白酶敏感,对胰蛋白酶和链霉蛋白酶不敏感。目前已报道的有六种类型,分别为Nisin A[22]、Nisin Z[23]、Nisin Q[24]、Nisin F、Nisin U和NisinU2[25]。Nisin的抑菌机理已研究的较为深入,首先Nisin通过疏水或静电作用与敏感菌株细胞壁中的阴离子组分(磷壁酸、酸性多糖或磷脂)结合穿过细胞壁,到达细胞膜。随后与细胞膜中的脂II结合。脂II为细胞壁合成过程中肽聚糖单体的运输载体,一旦Nisin与脂II结合,肽聚糖单体供应不足,导致细胞壁合成受阻,细胞死亡。除此之外2个或4个Nisin-脂质Ⅱ复合物可在靶细胞膜上形成稳定的孔洞(图2),导致膜通透性增加,膜电位消散,内容物泄露最终导致细胞死亡[26-28]。罗欣等[29]将Nisin应用到牛肉保鲜中,显著延长了保鲜期。江芸[30]等也将Nisin运用于鲜猪肉的保鲜,发现Nisin对肉中的G+有明显的抑菌作用。片球菌素是由片球菌分泌到胞外的一类热稳定小分子多肽,为Ⅱ类细菌素。片球菌素同样使敏感菌的细胞膜上形成孔洞,而导致胞内钾、无机磷酸盐等离子的流失,最终导致细胞质子驱动势(PMF)的丧失。PMF包括膜电位ΔΨ和氢浓度差ΔpH,与Nisin不同,片球菌素可导致ΔpH的完全丧失以及ΔΨ的部分丧失,而Nisin会导致ΔΨ和ΔpH的完全丧失[31]。片球菌素在肉制品中的应用较多,研究表明涂有片球菌素的火腿片,李斯特菌和沙门氏菌显著降低,货架期延长。Buyong等[32]将片球菌素应用于奶酪发酵中,其抑制李斯特菌的效果显著[33]。
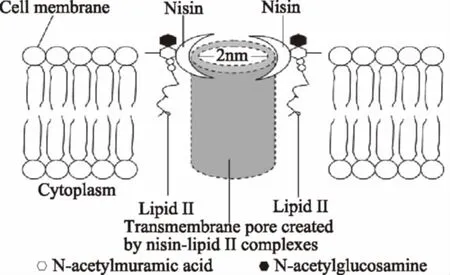
图2 nisin对细胞膜的作用图[26]Fig.2 The action of nisin on cell membrane
细菌素的作用机制主要为在细胞膜产生孔洞,造成胞内物质泄露,细胞死亡。Ⅰ类和Ⅱ类细菌素,分子量较小,易穿过肽聚糖层到达细胞膜,对G+有较好的杀菌效果,然而它们无法穿过G-的外膜层,因而对G-的抑菌效果较差。只有极少数细菌素如microcin E492[34],能识别G-外膜层的受体TonB,然后穿过外膜层进入内膜,因而能杀死G-。另外Ⅲ类细菌素分子量一般较大,不易穿过肽聚糖层,因而其抑菌谱较窄且抑菌效果较差。
2.2聚赖氨酸
ε-聚赖氨酸ε-Poly-L-Lysine(ε-PL)是由微生物分泌的一种由赖氨酸单体通过α-羧基和ε-氨基形成酰胺键连接而成的均聚氨基酸[35]。ε-PL对细菌、真菌及病原体均有抑制作用,具有抑菌谱广、活性高、稳定性强、安全性高等优点[36],可以作为一种天然、安全、高效的食品添加剂。ε-PL的抑菌活性与其聚合度密切相关,研究发现25~35个氨基酸残基的ε-PL具有更强的抗微生物活性,通常作为食品防腐剂[37]。SHIMA[38]等发现ε-PL通过静电作用吸附到细胞膜表面,使细胞膜物理裂解,内容物流出而菌体死亡。Yamanaka等[39]也发现经ε-PL处理过的细胞会渗漏出一种参与三羧酸循环的酶(NADH依赖的苹果酸脱氢酶MDH),并且随着细胞存活率的降低,MDH释放量增加,说明细胞膜受到损伤。另外,ε-PL可抑制微生物的呼吸作用,使ATP和NADH亏损,合成代谢受阻最终导致动态膜结构不能维持,细胞自溶[40]。冯建岭[41]研究了ε-PL对大肠杆菌的抑菌机理:ε-PL能改变大肠杆菌细胞外膜和细胞内膜的通透性,使细胞正常形态遭到破坏,膜内外离子失衡,细胞正常生理活动遭到干扰,最终细胞崩溃死亡,这也就支持了上述观点:ε-PL的抑菌方式是作用于细胞膜上的一种物理活动[42]。莫树平等[43]将ε-PL应用在广式腊肠的防腐中,菌落总数及挥发性盐基氮均显著降低。Hyldgaard[44]将ε-PL应用在新鲜的火鸡肉中,能显著抑制恶臭假单胞菌的繁殖。除了对细胞膜产生物理损伤之外,ε-PL也能通过静电作用吸附到G-的外膜层,释放脂多糖,改变外膜层的通透性,同时能干扰胞内蛋白和核酸类物质的合成,因而具有较广的抑菌谱,成为具有较大应用潜力的食品防腐剂。
2.3植物精油或提取物
植物精油或提取物是一类植物次生代谢物质,分子量较小[45]。国外对植物精油或提取物的抑菌机理研究较多,现已逐步深入到细胞、分子水平等研究层面。植物精油对革兰氏阴性和阳性菌均有抑制作用,抑菌谱较广[46],其对细胞膜的作用方式可造成细胞不可逆的损伤。有学者[47]认为植物精油抗菌成分为一些天然酚类和萜类物质,因此植物精油抗菌作用方式与其他酚类物质相似[48];酚类物质不仅作用于细胞膜从而改变细胞渗透性并释放出胞内物质如核糖、谷氨酸钠等,而且还能干扰膜的正常生理功能如电子转移、营养吸收、蛋白质及核酸合成和酶活性等;植物精油抗菌作用机理可能是这些作用中的一种或多种。植物精油和其组成部分有一个重要特征是它们的疏水性。所以有学者[49]认为精油的疏水性结构能够分离细胞膜与线粒体上的脂类,使细胞通透性增加。导致一些离子物质和细胞内容物的渗漏[50-52]。尽管细菌细胞某种程度的泄漏不会使细胞活力丧失,但是内容物的大量损失和离子等物质的渗漏会导致细胞的死亡。研究表明香芹酚作用于蜡状芽孢杆菌的细胞膜上,溶解在磷脂双分子层之中,在脂肪酸链中排成一列[53],这种扭曲的物理结构会导致细胞膜的膨胀和不稳定,增加膜的流动性,反过来会影响膜的渗透性。K Pandima Devi[54]等研究发现丁香酚与伤寒沙门氏菌细胞膜相互作用,破坏细胞膜,从而起到抑菌活性。也有研究表明[55]丁香酚的疏水性使它能够穿透革兰阴性菌膜的脂多糖并改变细胞结构,随后导致细胞内成分泄漏使其死亡。
目前已有学者将植物精油应用在新鲜肉类的保鲜中。Khanjari等[56]将牛至精油添加羧甲基壳聚糖中,结合真空包装可将新鲜鸡肉的货架期延长到14 d。张慧芸[57]等制备了丁香精油-壳聚糖复合可食包装膜用于生肉糜中抑菌保鲜,发现在4 ℃冷藏的条件下生肉糜的货架期可达10~12d,保鲜效果良好。植物精油或提取物来源丰富,已作为天然防腐保鲜剂投放市场,但仍存在以下问题应深入研究:植物精油是一类天然混合物,其成分众多、结构复杂,有效成分分离困难。因此不清楚具体是哪种或哪几种成分发挥作用,影响其作用效果。部分植物精油具有刺激性气味,限制了其在食品保鲜中的应用。
3 以胞内酶或遗传物质(DNA)为损伤目标的生物防腐剂
除了损伤细胞壁和细胞膜,某些小分子也可通过自由扩散或细胞膜上的转运蛋白进入胞内,干扰胞内核酸物质和蛋白质代谢杀死靶细胞。如来源于大肠杆菌的细菌素Mccb17,可通过孔蛋白OmpF和内膜转运蛋白Sbma相继穿过外膜和内膜到达胞内。随后Mccb17通过抑制DNA促旋酶活性从而干扰DNA的复制[58]。细菌素MccJ25可识别外膜层的铁载体受体FhuA,随后经TonB-SbmA转运系统进入胞内。进入细胞后 MccJ25通过抑制mRNA转录而抑制菌体生长[59]。细菌素MccC7-C51可通过位于内膜层的YejABEF转运入胞内,随后经胞质氨肽酶催化生成天冬氨酰-腺苷酸,其可抑制天冬氨酰-tRNA合成酶活性,从而阻断mRNA的合成[60]。
诺卡噻唑菌素、硫链丝菌肽和其他的一些抑菌肽也可结合敏感菌株的核糖体rRNA,抑制蛋白质的合成[61]。某些植物精油或提取物除了能损伤细胞壁(膜),也能进入胞内,干扰遗传物质的合成,进而杀死细菌。Chung[62]等认为蒿属植物Vulgarone B精油的抗菌机制与 DNA 裂解有关。因为经vulgarone B处理的质粒pBR322和λDNA,超螺旋结构解体,产生大量线性DNA片段,表明Vulgarone B精油能损坏细菌DNA。壳聚糖是甲壳素脱乙酰化的衍生物,为天然生物抗菌物质,研究发现低聚壳聚糖同样可穿透微生物细胞,抑制mRNA转录,从而杀死靶细胞[63]。
4 以G-外膜层为损伤目标的生物防腐剂
G-细胞壁外包裹着一层厚厚的外膜层,由脂多糖、脂蛋白和脂质双层组成。多数抗菌剂在外膜层上无特定的受体,因而很难起到杀菌作用。因此越来越多的学者开始将目光投向能损伤外膜层的生物防腐剂上。壳聚糖和植物精油是目前已知的典型代表。
4.1壳聚糖
壳聚糖是生物多糖甲壳素的衍生物,研究表明其对部分G-有较高的抗菌活性[64]。做为聚合高分子物质,壳聚糖虽然无法通过G-的外膜,但它的C-2位氨基的pKa在6.3~7.0左右,在酸性溶液中氨基可以质子化带正电,因而可以与外膜层的阴离子相互作用,破坏外膜层。Helander[65]发现,在SDS的存在下壳聚糖可激活铜绿假单胞菌和鼠伤寒沙门氏菌的水解,这是因为壳聚糖可破坏外膜层,增强了SDS对内膜的溶解。含高阳离子鼠伤寒沙门氏菌突变体比亲本菌株更耐壳聚糖说明壳聚糖对外膜层的破坏力与菌株表面的阴离子直接相关。目标菌株表面携带的负电荷越多,将会吸附更多的壳聚糖,细胞表面则聚集更多的正电荷,这必将破坏外膜的完整性,最终导致细胞壁和细胞膜通透性显著增大,细胞溶解死亡。因此,比起G+,G-由于其细胞表面携带更多的负电荷,比G+更容易对壳聚糖敏感[66]。段静芸等[67]将壳聚糖应用于冷却鲜猪肉的保鲜,结果表明:1%酸溶性壳聚糖溶液可将保鲜期延长至7 d。刘占东等[68]制备了肉桂精油壳聚糖纳米粒,可显著改善冷却猪肉的货架期。虽然壳聚糖具有无毒、生物相容性、生物可降解性、高化学活性等优点,但壳聚糖作为抑菌剂还存在最小抑菌浓度高,且只有酸溶性壳聚糖溶液才具有抑菌活性,中性和碱性环境体系中不具有抑菌活性也极大限制了壳聚糖在食品保鲜中的应用。
4.2植物精油
除了壳聚糖,部分植物精油或提取物也能损伤G-的外膜层[69]。Helander等[70]发现香芹酚和百里香酚能够瓦解G-外膜,释放脂多糖(LPS)进而增加细胞膜的通透性。百里香精油,可导致欧文氏菌外膜蛋白质结构发生显著改变,从而破坏外膜层起到抗菌作用[71]。
5 结语
近些年来,生物防腐剂的作用机理已取得一定进展,从损伤指示菌的外膜层、细胞壁、到改变细胞膜的渗透性,导致胞内物质泄露,细胞溶解直到损伤胞内核酸等遗传物质。但目前食品贮藏过程中,多数还是通过控制单一因素来达到食品的保鲜,这势必会增加每个因素的强度,从而影响品质。另外某一个单一因素通常只针对一个特定的靶点,例如多数细菌素通常作用于细胞膜,造成膜穿孔而使胞内物质泄露,除了极少数细菌素,它们在外膜层上无特定的受体,因而很难起到杀菌作用。肽聚糖水解酶能水解细胞壁的肽聚糖造成细胞裂解,对G+有较好的抑菌效果,但是G-细胞壁肽聚糖层较薄,肽聚糖层对G-的屏障保护作用不如G+那么强,并且肽聚糖水解酶也不能穿过外膜层顺利到达细胞壁,从而起到裂解作用。基于此,德国学LeLisoter博士提出的一套用于食品保藏的科学理论[72],即栅栏技术,将抑制腐败菌生长繁殖的多个栅栏因子协同作用,以最大限度地形成不利于微生物生长的微环境。近年来,国内外也逐步将栅栏理论应用于食品保鲜中,曾友明等用Nisin和溶菌酶复配可将低温肉制品保鲜期达到3个月以上[73]。Vardaka[74]将柑橘提取物和壳聚糖复配应用于真空包装的火鸡肉,抑制了大肠杆菌和沙门氏菌的生长,将保质期延长至21 d以上。但目前的研究多集中在对不同的栅栏因子防腐效果的研究上,针对不同的产品,多凭经验自由组合,需多次尝试防腐效果,耗时耗力,也浪费大量的资源。这就需要以细胞模型为基础,系统研究不同栅栏因子的防腐机理,有效针对微生物细胞的不同靶点,如细胞外膜层、细胞壁、细胞膜和胞内核酸和蛋白等,科学合理的由外至内,从多方面打破其内环境平衡,则可实现有效的栅栏交互作用,比应用单一而高强度的栅栏更为有效。
[1]刘贵州,陈志波. 冷杀菌技术在食品行业中的应用[J]. 食品界,2016(4):121-122.
[2]段鑫,欧杰,李柏林,等.辐照技术在肉制品杀菌保鲜中的应用[J].食品科学,2010,31(1):278-282.
[3]邓明. 栅栏技术在冷却猪肉保鲜中的应用[D]. 武汉:华中农业大学,2006.
[4]蒋昱,张朝晖,周晓云. 乳链菌肽研究进展[J]. 科技通报,2010,26(3):358-361.
[5]高继业,李继祥,黄伟,等.鲜猪肉在保藏中的主要腐败菌分析[J]. 食品科学,2015,36(22):173-176.
[6]全拓.肉制品中主要微生物的检测与研究[D]. 重庆:西南大学,2012.
[7]王丹丹,郭淑元.芽胞杆菌肽聚糖水解酶的功能研究进展[J]. 生物技术通报,2015,31(2):45-52.
[8]Chhatwal G S,Mcmillan D J,Talay S R,et al. Pathogenicity factors in group C and G Streptococci[M]. ASM Press,2006:213-221.
[9]Callewaert L,Walmagh M,Michiels C W,et al.Food applications of bacterial cell wall hydrolases[J]. Current Opinion in Biotechnology,2010,22(2):164-171.
[10]Loessner M J. Bacteriophage endolysins-Current state of research and applications[J]. Current Opinion in Microbiology,2005,8(4):480-487.
[11]任西营,胡亚芹,胡庆兰,等.溶菌酶在水产品防腐保鲜中的应用[J]. 食品工业科技,2013,34(8):390-394.
[12]Iaconelli A,Fiorentini L,Bruschi S,et al. Absence of Allergic Reactions to Egg White Lysozyme Additive in Grana Padano Cheese[J]. Journal of the American College of Nutrition,2008,27(2):326-331.
[13]Silvetti T,Brasca M,Lodi R,et al. Effects of Lysozyme on the Microbiological Stability and Organoleptic Properties of Unpasteurized Beer[J]. Journal of the Institute of Brewing,2010,116(1):33-40.
[14]De-La-Re-Vega E,García-Galaz A,Díaz-Cinco M E,et al. White shrimp(Litopenaeus vannamei)recombinant lysozyme has antibacterial activity against Gram negative bacteria:Vibrioalginolyticus,VibrioparahemolyticusandVibriocholerae[J]. Fish & Shellfish Immunology,2006,20(3):405-408.
[15]Callewaert L,Walmagh M,Michiels C W,et al. Food applications of bacterial cell wall hydrolases[J]. Current Opinion in Biotechnology,2010,22(2):164-171.
[16]Donovan D M,Fosterfrey J,Dong S,et al. The cell lysis activity of theStreptococcusagalactiaebacteriophage B30 endolysin relies on the cysteine,histidine-dependent amidohydrolase/peptidase domain[J]. Applied & Environmental Microbiology,2006,72(7):5108-5112.
[17]Zimmer M,Vukov N,Scherer S,et al. The murein hydrolase of the bacteriophage phi3626 dual lysis system is active against all testedClostridiumperfringensstrains[J]. Applied & Environmental Microbiology,2002,68(11):5311-5317.
[18]Obeso J M,Martínez B,Rodríguez A,et al. Lytic activity of the recombinantstaphylococcalbacteriophage PhiH5 endolysin active againstStaphylococcusaureusin milk[J]. International Journal of Food Microbiology,2008,128(128):212-218.
[19]Ahn J S,Chandramohan L,Liou L E,et al. Characterization of CidR-mediated regulation inBacillusanthracis,reveals a previously undetected role of S-layer proteins as murein hydrolases[J]. Molecular Microbiology,2006,62(4):1158-1169.
[20]Acosta F,Ferreras E,Berenguer J. Theβ-barrel assembly machinery(BAM)is required for the assembly of a primitive S-layer protein in the ancient outer membrane ofThermusthermophilus[J]. Extremophiles Life Under Extreme Conditions,2012,16(6):853-861.
[21]宋达峰. 新型植物乳杆菌细菌素PZJ5的分离纯化及特性研究[D]. 杭州:浙江大学,2013.
[22]Gross E,Morell J L. The structure of nisin.[J]. Journal of the American Chemical Society,1971,93(18):4634-4635.
[23]Mulders J W M,Boerrigter I J,Rollema H S,et al. Identification and characterization of the lantibiotic nisin Z,a natural nisin variant[J]. European Journal of Biochemistry,1991,201(3):581-584.
[24]Yoneyama F,Fukao M,Zendo T,et al. Biosynthetic characterization and biochemical features of the third natural nisin variant,nisin Q,produced byLactococcuslactis61-14.[J]Appl Microbiol 2008;105(6):1982-1990.
[25]Piper C,Hill C,Cotter Pd,Ross Rp. Bioengineering of a Nisin A-producingLactococcuslactisto create isogenic strains producing the natural variants Nisin F,Q and Z. Microb Biotechnol 2011;4(3):375-382.
[26]Punyauppapath S,Phumkhachorn P,Rattanachaikunsopon P. Nisin:production and mechanism of antimicrobial action[J]. International Journal of Current Research & Review 2015;7(2):47-53.
[27]Wiedemann I,Benz R,Sahl H G. Lipid II-mediated pore formation by the peptide antibiotic nisin:a black lipid membrane study.[J]. Journal of Bacteriology,2004,186(10):3259-3261.
[28]Sahl H G,Kordel M,Benz R. Voltage-dependent depolarization of bacterial membranes and artificial lipid bilayers by the peptide antibiotic nisin[J]. Archives of Microbiology,1987,149(2):120-124.
[29]罗欣,朱燕山. Nisin在牛肉冷却肉保鲜中的应用研究[J].食品科学,2000,21(3):53-57. DOI:10.3321/j.issn:1002-6630.2000.03.021.
[30]江芸. 国产Nisin的特性及其在肉品保鲜中的应用[D]. 南京:南京农业大学,2000.
[31]Montville T J,Chen Y. Mechanistic action of pediocin and nisin:recent progress and unresolved questions[J]. Applied Microbiology and Biotechnology,1998,50(5):511-519.
[32]Santiago-Silva P,Soares N F F,Nóbrega J E,et al. Antimicrobial efficiency of film incorporated with pediocin(ALTA ®;,2351)on preservation of sliced ham[J]. Food Control,2009,20(1):85-89.
[33]Buyong N,Use of a genetically enhanced,pediocin-producing starter-culture,Lactococcuslactissubsp. lactis MM217,to controlListeriamonocytogenesin Cheddar cheese[J]. Applied and Environmental Microbiology,1998,64:4842-4845.
[34]Destoumieuxgarzón D,Peduzzi J,Thomas X,et al. Parasitism of Iron-siderophore Receptors ofEscherichiaColi,by the Siderophore-peptide Microcin E492m and its Unmodified Counterpart[J]. BioMetals,2006,19(2):181-191.
[35]Shima S,Sakai H. Poly-L-lysine produced by Streptomyces,PartⅢ[J]. Chemical studies. Agric Biol Chem,1981,45(11):2503-2508.
[36]李诚,石磊. ε-聚赖氨酸抑菌性能研究[J]. 食品与发酵工业,2009,35(2):39-43.
[37]Cherkaoui A,Hibbs J,Emonet S,et al. Comparison of Two Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry Methods with Conventional Phenotypic Identification for Routine Identification of Bacteria to the Species Level[J]. Journal of Clinical Microbiology,2010,48(4):1169-1175.
[38]Shima S,Fukuhara Y,Sakai H. Inactivation of bacteriophages by ε-poly-L-lycine produced bystreptomyces[J]. Agricultural & Biological Chemistry,1982,46(7):1917-1919.
[39]Yamanaka K,Hamano Y. Biotechnological Production of Poly-Epsilon-l-Lysine for Food and Medical Applications[M]. Amino-Acid Homopolymers Occurring in Nature. 2010:61-75.
[40]贾士儒. 生物防腐剂-ε-聚赖氨酸研究进展[C]//氨基酸、呈味核苷酸生产技术交流会,2004.
[41]韩晴,冯建岭,韩浩,等. ε-聚赖氨酸在食品应用的研究进展[J]. 山东食品发酵,2014(3):45-48.
[42]谭之磊. ε-聚赖氨酸及其复合材料的制备与抑菌活性研究[D]. 天津:天津大学,2014.
[43]莫树平,张菊梅,吴清平,等. ε-聚赖氨酸复合生物防腐剂对广式腊肠的防腐效果研究[J]. 食品研究与开发,2010,31(12):224-229.
[44]Hyldgaard M,Meyer R L,Peng M,et al. Binary combination of epsilon-poly-l-lysine and isoeugenol affect progression of spoilage microbiota in fresh turkey meat,and delay onset of spoilage in Pseudomonas putida challenged meat.[J]. International Journal of Food Microbiology,2015,215:131-142.
[45]Raut J S,Karuppayil S M,Raut J S,et al. A status review on the medicinal properties of essential oils[J]. Industrial Crops & Products,2014,62(62):250-264.
[46]Basile A,Cobianchi R C,Rigano,et al. Potential allelopathic activity of Sideritis italica(Miller)Greuter et Burdet essential oil[J]. Plant Biosystems,2011,145(1):241-247.
[47]Zhu Shunying,Yang Yang,Yu Huaidong,et al. Chemical composition and antimicrobial activity of the essential oils of Chrysanthemum indicum[J]. Journal of Ethnopharmacology,2005,96(1-2):151-158.
[48]Thoroski J,Blank G,Biliaderis C. Eugenol Induced Inhibition of Extracellular Enzyme Production byBacillussubtilis[J]. Journal of Food Protection,1989,52(6):399-403.
[49]Burt S. Essential oils:their antibacterial properties and potential applications in foods--a review[J]. International Journal of Food Microbiology,2004,94(3):223-253.
[50]Oosterhaven K,Poolman B,Smid E J. S-Carvone as a natural potato sprout inhibiting,fungistatic and bacteristatic compound[J].Industrial Crops & Products,1995,4(1):23-31.
[51]Ultee A,Bennik M H J,Moezelaar R. The Phenolic Hydroxyl Group of Carvacrol Is Essential for Action against the Food-Borne PathogenBacilluscereus[J]. Applied & Environmental Microbiology,2002,68(4):1561-1568.
[52]Carson C F,Mee B J,Riley T V. Mechanism of action of Melaleuca alternifolia(tea tree)oil onStaphylococcusaureusdetermined by time-kill,lysis,leakage,and salt tolerance assays and electron microscopy[J]. Antimicrobial Agents & Chemotherapy,2002,46(6):1914-1920.
[53]Ultee A,Kets E P W,Alberda M,et al. Adaptation of the food-borne pathogen,Bacilluscereus,to carvacrol[J]. Archives of Microbiology,2000,174(4):233-238.
[54]Devi K P,Nisha S A,Sakthivel R,et al. Eugenol(an essential oil of clove)acts as an antibacterial agent againstSalmonellatyphi,by disrupting the cellular membrane[J]. Journal of Ethnopharmacology,2010,130(1):107-115.
[55]Burt S. Essential oils:Their antibacterial properties and potential applications in foods-A review. International Journal of Food Microbiology,94(3),223-225.
[56]Khanjari A,Karabagias I K,Kontominas M G. Combined effect of N,O-carboxymethyl chitosan and oregano essential oil to extend shelf life and controlListeriamonocytogenes,in raw chicken meat fillets[J]. Lebensmittel-Wissenschaft und-Technologie,2013,53(1):94-99.
[57]张慧芸,郭新宇. 丁香精油-壳聚糖复合可食性膜对生肉糜保鲜效果的影响[J]. 食品科学,2014,35(18):196-200.
[58]Parks W M,Bottrill A R,Pierrat O A,et al. The action of the bacterial toxin,microcin B17,on DNA gyrase[J]. Biochimie,2007,89(4):500-507.
[59]Vincent P A,Morero R D. The structure and biological aspects of peptide antibiotic microcin J25[J]. Current Medicinal Chemistry,2009,16(5):538-549.
[60]Metlitskaya A,Kazakov T,Kommer A,et al. Aspartyl-tRNA synthetase is the target of peptide nucleotide antibiotic Microcin C[J]. Journal of Biological Chemistry,2006,281(26):18033-18042.
[61]Bagley M C,Dale J W,And E A M,et al. Thiopeptide Antibiotics[J]. Cheminform,2005,36(24):685-714.
[62]Chung E Y,Byun Y H,Shin E J. Antibacterial effects of vulgarone B from Artemisia iwayomogi alone and in combination with oxacillin[J]. Archives of Pharmacal Research,2009,32(12):1711-1719.
[63]Sashiwa H,Aiba S I. Chemically modified chitin and chitosan as biomaterials[J]. Progress in Polymer Science,2004,29(9):887-908.
[64]Sagoo S,Board R,Roller S. Chitosan inhibits growth of spoilage micro-organisms in chilled pork products[J]. Food Microbiology,2002,19(2):175-182.
[65]Helander I M,Nurmiaholassila E L,Ahvenainen R,et al. Chitosan disrupts the barrier properties of the outer membrane of gram-negative bacteria[J]. International Journal of Food Microbiology,2001,71(2-3):235-244.
[66]Nikaido H. Outer membrane barrier as a mechanism of antimicrobial resistance[J]. Antimicrobial Agents & Chemotherapy,1989,33(33):1831-1836.
[67]段静芸,徐幸莲,周光宏. 壳聚糖在冷却鲜猪肉保鲜中的应用研究[J]. 食品工业科技,2001(4):26-28.
[68]刘占东,李璐,全国芬,等. 肉桂精油壳聚糖纳米粒在冷却肉保藏中的应用[J]. 西北农林科技大学学报自然科学版,2016,44(5):193-199.
[69]Kim S Y,Kang D H,Kim J K,et al. Antimicrobial Activity of Plant ExtractsAgainstSalmonella,Typhimurium,Escherichiacoli,O157∶H7,andListeriamonocytogenes,on Fresh Lettuce[J]. Journal of Food Science,2011,76(1):M41-M46.
[70]Helander I M,Alakomi H L,Latvakala K,et al. Characterization of the action of selected essential oil components on gram-negative bacteria[J]. Journal of Agricultural & Food Chemistry,1998,46(9):3590-3595.
[71]Horváth G,Kovács K,Kocsis B,et al. Effect of Thyme(Thymus vulgaris L.)Essential Oil and Its Main Constituents on the Outer Membrane Protein Composition of Erwinia Strains Studied with Microfluid Chip Technology[J]. Chromatographia,2009,70(11):1645-1650.
[72]Leistner L. Further developments in the utilization of hurdle technology for food preservation[J]. Journal of Food Engineering,1994,22(1):421-432.
[73]曾友明,马小明,丁泉水,等. 天然保鲜剂对延长低温肉制品货架期作用的研究[J]. 食品工业科技,2002(10):28-30.
[74]Vardaka V D,Yehia H M,Savvaidis I N. Effects of Citrox and chitosan on the survival ofEscherichiacoliO157∶H7 andSalmonellaentericain vacuum-packaged turkey meat.[J]. Food Microbiology,2016,58:128-134.
Preservationmechanismandapplicationsofbiologicalpreservatives
WANGXiao-meng1,2,JIANGYun2,SUNZhi-lan1,*,LIUFang1,WANGDao-ying1,ZHANGXin-xiao1,ZHUYong-zhi1,XUWei-min1,3
(1.Institute of Agricultural Products Processing,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China;2.Department of Food Science,Ginling College,Nanjing Normal University,Nanjing 210097,China;3.Jiangsu Collaborative Innovation Center of Meat Productionand Processing,Quality and Safety Control,Nanjing 210095,China)
Spoilage caused by microorganisms during the food processing,storage and transportation process has been a worldwide problem in the field of food preservation. Due to the security risks can not be ignored caused by the use of chemical preservatives,the development of safe and efficient biological preservatives has gradually become the focal point. However,the single target and high-cost of biological preservative restricts its development. So how to combine different biological preservatives reasonably and achieve multi-target attack on the spoilage bacteria on the basis of reducing the intensity of single factor has attracted more and more concern. In this paper,the biological preservative with the target of cell wall,cell membrane,intracellular genetic material and outer membrane layer of gram negative bacteria were systematically reviewed. Their mode actions and applications in food preservation were summarized,and further studies in this area are also suggested. This work will provide a theoretical basis for the precise combination of biological preservatives.
biological preservatives;preservation mechanism;preservation applications
TS201.3
A
1002-0306(2017)19-0304-08
10.13386/j.issn1002-0306.2017.19.056
2017-04-14
王筱梦(1992-),女,硕士研究生,研究方向:肉品安全与质量控制,E-mail:625196221@qq.com。
*通讯作者:孙芝兰(1984-),女,博士,副研究员,研究方向:肉品安全与质量控制,E-mail:zhilan408@163.com。
江苏省农业科技自主创新资金项目(CX(15)1008);国家自然科学基金(31601530);江苏省产学研合作项目(BY2015073-01)。
