蛋氨酸对宫内发育迟缓断奶仔猪血浆生化指标和肠道消化吸收功能的影响
2017-10-19莉莉
, ,, , ,莉莉,
(南京农业大学动物科技学院,江苏南京 210095)
蛋氨酸对宫内发育迟缓断奶仔猪血浆生化指标和肠道消化吸收功能的影响
苏伟鹏,张昊,应志雄,李悦,周乐,张莉莉,王恬*
(南京农业大学动物科技学院,江苏南京 210095)
目的:研究蛋氨酸对宫内发育迟缓(IUGR)断奶仔猪血浆生化指标和肠道消化吸收功能的调节作用。方法:所有仔猪于21 d龄断奶,30头正常出生体重(NBW)断奶仔猪饲喂基础日粮(NBW-CON组),60头IUGR断奶仔猪随机分成两个处理组,分别饲喂基础日粮(IUGR-CON组)和添加0.12%蛋氨酸的实验日粮(IUGR-MET组),每个处理组6个重复,每个重复5头猪,实验期为28 d。结果:与NBW-CON断奶仔猪相比,IUGR-CON断奶仔猪血浆尿素氮含量显著升高(p<0.05),血浆总蛋白和D-木糖含量显著降低(p<0.05)。IUGR-CON断奶仔猪粗蛋白和总能表观消化率、空肠食糜胰蛋白酶活性、黏膜碱性磷酸酶和Na+-K+-ATP酶活性均显著降低(p<0.05)。与IUGR-CON断奶仔猪相比,IUGR-MET断奶仔猪血浆尿素氮含量显著降低(p<0.05),血浆D-木糖含量显著升高(p<0.05)。日粮添加0.12%蛋氨酸显著缓解IUGR介导断奶仔猪粗蛋白表观消化率、空肠食糜胰蛋白酶活性和黏膜Na+-K+-ATP酶活性降低(p<0.05)。结论:日粮添加0.12%蛋氨酸可降低IUGR断奶仔猪血浆尿素氮含量,并在一定程度上缓解了IUGR对断奶仔猪肠道消化吸收功能的不良影响。
蛋氨酸,宫内发育迟缓,断奶仔猪,肠道,消化吸收功能
胎儿宫内发育迟缓(Intrauterine growth retardation,IUGR)是围产期的常见并发症之一,临床表现为低出生体重或极低出生体重、各组织器官生长发育受阻、高发病率和死亡率等[1-2]。据统计,全球每年约有5%~10%的IUGR新生儿,已经成为困扰人类医学的重大难题[3]。胎儿生长发育与机体对营养物质消化吸收能力的高低密切相关,而肠道则是机体最为重要的消化吸收器官[4]。诸多研究表明,IUGR会造成胎儿出生后肠道消化、吸收和代谢等功能的异常[5-6]。
近年来,膳食氨基酸在维持肠道健康和预防肠道疾病等领域的应用受到广泛关注[7]。蛋氨酸(Methionine,Met)属于含硫氨基酸,是机体必需氨基酸之一[8]。研究表明,蛋氨酸在蛋白质代谢、DNA甲基化以及抗氧化功能中具有重要作用[9]。同时,含硫氨基酸在维持肠道消化、吸收和代谢功能中也发挥着积极作用[10]。Bauchart-Thevret 等[11]研究发现,含硫氨基酸的缺乏会导致肠道绒毛萎缩,绒毛表面积减少,从而影响肠道对营养物质的消化吸收。因此,蛋氨酸对于维持肠道正常功能具有重要意义。
但有关蛋氨酸缓解IUGR后代肠道消化吸收功能异常的报道较少,特别是在出生后早期这一关键阶段。猪和人在肠道结构、消化系统等方面均有较好的相似性,IUGR猪作为人类理想的动物模型,对临床治疗IUGR新生儿肠道消化吸收功能紊乱具有重要的参考意义[12]。因此,本研究以IUGR断奶仔猪为动物模型,探讨蛋氨酸对IUGR断奶仔猪血浆生化指标和肠道消化吸收功能的影响,为改善IUGR新生儿肠道功能损伤提供新的思路,同时为蛋氨酸在IUGR后代健康饮食中的应用提供参考依据。
1 材料与方法
1.1材料与仪器
L-蛋氨酸(纯度99%) 韩国希杰有限公司;葡萄糖试剂盒、总胆固醇试剂盒、甘油三酯试剂盒、总蛋白试剂盒、白蛋白试剂盒、尿素氮试剂盒 上海科华生物工程股份有限公司;淀粉酶试剂盒、脂肪酶试剂盒、胰蛋白酶试剂盒、D-木糖试剂盒、碱性磷酸酶试剂盒、Na+-K+-ATP酶试剂盒、总蛋白定量测定(BCA法)试剂盒 南京建成生物工程研究所。
Selectra-E型全自动生化分析仪 荷兰威图科学公司;BSA224S-CW型分析天平 德国Sartorius公司;KJELTEC 2300型全自动凯氏定氮仪 瑞典FOSS分析仪器公司;TYHW-V型全自动量热仪 鹤壁市天宇仪器仪表制造有限公司;Bio-Gen Series PRO 200型匀浆机 美国PRO Scientific公司;5804R型台式高速冷冻离心机 德国Eppendorf公司;DK-S24型电热恒温水浴锅 上海精宏实验设备有限公司;T-6m型紫外可见分光光度计 南京菲勒仪器有限公司;DW-25L262型医用低温保存箱 青岛海尔特种电器有限公司;Multiskan Go型全波长酶标仪,8925型-80 ℃超低温冰箱 美国Thermo Fisher Scientific公司。
1.2实验设计
在体况相似、胎次接近、品种相同的30头母猪所产的新生仔猪中,每窝各挑选1头正常出生体重(Normal birth weight,NBW)和2头IUGR新生仔猪(以出生体重接近群体平均值且小于0.5个标准差的仔猪为NBW仔猪,以出生体重低于群体平均值2个标准差的仔猪为IUGR仔猪[13-14]),所用仔猪全部为母。所有仔猪于21 d龄断奶,30头NBW断奶仔猪饲喂基础日粮(NBW-CON组),60头IUGR断奶仔猪随机分成两个处理组,分别饲喂基础日粮(IUGR-CON组)和添加0.12%蛋氨酸的实验日粮(IUGR-MET组),每个处理组6个重复,每个重复5头猪,实验期为28 d。日粮配制参照NRC(2012)猪的营养需要[15],日粮配方和营养水平见表1。实验猪饲养管理严格执行卫生防疫制度。
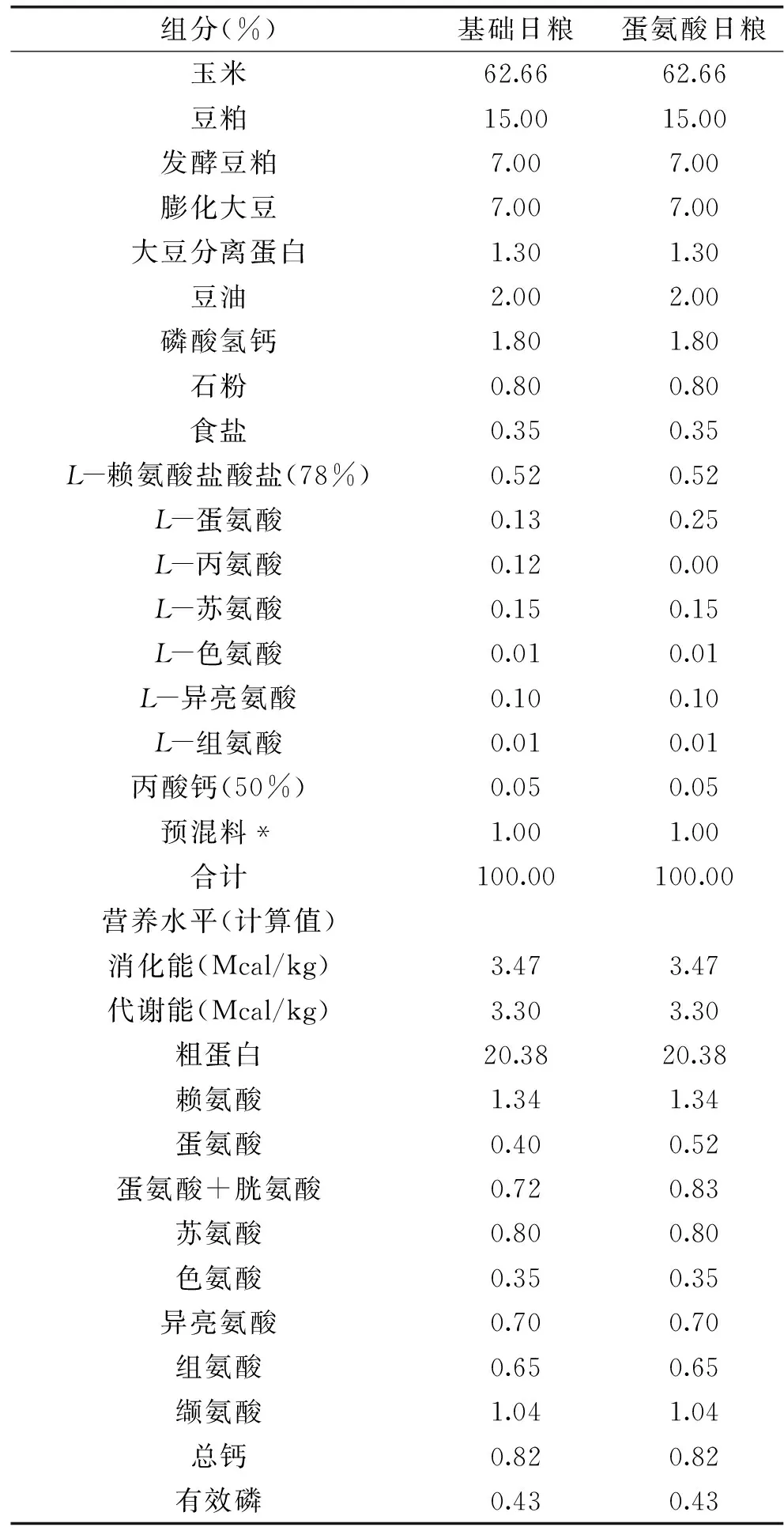
表1 日粮配方和营养水平Table 1 Composition and nutrient levels of the diets
注*:预混料为每kg全价料提供:维生素A,8000 IU;维生素D3,3000 IU;维生素E,20 IU;维生素K3,3 mg;维生素B1,2 mg;维生素B2,5 mg;维生素B6,7 mg;维生素B12,0.02 mg;烟酸,30 mg;泛酸,15 mg;叶酸,0.3 mg;生物素,0.08 mg;氯化胆碱,500 mg;铁,110 mg;铜,7 mg;锰,5 mg;锌,110 mg;碘,0.3 mg;硒,0.3 mg。

表2 Met对IUGR断奶仔猪血浆生化指标的影响Table 2 Effects of Met on plasma biochemical parameters in IUGR weanling piglets
注:NBW-CON:NBW断奶仔猪饲喂基础日粮;IUGR-CON:IUGR断奶仔猪饲喂基础日粮;IUGR-MET:IUGR断奶仔猪饲喂添加0.12%蛋氨酸的实验日粮;同行数据肩标不同小写字母表示差异显著(p<0.05);含相同字母或无字母表示差异不显著(p>0.05),表3~表5、图1同。
1.3样品采集与处理
49 d龄时,对所有实验猪进行称重,每组每重复中挑选一头体重适中的实验猪。按1 mL/kg体重的剂量给仔猪灌服10%的D-木糖溶液,1 h后于前腔静脉采集血液5 mL,收集于肝素钠抗凝管中,在4 ℃下2000×g离心10 min,收集上层血浆,保存于-80 ℃超低温冰箱待测。在采集血液后,肌内注射戊巴比妥钠(50 mg/kg体重)麻醉处以安乐死。迅速剖开腹腔,分离出空肠和回肠。分别挤出每段肠道食糜用于肠道内容物酶活性的测定,并用手术剪剪开肠道,刮取肠道黏膜并装入冻存管中,液氮速冻后于-80 ℃超低温冰箱保存待测。
于实验第26~28 d,以重复为单位,每天采集粪便样本150 g,并将同一重复仔猪的粪便混匀,加入10%盐酸进行固氮,-20 ℃冰箱保存待测。同时,参照张丽英[16]的方法,采用四分法收集饲料样品各250 g,4 ℃冰箱保存待测。
1.4测定指标及方法
1.4.1 血浆生化指标测定 使用全自动生化分析仪测定仔猪血浆葡萄糖、总胆固醇、甘油三酯、总蛋白、白蛋白和尿素氮的含量。血浆球蛋白含量为总蛋白和白蛋白的差值。
1.4.2 养分表观消化率测定 使用盐酸不溶灰分作为指示剂,测定方法参照GB/T23742-2009。饲料及粪便中的干物质、粗蛋白、粗脂肪、总能和粗灰分的测定参照张丽英[16]的方法。养分表观消化率按照以下公式进行计算:
养分表观消化率(%)=100-100×[(饲料中酸不溶灰分含量/粪样中酸不溶灰分含量)×(粪样中养分含量/饲料中养分含量)]
1.4.3 食糜和肠道黏膜匀浆液制备与指标测定 分别称取0.2 g左右食糜和肠道黏膜组织,按照重量(g)∶体积(mL)=1∶4的比例加入预冷的0.9%生理盐水,冰水浴条件下机械匀浆,4 ℃下1000×g离心10 min,取上清即20%匀浆液,放置于-20 ℃冰箱保存待测。BCA法测定蛋白含量。测定食糜匀浆液中淀粉酶、脂肪酶和胰蛋白酶活性及肠道黏膜匀浆液中碱性磷酸酶和Na+-K+-ATP酶活性。以上指标均严格按照产品说明书进行操作。
1.4.4D-木糖含量测定 血浆中D-木糖含量使用南京建成生物工程研究所试剂盒进行测定,并严格按照产品说明书进行操作。
1.5数据统计与分析
实验数据应用SPSS 16.0统计软件中的单因素方差分析进行差异显著性检验,并采用Tukey法进行多重比较,以p<0.05作为差异显著性的判断标准。实验结果以平均值±标准误表示。
2 结果与分析
2.1Met对IUGR断奶仔猪血浆生化指标的影响
由表2可知,与NBW-CON断奶仔猪相比,IUGR-CON断奶仔猪血浆总蛋白含量显著降低(p<0.05),尿素氮含量显著升高(p<0.05),葡萄糖、总胆固醇、甘油三酯、白蛋白和球蛋白含量无显著差异(p>0.05)。与IUGR-CON断奶仔猪相比,IUGR-MET断奶仔猪血浆尿素氮含量显著降低(p<0.05),葡萄糖、总胆固醇、甘油三酯、总蛋白、白蛋白和球蛋白含量无显著差异(p>0.05)。与NBW-CON断奶仔猪相比,IUGR-MET断奶仔猪血浆葡萄糖、总胆固醇、甘油三酯、总蛋白、白蛋白、球蛋白和尿素氮含量无显著差异(p>0.05)。
血浆的化学成分主要来源于胃肠道所消化吸收的营养物质以及机体的代谢产物,其含量的变化可反映机体对营养物质的利用效率以及组织的代谢水平。血浆总蛋白含量可反映机体对蛋白质的消化吸收能力及蛋白质代谢情况[17]。而尿素氮则是机体蛋白质代谢的主要终产物,其含量常用来反映体内蛋白质利用效率[18]。本实验研究发现,IUGR导致断奶仔猪血浆总蛋白含量减少,尿素氮含量升高,提示机体对蛋白质的消化吸收能力降低,蛋白质分解加强。王远孝[19]的研究结果显示,28 d龄IUGR仔猪血清总蛋白含量显著降低,尿素氮含量显著升高,与本实验结果一致。研究认为,日粮中氨基酸水平的改变可引起血中尿素氮含量的变化,血浆尿素氮含量的下降,反映了较高的氮利用效率和较少的尿素合成[20]。本研究中,通过日粮添加蛋氨酸可显著降低IUGR-MET断奶仔猪血浆尿素氮含量,表明机体氮的吸收量增加,蛋白质合成代谢增强。另外,Tian等[21]研究发现,日粮添加0.12%蛋氨酸可显著提高仔猪血清总蛋白含量,显著降低尿素氮含量,与本实验结果相似。
2.2Met对IUGR断奶仔猪养分表观消化率的影响
由表3可知,与NBW-CON断奶仔猪相比,IUGR-CON断奶仔猪粗蛋白和总能的表观消化率显著降低(p<0.05),干物质、粗脂肪和粗灰分的表观消化率无显著差异(p>0.05)。与IUGR-CON断奶仔猪相比,IUGR-MET断奶仔猪粗蛋白的表观消化率显著升高(p<0.05),干物质、粗脂肪、总能和粗灰分的表观消化率无显著差异(p>0.05)。与NBW-CON断奶仔猪相比,IUGR-MET断奶仔猪干物质、粗蛋白、粗脂肪、总能和粗灰分的表观消化率无显著差异(p>0.05)。

表3 Met对IUGR断奶仔猪养分表观消化率的影响(%)Table 3 Effects of Met on apparent nutrientdigestibility in IUGR weanling piglets(%)

表4 Met对IUGR断奶仔猪肠道食糜消化酶活性的影响Table 4 Effects of Met on digestive enzyme activities in the intestinal digesta of IUGR weanling piglets
养分表观消化率是衡量机体消化能力的重要指标。本实验中,IUGR导致49 d龄断奶仔猪粗蛋白和总能的表观消化率显著降低,提示IUGR仔猪对食物中营养物质的利用效率较低。Greenwood等[22]研究表明,与NBW羔羊相比,IUGR导致新生羔羊总能利用效率降低,从而影响机体对蛋白质和脂肪的沉积。肠道是蛋氨酸代谢的重要场所,蛋氨酸在肠道中的代谢对于肠道黏膜生长和维持肠道正常功能具有积极作用[23-24]。本实验结果显示,日粮添加蛋氨酸使IUGR断奶仔猪粗蛋白的表观消化率显著提高。这可能是由于蛋氨酸水平的提高促进了IUGR断奶仔猪肠道黏膜生长,从而增强了机体对营养物质的利用效率。陈颖等[25]研究表明,随着蛋氨酸水平的提高(0.28%~0.37%),断奶仔猪对干物质和粗蛋白的表观消化率呈线性增加,与本文结果相似。
2.3Met对IUGR断奶仔猪肠道食糜消化酶活性的影响
由表4可知,与NBW-CON断奶仔猪相比,IUGR-CON断奶仔猪空肠食糜胰蛋白酶活性显著降低(p<0.05),淀粉酶和脂肪酶活性无显著差异(p>0.05)。与IUGR-CON断奶仔猪相比,IUGR-MET断奶仔猪空肠食糜胰蛋白酶活性显著升高(p<0.05),淀粉酶和脂肪酶活性无显著差异(p>0.05)。与NBW-CON断奶仔猪相比,IUGR-CON断奶仔猪回肠食糜淀粉酶、脂肪酶和胰蛋白酶活性无显著差异(p>0.05)。与IUGR-CON断奶仔猪相比,IUGR-MET断奶仔猪回肠食糜淀粉酶、脂肪酶和胰蛋白酶活性无显著差异(p>0.05)。与NBW-CON断奶仔猪相比,IUGR-MET断奶仔猪空肠和回肠食糜淀粉酶、脂肪酶和胰蛋白酶活性无显著差异(p>0.05)。
消化酶活性直接影响肠道对营养物质的消化能力。本实验发现,IUGR-CON断奶仔猪空肠胰蛋白酶活性显著降低。Dong等[6]研究表明,IUGR导致哺乳仔猪肠道绒毛萎缩,空肠和回肠胰蛋白酶活性显著降低,与本实验结果相似。上述结果提示,IUGR仔猪肠道生长发育受阻,可引起肠道消化酶活性异常,从而严重影响机体对营养物质的消化。帅柯[26]研究表明,蛋氨酸显著提高幼建鲤肠道脂肪酶、胰蛋白酶和糜蛋白酶活性。本实验发现,蛋氨酸显著提高IUGR断奶仔猪空肠胰蛋白酶活性,而对淀粉酶和脂肪酶活性无显著影响。说明蛋氨酸对肠道消化酶活性的调节作用可能受物种、机体状态以及饲喂方式等因素的影响。
2.4Met对IUGR断奶仔猪血浆D-木糖含量的影响
由图1可知,与NBW-CON断奶仔猪相比,IUGR-CON断奶仔猪血浆D-木糖含量显著降低(p<0.05)。与IUGR-CON断奶仔猪相比,IUGR-MET断奶仔猪血浆D-木糖含量显著升高(p<0.05)。与NBW-CON断奶仔猪相比,IUGR-MET断奶仔猪血浆D-木糖含量无显著差异(p>0.05)。

图1 Met对IUGR断奶仔猪血浆D-木糖含量的影响Fig.1 Effects of Met on plasma D-xylose contentin IUGR weanling piglets

表5 Met对IUGR断奶仔猪肠道黏膜碱性磷酸酶和Na+-K+-ATP酶活性的影响Table 5 Effects of Met on activities of alkaline phosphatase and Na+-K+-ATPase in the intestine of IUGR weanling piglets
2.5Met对IUGR断奶仔猪肠道黏膜碱性磷酸酶和Na+-K+-ATP酶活性的影响
由表5可知,与NBW-CON断奶仔猪相比,IUGR-CON断奶仔猪空肠黏膜碱性磷酸酶和Na+-K+-ATP酶活性显著降低(p<0.05)。与IUGR-CON断奶仔猪相比,IUGR-MET断奶仔猪空肠黏膜Na+-K+-ATP酶活性显著升高(p<0.05),碱性磷酸酶活性无显著差异(p>0.05)。与NBW-CON断奶仔猪相比,IUGR-CON断奶仔猪回肠黏膜碱性磷酸酶和Na+-K+-ATP酶活性无显著差异(p>0.05)。与IUGR-CON断奶仔猪相比,IUGR-MET断奶仔猪回肠黏膜碱性磷酸酶和Na+-K+-ATP酶活性无显著差异(p>0.05)。与NBW-CON断奶仔猪相比,IUGR-MET断奶仔猪空肠和回肠黏膜碱性磷酸酶和Na+-K+-ATP酶活性无显著差异(p>0.05)。
D-木糖吸收实验是评价小肠吸收功能的一种重要方法[27]。血液中木糖浓度越高,表明小肠吸收功能越好。本研究结果显示,IUGR断奶仔猪血浆D-木糖含量显著降低,与Zhang等[5]研究结果一致。肠型碱性磷酸酶分布于肠上皮刷状缘细胞表面,与脂类、葡萄糖等多种营养物质的吸收密切相关[28-29]。肠道中Na+-K+-ATP酶在电解质、水、葡萄糖等物质的吸收过程中发挥重要作用[30-31]。本实验中,IUGR显著降低49 d龄断奶仔猪空肠黏膜碱性磷酸酶和Na+-K+-ATP酶活性,与黄强等[32]研究结果一致,提示IUGR仔猪肠道吸收功能较弱。本实验通过日粮添加蛋氨酸显著提高IUGR-MET断奶仔猪血浆D-木糖含量和空肠黏膜Na+-K+-ATP酶活性,提示蛋氨酸能提高IUGR断奶仔猪肠道吸收功能,促进机体对营养物质的吸收。另外,帅柯[26]发现,不同形式蛋氨酸对幼建鲤肠道碱性磷酸酶和Na+-K+-ATP酶活性均有显著提高作用,与本实验结果相似。
3 结论
本实验结果发现,IUGR导致断奶仔猪血浆尿素氮含量显著升高,血浆总蛋白和D-木糖含量、养分表观消化率和空肠消化吸收酶活性均显著降低。日粮添加0.12%蛋氨酸显著降低IUGR断奶仔猪血浆尿素氮含量,显著升高血浆D-木糖含量,并显著缓解IUGR介导断奶仔猪粗蛋白表观消化率、空肠食糜胰蛋白酶活性和Na+-K+-ATP酶活性降低。上述结果提示,日粮添加蛋氨酸可在一定程度上缓解IUGR对断奶仔猪肠道消化吸收功能的不良影响。本研究进一步丰富了蛋氨酸在促进肠道消化吸收功能的积极作用,也为建立IUGR后代营养干预方法提供新的思路和理论依据。
[1]Valsamakis G,Kanaka-Gantenbein C,Malamitsi-Puchner A,et al. Causes of intrauterine growth restriction and the postnatal development of the metabolic syndrome[J]. Annals of the New York Academy of Sciences,2006,1092:138-147.
[2]Mandruzzato G,Antsaklis A,Botet F,et al. Intrauterine restriction(IUGR)[J]. Journal of Perinatal Medicine,2008,36(4):277-281.
[3]Bamfo J E,Odibo A O. Diagnosis and management of fetal growth restriction[J]. Journal of pregnancy,2011,2011:640715.
[4]Wu G. Intestinal mucosal amino acid catabolism[J]. Journal of Nutrition,1998,128(8):1249-1252.
[5]Zhang L L,Zhang H,Li Y,et al. Effects of medium-chain triglycerides on intestinal morphology and energy metabolism of intrauterine growth retarded weanling piglets[J]. Archives of Animal Nutrition,2017,71(3):231-245.
[6]Dong L,Zhong X,He J T,et al. Supplementation of tributyrin improves the growth and intestinal digestive and barrier functions in intrauterine growth-restricted piglets[J]. Clinical Nutrition,2016,35(2):399-407.
[7]Wang W W,Qiao S Y,Li D F. Amino acids and gut function[J]. Amino Acids,2009,37(1):105-110.
[8]Mastrototaro L,Sponder G,Saremi B,et al. Gastrointestinal methionine shuttle:Priority handling of precious goods[J]. IUBMB Life,2016,68(12):924-934.
[9]Métayer S,Seiliez I,Collin A,et al. Mechanisms through which sulfur amino acids control protein metabolism and oxidative status[J]. Journal of Nutritional Biochemistry,2008,19(4):207-215.
[10]Fang Z F,Yao K,Zhang X L,et al. Nutrition and health relevant regulation of intestinal sulfur amino acid metabolism[J]. Amino Acids,2010,39(3):633-640.
[11]Bauchart-Thevret C,Stoll B,Chacko S,et al. Sulfur amino acid deficiency upregulates intestinal methionine cycle activity and suppresses epithelial growth in neonatal pigs[J]. American Journal of Physiology Endocrinology and Metabolism,2009,296(6):E1239-1250.
[12]Ferenc K,Pietrzak P,Godlewski M M,et al. Intrauterine growth retarded piglet as a model for humans-Studies on the perinatal development of the gut structure and function[J]. Reproductive Biology,2014,14(1):51-60.
[13]Wang T,Huo Y J,Shi F X,et al. Effects of intrauterine growth retardation on development of the gastrointestinal tract in neonatal pigs[J]. Biology of the Neonate,2005,88(1):66-72.
[14]D’Inca R,Kloareg M,Gras-Le Guen C,et al. Intrauterine growth restriction modifies the developmental pattern of intestinal structure,transcriptomic profile,and bacterial colonization in neonatal pigs[J]. Journal of Nutrition,2010,140(5):925-931.
[15]National Research Council. Nutrient requirements of swine. 11th ed[S]. Washington,DC.:National Academy Press,2012.
[16]张丽英. 饲料分析及饲料质量检测技术(第2版)[M].北京:中国农业大学出版社,2003:13-94.
[17]范泽,李静辉,王安琪,等. 饲料中木薯淀粉添加水平对鲤生长性能、消化能力及糖代谢的影响[J]. 动物营养学报,2016,28(12):4044-4053.
[18]Coma J,Carrion D,Zimmerman D R. Use of plasma urea nitrogen as a rapid response criterion to determine the lysine requirement of pigs[J]. Journal of Animal Science,1995,73(2):472-481.
[19]王远孝. IUGR猪的生长与肠道发育及L-精氨酸和大豆卵磷脂的营养调控研究[D]. 南京:南京农业大学,2011:52-60.
[20]Brown J A,Cline T R. Urea excretion in the pig:an indicator of protein quality and amino acid requirements[J]. Journal of Nutrition,1974,104(5):542-545.
[21]Tian Q Y,Zeng Z K,Zhang Y X,et al. Effect of L-or DL-methionine supplementation on nitrogen retention,serum amino acid concentrations and blood metabolites profile in starter pigs[J]. Asian Australasian Journal of Animal Sciences,2016,29(5):689-694.
[22]Greenwood P L,Hunt A S,Hermanson J W,et al. Effects of birth weight and postnatal nutrition on neonatal sheep:I. Body growth and composition,and some aspects of energetic efficiency[J]. Journal of Animal Science,1998,76(9):2354-2367.
[23]Bauchart-Thevret C,Stoll B,Burrin D G. Intestinal metabolism of sulfur amino acids[J]. Nutrition Research Reviews,2009,22(2):175-187.
[24]Shoveller A K,Stoll B,Ball R O,et al. Nutritional and functional importance of intestinal sulfur amino acid metabolism[J]. Journal of Nutrition,2005,135(7):1609-1612.
[25]陈颖,朴香淑,赵泮峰,等. 评估L-蛋氨酸的有效性及标准回肠可消化蛋氨酸水平对断奶仔猪生长性能、营养物质表观消化率及血浆参数的影响[J]. 动物营养学报,2013,25(10):2430-2439.
[26]帅柯. 蛋氨酸对幼建鲤消化功能和免疫功能的影响[D]. 雅安:四川农业大学,2006:28-63.
[27]Haeney M R,Culank L S,Montgomery R D,et al. Evaluation of xylose absorption as measured in blood and urine:a one-hour blood xylose screening test in malabsorption[J]. Gastroenterology,1978,75(3):393-400.
[28]Malagelada J R,Linscheer W G,Fishman W H. The effect of fatty acid perfusion on intestinal alkaline phosphatase. II. Studies on the rat[J]. The American journal of digestive diseases,1977,22(6):516-523.
[29]Roubaty C,Portmann P. Relation between intestinal alkaline phosphatase activity and brush border membrane transport of inorganic phosphate,D-glucose,and D-glucose-6-phosphate[J].Pflügers Archiv:European Journal of Physiology,1988,412(5):482-490.
[30]Wild G E,Thompson J A,Searles L,et al. Small intestinal Na+,K+-adenosine triphosphatase activity and gene expression in experimental diabetes mellitus[J]. Digestive Diseases and Sciences,1999,44(2):407-414.
[31]Charney A N,Donowitz M. Functional significance of intestinal Na+-K+-ATPase:invivoouabain inhibition[J]. American Journal of Physiology,1978,234(6):E629-636.
[32]黄强,白凯文,徐稳,等. 日粮添加亮氨酸对宫内发育迟缓断奶仔猪小肠葡萄糖吸收和能量代谢的影响[J]. 南京农业大学学报,2017,40(2):339-345.
Effectsofmethionineonplasmabiochemicalparametersandintestinaldigestiveandabsorptivefunctioninintrauterinegrowth-retardedweanlingpiglets
SUWei-peng,ZHANGHao,YINGZhi-xiong,LIYue,ZHOULe,ZHANGLi-li,WANGTian*
(College of Animal Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
Objective:The aim of this study was to investigate the effects of methionine on plasma biochemical parameters and intestinal digestive and absorptive function in weanling piglets with intrauterine growth retardation(IUGR). Methods:After weaning(21 d of postnatal age),thirty female normal birth weight(NBW)piglets were assigned to receive the control diet(NBW-CON),and sixty same-sex IUGR piglets were randomly assigned to receive the control diet(IUGR-CON)or the control diet supplemented with 0.12% methionine(IUGR-MET)for 28 d,each group consisted of six replicates with five piglets per replicate. Results:Compared with NBW-CON piglets,the plasma urea nitrogen content of piglets in IUGR-CON group was increased,whereas the plasma total protein andD-xylose contents were significantly decreased(p<0.05). In addition,the apparent digestibility of crude protein and gross energy,the activity of trypsin in the jejunal digesta,and the activities of alkaline phosphatase and Na+-K+-ATPase in the jejunal mucosa of piglets in IUGR-CON group were also significantly decreased(p<0.05). Compared with piglets in IUGR-CON group,IUGR-MET piglets had decreased plasma urea nitrogen content,whereas increased plasmaD-xylose content(p<0.05). Dietary supplementation of 0.12% methionine significantly alleviated the decreased apparent digestibility of crude protein,the activity of trypsin in jejunal digesta,and the activity of Na+-K+-ATPase in jejunal mucosa(p<0.05). Conclusion:Dietary supplementation of 0.12% methionine significantly decreased plasma urea nitrogen content and partially improved digestive and absorptive function in the intestine of IUGR weanling piglets.
methionine;intrauterine growth retardation;weanling piglets;intestine;digestive and absorptive function
TS201.4
A
1002-0306(2017)19-0298-06
10.13386/j.issn1002-0306.2017.19.055
2017-05-08
苏伟鹏(1993-),男,硕士研究生,研究方向:动物营养与饲料科学,E-mail:weipengsu@126.com。
*通讯作者:王恬(1958-),男,博士,教授,研究方向:动物营养与饲料科学,E-mail:twang18@163.com。
国家自然科学基金(31572418);江苏高校优势学科建设工程二期项目。
