反相高效液相色谱测定饮料中新橙皮苷二氢查尔酮
2017-10-19,,,,,
,, ,, ,
(1.四川省分析测试服务中心,四川成都 610023;2.四川赛纳斯分析检测有限公司,四川成都 610023;3.西华大学理学院,四川成都 610039;4.赛默飞世尔科技有限公司成都应用实验室,四川成都 610023)
反相高效液相色谱测定饮料中新橙皮苷二氢查尔酮
张剑1,2,蔡函青2,杨捷2,盖世英1,赵彦3,冉良冀4
(1.四川省分析测试服务中心,四川成都 610023;2.四川赛纳斯分析检测有限公司,四川成都 610023;3.西华大学理学院,四川成都 610039;4.赛默飞世尔科技有限公司成都应用实验室,四川成都 610023)
建立了反相高效液相色谱检测饮料中新橙皮苷二氢查尔酮的分析方法。分别对提取方法、沉淀剂的使用和色谱条件进行了优化。采用核壳型的Accucore C18(2.6 μm,4.6 mm×100 mm)色谱柱为分析柱,以甲醇和水(45∶55,v/v)为流动相,等度洗脱,流速1.0 mL/min,柱温25 ℃,紫外检测波长283 nm,进样量10 μL,外标法定量分析。结果表明新橙皮苷二氢查尔酮的分离在10 min以内,具有良好峰形,在0.5~50 mg/L浓度范围内,有良好的线性关系,相关系数r>0.999,检出限为0.15 mg/L,在10、40、80 mg/kg加标水平下平均回收率在90.2%~103.5%之间,相对标准偏差(RSD)在1.96%~7.59%之间(n=6)。结果表明该方法选择性强、灵敏度高、操作简便,可用于饮料中新橙皮苷二氢查尔酮的检测。
新橙皮苷二氢查尔酮,高效液相色谱,饮料,甜味剂
新橙皮苷二氢查耳酮(Neohesperidin dihydrochalcone,NHDC)是一种二氢查耳酮糖苷化合物,有多种生理活性功能,甜度通常是蔗糖的1000~2000倍,甜味口感好,持续时间长,具有高甜度、低热量、低毒、稳定性好等特点,逐渐引起了广泛的关注,在食品工业、医药工业和饲料工业等领域都有良好的应用[1-4]。新橙皮苷二氢查耳酮是美国学者Horowitz和Gentili在研究柑桔黄酮类物质时发现的[5-6],1994年欧盟批准新橙皮苷二氢查耳酮作为食品甜味剂使用,我国也于1997年将其列入《食品添加剂使用卫生标准》中允许使用的食品香料品种名单[2-3]。食品添加剂是现代食品工业尤其是饮料工业发展中不可或缺的物质,然而近年来食品添加剂的超量、超范围使用现象屡见不鲜。我国国家标准GB 2760-2014只对常见甜味剂的适用范围和添加限量有明确的规定[7],监管部门的日常监督也往往局限于糖精钠、安赛蜜和甜蜜素等老一代甜味剂。目前,对新型甜味剂如新橙皮苷二氢查耳酮的检测方法研究较少,没有相应的检测标准。因此,有必要建立一种专属性强、灵敏度高、定性定量准确的检测方法。
食品中新橙皮苷二氢查耳酮的检测方法已有毛细管区带电泳法(CZE)、液相色谱法(HPLC)、液相色谱-串联质谱法(HPLC-MS/MS)等[8-16]。HPLC-MS/MS方法虽然灵敏度高、选择性强,但仪器昂贵,普及性不强。利用液相色谱检测饮料中新橙皮苷二氢查耳酮的方法鲜见报到,因此,本文建立了采用反相液相色谱法测定饮料中新橙皮苷二氢查耳酮的方法。
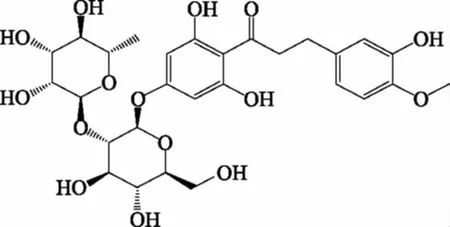
图1 新橙皮苷二氢查耳酮的结构式Fig.1 Structure of neohesperidin dihydrochalcone
1 材料与方法
1.1材料与仪器
新橙皮苷二氢查耳酮 纯度>98%,美国Sigma-Aldrich公司;甲醇 色谱纯,美国Fisher公司;其它试剂均为分析纯,实验用水为超纯水,饮料样品为超市购买。
Ultimate 3000超高效液相色谱仪 美国赛默飞公司;配双三元梯度泵DGP-3600RS、自动进样器WPS-3000TRS、柱温箱TCC-3000RS、二极管阵列检测器DAD-3000RS、变色龙色谱管理软件Chromeleon 7.2 SR4;ME204E 电子天平 瑞士Mettler公司;Integral 3 Milli-Q超纯水仪 德国Millipore公司;台式高速离心机H/T16MM 湖南赫西;数控超声波清洗器KQ-500DE 昆山市超声仪器有限公司;微孔过滤膜0.45 μm 天津津腾。
1.2色谱条件
色谱柱:Accucore C18柱(2.6 μm,4.6 mm×100 mm);柱温:25 ℃;进样量:10 μL;检测波长:283 nm;流动相:甲醇∶水=45∶55;流速:1.0 mL/min。
1.3标准溶液的配制
标准储备溶液:称取新橙皮苷二氢查尔酮约0.05 g(精确至0.0001 g)于小烧杯中,加入甲醇,超声溶解后转移至50 mL容量瓶中,用甲醇定容至刻度,摇匀,配成质量浓度约1000 mg/L的标准储备溶液,于4 ℃保存。
中间标准溶液:移取1000 mg/L的标准储备溶液2.5 mL至50 mL容量瓶中,用甲醇定容至刻度,摇匀,配成质量浓度约为50 mg/L的中间标准溶液,于4 ℃保存。
系列浓度标准溶液:移取中间标准溶液0.1、0.2、1.0、2.0、5.0、10.0 mL分别置于10 mL容量瓶中,用流动相稀释至刻度,摇匀,得到质量浓度为0.5、1、5、10、25、50 mg/L的标准工作溶液,现配现用。
1.4样品处理
蛋白饮料:准确称取5.0 g样品于25 mL比色管中,加入1.0 mol/L乙酸锌溶液和0.25 mol/L亚铁氰化钾溶液(含3%冰乙酸)各1.0 mL,加入提取液,定容至刻度,混匀,5000 r/min离心10 min,取上清液,经微孔过滤膜过滤,滤液上机分析。
非蛋白饮料:准确称取2.0 g样品于25 mL比色管中,加入提取液,定容至刻度,混匀,经微孔过滤膜过滤,滤液上机分析。
固体饮料:准确称取2.0 g样品于25 mL比色管中,加入20 mL提取液,超声提取10 min,定容至刻度,混匀,经微孔过滤膜过滤,滤液上机分析。
2 结果与分析
2.1样品处理条件的优化
2.1.1 提取溶剂的选择 本实验以不同体积份数的甲醇水溶液(0、45%、65%、85%、100%,v/v)作为提取液进行超声提取,比较不同溶剂的提取能力。结果表明以水作为单一溶剂回收率小于80%,效果相对较差。而其余不同浓度的甲醇水溶液作为提取液的回收率均大于90%,能够满足实验要求,但样品溶剂中甲醇浓度过高易出现分叉峰。为了新橙皮苷二氢查耳酮具有良好峰形,同时又不影响回收率,实验选用65%甲醇水溶液作为提取溶剂。
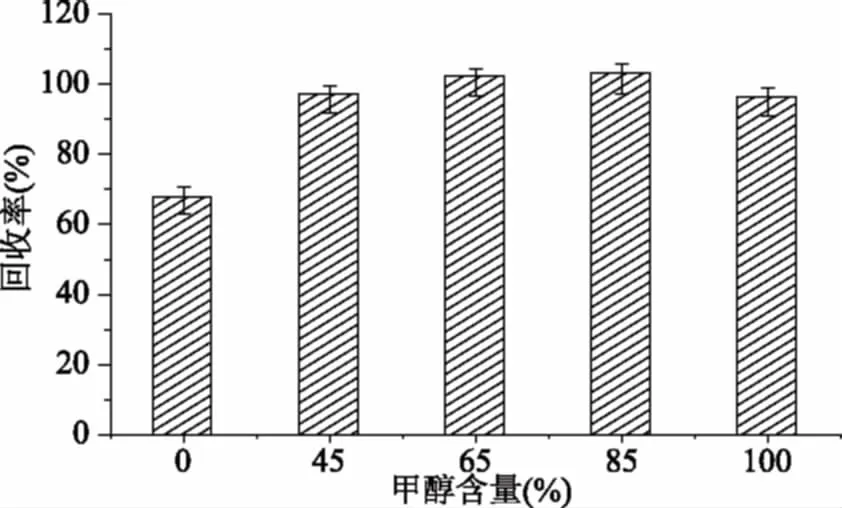
图2 不同溶剂的提取效率Fig.2 Extracting efficiency of different extracting solvents
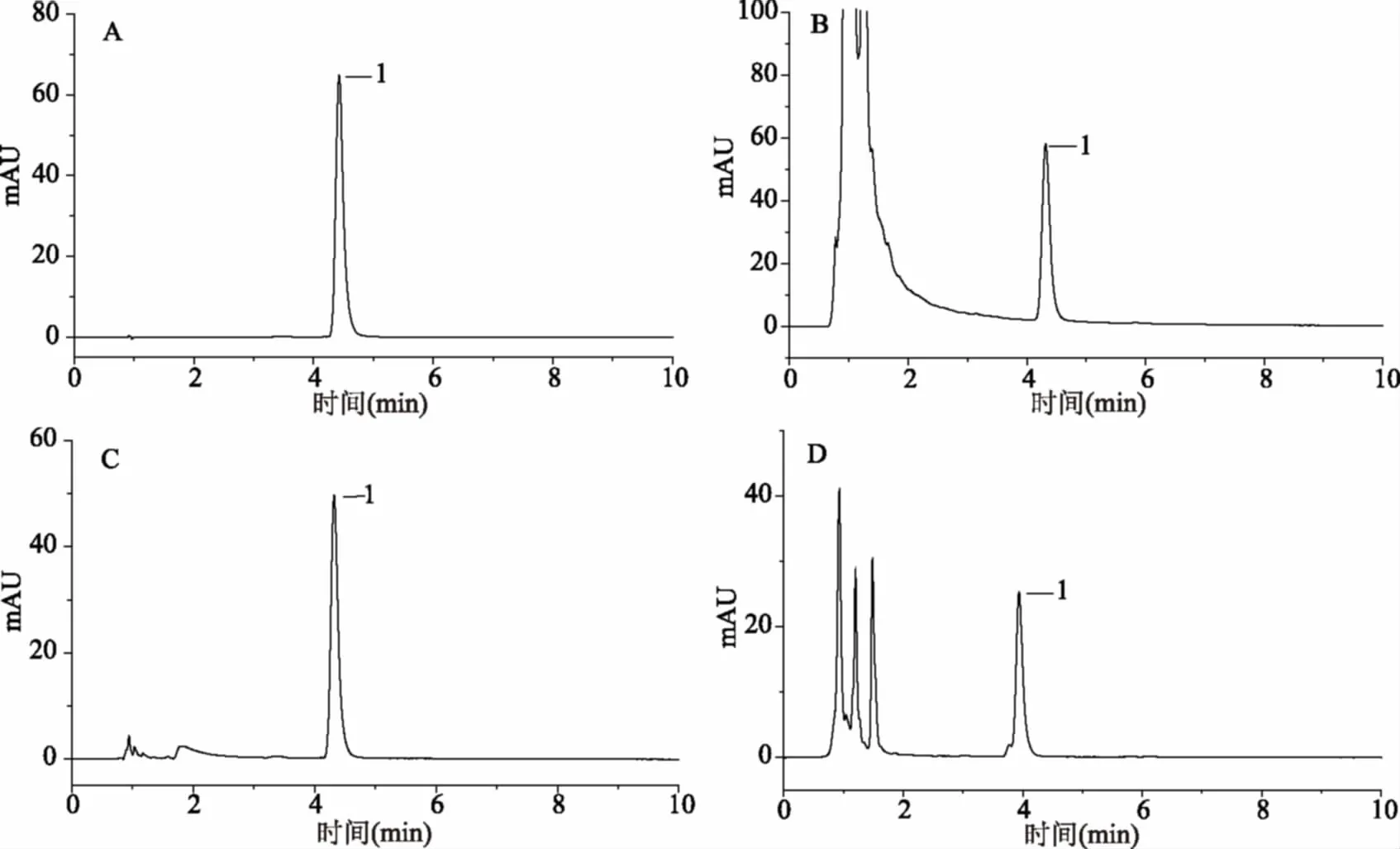
图3 新橙皮苷二氢查耳酮的色谱图Fig.3 Chromatogram of neohesperidin dihydrochalcone注:1.新橙皮苷二氢查耳酮;A.标准品;B.固体饮料加标;C.非蛋白饮料加标;D. 蛋白饮料加标。
2.1.2 沉淀剂的选择 乳饮料中含有大量蛋白质及其他大分子颗粒物,不仅导致基线发生较大波动,同时也会影响色谱柱的分离效果和使用寿命,因此需要快速、高效的沉淀蛋白质。常用沉淀蛋白质的方法有:加酸、加浓盐溶液、加重金属盐、加有机溶剂等,一般以后两者方法应用最为广泛[17-18]。本实验比较了5 g乳饮料样品中加入250 μg新橙皮苷二氢查耳酮,分别用5、10、15 mL不同体积的乙腈沉淀蛋白质,结果表明乙腈用量少,蛋白质沉淀不完全,15 mL乙腈能完全沉淀蛋白,但目标峰受杂质干扰较大。同时本实验也参考了国家标准GB/T 23495-2009联合使用亚铁氰化钾和乙酸锌进行蛋白沉淀,也参考了其它文献,两者的浓度一般约为0.25 mol/L和1.0 mol/L[18-22]。本实验比较了两种沉淀剂的不同使用量(0.5、1、2 mL)对结果的影响,实验表明亚铁氰化钾和乙酸锌分别加入1 mL,沉淀效果明显,回收率也最高。因此本实验最终选择亚铁氰化钾和乙酸锌作为最终蛋白沉淀剂。

表1 NHDC的线性方程、相关系数、线性范围、检出限和定量限Table 1 Linear equations,correlation coefficients,linear ranges,limit of detection and limit of quantification of NHDC
2.2色谱条件的优化
2.2.1 色谱柱的选择 选取了不同型号的5种色谱柱Inertsil ODS-SP,CNW Athena C18-WP,Agilent ZORBAX SB-aq C18,Diamonsil C18和Accucore C18,按相同的色谱条件进行实验。结果显示,新橙皮苷二氢查耳酮在5种不同型号的C18色谱柱上均能得到良好的峰形,Accucore C18峰形更加尖锐,信噪比和灵敏度更高,因此确定Accucore C18为首选的色谱柱。
2.2.2 流动相的选择 本实验考察了甲醇和乙腈两种有机相分别与水(45∶55,v/v)混合作为流动相对新橙皮苷二氢查耳酮出峰的影响,结果表明在两种流动相下均得到了良好的峰形。考虑到甲醇的毒性和成本都比乙腈要小,最终选择甲醇作为有机相。同时也比较了以不同比例(30∶70、45∶55、60∶40,v/v)的甲醇-水作为流动相时,新橙皮苷二氢查耳酮的出峰情况,结合样品中基质的干扰与分析效率,最终选择甲醇-水(45∶55,v/v)作为流动相。
2.2.3 检测波长的选择 对新橙皮苷二氢查耳酮在210~400 nm波长范围内进行扫描,光谱图见图4,发现NHDC在223 nm和283 nm附近有特征吸收。考虑到样品基质可能带来的干扰,同时为了使目标物得到较高的响应值,因此选择283 nm作为最佳的检测波长。
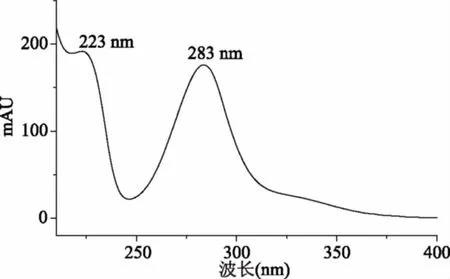
图4 NHDC的光谱图Fig.4 Spectrogram of neohesperidin dihydrochalcone
2.3线性范围、检出限和定量限
将1.3中不同质量浓度的标准溶液按设定的色谱条件进行测定,绘制标准工作曲线。结果表明,在1.0~100 mg/L的质量浓度范围内,目标物的质量浓度X(mg/L)和峰面积Y之间有良好的线性关系,以信噪比(S/N)为3确定检出限(LOD),以信噪比(S/N)为10确定定量限(LOQ),结果见表1。
2.4回收率和精密度
采用在空白样品中添加标准溶液的方法,对蛋白饮料、非蛋白饮料和固体饮料进行添加回收率实验,3个质量浓度添加水平分别为10、40、80 mg/kg,每个浓度水平进行6次重复实验,计算平均回收率和精密度。结果表明新橙皮苷二氢查耳酮的平均回收率在90.2%~103.5%,相对标准偏差RSD为1.96%~7.59%(见表2),说明该方法的准确度与精密度可满足实验要求。
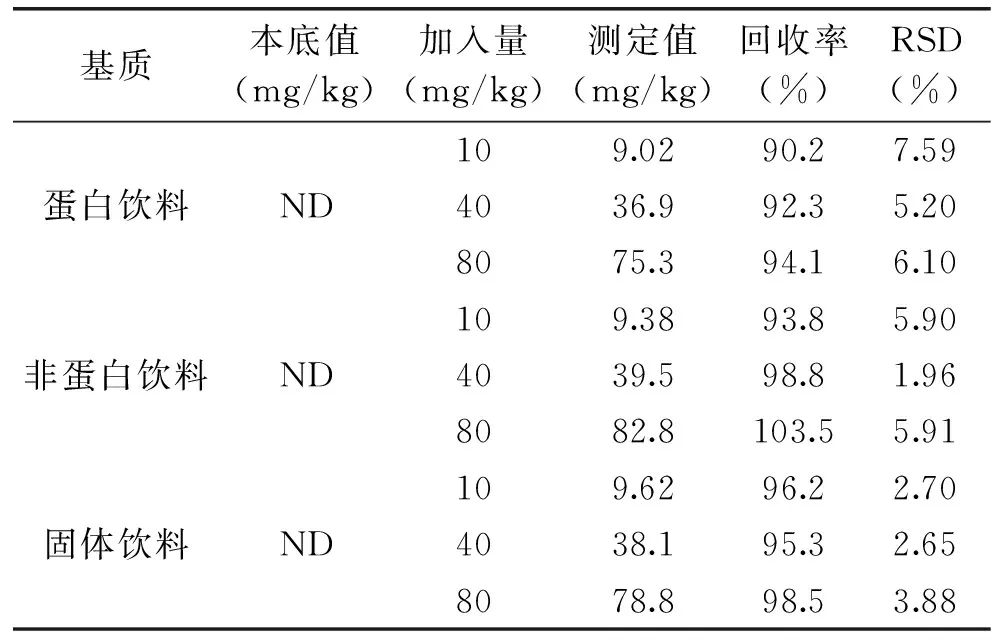
表2 不同饮料中NHDC的加标回收率实验(n=6)Table 2 The spiked recovery tests ofNHDC in beverages(n=6)
注:ND:not detection。
2.5稳定性
取同一样品溶液,分别放置0、2、4、8、16、24 h后,在优化的色谱条件下进行分析。新橙皮苷二氢查耳酮的峰面积RSD为1.52%,表明其提取液在24 h内稳定性良好。
2.6样品的测定
应用所建立的方法对蛋白饮料、非蛋白饮料、固体饮料等18批次的饮料进行检测,其中有1批次样品检出有新橙皮苷二氢查耳酮,含量为46.5 mg/kg,其余均未检出。
3 结论
本研究建立了饮料中新橙皮苷二氢查耳酮的高效液相色谱测定方法,该方法简单快速,准确度高,精密度高。为饮料中新橙皮苷二氢查耳酮的日常分析和质量控制提供了一种稳定、灵敏、选择性好的分析方法,具有较好的实际应用前景。
[1]Varzakas T,Labropoulos A,Anestis S.Sweeteners:nutritional aspects,applications,and productiontechnology[M]. United States:CRC Press,2012.
[2]温辉梁,欧阳振宇,胡晓波,等.新橙皮苷二氢查尔酮的研究进展[J].中国调味品,2008,10(10):70-73.
[3]雷琳,黄宝华,卢宇靖,等.新橙皮苷二氢查耳酮的调味应用及其生理活性研究进展[J].中国调味品,2014,39(12):41-47.
[4]陈良,刘传滨,张 钦,等.新甲基橙皮苷二氢查耳酮的应用研究进展[J].饮料工业,2016,19(1):53-56.
[5]Horowitz R M,Gentill B. Dihydrochalcone derivates and their use as sweetening agents. U.S. Patent 3.087.821[P],1963-04-30[2017-02-08]http://www.freepatentsonline.com/3087821. html.
[6]Benavente-Garcia O,Castillo J,Del Bano M J,et al.Improved water solubility of neohesperidin dihydrochalcone in sweetener blends[J].,2001,49(1):189-191.
[7]中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品添加剂使用标准:GB 2760-2014[S].北京:中国标准出版社,2014.
[8]Perez-Ruiz T,Martinez-Lozano C,Tomas V,et al.Quantitative assay for neohesperidin dihydrochalcone in foodstuffs by capillary electrophoresis[J].Chromatographia,2000,51(7):385-389.
[9]Zygler A,Wasik A,Kot-Wasik A,et al.Determination of nine high-intensity sweeteners in various foods by high performance liquid chromatography with mass spectrometric detection[J]. Analytical and Bioanalytical Chemistry,2011,400(7):2159-2172.
[10]Chang C S,Yeh T S.Detection of 10 sweeteners in various foods by liquid chromatographytandem mass spectrometry[J]. Journal of Food and Drug Analysis,2014,22(3):318-328.
[11]Kubica P,Namiesnik J,Wasik A.Determination of eight artificial sweeteners and common Stevia rebaudiana glycosides in non-alcoholic and alcoholic beverages by reversed-phase liquid chromatography coupled with tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry,2015,407(5):1505-1512.
[12]Zhang W,Jiang S,Qian D W,et al.Determination of Metabolism of Neohesperidin by Human Intestinal Bacteria by UPLC-Q-TOF/MS[J]. Chromatographia,2014,77(5):439-445.
[13]牛之瑞,王秀君,于毅涛,等.液相色谱-质谱联用同时测定白酒中种甜味剂[J].食品科学,2016,37(2):178-181.
[14]阮丽萍,蔡梅,吉文亮,等.高效液相色谱-串联质谱法同时测定调味品中种人工合成甜味剂[J].中国食品卫生杂志,2013,25(4):331-335.
[15]Wasik A,Mccourt J,Buchgraber M.Simultaneous determination of nine intense sweeteners in foodstuffs by high performance liquid chromatography and evaporative light scattering detection-Development and single-laboratory validation[J].Journal of Chromatography A,2007,1157(1):187-196.
[16]徐国波,袁小红,索志荣,等.法检测合成新橙皮苷二氢查尔酮[J].食品研究与开发,2011,31(11):153-155.
[17]王珊,黄胜阳.植物多糖提取液脱蛋白方法的研究[J].食品科技,2012,37(9):188-191.
[18]孙伟,王荣荣,汪清美.测定中添加剂前处理方法的探讨[J].中国乳品工业,2015,43(2):57-59.
[19]国家质量技术监督检验检疫总局.食品中苯甲酸、山梨酸和糖精钠的测定 高效液相色谱法:GB/T 23495-2009[S]. 北京:中国标准出版社,2009.
[20]高琳,陈百莹,张阿惜,等.亚铁氰化钾乙酸锌净化-离子色谱法检测转基因大豆的草甘膦残留[J].农药,2016,55(2):111-114.
[21]商博东,马永民,王栩冬,等.高效液相色谱法测定肉制品中山梨酸钾的样品前处理方法探讨[J].中国卫生检验杂志,2003,13(1):110.
[22]黄志勇,陈艳,冯慧,等.乙酸酐衍生-法测定饮料中三氯蔗糖含量[J].食品科学,2016,37(14):203-206.
Determinationofneohesperidindihydrochalconeinbeveragesbyreversedphasehighperformanceliquidchromatography
ZHANGJian1,2,CAIHan-qing2,YANGJie2,GAIShi-ying1,ZHAOYan3,RANLiang-ji4
(1.Analytical and Metrical Center of Sichuan Province,Chengdu 610023,China;2.Sichuan Sainasi Analysis and Testing Service Co.,Ltd.,Chengdu 610023,China;3.College of Science,Xihua University,Chengdu 610039,China;4.Chengdu Application Lab of Thermo Fisher Scientific,Chengdu 610023,China)
A method of reversed phase high performance liquid chromatography was established for the determination of neohesperidin dihydrochalcone in beverages. The extraction method,precipitant and chromatography conditions were optimized. The separation was performed on an Accucore C18(2.6 μm,4.6 mm×100 mm)with methanol and water(45∶55,v/v)isocratic elution as the mobile phase at a flow rate of 1.0 mL/min and 25 ℃.The detection wavelength was at 283 nm and the sample injection volume was 10 μL. Neohesperidin dihydrochalcone was isolated with satisfactory resolution within 10 min. The concentration of neohesperidin dihydrochalcone in the range of 0.5~50 mg/L was linearly correlated to the peak area,with correlation coefficients higher than 0.999 and detection limit of 0.15 mg/L. The recoveries of neohesperidin dihydrochalcone at three spiked levels(10,40,80 mg/kg)were in the range of 90.2%~103.5% and the relative standard deviations(RSDs)were in the range of 1.96%~7.59%(n=6). The method is specific,sensitive,simple and sui
Table for the determination of neohesperidin dihydrochalcone in beverages.
neohesperidin dihydrochalcone;HPLC;beverage;sweeteners
TS207.3
A
1002-0306(2017)19-0256-05
10.13386/j.issn1002-0306.2017.19.047
2017-03-08
张剑(1984-),男,硕士研究生,工程师,研究方向:食品分析,E-mail:1765113632@qq.com。
四川省科技服务业示范项目(2016GFW0182)。
