一株琼胶降解菌的筛选、鉴定及粗酶学性质
2017-10-19,,,,,,
, , , , , ,
(1.青岛农业大学食品科学与工程学院,山东青岛 266109;2.青岛农业大学生命科学学院,山东青岛 266109;3.君顶酒庄有限公司,山东蓬莱 265600)
一株琼胶降解菌的筛选、鉴定及粗酶学性质
刘兴凯1,3,朱丹2,周薪1,房玲1,郭爽1,郭瑞1,程凡升1
(1.青岛农业大学食品科学与工程学院,山东青岛 266109;2.青岛农业大学生命科学学院,山东青岛 266109;3.君顶酒庄有限公司,山东蓬莱 265600)
本研究通过初筛、复筛从青岛近海沉积物中分离出一株具有琼胶酶活性的菌株,该菌的最佳发酵时间为26 h,对该菌培养基进行卢戈氏碘液染色后菌落周围出现明显透明圈,镜检观察菌株的革兰氏染色结果表明,该菌为革兰氏阴性菌。经过鉴定,该菌株为不动杆菌(Acinetobactersp.),命名为Acinetobactersp. LXK,对该菌的粗酶学特性进行初步研究,结果显示,该酶的最适反应温度为40 ℃,最适底物浓度为0.5%,最适反应体系pH为8.0,K+和Ca2+对酶解反应有促进作用,Fe2+、Mn2+和Ba2+对酶解反应有不同程度的抑制作用。
琼胶酶,海洋细菌,筛选,鉴定
海洋多糖工业的兴起使得海洋多糖及其降解酶受到了广泛的重视。现如今,备受瞩目的琼胶寡糖有着分子量小、水溶性好、易吸收等特点,使其抗病消炎、抗淀粉老化、保湿美白等功效的应用价值大幅提升,已经广泛应用在食品、化妆品和医疗等领域[1]。但是,利用琼胶酶降解琼胶规模性生产琼胶寡糖在世界范围内是个研究的难点,原因就在于缺少工程菌和琼胶酶产生菌的产酶活力低等问题。我国虽然是一个海洋大国,海洋资源雄厚,但生产的多为初级产品,在琼胶及琼寡糖的研发与应用领域尚处于起步阶段。琼胶,也叫琼脂,是从石花菜、江蓠等红藻植物中提取出一类藻胶,由琼脂糖(agarose)和琼脂胶(agaropectin)组成[2]。琼脂糖是由1,3连结的β-D-半乳糖和1,4连结的3,6-内醚-L-半乳糖交替连接起来的长链分子[3];琼脂胶由包含硫酸基、甲基等多种取代基的复杂单糖残基多糖链构成[4]。目前,降解琼胶生产琼寡糖较常用的方法有两种,一个是化学法,另一个是酶解法[5]。化学降解法存在反应条件难以控制、产品分析和产物回收难等弊端[6]。酶解法降解琼胶因特异性强、反应条件温和、降解过程简单易控等优点使其成为生产琼寡糖的主要手段。
从19世纪50年代开始,人们陆续分离出多种琼胶降解菌,包括芽孢杆菌属(Bacillussp.)[7]、盐杆菌属(Salegentibactersp.)[8]、假单孢菌属(Pseudomonassp.)[9]、寡养单胞菌属(Stenotrophomonassp.)[10]、噬琼胶菌属(Agarivoranssp.)[11]、短杆菌属(Brevibacteriumsp.)[12]、弧菌属(Vibriosp.)[13]、黄杆菌属(Flavobacteriumsp.)[14]、假交替单孢菌属(Alteromonassp.)[15]和不动杆菌属(Acinetobactersp.)[16]等,海洋是琼胶酶产生菌生存的大环境,较容易分离出琼胶降解菌,例如,刘丽莉[6]和蔡俊鹏[17]等人分别在海藻中分离出产琼胶酶菌株Vibrioagarivorans. ZGR-26、Aeromonastrota. JK333;郭彦岑[18]等人在海洋沉积物中分离出产琼胶酶菌株Vibriosp.FG2;马悦欣[19]等人在仿刺参消化道内分离出产琼胶酶菌株Pseudoalteromonassp. HF3-04;杜宗军[20]等人和褚艳[21]等人分别在海水中分离出产琼胶酶菌株Alteromonasaddita. QM65、Pseudomonassp. CY-24。但是,由于琼胶酶活性低等问题,目前还没有工业化的菌株。进一步寻找产琼胶酶的菌株是酶法制备琼寡糖的迫切需要。本研究从青岛近海沉积物中分离具有琼胶酶活性的菌株,对其进行鉴定和粗酶学特性的初步研究,以期获得适合工业应用的琼胶酶。
1 材料与方法
1.1材料与仪器
琼脂粉、酵母粉、蛋白胨 北京双旋微生物培养基制品厂;NaCl、MgSO4、KCl 天津市致远化学试剂有限公司;CaCl2、K2HPO4、乙醇 天津市巴斯夫化工有限公司;FeSO4莱阳市康德化工有限公司;沙皇染液、结晶紫染液 北京陆桥技术有限责任公司。
DHP-9.32恒温培养箱 山东龙口市先科仪器公司);QYC-200恒温摇床 上海福玛实验设备有限公司;SW-CJ-2D超净工作台 青岛恒正实验设备有限公司;711111090000移液枪 上海恒奇仪器仪表有限公司;XSP-460.460T显微镜 上海中恒仪器有限公司;Bio-Rad T100 PCR仪 北京伯辉生物科技有限公司;XYOG02高压蒸汽灭菌锅 新华医疗器械有限公司;PB-10pH计 北京力高兴业科技有限公司;WFZ-2100分光光度计 尤尼克上海仪器有限公司,等。
1.2培养基
人工海水(%,w/v):NaCl 2.5,MgSO40.5,KCl 0.1,CaCl20.02,K2HPO40.01,FeSO40.002;牛肉膏蛋白胨培养基(%,w/v):蛋白胨1,牛肉膏0.3,琼脂粉1.5,NaCl 0.5,pH7.2~7.6;初筛培养基:2216 E固体培养基;复筛培养基(%,w/v):琼脂粉0.2,酵母浸出粉0.3,人工海水配制,pH7.2~7.6;斜面培养基:同初筛培养基
1.3菌株的筛选
取样地点是青岛红岛近海海域。取近海沉积物于无菌密封袋中,常温保存。取沉积物样品5 g于45 mL无菌水中,振荡摇匀。将稀释10-1~10-5五个浓度梯度的样液分别涂布在牛肉膏蛋白胨平板培养基中,30 ℃培养1~2 d,挑取透明圈或凹陷较大的菌落点接于初筛平板培养基,并做好标记,在30 ℃下培养1~2 d后用卢戈氏碘液进行染色,挑选透明圈与菌落的直径比值大的菌落,并根据标记挑取原菌落于初筛培养基上进行划线培养1~2 d,挑取单菌落于复筛液体培养基中,30 ℃,150 r/min发酵培养1~2 d,测发酵液的酶活力,筛选出酶活力较高的菌株,并进行斜面和甘油管保藏。
1.4琼胶酶活力测定
于25 mL比色管中加入0.5 mL经4 ℃ 6000 r/min离心10 min的发酵上清液和1.5 mL含0.5%琼脂的磷酸盐缓冲液(pH7.0),置于50 ℃水浴保温15~20 min后取出,加入1.0 mL DNS试剂终止酶解反应,沸水浴显色5 min,冷却后定容至25 mL,充分摇匀后于5000 r/min离心10 min,取适量上清液在520 nm处测吸光值,将酶液煮沸灭活后同此法处理作为对照。根据标准曲线算出上清液中的还原糖含量。酶活力单位定义为在上述条件下,1 min转化生成1 μg还原糖所需酶的量为一个酶活力单位(U/mL)。
1.5菌体生长和产酶曲线的测定
以3%的接种量将种子液接种到发酵培养基,150 r/min,30 ℃摇床发酵培养,每2 h取适量发酵液测生物量及酶活力,绘制生长和产酶曲线。
1.6菌种形态学鉴定
观察菌落在平板上的形态并对其进行卢戈氏[22]染色、革兰氏染色并镜检观察菌体形态等。
1.7系统发育树的构建
CTAB法提取菌株基因组DNA,将收集得到的DNA为模板,引物采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGCTA CCTTGTTACGACTT-3′)。PCR扩增程序为 95 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35 个循环;72 ℃ 10 min。将PCR产物琼脂糖凝胶电泳检测,送至上海生工生物工程有限公司测序。利用 BLAST 程序在GenBank上对结果进行相似性比对,使用 MEGA6.0的 Neighbor-Joining(NJ)方法构建系统发育进化树。
1.8酶学性质研究
最适温度的测定:在20~70 ℃下测定酶活力,其中底物浓度0.5%、反应体系pH7.0;最适pH的测定:在pH4.0~9.0下测定酶活力,其中酶解温度是45 ℃、底物浓度为0.5%;最适底物浓度的测定:在底物浓度0.1%~1.0%下测定酶活力,其中酶解温度45 ℃、反应体系pH7.0;金属离子对酶解反应的影响:将琼胶酶酶液中分别加入Mn2+(MnCl2)、Ca2+(CaCl2)、Ba2+(BaCl2)、Na+(NaCl)、K+(KCl)、Mg2+(MgCl2)、Fe2+(FeCl2)使酶溶液含有5 mmol/L的金属离子,4 ℃放置10 min后测定酶活力。以上实验做三次平行,结果取平均值。
2 结果与分析
2.1菌体生长及产酶曲线
对菌体进行摇瓶发酵,每2 h取少量发酵液测其酶活力和在600 nm处的吸光值,由图1知,发酵前期菌体生长速度较快,在20 h后生物量基本达到平衡,酶活力在24~26 h处达到最大。
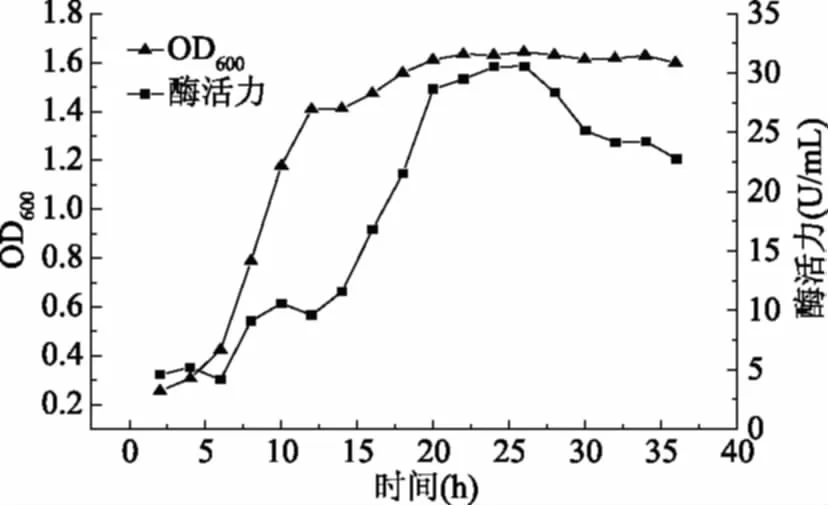
图1 菌株生长及产酶曲线Fig.1 Time courses of growth in seed culture of the strain
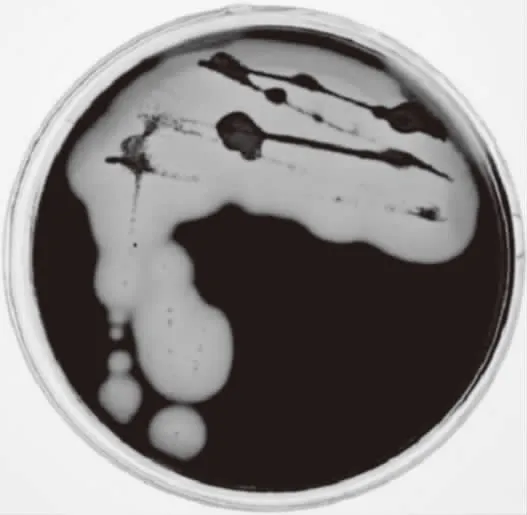
图2 卢戈氏染色结果Fig.2 Bacterial cultures stained with lugol iodine
2.2筛选及形态学鉴定
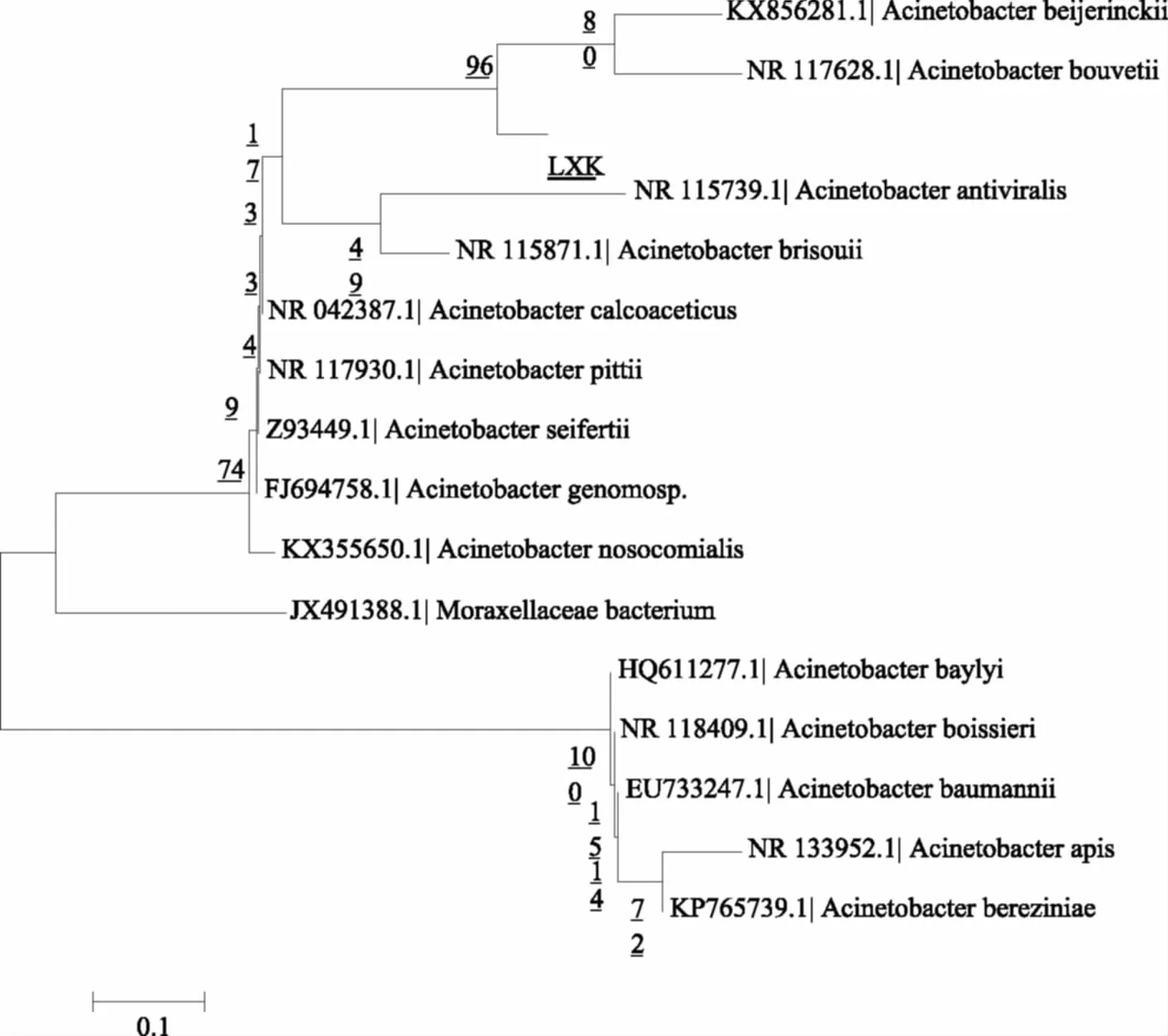
图4 依据16S rDNA序列同源性比较构建的系统发育树Fig.4 Phylogenetic tree of the Acinetobacter sp. strains based on 16S rRNA gene sequence
将该菌在平板上培养24 h后,培养基表面形成明显白色菌落,菌落表面湿滑,边缘平整,中央凹陷。对菌落进行卢戈氏碘液染色,染色结果如图2所示,菌落周围形成明显的透明水解圈,这是由于培养基被降解的部分生成具有还原性的寡糖,不能被卢戈氏碘液染色,而未被降解掉的部分能够被卢戈氏碘液染成深色[10]。对菌落进行革兰氏染色镜检结果如图3所示,菌体被染成红色,表明该菌属革兰氏阴性菌,与已报道的绝大多数产琼胶酶菌株属革兰氏阴性菌[23-24]结果相符。

图3 革兰氏染色镜检结果Fig.3 Microscopic bacterial gram stain
2.3系统发育树的构建
用MEGA6.0软件,根据16S rDNA序列相似性,将该菌与NCBI数据库中相应的细菌一起构建系统发育树,由系统发育树可知,该序列与Acinetobacterbeijerinckii(Genbank Accession No.KX856281.1)和Acinetobacterbouvetii(Genbank Accession No. NR117628.1)等菌属相似性高达99%,能够证明菌LXK为不动杆菌(Acinetobactersp.)。目前,不动杆菌产琼胶酶的研究报道较少,仅Lakshmikanth[16]等人和陈虹[25]等人从土壤中筛选出能够产琼胶酶的不动杆菌,从海洋环境中分离出产琼胶酶的不动杆菌未见报道。
2.4酶解反应最适温度的确定
将酶反应体系分别置于20、30、40、50、60和70 ℃的水浴中反应,测定各温度下琼胶酶活力,结果见图5。从图5中可以看出,最适酶解温度为40 ℃,温度过高和过低都不利于酶解,这与来自不动杆菌AG LSL-1[16]、紫色杆菌SY12[26]、弧菌JMUAZ6[27]的琼胶酶的最适酶解温度相同。由于琼胶具有凝固性,当温度较低时底物发生凝固,粗酶液与底物的接触面积减少,酶解效率降低;温度过高时,酶受热失活,同样影响酶解效率。
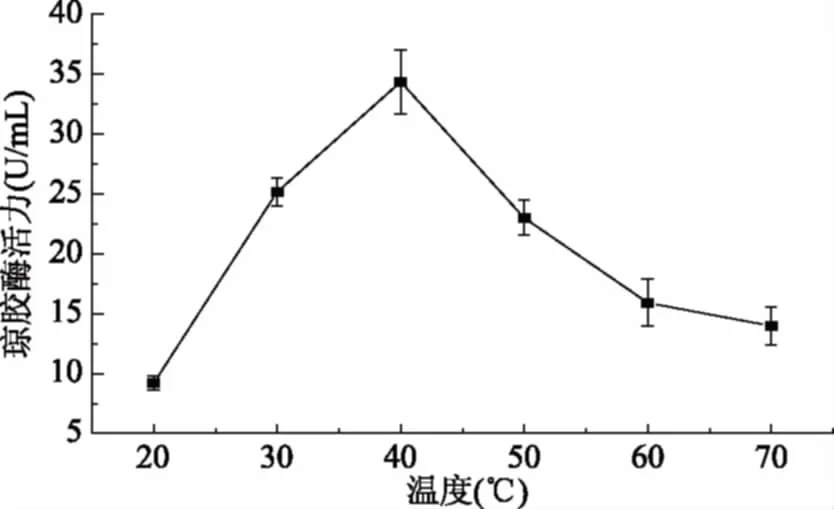
图5 温度对琼胶酶活性的影响Fig.5 Effect of temperature on the agarase activity
2.5酶解反应最适底物浓度的确定
选取0.1%~1.0%的浓度梯度研究琼脂粉浓度对琼胶酶活力的影响,实验结果见图6。从图6中可以看出,随着底物浓度的增大,琼胶酶活力随之增大,在底物浓度为0.5%时琼胶酶活力达到最大值,继续增大底物浓度,琼胶酶活力逐渐下降,原因是底物浓度过大,降低了分子的扩散性,降低酶解反应效率。因此,酶的最适底物浓度为0.5%。
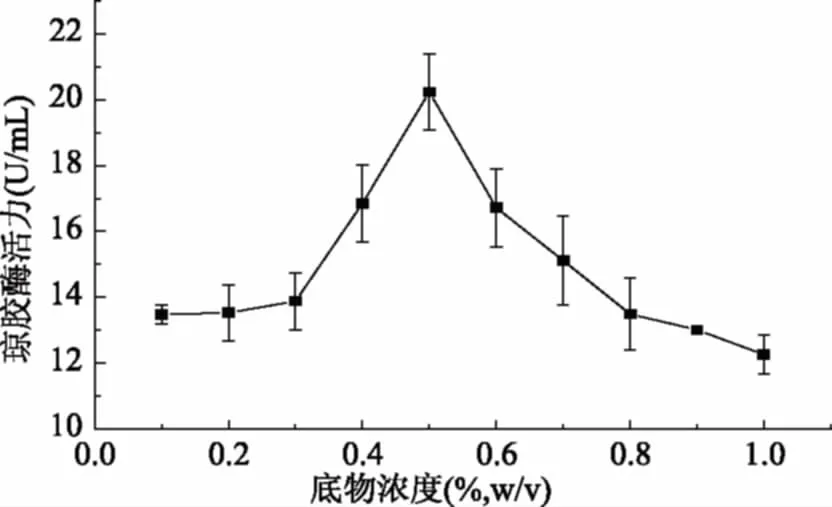
图6 底物浓度对琼胶酶活力的影响Fig.6 Effects of substrate concentration on the agarase activity
2.6酶解反应体系最适pH的确定
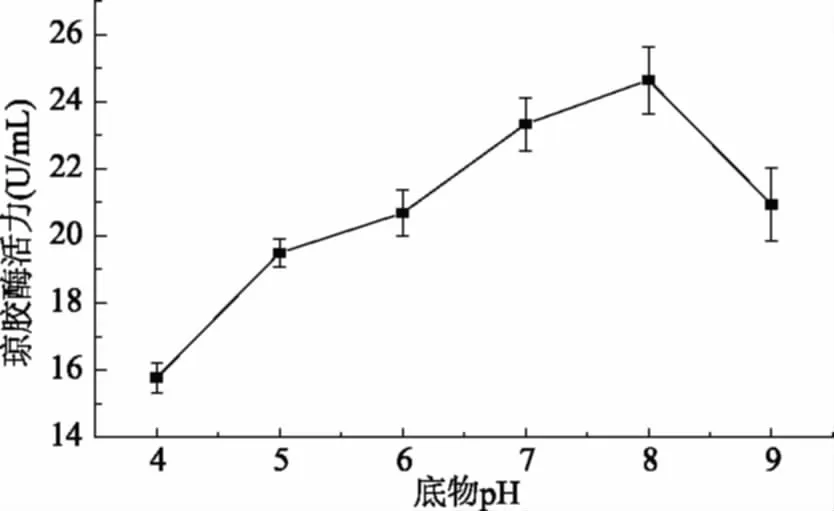
图7 酶解反应体系pH对琼胶酶活力的影响Fig.7 Effects of pH on the agarase activity
反应体系pH可以影响酶的结构和稳定性,同时底物和酶的解离状态也受pH的影响[26]。为探究反应体系pH对琼胶酶活力的影响,选取pH4.0~9.0六个pH梯度进行酶解实验,结果见图7。由图7可知,琼胶酶活力随着体系pH的增大呈现先增大后减小趋势,在pH8.0附近达到最大值,继续增大pH,琼胶酶活力反而下降,可能是强碱性环境导致酶蛋白变性从而使琼胶酶失活[28]。
2.7金属离子对酶解反应的影响
选取7种金属离子研究它们对酶解反应的影响,结果见图8。从图中可以看出,K+和Ca2+能促进酶解反应,Na+和Mg2+对酶解反应的影响较小,而Fe2+、Mn+和Ba2+对酶解反应起抑制作用,此结果与琼胶酶降解菌Agarivoranssp. LQ48[11]、Vibriosp. JMUAZ5[29]研究结果相似。
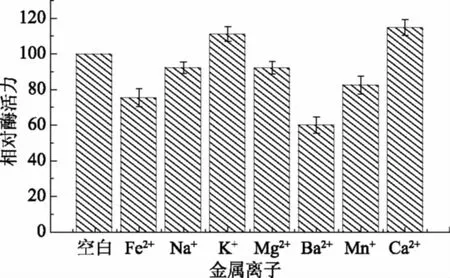
图8 金属离子对酶解反应的影响Fig.8 Effects of metal ion on enzymatic hydrolysis
3 结论
本研究通过大量筛选工作,从海洋环境分离得到一株具有琼胶酶活性的细菌,通过镜检发现该菌为革兰氏阴性菌,并通过16Sr RNA基因序列的测定,确定该菌为不动杆菌,是首次从海洋环境中分离出的能够产琼胶酶的不动杆菌,并命名为不动杆菌Acinetobactersp. LXK。对该菌的粗酶学特性进行了初步研究,结果表明,最适酶解温度为40 ℃,酶解最适底物浓度在0.5%,酶解反应体系最适pH在8.0,K+和Ca2+能促进酶解反应,Na+和Mg2+对酶解反应的影响较小,而Fe2+、Mn+和Ba2+对酶解反应起抑制作用。本研究的开展为海洋多糖的深入研究和琼胶寡糖的规模化生产起到了极大的促进作用。
[1]Fu X T,Kim S M. Agarase:Review of Major Sources,Categories,Purification Method,Enzyme Characteristics and Applications[J]. Marine Drugs,2010,8(1):200-218.
[2]欧昌荣,汤海青,管斌. 琼胶酶生产菌的筛选、鉴定及其酶学性质的初步研究[J]. 食品科学,2005(6):86-90.
[3]Temuujin U,Chi W J,Chang Y K,et al. Identification and Biochemical Characterization of Sco3487 from Streptomyces coelicolor A3(2),an Exo-and Endo-Type-Agarase-Producing Neoagarobiose[J]. Journal of Bacteriology,2011,194(1):142-149.
[4]王祥红,贾仁洁,张超,等. 产琼胶酶海洋细菌的分离、鉴定及其分解琼胶实验[J]. 生物学通报,2011,46(5):50-51.
[5]梅建凤,李莎,茅鹤婷,等. 一株产琼胶酶海洋细菌的分离与鉴定[J]. 海洋科学,2014(2):71-75.
[6]刘丽莉,祖国仁. 新型产琼胶酶海洋细菌的筛选和鉴定[J]. 湖北农业科学,2014,53(20):4831-4834.
[7]Fu X T,Lin H,Kim S M. Purification and characterization of a novelβ-agarase,AgaA34,fromAgarivoransalbusYKW-34[J]. Applied Microbiology and Biotechnology,2008,78(2):265-273.
[8]Mehdi H,Giti E. Investigation of alkane biodegradation using the microtiter plate method and correlation between biofilm formation,biosurfactant production and crude oil biodegradation[J]. International Biodeterioration & Biodegradation,2008,62(2):170-178.
[9]Chi W,Park D Y,Seo Y B,et al. Cloning,expression,and biochemical characterization of a novel GH16β-agarase AgaG1 from Alteromonas sp. GNUM-1[J]. Applied Microbiology and Biotechnology,2014,98(10):4545-4555.
[10]马芮萍,朱艳冰,倪辉,等. 一株产琼胶酶细菌的分离、鉴定及其琼胶酶基本性质[J]. 微生物学报,2014,54(5):543-551.
[11]Long M,Yu Z,Xu X. A Novelβ-Agarase with High pH Stability from MarineAgarivoranssp. LQ48[J]. Marine Biotechnology,2010,12(1):62-69.
[12]徐丽,刘江涛,蔡俊鹏. 一株琼胶酶高产菌株的筛选鉴定及产酶条件的优化[J]. 现代食品科技,2006,22(4):19-22.
[13]Liu N,Mao X,Yang M,et al. Gene cloning,expression and characterisation of a newβ-agarase,AgWH50C,producing neoagarobiose fromAgarivoransgilvusWH0801[J]. World Journal of Microbiology and Biotechnology,2014,30(6):1691-1698.
[14]卢斌,柯才焕,杨明,等. 一株高产琼胶酶菌株MA-B22的分子鉴定与产酶条件优化[J]. 水产学报,2009,33(6):1037-1043.
[15]Oh C,Nikapitiya C,Lee Y,et al. Cloning,purification and biochemical characterization of beta agarase from the marine bacterium Pseudoalteromonas sp. AG4[J]. Journal of Industrial Microbiology & Biotechnology,2010,37(5):483-494.
[16]Lakshmikanth M,Manohar S,Souche Y,et al. Extracellularβ-agarase LSL-1 producing neoagarobiose from a newly isolated agar-liquefying soil bacterium,Acinetobacter sp.,AG LSL-1[J]. World Journal of Microbiology and Biotechnology,2006,22(10):1087-1094.
[17]蔡俊鹏,刘江涛. 产琼胶酶菌株的筛选及其胞内外酶活的测定[J]. 天然产物研究与开发,2005,17(6):730-732.
[18]郭彦岑,尹群健,卓书辉,等. 琼胶酶高产细菌的分离及鉴定[J]. 西北师范大学学报:自然科学版,2012,48(6):76-81.
[19]马悦欣,安军,刘双连,等. 仿刺参消化道内产琼胶酶菌株的选育及培养条件优化[J]. 大连水产学院学报,2007,22(2):86-91.
[20]杜宗军,赵苑,李美菊,等. 青岛近海琼胶降解细菌的筛选和多样性分析[J]. 中国海洋大学学报:自然科学版,2007(2):277-282.
[21]褚艳,于文功,韩峰. 琼胶酶高产海洋假单胞菌CY24的筛选及培养条件优化[J]. 中国海洋药物,2003(5):1-4.
[22]牟宗娟,李贵阳,茅云翔,等. 4株琼胶降解菌的分离、鉴定及产酶条件分析[J]. 海洋科学,2013(4):13-20.
[23]刘振华,周晨妍,王燕,等. 一株产琼胶酶细菌的鉴定和发酵条件优化[J]. 基因组学与应用生物学,2016(4):892-900.
[24]杜宗军,王鹏,李筠,等. 两株琼胶酶高产细菌的筛选和鉴定[J]. 海洋科学,2002,26(3):1-4.
[25]陈虹,张建芬,柯薇. 一株琼胶酶产生菌的分离及产酶培养基优化[J]. 食品科技,2014(4):10-14.
[26]时岩玲,于文功,路新枝. 海洋紫色杆菌β-琼胶酶的分离纯化及性质[J]. 武汉大学学报:理学版,2008,54(4):497-502.
[27]肖琼,肖安风,姚德恒,等. 琼胶酶水解工艺条件的优化及产物分析[J]. 中国食品学报,2015,15(12):99-106.
[28]张千,曾润颖. 厦门沿岸海域杂色鲍中产琼胶酶菌株的筛选及其酶学性质的研究[J]. 台湾海峡,2011,30(2):216-222.
[29]赵蕊,倪辉,洪清林,等. 海洋细菌JMUAZ5琼胶酶的酶学性质及酶解产物的抗氧化活性[J]. 中国食品学报,2016,16(1):61-68.
一套《食品工业科技》在手,纵观食品工业发展全貌
Isolation,identificationandenzymologypropertiesofanagarase-producingstrain
LIUXing-kai1,3,ZHUDan2,ZHOUXin1,FANGLing1,GUOShuang1,GUORui1,CHENGFan-sheng1
(1.College of Food Science and Engineering,Qingdao Agricultural University,Qingdao 266109,China;2.College of Life Science,Qingdao Agricultural University,Qingdao 266109,China;3.Chateau Junding,Penglai 265600,China)
An agar-decomposing strain was isolated from Qingdao offshore deposits. The optimal fermentation time was 26 h,transparent zones appeared after staining with lugol’s iodine. The bacteria was gram-negative and classified in the genusAcinetobacter,named asAcinetobactersp. LXK. By studying the primary properties of agarase and study showed that:the optimal pH and temperature for enzymolysis were pH8.0 and 40 ℃ respectively,the optimum concentration of substrate was 0.5%,the enzyme was activate by K+,Ca2+and inhabited by Fe2+,Mn2+,Ba2+.
agarase;marine bacteria;screening;identification
TS201.3
A
1002-0306(2017)19-0100-05
10.13386/j.issn1002-0306.2017.19.019
2017-02-21
刘兴凯(1994-),男,本科,研究方向:食品生物技术,E-mail:1176738058@qq.com。
国家自然科学基金项目(31301438,31501331);山东省优秀中青年科学家奖励基金(BS2013SW034);校高层次人才启动基金(1113321);青岛农业大学应用型人才培养特色名校建设工程大学生科技创新项目。
