无瓣海桑果实乙醇提取物及其不同极性萃取物抗氧化活性
2017-10-19,,,,,
,,, ,,
(1.暨南大学中药学博士后流动站,广东广州 510632;2.广西药用植物研究所,中药学博士后工作站,广西南宁 530023;3.广西中医药大学药学院,广西南宁 530001;4.广西科学院广西海洋天然产物与组合生物合成化学重点实验室培育基,广西南宁 530007;5.广西大学轻工与食品工程学院,广西南宁 530004)
无瓣海桑果实乙醇提取物及其不同极性萃取物抗氧化活性
易湘茜1,2,3,李家怡4,5,高程海4,张卿5,周文红5,邓家刚2,3,*
(1.暨南大学中药学博士后流动站,广东广州 510632;2.广西药用植物研究所,中药学博士后工作站,广西南宁 530023;3.广西中医药大学药学院,广西南宁 530001;4.广西科学院广西海洋天然产物与组合生物合成化学重点实验室培育基,广西南宁 530007;5.广西大学轻工与食品工程学院,广西南宁 530004)
研究了无瓣海桑果实乙醇提取物及其不同极性萃取物的抗氧化活性。无瓣海桑果实采用95%乙醇浸提后经减压浓缩得到乙醇提取物,然后依次采用乙酸乙酯、正丁醇等有机溶剂进行萃取并收集剩余液体得到乙酸乙酯相萃取物、正丁醇相萃取物、水相残留物。在超氧阴离子自由基、DPPH自由基、ABTS+自由基清除能力和还原能力的抗氧化活性测试体系中,无瓣海桑果实乙醇提物及不同极性萃取物均具有一定的抗氧化活性,并且呈明显的量效关系。乙醇提取物在DPPH自由基清除和还原能力测定中表现出较好的抗氧化活性。乙酸乙酯相萃取物在4种测定体系中均表现出很好的抗氧化活性,且其DPPH自由基清除活性(IC50=1.69 μg·mL-1)明显强于阳性对照VE(IC50=6.06 μg·mL-1),超氧阴离子自由基清除活力(IC50=0.35 mg·mL-1)与阳性对照VC(IC50=0.30 mg·mL-1)相近。
无瓣海桑果实,超氧阴离子自由基,DPPH自由基,ABTS+自由基,还原能力,抗氧化活性
无瓣海桑(Sonneratiaapetala)为真红树植物,原产于孟加拉国,在我国海南岛、广西、广东、福建和台湾均有引种[1]。无瓣海桑果实呈球形或椭圆形,成熟果实在印度、孟加拉国用于酿酒[2]。无瓣海桑在广西主要分布在茅尾海滩涂,面积约1万亩,年产果实1~5万公斤。由于加工利用研究缺乏,大量成熟果实被直接遗弃在滩涂上,造成了资源浪费和环境污染。研究表明,无瓣海桑果实营养丰富,富含总酚、氨基酸、粗纤维、可溶性缩合单宁等[3-4]。Patra J K和Hossain S J等研究进一步表明,无瓣海桑果实还富含黄酮类、多酚类、花青素和维生素C,它们大多具有抗氧化功能,有作为天然抗氧化剂资源开发的利用价值[5-6]。目前使用的抗氧化剂有TBHQ、BHT和BHA等均为人工合成抗氧化剂,其能有效阻断自由基参与的不良反应,但是其对机体存在潜在的毒副作用[7]。因此,从植物中寻找高效安全的天然抗氧化剂日益成为研究热点。本研究以无瓣海桑果实乙醇提取物及不同极性萃取物为研究对象,测定比较其对超氧阴离子自由基、DPPH自由基、ABTS+自由基的清除能力和还原能力,为无瓣海桑果实的抗氧化领域开发应用提供参考依据。
1 材料与方法
1.1材料与仪器
新鲜无瓣海桑果实 采自广西茅尾海自治区级红树林自然保护区,经广西北部湾海洋研究中心许铭本工程师鉴别为海桑科海桑属无瓣海桑(Sonneratiaapetala)果实;DPPH(1,1-二苯基-2-三硝基苯肼) 梯希爱(上海)化成工业发展有限公司;焦性没食子酸(邻苯三酚) Solarbio公司;ABTS+(2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸) Solarbio公司;生育酚 Sigma公司;其他试剂 国产分析纯。
Cary 100紫外分光光度计 美国瓦里安公司;XS105电子天平 梅特勒-托利多仪器有限公司;HH-S6数显恒温水浴锅 金坛市医疗仪器厂;N1100-VW旋转蒸发仪 日本东京理化株式会社;Alpha 1-4冷冻干燥机 德国Christ公司。
1.2实验方法
1.2.1 无瓣海桑果实乙醇提取物及其不同极性萃取物样品制备 将采集到的新鲜无瓣海桑果实切碎,浸泡于95%乙醇中,提取3次,每次7 d,真空浓缩得到乙醇提取物(EE)。将部分乙醇提取物依次用乙酸乙酯和正丁醇等有机溶剂进行萃取,萃取液真空浓缩后分别得到乙酸乙酯相萃取物、正丁醇相萃取物以及水相残留物。采用真空冷冻干燥得到乙醇提取物样品(EE)、乙酸乙酯相萃取物样品(EAE)、正丁醇相萃取物样品(BE)和水相萃取物样品(WE)。将乙醇提取物和不同极性极性萃取部位分别用无水乙醇溶解成不同浓度梯度溶液,-4 ℃封口冷藏备用。
1.2.2 无瓣海桑果实乙醇提取物及其不同极性萃取物抗氧化性能测定
1.2.2.1 超氧阴离子自由基清除作用的测定 参照邻苯三酚自氧化法[8],并有所改动。向比色管中加入1 mol·L-1的Tris-HCl缓冲溶液(pH7.5)5 mL,于20 ℃水浴中保温20 min,分别加入0.5 mL不同浓度的无瓣海桑果实乙醇提取物或不同极性萃取部位溶液和3 mmol·L-1的邻苯三酚0.1 mL后混匀,于25 ℃水浴中反应3 min,在320 nm处测定吸光度,每30 s测定1组数据。测定邻苯三酚自氧化的吸光度并计算氧化速率(ΔA0/Δt),测定添加测试样品后与邻苯三酚反应体系的吸光度并计算氧化速率(ΔAi/Δt),并以同等浓度的VC为阳性对照,计算各测试样品对超氧阴离子自由基清除率[9]:
超氧阴离子自由基清除率(%)=(ΔA0/Δt-ΔAi/Δt)/(ΔA0/Δt)×100
式中:ΔA0/Δt表示邻苯三酚自氧化反应速率,ΔAi/Δt表示加入待测样品后邻苯三酚自氧化反应速率。
1.2.2.2 DPPH自由基清除作用的测定 精密称取16.0 mg DPPH固体,用无水乙醇溶解并定容至200 mL棕色容量瓶中,得浓度为0.2 mmol·L-1的DPPH储备液,避光保存,备用。取DPPH储备液,将其浓度分别稀释为0.02、0.04、0.06、0.08、0.10、0.12 mmol·L-1,于516 nm波长测定其吸光度,以吸光度为纵坐标(Y)对浓度(X)作线性拟合,得到标准曲线:Y=9.0459X+0.0509,R2=0.9993。最佳试剂浓度范围为0.02~0.12 mmol·L-1。
取不同浓度无瓣海桑果实乙醇提取物和不同极性萃取物的样品溶液2.0 mL置小试管中,加入2.0 mL 0.10 mmol·L-1的DPPH溶液,充分混合后室温避光反应30 min,于516 nm波长处测定吸光度A,同时测定2.0 mL无水乙醇和2.0 mL DPPH混合溶液的吸光度为A1,测定2.0 mL样品溶液和2.0 mL无水乙醇的混合液吸光度A0,并以同浓度的VE为阳性对照。按照下式计算清除率,清除率越大,表示抗氧化能力越强。
DPPH自由基清除率(%)=[1-(A-A0)/A1]×100
1.2.2.3 ABTS+自由基清除作用的测定 20 mL的7 mmol·L-1ABTS和352 μL的140 nmol·L-1过硫酸钾混合,室温暗处放置12~16 h,配制成ABTS+·测定溶液。使用前将ABTS+贮备液用无水乙醇稀释,至734 nm 处测其吸光度值为0.70±0. 02时使用[10]。
于比色管中依次加入不同浓度无瓣海桑果实乙醇提取物和不同极性萃取物样品0.5 mL及ABTS+·工作液5.0 mL,以去离子水作为空白对照,6 min室温避光反应后于734 nm处测定吸光值A1,测定样品的吸光值为A2,ABTS+·溶液的吸光值为A0,以VC为阳性对照。
按照下式计算各个组的清除率:
ABTS+·清除率(%)=[1-(A1-A2)/A0]× 100
1.2.2.4 还原能力的测定 参照普鲁士蓝法[11]。将2.0 mL不同浓度的无瓣海桑果实乙醇提取物和不同极性萃取物样品与5.0 mL的0.2 mol·L-1磷酸缓冲溶液(pH6.6)、5.0 mL的1%铁氰化钾溶液混匀,40 ℃条件下水浴30 min,再加入10%三氯乙酸溶液5 mL,混匀后在4000 r·min-1离心20 min,取上清液10 mL与同体积去离子水混合,再加入1%三氯化铁溶液2 mL,在740 nm处测定吸光度。
2 结果与讨论
2.1无瓣海桑果实乙醇提取物和不同极性萃取物对超氧阴离子自由基的清除作用
超氧阴离子自由基是机体内寿命最长的自由基,通常是自由基链式反应的诱发剂,会产生活性更强的自由基。无瓣海桑果实的乙醇提取物及其不同极性部位在体外清除邻苯三酚自氧化产生的超氧阴离子能力,结果见图1所示。
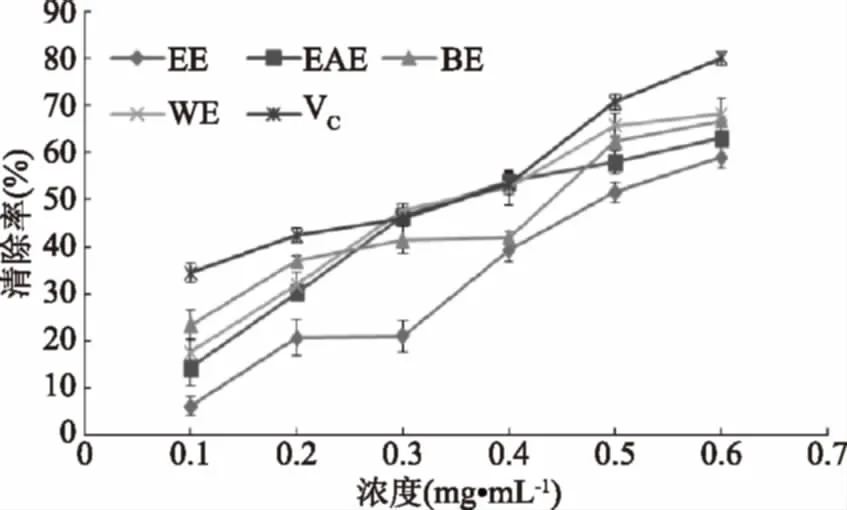
图1 无瓣海桑果实的乙醇提取物及不同极性萃取物对超氧阴离子自由基的清除作用Fig.1 Superoxide anion radical scavenging ablity of alcoholextracts and three polarity extractants of S. apetala fruits
由图1可知,无瓣海桑果实乙醇提取物及3个极性萃取物均具有清除超氧阴离子自由基的能力。随着浓度的增加,各个测试样品对超氧阴离子自由基的清除作用逐渐增强,并且呈现一定的剂量对应关系。IC50值大小依次为维生素C(0.30 mg·mL-1)<水相残留物(0.34 mg·mL-1)<乙酸乙酯相萃取物(0.35 mg·mL-1)<正丁醇相萃取物(0.43 mg·mL-1)<乙醇提取物(0.49 mg·mL-1)。
2.2无瓣海桑果实乙醇提取物和不同极性萃取物对DPPH自由基的清除作用
当向DPPH自由基溶液中加入自由基清除剂,孤对电子被配对,深紫色的DPPH自由基被还原成黄色DPPH-H非自由基形式,其褪色程度与所接受的电子数量成定量关系,因而可以通过吸光度的变化进行定量分析测试样品对DPPH自由基的清除能力。
由图2可知,无瓣海桑果实的乙醇提取物及不同极性部位均具有较强的DPPH自由基清除能力,总体趋势是随着样品浓度的增加而增大,表明清除自由基能力与浓度呈明显的量效关系。乙酸乙酯相萃取物活性最强,在浓度为2.5 μg·mL-1时,其清除率便可达到60.38%(IC50=1.69 μg·mL-1),优于阳性对照VE。对比各个样品DPPH清除率的IC50发现,无瓣海桑果实的乙醇提物及不同极性萃取物清除DPPH自由基的IC50均小于阳性对照VE(IC50=6.06 μg·mL-1)。无瓣海桑果实中含有较多清除DPPH自由基的物质,乙酸乙酯萃取相是主要清除DPPH自由基的活性部位。
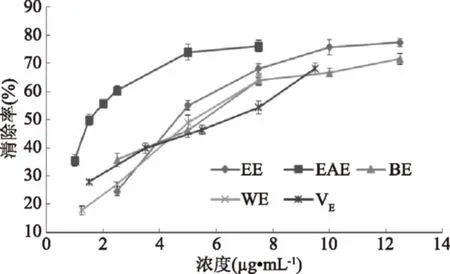
图2 无瓣海桑果实的乙醇提取物及不同极性部位对DPPH自由基的清除作用Fig.2 DPPH scavenging rate of alcohol extractsand different polarity extractants of S. apetala fruits
2.3无瓣海桑果实乙醇提取物和不同极性萃取物对ABTS+自由基的清除作用
ABTS是一种人工合成的水溶性的显色剂,但可被活性氧或自由基氧化,生成稳定的蓝绿色阳离子自由基ABTS+,在734 nm处有最大吸收,当加入自由基清除剂时,溶液颜色变浅,最大吸收波长处的吸收减弱。因此,可以通过测定受试物与ABTS+反应使ABTS+颜色变浅程度,反映该物质清除自由基的能力[12]。
由图3可知,无瓣海桑果实的乙醇提取物及不同极性部位均对ABTS+有清除作用,随着浓度的加大,清除能力增强。清除能力大小顺序为乙酸乙酯相>水相>乙醇提取物>正丁醇相。比较各测试样品的IC50值发现,乙酸乙酯萃取相的IC50值最小为8.13 μg·mL-1,其清除ABTS+自由基能力最强,优于阳性对照维生素C(IC50=11.00 μg·mL-1)。
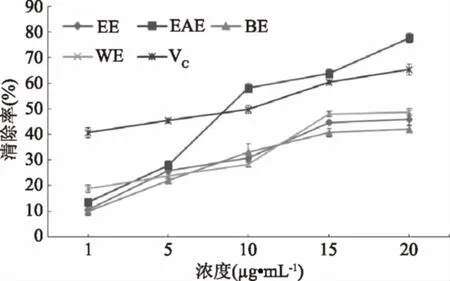
图3 无瓣海桑果实的乙醇提取物及不同极性部位对ABTS+自由基的清除作用Fig.3 ABTS+·scavenging rate of alcohol extractsand different polarity extractants of S.apetala fruits
2.4无瓣海桑果实乙醇提取物和不同极性萃取物的还原能力
当反应体系中存在还原性物质时,铁氰化钾被还原成亚铁氰化钾,亚铁氰化钾在酸性条件下与三氯化铁反应,生成普鲁士蓝,在700 nm处有最大吸收峰。故吸光值越大,反映样品还原能力越强。由图4可知,无瓣海桑果实的乙醇提取物及不同极性部位均具有一定的还原能力。在所有的测试样品中,乙酸乙酯萃取相展现出最强的还原能力,且在测定范围内,随着质量浓度的增加,还原能力逐渐增强,还原能力大小为乙酸乙酯萃取相>乙醇提取物>正丁醇萃取相>水相残留物。
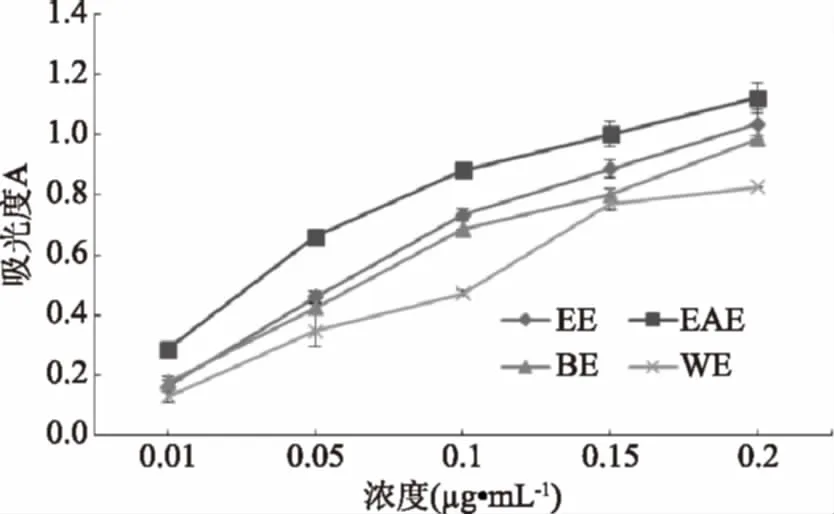
图4 无瓣海桑果实的乙醇提取物及不同极性部位的还原能力Fig.4 Reduction abilities of alcohol extractsand different polarity extractants of S. apetala fruits
3 结论与讨论
对无瓣海桑果实使用95%的乙醇浸泡得到粗提物,依次用乙酸乙酯、正丁醇溶液对粗提物进行萃取,获得不同极性部位样品,通过体外对超氧阴离子自由基清除、DPPH自由基清除、ABTS+自由基清除和还原能力4种方法测定,评价了各个提取物的抗氧化活性。研究表明乙醇提取物及其三种不同极性部位均具有一定的抗氧化活性,并且呈明显的量效关系。在4种抗氧化活性研究中,我们发现不同提取物抗氧化能力排序不完全一致,可能是由于不同极性部位中含有的主要抗氧化成分种类和构效关系不同,以及不同抗氧化活性的作用机理不同导致[13]。在对DPPH自由基、ABTS+自由基清除和还原能力测试中,乙酸乙酯萃取相均表现出较强的清除作用和还原能力,其DPPH自由基清除能力优于阳性对照VE,ABTS+自由基清除能力优于阳性对照VC,表明乙酸乙酯萃取相是无瓣海桑果实抗氧化的主要活性部位。钟雪莲等对瑶山梭罗果实不同提取部位的抗氧化活性研究中发现乙酸乙酯萃取相具有较高的体外抗氧化能力,乙酸乙酯萃取相的抗氧化活性是正丁醇萃取相的1.4倍[14],郑朋朋对拐枣不同提取物的体外抗氧化作用研究中发现,拐枣乙酸乙酯萃取相的抗氧化能力最强,在浓度为200 μg·mL-1时对ABTS+自由基清除率最高达到98.57%[15]。由于无瓣海桑果实乙醇提取物及其不同极性部位中含有化学结构成具有明显的多样性,因此,有必要对活性物质分离纯化及其构效关系进一步研究。
[1]王瑞江,陈忠毅.海桑科的系统进化及地理分布[J].广西植物,2002,22(3):214-219.
[2]覃媚.红树无瓣海桑果实中化学成分及其抗氧化活性研究[D].广西大学,2015.
[3]林海生,宋文东.无瓣海桑叶子和果实中氨基酸成分的检测分析[J].氨基酸和生物资源,2009,31(2):76-78.
[4]林海生,宋文东,吴婕,等.无瓣海桑叶子和果实中脂肪酸成分的检测分析[J].福建分析测试,2009,18(3):5-9.
[5]Patra JK,Das SK,ThatoiH. Phytochemical profiling and bioactivity of a mangrove plant,Sonneratiaapetala,from Odisha Coast of India[J].Chinese Journal of Integrative Medicine,2015,21(4):274-285.
[6]Hossain SJ,Basar MH,Rokeya B,et al. Evaluation of antioxidant,antidiabetic and antibacterial activities of the fruit ofSonneratiaapetala(Buch.-Ham.)[J]. Oriental Pharmacy and Experimental Medicine,2013,13(2):95-102.
[7]皮建辉,胡朝暾,蔡婧,等.金樱子提取物不同极性部位体外抗氧化活性研究[J].江苏农业科学,2013,41(3):285-288.
[8]李利华.黑胡椒提取物的抗氧化活性研究[J].中国调味品,2016,41(9):36-39.
[9]张建军,谢丽源,刘树海,等.不同产地银耳抗氧化活性物质及抗氧化能力分析[J].西南农业学报,2015,28(1):333-338.
[10]ChuF X,FanD B,QinTF,et al.Evaluation of forestry residue-source oil-tea cake as an extender for phenol-formaldehyde plywood adhesive[J].Forest Products Journal,2010,60(7):610-614.
[11]Tun Y T,Wu J H,Huang C Y,et al.Antioxidant activities and phytochemical characteristicsof Extracts from Acacia confusa bark[J].Bioresource Technology,2009,100(1):509-514.
[12]谷丽华,俞桂新,王峥涛.基于ABTS自由基的薄层色谱-生物自显影新方法的建立及其在中药抗氧化活性评价中的应用[J].上海中医药大学学报,2013,27(3):99-104.
[13]李华,李佩洪,王晓宇,等.抗氧化检测方法的相关性研究[J].食品与生物技术学报,2008,27(4):6-11.
[14]钟雪莲,罗亨铭,杨再波,等.瑶山梭罗果实不同提取部位的抗氧化活性研究[J].食品科技,2012,37(8):232-234.
[15]郑朋朋,李珊,杨正涛,等.拐枣不同提取物的体外抗氧化作用[J]. 中国酿造,2015,34(9):121-124.
AntioxidantactivityofalcoholextractanddifferentpolarpartsofSonneratiaapetalafruits
YIXiang-xi1,2,3,LIJia-yi4,5,GAOCheng-hai4,ZHANGQing5,ZHOUWen-hong5,DENGJia-gang2,3,*
(1.The Post-Doctoral Research Station of Chinese Medicine,Jinan University,Guangzhou 510632,China;2.Guangxi Botanical Garden of Medicinal Plants,Nanning 530023,China;3.School of Pharmaceutical Sciences,Guangxi University of Chinese Medicine,Nanning 530001,China;4.Guangxi Key Laboratory of Marine Natural Products and CombinatorialBiosynethesis Chemistry,Guangxi Academy of Sciences,Nanning 530007,China;5.Light Industry and Food Engineering College,Guangxi University,Nanning 530004,China)
The antioxidant activities of alcohol extract and different polar parts ofSonneratiaapetalafruits were studied. The ethanol extract was obtained by the addition of ethanol,and then successively extract by ethyl acetateand,butanol and the remaining liquid was collected to obtain n-butanol phase,ethyl acetate phase and aqueous phase residue. The antioxidant activity of all extracts were evaluated by superoxide anion radical,DPPH free radical,ABTS+free radical scavenging ability and reducing ability. The results showed that all test samples had antioxidant activities and showed significant dose-effect relationship. Alcohol extraction showed medium antioxidant activity in the determination of DPPH radical scavenging and reducing ability. The ethyl acetate phase exhibited strong antioxidant activity in DPPH free radical,ABTS+free radical scavenging and reducing ability,its DPPH free radical scavenging activity(IC50=1.69 μg·mL-1)was obviously stronger than positive control vitamin E(IC50=6.06 μg·mL-1),and its superoxide anion radical scavenging activity(IC50=0.35 mg·mL-1)showed no difference from control(IC50=0.30 mg·mL-1).
Sonneratiaapetalafruits;superoxide anion radical;DPPH radical;ABTS+free radical;reducing ability;antioxidant activity
TS201.1
A
1002-0306(2017)19-0027-04
10.13386/j.issn1002-0306.2017.19.005
2017-04-11
易湘茜(1981-),女,博士后,副教授,主要从事海洋生物资源开发与利用方面的研究,E-mail:42672960@qq.com。
*通讯作者:邓家刚(1953-),男,教授,博士后合作导师,主要从事海洋中药理论与应用方面研究,E-mail:dengjg53@126.com。
广西自然科学基金项目(2015GXNSFBA139195);广西高校科学技术研究项目(KY2015YB146);广西中药药效研究重点实验室建设项目(16-380-29);中国博士后科学基金面上资助项目(2016M602920XB)。
