GC-MS法测定小麦中硅噻菌胺的残留量
2017-10-19,,,,,
,,,,,
(南京农业大学食品科技学院,江苏南京 210095)
GC-MS法测定小麦中硅噻菌胺的残留量
徐敬国,杨雨蒙,胡伊旻,黄思琪,史雅凝,辛志宏*
(南京农业大学食品科技学院,江苏南京 210095)
硅噻菌胺是一种专一防治小麦全蚀病的新型杀菌剂。利用气相色谱-质谱(GC-MS)联用技术建立了一种高效准确的检测小麦中硅噻菌胺残留的方法。样品经乙腈萃取、Florisil固相萃取柱净化后,利用GC-MS检测。结果表明:预处理后样品中硅噻菌胺GC-MS保留时间为7.188 min,在加标量分别为0.001、0.01、0.025 mg时,其平均回收率分别为103.3%、86.5%、80.9%,相对标准偏差(RSD)为7.50%、5.11%、3.52%。该方法在0.006~0.1 mg/kg范围内具有较好的线性关系(R2=0.9998),最低检测限(LOD)为0.002 mg/kg,定量限(LOQ)为0.006 mg/kg。该研究为小麦中硅噻菌胺残留提供了一种简便快速有效的检测方法。
硅噻菌胺,气相色谱-质谱,小麦,残留
硅噻菌胺(silthiopham),即N-烯丙基-4,5-二甲基-2-(三甲基硅烷基)噻吩-3-甲酰胺,是一种新型含硅噻吩酰胺类杀菌剂[1],为白色颗粒状固体,极易溶于水和有机溶剂。硅噻菌胺作为防治小麦全蚀病最好的杀菌剂之一,其主要剂型有99%硅噻菌胺原粉和12.5%硅噻菌胺悬浮剂[2]。研究表明,硅噻菌胺可以干扰小麦全蚀病菌线粒体的腺嘌呤核苷酸转运,在种子处理阶段加入硅噻菌胺可以专一有效地防治小麦全蚀病[3-5]。
近年来,随着硅噻菌胺的大范围使用,其在相关农产品中的残留及环境安全问题受到越来越广泛的关注,因此,建立有效的硅噻菌胺残留检测方法对规范其合理使用具有重要作用。王东伟等以邻苯二甲酸二戊酯为内标物,建立了硅噻菌胺悬浮剂原药有效成分含量的气相色谱检测方法[6]。郑丽等采用高效液相色谱法,以240 nm为检测波长实现了对硅噻菌胺原药快速、高效的定性、定量分析[7]。陈小龙等建立了液相色谱串联质谱检测果蔬中新型酰胺类杀菌剂残留量的方法,该方法可以同时实现多种酰胺类农药残留的检测,可应用于果蔬中硅噻菌胺残留的分析[8]。
但是,目前国内关于硅噻菌胺检测分析的报道主要集中在对原药的分析,农产品中硅噻菌胺残留的测定方法相对较少,其中小麦作为硅噻菌胺主要施用的农作物,其农药残留的检测至今未有报道。小麦中存在多种测定干扰成分,基质效应强,文献多采用凝胶色谱和固相萃取或二者联用来对其进行净化,以除去样品中的脂肪、色素、糖等杂质[9-10]。硅噻菌胺属于酰胺类化合物,对酰胺类化合物的分析多采用液相或气相色谱串联质谱技术,从而达到对酰胺类化合物的痕量、准确分析[11-16]。因此,本文运用气相色谱-质谱技术,建立了一种高效准确检测小麦中硅噻菌胺残留量的方法。该方法通过乙腈萃取样品、Florisil固相萃取柱净化后,利用GC-MS检测,以期为小麦中硅噻菌胺残留量检测提供一种快速有效的方法。
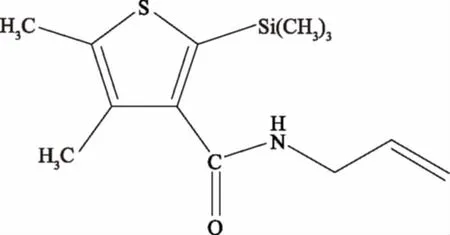
图1 硅噻菌胺结构式[1]Fig.1 The structural formula of silthiopham[1]
1 材料与方法
1.1试剂与仪器
纯度为98.0%的硅噻菌胺标准品 Dr. Ehrenstorfer公司;乙腈、正己烷、丙酮均为分析纯 上海凌峰化学试剂有限公司;氯化钠,分析纯 国药集团化学试剂有限公司;丙酮 色谱纯,国药集团化学试剂有限公司;Florisil固相萃取柱 美国Agilent公司;水 为双蒸水;小麦样品 江苏省盐城市响水县农贸市场。
Agilent 7890A型气相色谱仪,Agilent 5975C型质谱仪,气相色谱柱(HP-5) 美国安捷伦公司生产;HSE-12B型固相萃取仪 天津市恒奥科技发展有限公司;EYELA N-1100型旋转蒸发仪 上海爱朗仪器有限公司;85-2型磁力搅拌器 上海司乐仪器有限公司。
1.2标准溶液的配制
准确称取0.01 g(精确至0.0001 g)硅噻菌胺标准品,用丙酮(色谱纯)溶解并定容至10 mL,配制成1000 mg/L标准储备液,置于-20 ℃保存。利用梯度稀释法以小麦基质匹配标准溶液将标准储备液稀释成质量浓度分别为0.25、0.5、1.0、2.5、5.0 mg/L的硅噻菌胺标准工作溶液[17]。
1.3样品的提取和净化
1.3.1 样品提取 称取25.0 g(精确至0.1 g)样品置于三角瓶中,加入100 mL乙腈后于振荡器上振荡提取20 min,加入8.0 g NaCl,继续振荡搅拌10 min,用抽滤装置抽滤后获得样品提取液,于40 ℃减压浓缩至近干,剩余液体用氮气吹干,最后加入2~3 mL正己烷超声辅助溶解。
1.3.2 Florisil固相萃取柱净化 依次用5 mL丙酮-正己烷(50∶50,v+v)、5 mL正己烷活化Florisil固相萃取柱,将样品溶液转移至固相萃取柱中,流速为2.0 mL/min,收集淋洗液,用10 mL丙酮-正己烷(50∶50,v+v)洗脱固相萃取柱,合并两次淋洗液[18],于旋转蒸发器中40 ℃浓缩,用氮气吹干,加丙酮定容至10.0 mL,检测时过0.22 μm滤膜,自动进样分析。
1.4GC-MS条件
气相色谱条件[19-20]:进样口温度,210 ℃;程序升温,初始温度80 ℃,先以20 ℃/min升温至120 ℃保持1 min,再以30 ℃/min升温至240 ℃保持1 min,最后以20 ℃/min升温至290 ℃,保持4 min;载气,高纯氦气(99.999%);进样量1.0 μL;不分流进样。
质谱检测条件[20]:电子轰击电离源(EI),70 eV;离子源温度,230 ℃;四级杆温度,150 ℃;GC-MS进样口温度,280 ℃;溶剂延迟,1 min;选择离子监测模式,定量离子m/z 252,定性离子268和139。
1.5添加回收实验、检测限和定量限的确定
向空白小麦样品中分别添加0.001、0.01、0.025 mg的硅噻菌胺标准溶液,测定其添加回收率,重复5次并计算相对标准偏差(RSD)。以不含硅噻菌胺的空白小麦样品作为基质,添加不同浓度的硅噻菌胺标准溶液,对小麦样品进行前处理,GC-MS检测硅噻菌胺残留,以S/N=3确定该方法的检出限,S/N=10作为定量限[21-22]。
1.6数据分析方法
利用Microsoft Excel 2010绘制硅噻菌胺标准曲线,样品中硅噻菌胺残留量由外标法计算得到。
2 结果与讨论
2.1样品前处理条件的优化
萃取溶剂的选择:小麦样品的前处理对后续的分析尤为重要,前处理不合适不但降低回收率,而且会对分析仪器造成严重污染。测定农药残留时,样品前处理多采用丙酮和乙腈萃取[22-23]。本研究对这两种提取剂进行了对比,发现应用丙酮作为萃取剂时,不同添加水平的回收率在70%~90%之间,而利用乙腈作为萃取剂其回收率均大于80%,在低添加水平甚至可以达到103.3%。实验结果表明,使用乙腈萃取有效地减少了干扰杂质在样品溶液中的溶解,且待测组分硅噻菌胺在乙腈中溶解度良好,添加回收率较高,因此选用乙腈作为萃取剂。
根据文献[24]报道,加入氯化钠可以有效破坏溶液的乳化现象,实验发现,在提取液中加入适量的氯化钠可以有效澄清提取液,有利于后续的抽滤操作。
固相萃取条件优化:本研究首先对Florisil和Envi-carb/LC-NH2两种固相萃取柱分离萃取硅噻菌胺的效果进行了对比,结果表明:当标准样品添加量为0.01 mg时,Florisil柱对硅噻菌胺的平均回收率(100.2%)明显优于Envi-carb/LC-NH2柱(89.0%),因此选用Florisil固相萃取柱进行实验。以不同体积比的丙酮:正己烷为淋洗剂对固相萃取条件进行优化,分别计算相应的硅噻菌胺回收率,结果如图2所示。当丙酮:正己烷(v+v)的比例为40∶60、50∶50及60∶40时,硅噻菌胺的回收率均接近100%,且无显著性差异(p>0.05),然而,丙酮-正己烷50∶50净化后的样品色谱峰背景干扰最小,因此选用丙酮∶正己烷=50∶50作为Florisil柱的淋洗剂。
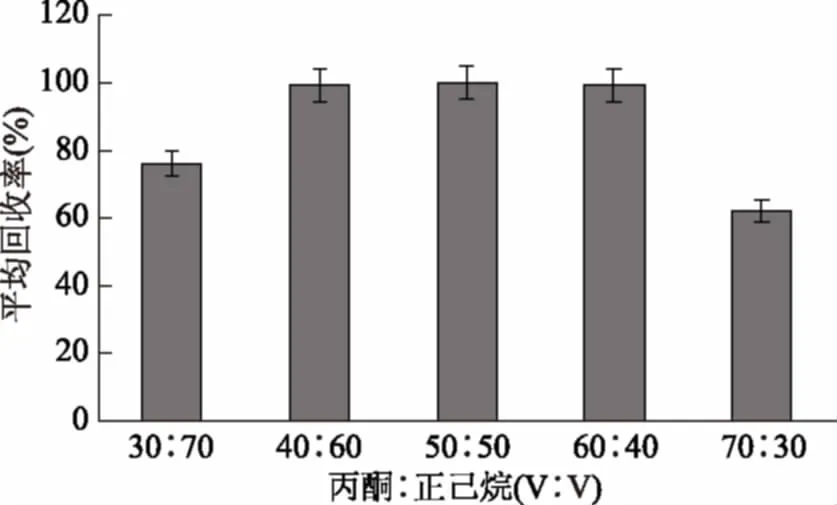
图2 不同体积比的丙酮:正己烷对Florisil固相萃取柱萃取效果的影响Fig.2 Effects of extractions of Florisilwith different volume ratios between acetone and hexane
2.2检测条件的优化
进样口的温度要高于被分析物的沸点,确保样品组分不会在进样口滞留从而影响对农药残留分析的准确性,经过预实验确定进样口温度为210 ℃。
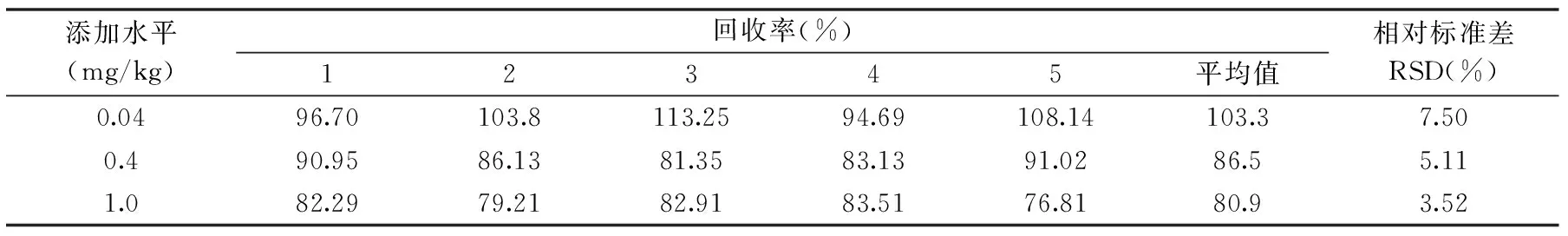
表2 硅噻菌胺在小麦中的添加回收率及相对标准偏差(n=5)Table 2 The spiked recoveries and RSDs of silthiopham in wheat samples(n=5)
柱温箱的温度控制显著影响目标物质的出峰时间及分离效果,提高初始温度及升温速率都会明显的缩短目标组分的出峰时间,使得色谱峰峰宽减小峰高增强,从而提高方法的灵敏度。但是升温速率快会对目标组分的分离度产生影响,柱温过高会使得色谱基线漂移,反而会降低分析方法的灵敏度。因此,本实验优化了柱温箱的温度控制,采用60 ℃作为其初始温度,程序升温至290 ℃。
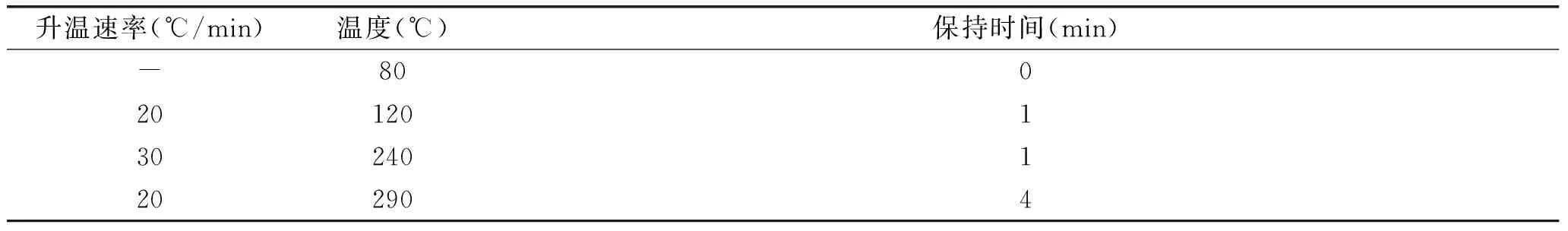
表1 程序升温方式 Table 1 The temperature programming of the GC-MS
2.3方法的线性关系及检出限
以质量浓度分别为0.25、0.5、1.0、2.5、5.0 mg/L的硅噻菌胺标准品的浓度为横坐标,以各自峰面积为纵坐标计算回归方程,制作标准曲线(图3)。线性关系为y=270004x-24289,相关系数R2=0.9998。在不含硅噻菌胺的空白小麦样品中,添加不同浓度的硅噻菌胺标准溶液,以S/N=3确定该方法的检出限为0.002 mg/kg,S/N=10作为定量限0.006 mg/kg。
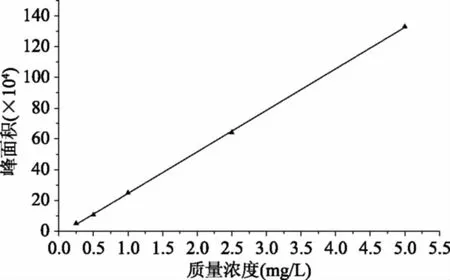
图3 硅噻菌胺标准曲线Fig.3 Standard curve of silthiopham

图4 硅噻菌胺标准品色谱图(1.0 mg/L)及其选择监测离子Fig.4 Chromatogram of standard sample ofsilthiopham with the dose 1.0 mg/L

图5 小麦样品的选择离子监测色谱图Fig.5 The chromatogram of wheat samples注:A:空白样品;B:标准物质添加(1.0 mg/L)。
2.4方法的添加回收率和灵敏度
在样品中分别加入0.001、0.01、0.025 mg的硅噻菌胺标准品,在优化的GC-MS条件下对硅噻菌胺残留进行测定计算,平均回收率分别为103.3%、86.5%、80.9%,相对标准偏差为7.50%、5.11%、3.52%,符合农药残留检测的要求。添加回收率及相对标准偏差结果如表2所示。
2.5实际小麦样品的测定
利用本文建立的GC-MS方法对来自江苏省盐城市的小麦样品进行检测。由于目前没有小麦中硅噻菌胺农药残留的国家标准限值,而根据EU No 398/2014规定的小麦中硅噻菌胺MRL值为0.01 mg/kg[25]。对66份小麦样品的测定结果显示,有10份样品中检测出硅噻菌胺残留,检出率为15%,含量均小于定量限0.006 mg/kg,因此本次抽检的小麦样品均小于欧盟EU No 398/2014规定的MRL值。
3 结论
运用GC-MS技术,建立了小麦中硅噻菌胺残留量的分析方法。该方法优化了小麦前处理过程,采用乙腈为提取剂处理小麦样品可以有效降低样品基质中蜡质、脂肪和一些亲脂性色素的含量,减少了杂质干扰,并且对硅噻菌胺有较好的提取效率[26]。采用Florisil固相萃取柱净化,并以丙酮∶正己烷=50∶50为淋洗液可以提高硅噻菌胺回收率,达到对农药残留准确分析的目的。对空白样品进行添加回收实验,在添加量分别为0.001、0.01和0.025 mg时,硅噻菌胺的平均回收率分别为103.3%、86.5%、80.9%,相对标准偏差分别为7.50%、5.11%、3.52%,最低检测限为0.002 mg/kg,定量限为0.006 mg/kg,满足农药残留分析的要求。
本文首次利用气相色谱-质谱联用技术对小麦中硅噻菌胺残留量进行测定分析,此方法样品前处理过程简便、快捷,实现了样品的自动化分析且检测灵敏度好,适用于小麦样品硅噻菌胺残留的定性和定量测定,从而为小麦中硅噻菌胺残留量的检测提供了一种简便有效的方法。
[1]靳文波,谢桂英,孙淑君,等. 硅噻菌胺合成新工艺[J]. 农药,2013,(7):484-486.
[2]王保通,商鸿生,李强,等. 硅噻菌胺拌种防治小麦全蚀病实验研究[J]. 西北农业学报,2005,14(3):26-28,37.
[3]王宴雷,陈宏,王亚红,等. 硅噻菌胺对小麦全蚀病的防病机理研究[J].麦类作物学报,2012,32(6):1199-1204.
[4]陈怀谷. 小麦全蚀病菌的遗传组成和病害的防治技术研究[D].南京:南京农业大学,2012.
[5]Joseph-Horne T,Heppner C,Headrick J,et al. Identification and Characterization of the Mode of Action of MON 65500:A Novel Inhibitor of ATP Export from Mitochondria of the Wheat “Take-All” Fungus,Gaeumannomyces graminis,var. tritici[J]. Pesticide Biochemistry & Physiology,2000,67(3):168-186.
[6]王冬伟,曹立冬,黄啟良. 125 g/L硅噻菌胺悬浮剂气相色谱分析[J]. 农药,2014,(6):416-417.
[7]郑丽,曹立冬,邢华,等. 硅噻菌胺原药高效液相色谱分析方法研究[J]. 农药科学与管理,2014,(5):47-49.
[8]陈小龙,李正翔,曹赵云,等. 液相色谱-串联质谱法测定蔬菜和水果中6种新型酰胺类杀菌剂的残留量[J]. 色谱,2013,31(10):954-960.
[9]杨晓云,杨尚春,宁焕焱,等. 小麦中多种农药的快速残留分析[J]. 分析测试学报,2010,29(6):617-620.
[10]吴丽华. 气相色谱法快速检测小麦中多种农药残留[J]. 食品与机械,2013(04):71-75.
[11]张云,黄传辉,陈泽宇. 超高效液相色谱-串联质谱法测定植物油中邻氨基苯甲二酰胺类农药[J]. 食品安全质量检测学报,2016(07):2860-2866.
[12]康庆贺,杨长志. 气相色谱法同时测定糙米中6种取代苯类及酰胺类农药残留[J]. 色谱,2003(04):421-423.
[13]黄超群,谢文,于卓然,等. 液相色谱-串联质谱法测定果蔬中10种酰胺类农药的残留量[J]. 食品安全质量检测学报,2015(03):886-892.
[14]孙亚米,吕燕,吴银良. 液相色谱-串联质谱法快速测定果蔬中16种新型酰胺类杀菌剂残留量[J]. 食品科学,2015,36(12):230-236.
[15]王云凤,王伟,秦洪健,等. 液相色谱-质谱法测定果蔬中10种酰胺类杀菌剂残留量[J]. 食品研究与开发,2010(01):113-116.
[6]王冬伟,曹立冬,黄啟良. 125 g/L硅噻菌胺悬浮剂气相色谱分析[J]. 农药,2014,(6):416-417.
[16]李文卓,钱圆,Matsumoto Haruna,等. 气相色谱-串联质谱检测蔬菜中氟吡菌酰胺及其代谢物残留[J]. 农药学学报,2016,18(6):759-764.
[17]叶倩,路大海,邓义才,等. 气相色谱-串联质谱法快速检测玉米粉中乙草胺、异丙甲草胺和三唑酮残留[J]. 农药学学报,2016,18(2):268-272.
[18]Wang J,Leung D. Determination of 142 pesticides in fruit-and vegetable-based infant foods by liquid chromatography/electrospray ionization-tandem mass spectrometry and estimation of measurement uncertainty.[J]. Journal of AOAC International,2008,92(1):279-301.
[19]罗俊凯,龚道新,丁春霞,等. 气相色谱-质谱法测定烟叶和土壤中丁硫克百威及其代谢产物的残留[J]. 农药学学报,2014,16(1):66-71.
[20]王玉然,梁化雨,李平亮,等. 苹果叶片中吡唑醚菌酯残留的超高效液相色谱-串联质谱检测方法[J]. 农药学学报,2016,18(6):752-758.
[21]Likas D T,Tsiropoulos N G,Miliadis G E. Rapid gas chromatographic method for the determination of famoxadone,trifloxystrobin and fenhexamid residues in tomato,grape and wine samples[J]. Journal of Chromatography A,2007,1150(1-2):208-214.
[22]Liu C,Qin D,Zhao Y,et al. Famoxadone residue and dissipation in watermelon and soil[J]. Ecotoxicology and Environmental Safety,2010,73(2):183-188.
[22]刘宇宏,黄科林,吴睿,等.农药残留检测前处理技术研究进展[J].企业科技与发展,2009,(11):15-18.
[23]王慧卿,于劲松,徐 斐,等.食品农药残留检测中样品前处理技术研究进展[J].广东农业科学,2013,40(8):111-114.
[24]Wang J,Chow W,Cheung W. Application of a tandem mass spectrometer and core-shell particle column for the determination of 151 pesticides in grains[J]. Journal of Agricultural & Food Chemistry,2011,59(16):8589.
[25]Official Journal of the European Union.Comission Regulation,No 398(2014-04-22). http://www.reading.ac.uk/foodlaw/eu/regs-14.htm
[26]马琳,陈建波,赵莉,等. 固相萃取-超高效液相色谱-串联质谱法同时测定果蔬中6种酰胺类农药残留量[J]. 色谱,2015(10):1019-1025.
Determinationofresidueofsilthiophaminwheatbygaschromatography-massspectrometrymethod
XUJing-guo,YANGYu-meng,HUYi-min,HUANGSi-qi,SHIYa-ning,XINZhi-hong*
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
Silthiopham is a new exclusive fungicide for take-all disease of wheat. An efficient and accurate analytical approach was developed for the residue of silthiopham in wheat by gas chromatography-mass spectrometry(GC-MS)technique. Samples were extracted with acetonitrile and purified via solid phase extraction column(Florisil). Then those purified samples were detected by GC-MS. The results indicated that the retention time(RT)of silthiopham was 7.188 min. And at the amount of standard sample of 0.001,0.01 and 0.025 mg,the average recovery rate of silthiopham were 103.3%,86.5%,80.9%,respectively,with the relative standard deviation(RSD)7.50%,5.11%,3.52%,separately. The linear ranges were from 0.006 to 0.1 mg/kg with a good linear relationship(R2=0.9998). The limit of detection was 0.002 mg/kg,and the limit of quantification was 0.006 mg/kg. Thus,this study provided a simple,rapid and effective method in determination of the residue of silthiopham in wheat.
silthiopham;gas chromatography-mass spectrometry(GC-MS);wheat;residue
TS207.3
A
1002-0306(2017)19-0236-05
10.13386/j.issn1002-0306.2017.19.043
2017-03-08
徐敬国(1991-),男,硕士研究生,研究方向为:食品营养与化学,E-mail:2015108058@njau.edu.cn。
*通讯作者:辛志宏(1974-),男,博士,教授,研究方向:食品营养与化学,E-mail:xzhfood@njau.edu.cn。
2016年农产品质量安全风险评估项目(GJFP201601205)。
