金鲳鱼鱼皮酶溶性胶原蛋白的提取工艺优化及基本特性
2017-10-19,,,,,
,,,,,
(海南大学食品学院,海南海口 570228)
金鲳鱼鱼皮酶溶性胶原蛋白的提取工艺优化及基本特性
廖伟,夏光华,王佳媚,杨晋坤,李永成,申铉日*
(海南大学食品学院,海南海口 570228)
为提高金鲳鱼加工副产物——鱼皮的利用率,本研究在前期单因素实验的基础上,以加酶量、液料比和提取时间三个单因素建立模型,采用响应面法Box-Behnken设计实验,优化了胃蛋白酶法提取金鲳鱼鱼皮酶溶性胶原蛋白(PSC)的提取工艺,并与酸溶性胶原蛋白(ASC)进行聚丙烯酰胺凝胶电泳、傅里叶变换红外光谱和差示扫描量热仪等基本理化特性的对比研究。结果表明,金鲳鱼鱼皮胶原蛋白的最佳提取工艺为:加酶量1.5%、液料比23∶1 mL/g、酶解时间27.5 h。此条件下通过实验验证得出,金鲳鱼鱼皮胶原蛋白实际提取率为64.68%,与响应面模型理论预测值65.17%基本一致;此外,本实验提取的PSC有较高热变性温度(30.44 ℃),与金鲳鱼皮ASC有相似的电泳性质和红外峰型,初步鉴定为I型胶原蛋白。该实验为金鲳鱼鱼皮酶溶性胶原的提取提供了理论参考。
金鲳鱼鱼皮,胶原蛋白,响应面法,提取工艺
胶原蛋白(collagen)是动物结缔组织中最常见的不溶性纤维蛋白,约占蛋白总量的33%[1],广泛分布在动物的皮肤、骨骼与肌腱等组织中。到目前为止,部分研究人员已从众多原料中提取并鉴定了至少27种不同类型的胶原蛋白(Type I-XXIX),每种类型的胶原在其结构与功能上有显著不同[2]。其中,研究学者对Ⅰ型胶原研究较多,该型胶原蛋白现已广泛应用于食品、医药、皮革、影像和化妆品工业中[3-4]。鱼皮是生产胶原蛋白的重要原料,具有价格低廉、来源丰富、安全性高等优点,现已逐渐成为陆生动物胶原蛋白的有效替代品[5]。
金鲳鱼(Trachinotusovatus)学名卵形鲳鲹,体型较大,肉质细嫩,养殖成活率高,一般可达90%以上,是近年来中国华南沿海地区代表性海水养殖品种之一[6]。然而,其鱼皮较硬,加工过程中通常剥除丢弃或用作动物饲料。随着金鲳鱼养殖量的不断增大,大量副产物鱼皮未能得到高值化利用,且关于金鲳鱼鱼皮胶原蛋白的提取工艺、理化特性少有研究。传统提取胶原蛋白工艺包括热水浸提,碱法、酸法等,采用这些方法提取胶原蛋白均有不同程度的缺陷,如提取的胶原蛋白不稳定易发生降解、提取周期长、提取率低等[7]。与上述几种方法相比,酶法提取胶原蛋白具有提取率高、周期短和胶原蛋白性质稳定等优点,能有效增加经济效益[8]。研究者已通过响应面法优化了鮟鱇鱼皮、鳕鱼皮、罗非鱼鳞等酶溶性胶原提取工艺,探明了除酶种类外,加酶量、提取时间、液料比、酶解温度等因素也会对提取率造成影响,但当酶解温度过高时,胶原蛋白易发生降解[5,9-10]。因此,本实验在低温弱酸条件下,选取加酶量、提取时间、液料比三个单因素,采用响应面模型优化金鲳鱼鱼皮酶溶性胶原提取过程,并通过聚丙烯酰胺凝胶电泳(SDS-PAGE)、红外光谱(ATR-FTIR)与差示扫描量热仪(DSC)等技术手段对金鲳鱼皮胶原的理化性质进行了对比分析。
1 材料与方法
1.1材料与仪器
新鲜金鲳鱼鱼皮 海南祥泰渔业股份有限公司提供,冷藏状态转运回实验室,去肉洗净在-20 ℃下冷藏以备用;羟脯氨酸标准品 上海信裕生物科技有限公司;胃蛋白酶(活性800~2500 U/mg) Sigma公司;I型猪皮胶原蛋白 四川铭让生物科技有限公司;其余试剂均为国产分析纯;实验室用水均为去离子水。
Stratos高速冷冻离心机 美国赛默飞公司;Eyel4冷冻干燥机 日本Tokyo Rikakikai公司;Dycz-24dn垂直电泳系统 北京市六一仪器厂;Tensor27傅里叶变换红外光谱仪 德国Bruker公司;DSC131EV差示扫描热量仪 法国塞塔拉姆仪器公司。
1.2实验方法
1.2.1 基本成分分析 水分含量测定参考GB/T 5009.3-2010[11],采用105 ℃常压干燥法;蛋白质含量测定参考GB/T 5009.5-2010[12],釆用凯氏定氮法;灰分含量测定参考GB/T 5009.4-2010[13],釆用高温灼烧法;脂肪含量测定参考GB/T 5009.6-2003[14],采用索氏抽提法。
1.2.2 羟脯氨酸含量测定 羟脯氨酸是胶原所特有的氨基酸,通过测定羟脯氨酸的含量,乘以相应的系数即可得到样品中胶原蛋白含量[15]。绘制羟脯氨酸标准曲线:吸取不同浓度的羟脯氨酸标准液1 mL加入150 mL柠檬酸缓冲液和250 mL氯胺T溶液混合均匀,经25 ℃恒温氧化后加入1 mL高氯酸(3.5 mol/L);10 min后加入1 mL对二甲基苯甲醛显色试剂,在65 ℃水浴显色,冷却后在560 nm处测定吸光值。以羟脯氨酸质量浓度(x)和对应的吸光度(y)绘制标准曲线,拟合回归方程。
样品中胶原蛋白含量(%)=羟脯氨酸含量(%)×11.1
式(1)
1.2.3 鱼皮胶原蛋白的分离与提取 参考Duan[16]的方法略有修改,所有操作均在4 ℃下进行。将新鲜金鲳鱼皮剪成小块,浸泡在0.1 mol/L的NaOH溶液中36 h,以除去杂蛋白和灰分;处理后的鱼皮反复冲洗至中性,随后浸泡在10%的正丁醇溶液中24 h以脱脂;将脱脂后的样品溶于0.5 mol/L乙酸中,根据实验设计的料液比、胃蛋白酶、时间进行浸提;浸提后用两层纱布过滤,滤液于12000×g下低温离心15 min以去除不溶物,收集上清液,添加NaCl盐析至终浓度0.9 mol/L;在10000×g下低温离心15 min,收集沉淀后溶于乙酸;收集后的样品液依次用0.1 mol/L的乙酸和蒸馏水为外液各透析24 h,随后在真空冷冻干燥机下冷冻干燥即为酶溶性胶原蛋白(PSC)。酸溶性胶原蛋白(ASC)采用相同的方法在不添加胃蛋白酶的情况下进行提取,同时用作实验对照。
胶原蛋白提取率(%)=提取液中胶原蛋白含量(g)/样品中胶原蛋白的含量(g)×100
式(2)
1.2.4 单因素实验 根据前期实验结果和相关文献[9,17-18],选取胶原蛋白溶解过程中的三个关键因素(加酶量、液料比和提取时间)。设定加酶量1.5%、液料比20∶1、提取时间24 h,进行单因素实验,考察加酶量0.5%、1%、1.5%、2%、2.5%;液料比10∶1、15∶1、20∶1、25∶1、30∶1 mL/g;提取时间12、18、24、30、36 h对金鲳鱼鱼皮酶溶性胶原提取率的影响。
1.2.5 响应面优化实验 在单因素实验基础上,采用响应面Box-Behnken设计三因素三水平的实验方案。实验因素与水平设计见表1。

表1 响应面实验因素及水平表Table 1 Factors and levels used in orthogonal array design
1.2.6 聚丙烯酰胺凝胶电泳(SDS-PAGE)分析 先配制胶原蛋白水溶液(2.5,w/v),随后与试样处理液均匀混合(1∶1,v/v),沸水浴5~10 min制样,冷却以备用。根据LaemmLi[19]的方法,采用不连续的三羟甲基氨基甲烷-甘氨酸电泳系统,在7.5%的分离胶和4%的浓缩胶,80 V稳流电压的条件下进行。市售Ⅰ型猪皮胶原蛋白作为对照
1.2.7 傅里叶变换红外光谱(ATR-FTIR)分析 取适量胶原样品,与KBr粉末在干燥灯下充分研磨,压片。随后将片状样品置于样品室内测定。光谱扫描范围为4000~500 cm-1,分辨率2 cm-1,扫描次数为4次。
1.2.8 差示扫描量热(DSC)分析 参考杨玲等[20]法,胶原样品溶于水中(1∶40,w/v),静置24 h

表2 金鲳鱼鱼皮基本成分(湿重)Table 2 General composition of the skin of Golden pompano(wet weight)
以混匀。随后称取样品溶液9~15 mg于铝锅中,加盖密封,置于样品槽中待测定。设置扫描温度为15~50 ℃,扫描速度为2 ℃/min。
1.3数据处理
每个样品实验复3次,数据通过SPSS 17.0分析处理,用x±s表示。
2 结果与分析
2.1金鲳鱼鱼皮成分分析
表2列出了金鲳鱼鱼皮的基本化学成分,数据显示其含水量为65.14%;干物质含量为34.56%,其中干物质主要为蛋白质,约占总质量的23.48%,高于已经报道的经济养殖鱼草鱼(16.56%)和美国红鱼(19.46%)[21-22],因此金鲳鱼鱼皮可视作是较好的蛋白质来源。此外,金鲳鱼鱼皮中含有8.02%的脂肪和1.36%的灰分,说明鱼皮胶原的提取也需要经历脱脂和脱灰等过程。
2.2标准曲线绘制
根据测定的数值,得到羟脯氨酸回归方程y=0.094x+0.0087,R2=0.9973(图1)。通过标准曲线计算得到金鲳鱼皮的羟脯氨酸含量为1.78%,乘以换算系数11.1[15],得出胶原蛋白含量为19.57%±1.37%,占鱼皮粗蛋白含量的83.33%,进一步说明金鲳鱼鱼皮富含胶原蛋白。

图1 羟脯氨酸标准曲线Fig.1 Standard curve of L-hydroxyproline
2.3单因素实验
2.3.1 加酶量对胶原蛋白提取率的影响 加酶量对金鲳鱼鱼皮胶原蛋白提取率的影响如图2所示,在加酶量0.5%~1.0%之间,胶原蛋白提取率随着加酶量的增加而显著增加(p<0.05),但当加酶量达到1.5%后开始下降,这与王珮等[5]的研究报道相似,这可能由于底物的量是一定的,酶与底物结合已达到饱和,而过量的酶会导致胶原蛋白降解,因此选择加酶量1.5%作为较优水平。
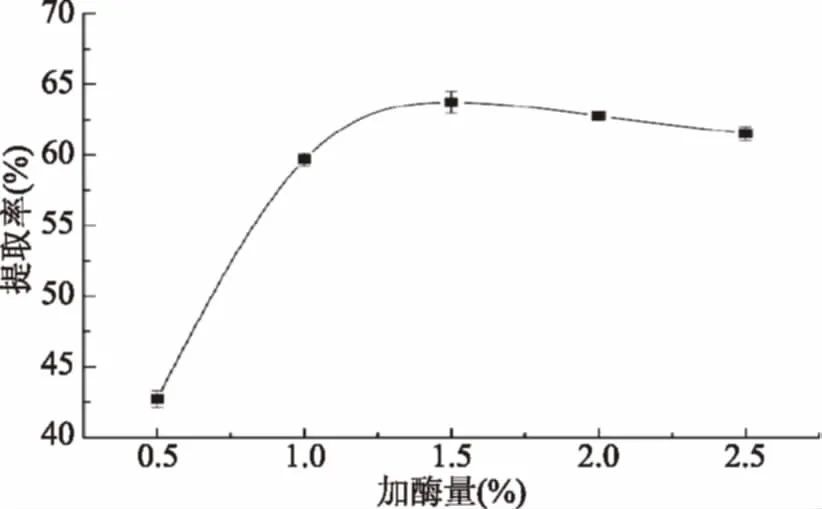
图2 加酶量对金鲳鱼鱼皮胶原蛋白提取率的影响Fig.2 Effect of enzyme concentration oncollagen yield from skin of Golden pompano
2.3.2 液料比对胶原蛋白提取率的影响 液料比对金鲳鱼鱼皮胶原蛋白提取率的影响如图3所示,胶原蛋白提取率随液料比的增大先呈增加趋势,至20∶1 mL/g处达到最大后呈减小趋势。结果表明:当液料比较低时(<15∶1 mL/g),金鲳鱼皮不能完全溶解,所以提取率低,而当液料比较高时可能造成蛋白分离纯化过程中损失增大,所以提取率也低;而在20∶1 mL/g处鱼皮可完全溶解且提取率达到最大,因此选择20∶1 mL/g作为较优水平。

图3 液料比对金鲳鱼鱼皮胶原蛋白提取率的影响Fig.3 Effect of water/solid ratioon collagen yield from skin of Golden pompano
2.3.3 提取时间对胶原蛋白提取率的影响 提取时间对金鲳鱼鱼皮胶原蛋白提取率的影响如图4所示,在提取时间12~24 h,胶原蛋白提取率随时间的延长而显著提高(p<0.05),但当提取时间超过24 h后,提取率再无显著变化(p>0.05),考虑到提取成本、结合工业生产实际需要,选择24 h为较优水平。
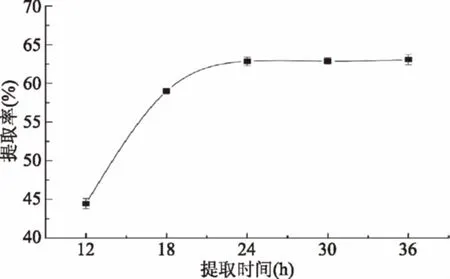
图4 提取时间对金鲳鱼鱼皮胶原蛋白提取率的影响Fig.4 Effect of extraction timeon collagen yield from skin of Golden pompano
2.4响应面实验
响应面实验设计方案和实验结果如表3所示。
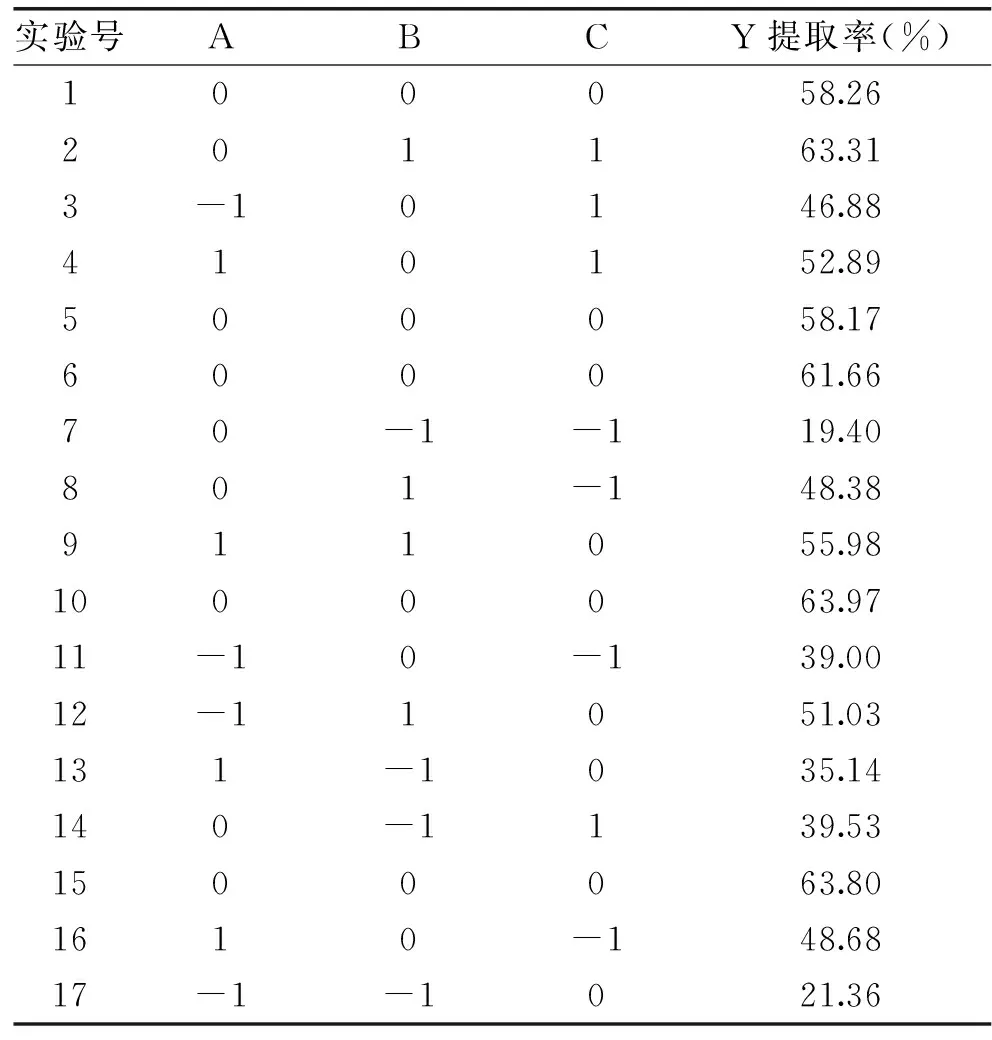
表3 响应面实验设计方案及结果Table 3 Experimental design and results of response surface
2.4.1 方差分析 对响应面结果进行多元回归分析,得到回归模型方差分析结果如表4所示。从结果可知,加酶量、液料比和提取时间的一次项、二次项影响显著,交互项影响不明显,说明各因素对金鲳鱼鱼皮胶原蛋白提取率不是简单的线性影响。响应面回归方程如下:Y=60.62+5.16A+12.15B+6C-3.18AB-1.66AC-0.76BC-7.92A2-10.85B2-6.58C2,R2=9.72,整体模型的Prob>F值小于0.05,并且失拟项不显著,因此该回归方程显著,说明该响应面实验方案设计可靠。
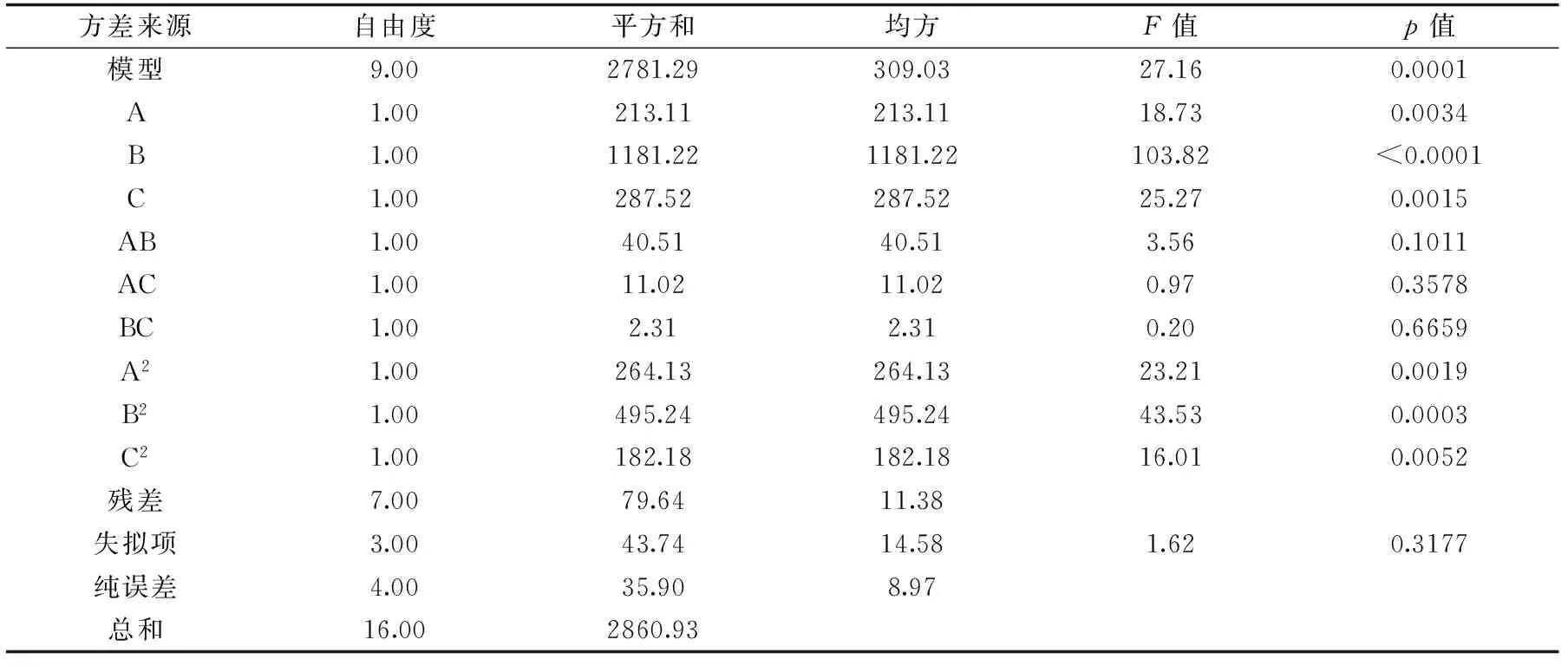
表4 回归模型方差分析结果Table 4 The results of variance analysis for the regression model
注:p<0.01,差异极显著;p<0.05,差异显著。
2.4.2 响应面分析 由图5a可知,提取时间固定不变,随着A(加酶量)的增加,胶原蛋白提取率呈先增后减的趋势,这说明过量的酶可能会使胶原蛋白发生降解。从等高线分析,当加酶量较低时等高线较密,说明在开始阶段加酶量对提取率影响显著。图5b可知,加酶量固定不变,随着B(料液比)的增加,提取率呈先增后减的趋势,另外从等高线密度可知,料液比对提取率的影响逐渐递减。由图5c可知,液料比固定不变,随着C(提取时间)的不断增加,胶原蛋白提取率呈先增后趋平稳的趋势,这可能是因为乙酸对胶原蛋白的溶解已达到饱和。综上所述,实验设计的三个单因素两两交互作用均有最大值,表明该响应面优化方案合理,能较好地反映三个因素对金鲳鱼鱼皮胶原蛋白提取率的影响。

图5 各两因素交互作用对金鲳鱼鱼皮胶原蛋白提取率影响的响应面图Fig.5 Response surface showing the effects of various operatingparameters on collagen yield from skin of Golden pompano
2.4.3 提取工艺确定分析 求解回归方程,得到酶法提取金鲳鱼皮胶原蛋白的最佳工艺条件为:加酶量1.53%、液料比23.15∶1 mL/g、提取时间27.60 h。在此条件下金鲳鱼胶原蛋白提取率可达65.17%。考虑工业利用的方便,将最优条件修改为加酶量1.5%、液料比23∶1 mL/g、提取时间27.5 h。在此条件下验证胶原蛋白实际提取率为64.68%,与理论值的误差为0.49%,证明该响应面模型合理可靠。并且,酶法提取胶原蛋白过程中所用的试剂均价格低廉,且胃蛋白酶使用量低,从成本角度考虑此方法可实现金鲳鱼鱼皮的高价值化利用。
2.5基本特性研究
2.5.1 SDS-PAGE电泳分析 图6为金鲳鱼鱼皮PSC与ASC电泳图,与市售I型猪皮胶原蛋白作对照。
从图6中观察,金鲳鱼鱼皮PSC和ASC均有两条α链(α1和α2)、一条β链,其中α1链条带色度接近于α2链的两倍,这与大鲵皮和鲟鱼鱼皮胶原电泳结果相似[7,20]。通过对比标准品计算可得,金鲳鱼鱼皮PSC和ASCα1链分子量约为118 kDa和120 kDa,α2链分子量约为115 kDa和116 kDa,与对照组I型猪皮胶原无明显差异。此外,鱼皮PSC的分子量相比ASC稍低,这可能是胃蛋白对PSC端肽区域进行了部分切割所导致的[23]。综上,此实验分离提取的金鲳鱼鱼皮PSC初步鉴定为I型胶原,并且胶原的主要结构未受到胃蛋白酶的影响。
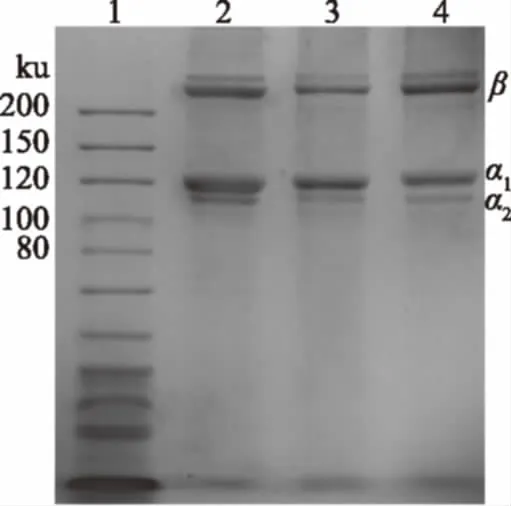
图6 金鲳鱼鱼皮PSC和ASC电泳图Fig.6 SDS-PAGE of PSCand ASC from skin of Golden pompano注:1.Markers;2.金鲳鱼鱼皮PSC;3.金鲳鱼鱼皮ASC;4.猪皮PSC。


图7 金鲳鱼鱼皮PSC和ASC红外光谱图Fig.7 IR spectra of PSC and ASCfrom skin of Golden pompano
金鲳鱼皮PSC和ASC酰胺I带吸收峰出现在1650.4和1651.2 cm-1,是由C=O伸缩振动引起,酰胺Ⅰ带与胶原蛋白的二级结构密切相关,是因为C=O不受肽链侧基的影响,只取决于肽链的构型[26]。PSC和ASC酰胺Ⅱ带吸收峰出现在1547.4和1548.3 cm-1,是由N-H弯曲和C-N伸缩振动引起。研究报道α链上的N-H与氢键缔合会使酰胺II带吸收峰向波数降低的方向偏移[27],这说明PSC中相邻α链之间存在更多的氢键。酰胺III峰通常比较微弱,其与N-H弯曲,C-N拉伸和来自酰胺键的N-H弯曲振动有关[28]。本实验中,鱼皮PSC和ASC的酰胺III带吸收峰都出现在1238.0 cm-1处。
以上结果表明,本实验酶法提取的金鲳鱼皮胶原(PSC)与传统酸法提取的胶原(ASC)均较好的保持了三股螺旋结构,且结构基本相似。
2.5.3 DSC分析结果 热稳定性一直是I型胶原在工业应用中最有价值的指标之一,DSC为评价胶原蛋白热稳定性提供了可靠的信息,结果如图8所示。

图8 金鲳鱼鱼皮PSC和ASC的热变性曲线Fig.8 Thermal denaturation curves of PSCand ASC from scales and skin of Golden pompano
金鲳鱼鱼皮PSC和ASC的变性温度分别为30.44 ℃和31.12 ℃,热焓值分别为0.72和0.91 J/g,说明金鲳鱼鱼皮PSC热稳定性稍低于ASC,这可能与胃蛋白酶作用于PSC端肽有关[29]。金鲳鱼鱼皮PSC和ASC变性温度高于大鲵皮PSC(26.5 ℃)和ASC(23.5 ℃)、鲤鱼鱼皮PSC(28.1 ℃)[7,30],低于哺乳动物猪皮PSC(38.0 ℃)和牛皮ASC(43.8 ℃)[31-32]。较高的变性温度说明金鲳鱼鱼皮PSC的主要螺旋结构保持完整,也为其工业利用提供了有力依据。
3 结论
采用响应面法优化金鲳鱼鱼皮酶溶性胶原蛋白的提取工艺,最优提取条件为加酶量1.5%、液料比23 mL/g、提取时间27.5 h。按照上述条件验证,实验结果(64.68%)和响应面理论值(65.17%)基本一致,说明本实验方案合理可靠。同时,通过SDS-PAGE电泳和红外光谱分析实验,金鲳鱼鱼皮PSC初步鉴定为Ⅰ型胶原,较好的保持了其三股螺旋结构,且与传统酸法提取的ASC有相似的电泳性质和红外峰型。
[1]Zhang M,Liu W,Li G. Isolation and characterisation of collagens from the skin of largefin longbarbel catfish(Mystus macropterus)[J]. Food Chemistry,2009,115(3):826-831.
[2]Mohammadi R,Mohammadifar M A,Mortazavian A M,et al. Extraction optimization of pepsin-soluble collagen from eggshell membrane by response surface methodology(RSM)[J]. Food Chemistry,2016,190(1):86-93.
[3]Singh P,Benjakul S,Maqsood S,et al. Isolation and characterisation of collagen extracted from the skin of striped catfish(Pangasianodon hypophthalmus)[J]. Food Chemistry,2011,124(1):97-105.
[4]Liu D,Liang L,Regenstein J M,et al. Extraction and characterisation of pepsin-solubilised collagen from fins,scales,skins,bones and swim bladders of bighead carp(Hypophthalmichthys nobilis)[J]. Food Chemistry,2012,133(4):1441-1448.
[5]王珮,苏秀榕,张永飞,等.鮟鱇鱼皮胶原蛋白酶提取最优工艺研究与结构表征[J].食品科学,2013,34(7):217-222.
[6]刘贤敏,刘晋,刘康,等. 2010年华南地区金鲳鱼养殖报告[J].当代水产,2011(2):27-28.
[7]顾赛麒,李莉,王锡昌,等.人工养殖大鲵皮胶原蛋白的性质研究[J].食品科学,2014,35(9):74-79.
[8]Chen S J,Chen H,Xie Q N,et al. Rapid isolation of high purity pepsin-soluble type I collagen from scales of red drum fish(Sciaenops ocellatus)[J]. Food Hydrocolloid,2016,52(4):68-77.
[9]马俪,王晓丹,程贺,等.响应面法优化酶法提取鳕鱼皮中胶原蛋白条件[J].中国酿造,2010,29(9):83-85.
[10]严子军,纪洁清,刘永.响应面优化酶溶性罗非鱼鳞胶原蛋白的提取工艺[J].广东农业科学,2013,40(18):86-88.
[11]GB 5009.3-2010食品中水分的测定[S].北京:中国标准出版社,2010.
[12]GB/T 5009.5-2010食品中蛋白质的测定[S].北京:中国标准出版社,2010.
[13]GB 5009.4-2010食品中灰分的测定[S].北京:中国标准出版社,2010.
[14]GB/T 5009.6-2003食品中脂肪的测定[S].北京:中国标准出版社,2003.
[15]Nagai T,Araki Y,Suzuki N. Collagen of the skin of ocellate puffer fish(Takifugu rubripes)[J]. Food Chemistry,2002,78(2):173-177.
[16]Duan R,Zhang J J,Du X Q,et al. Properties of collagen from skin,scale and bone of carp(Cyprinus carpio)[J]. Food Chemistry,2009,112(3):702-706.
[17]Feng W,Zhao T,Zhou Y,et al. Optimization of enzyme-assisted extraction and characterization of collagen from Chinese sturgeon(Acipenser sturio Linnaeus)skin[J]. Pharmacognosy Magazine,2013,9(1):32-37.
[18]任国艳,詹永献,郭金英,等.响应面优化草鱼鱼鳔酶溶胶原蛋白的提取工艺[J].食品科学,2012(22):154-157.
[19]Laemmli U K. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4[J]. Nature,1970,227(5259):680-685.
[20]杨玲,赵燕,鲁亮,等.鲟鱼鱼皮胶原蛋白的提取及其理化性能分析[J].食品科学,2013,34(23):41-46.
[21]程汉良,蒋飞,彭永兴,等. 野生与养殖草鱼肌肉营养成分比较分析[J].食品科学,2013,34(13):266-270.
[22]刘世禄,王波,张锡烈,等.美国红鱼的营养成分分析与评价[J].渔业科学进展,2002,23(2):25-32.
[23]Nalinanon S,Benjakul S,Kishimura H. Collagens from the skin of arabesque greenling(Pleurogrammus azonus)solubilized with the aid of acetic acid and pepsin from albacore tuna(Thunnus alalunga)stomach[J]. Journal of the Science of Food and Agriculture,2010,90(9):1492-1500.
[24]Yan M,Li B,Zhao X,et al. Characterization of acid-soluble collagen from the skin of walleye pollock(Theragra chalcogramma)[J]. Food Chemistry,2008,107(4):1581-1586.
[25]Doyle B B,Bendit E G,Blout E R. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers,1975,14(5):937-957.
[26]Muyonga J H,Cgb C,Duodu K G. Fourier transform infrared(FTIR)spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch(Lates niloticus)[J]. Food Chemistry,2004,86(3):325-332.
[27]Jackson M,Choo L P I,Watson P H,et al. Beware of connective tissue proteins:Assignment and implications of collagen absorptions in infrared spectra of human tissues[J]. Biochimica Et Biophysica Acta,1995,1270(1):1-6.
[28]Yousefi M,Ariffin F,Huda N. An alternative source of type I collagen based on by-product with higher thermal stability[J]. Food Hydrocolloid,2017,63(3):72-82.
[29]Chuaychan S,Benjakul S,Kishimura H. Characteristics of acid-and pepsin-soluble collagens from scale of seabass(Lates calcarifer)[J]. LWT-Food Science and Technology,2015,63(1):71-76.
[30]张俊杰,段蕊,刘佳梅,等.鲤鱼鱼皮和鱼骨酶溶性胶原蛋白性质异同的分析[J].食品科学,2008,29(12):128-131.
[31]沈菊泉,汤俊,沈亚领,等.酸法制备牛皮胶原蛋白及其结构性质研究[J].食品工业,2009(4):43-46.
[32]张玲,芮汉明,张立彦.酶法提取猪皮胶原及产物性质分析[J].食品科学,2013,34(19):123-127.
Optimizationofextractionprocessandbasicpropertiesforpepsin-solublecollagenfromGoldenpompanoskin
LIAOWei,XIAGuang-hua,WANGJia-mei,YANGJin-kun,LIYong-cheng,SHENXuan-ri*
(College of Food Science and Technology,Hainan University,Haikou 570228,China)
To improve the utilization rate of fish skin in processing by-product ofGoldenpompano,this paper used the response surface Box-Behnken method to optimize the extraction process of pepsin-soluble collagen(PSC)from the skin ofGoldenpompano. Based on the previous single factor experiment,the model was established by three factors(enzyme concentration,liquid-to-solid ratio and extraction time). In addition,the basic properties of PSC were characterized and compared with acid-soluble collagen(ASC)by Sodium Dodecyl Sulfate Poly Acrylamide Gel Electrophoresis(SDS-PAGE),Attenuated Total Reflectance Fourier Transform Infrared spectroscopy(ATR-FTIR)and Differential Scanning Calorimeter(DSC). The results showed that the optimum extraction conditions were 1.5% enzyme concentration,23∶1 mL/g liquid-to-solid ratio,and 27.5 h extraction time. Under this condition,the actual yield of collagen ofGoldenpompanoskin was 64.68%,which was close to the predicted value(65.17%). Moreover,the PSC obtained in this experiment had higher denaturation temperature(30.44 ℃)and preliminarily identified as type I collagen,which was similar to the electrophoretic and infrared peaks of ASC. The technical reference for the extraction of PSC fromGoldenpompanoskin was given in this research.
Goldenpompanoskin;collagen;response surface methodology;extraction process
TS254.9
A
1002-0306(2017)19-0142-06
10.13386/j.issn1002-0306.2017.19.027
2017-03-29
廖伟(1993-),男,硕士研究生,研究方向:农产品加工及贮藏,E-mail:wei_food@163.com。
*通讯作者:申铉日(1968-),男,博士,教授,研究方向:食品科学和水产品精深加工等领域,E-mail:shenxuanri2009@163.com。
海南省自然基金(317038);海南省重点研发计划(ZDYF2017104);海南大学科研启动基金资助项目(kyqd1662)。
