利用改良SOE-PCR技术定点突变TuMV C4-VPg基因
2017-10-19李国亮张淑江章时蕃谢露露剑王晓武孙日飞
李国亮 钱 伟 张淑江 李 菲 章时蕃 张 慧 谢露露 武 剑王晓武 孙日飞
利用改良SOE-PCR技术定点突变TuMV C4-VPg基因
李国亮 钱 伟 张淑江 李 菲 章时蕃 张 慧 谢露露 武 剑王晓武 孙日飞*
(中国农业科学院蔬菜花卉研究所,北京 100081)
芜菁花叶病毒(Turnip mosaic virus,TuMV)是白菜类蔬菜生产上的重要病害,其中TuMV VPg基因在TuMV侵染白菜类蔬菜的过程中起着至关重要的作用,且不同TuMV株系的致病性不同。本试验采用改良的重叠延伸PCR(SOE-PCR)技术,以TuMV C4-VPg基因序列为模板,定点突变TuMV C4-VPg与TuMV CDN1-VPg基因间5个差异核苷酸位点(决定5个氨基酸差异)。结果表明:通过SOE-PCR技术获得了5个TuMV C4-VPg基因的单点突变体,即TuMV C4-VPg-Ⅰ、TuMV C4-VPg-Ⅱ、TuMV C4-VPg-Ⅲ、TuMV C4-VPg-Ⅳ和TuMV C4-VPg-Ⅴ。
白菜类蔬菜;芜菁花叶病毒;VPg基因;重叠延伸PCR技术;单点突变
芜菁花叶病毒(Turnip mosaic virus,TuMV)属于马铃薯Y病毒科Y病毒属,是白菜类蔬菜生产上的主要病害之一。TuMV VPg蛋白是一种多功能蛋白,共价连接在病毒RNA的5′末端,类似帽子结构,在病毒复制的过程中起重要作用(Miyoshi et al.,2008),可与寄主拟南芥的翻译起始因子eIF(iso)4E互作,调控病毒RNA翻译的起始(Duprat et al.,2002)。Gallois等(2010)通过酵母双杂交试验发现寄主翻译起始因子eIF(iso)4E可以与VPg蛋白互作,通过调控病毒翻译的起始,从而对病毒的侵染产生干扰(Wittmann et al.,1997),在拟南芥eIF(iso)4E基因的帽结合蛋白中,将第46位和第92位氨基酸Trp突变为Leu后,eIF(iso)4E就不能与病毒VPg互作(Miyoshi et al.,2006);Dinkova等(2016)发现辣椒eIF4E的第94位和第107位氨基酸突变后,将影响TuMV VPg与eIF4E的互作,但eIF4E其他位置的突变对二者的互作没有影响。由此可知,关键氨基酸位点的变化对其功能的表达具有重要的影响,通过重叠延伸PCR技术(splicing by overlap extension PCR,SOE-PCR),可以快速、高效地获得单点突变体,为验证关键氨基酸位点的功能奠定基础。
重叠延伸PCR技术利用具有互补末端的特定引物,将两条PCR产物形成重叠链,在下一轮的扩增反应中,通过重叠链延伸来实现不同片段的拼接(熊爱生 等,2000;帅勇 等,2009)。该技术不需要限制性内切酶和连接酶的处理(Horton et al.,1989;Senanayake & Brian,1995),也不受突变位置及突变类型的限制,可以在DNA的任何位点插入突变(Urban et al.,1997;Gang et al.,2011)。重叠延伸PCR技术在生命科学领域已有广泛应用。翟玲等(2012)利用重叠延伸PCR技术,对LacZ报告基因的一些位点随机插入目标内含子,再对LacZ报告基因的活性进行比较分析,结果表明该方法与In-Fusion克隆相比有一定的优越性;李诺敏等(2013)利用重叠延伸PCR技术,对人tau基因进行定点突变,获得tau基因的6种同工异构体的克隆,进而在蛋白水平上验证了tau蛋白表达。该技术无需利用限制性内切酶,可以对基因的多个位置进行剪切和连接,具有很大的灵活性和简便性。
重叠延伸PCR技术即在体外定点突变基因位点,是一种获得单点突变基因的技术。芜菁花叶病毒(TuMV)侵染白菜类蔬菜后,TuMV VPg蛋白通过与白菜翻译起始因子eIF(iso)4E互作,促进病毒自身的增殖。为了进一步阐明不同TuMV株系间VPg基因的差异对TuMV致病性的影响,本试验采用改良的重叠延伸PCR技术,以TuMV C4-VPg基因为模板,定点突变核苷酸,克隆了5个单点突变基因,以期为揭示特定氨基酸位点对病毒致病机制的影响奠定基础。
1 材料与方法
1.1 试验材料
试验于2016年9月在中国农业科学院蔬菜花卉研究所分子遗传实验室进行。TuMV C4株系、大肠杆菌trans 5α菌株由中国农业科学院蔬菜花卉研究所白菜育种课题保存。质粒小提试剂盒、DNA Marker、DNA Polymerase、DNA 回收试剂盒购自天根生化科技(北京)有限公司;克隆载体pEASY-T1 Cloning Kit购自全式金(北京)有限公司;卡那霉素购自西格玛奥德里奇(上海)贸易有限公司。
1.2 重叠延伸PCR引物设计及第1轮PCR反应体系
重叠延伸PCR引物设计遵循常规引物设计原则,突变碱基位于引物中央偏3′端,引物长度30 bp左右为佳,引物过短不利于2个长片段的融合。在每个差异核苷酸位点处分别设计正、反向引物。TuMV C4-VPg和TuMV CDN1-VPg氨基酸序列存在5个差异位点,分别标记为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ,分别设计5对引物,即bioC4-Ⅰ-R/F、bioC4-Ⅱ-R/F、bioC4-Ⅲ-R/F、bioC4-Ⅳ-R/F和bioC4-Ⅴ-R/F(表1),TuMV C4-VPg基因的两端引物分别为bio120213/bio120214。引物由生工生物工程(上海)有限公司合成。第1轮重叠延伸PCR反应体系为50 μL,其中包括10×PCR缓冲液5 μL,0.8 mmol·L-1dNTPs 4 μL,1.0 μmol·L-1上、下游引物各 1 μL,50 ng·L-1模板 DNA 5 μL,1 U Taq 酶1 μL,ddH2O补齐50 μL。PCR反应程序:94 ℃变性 5 min;94 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸30 s,35个循环。利用2%琼脂糖凝胶电泳对PCR扩增产物进行鉴定,利用TIANGEN胶回收试剂盒对目标长度条带进行切胶回收。

表1 重叠延伸PCR引物
1.3 重叠延伸PCR技术过程解析
重叠延伸PCR技术利用变异位点处正、反向引物以及该基因两端引物进行第1轮PCR扩增,PCR产物形成包含overlap的重叠链;在第2轮PCR扩增中,通过overlap重叠链的延伸,可以将重叠链连接起来,如图1所示。以TuMV C4-VPg质粒为模板,进行第1轮PCR扩增。TuMV C4-VPg和TuMV CDN1-VPg氨基酸序列存在5个差异位点,将VPg基因序列分为6个片段,分别为P1、P2、P3、P4、P5、P6,以 TuMV C4-VPg质粒为模板,以 bio120213/bioC4-Ⅰ-R和 bioC4-Ⅰ-F/bio120214组合为引物,分别扩增短片段P1和P23456。
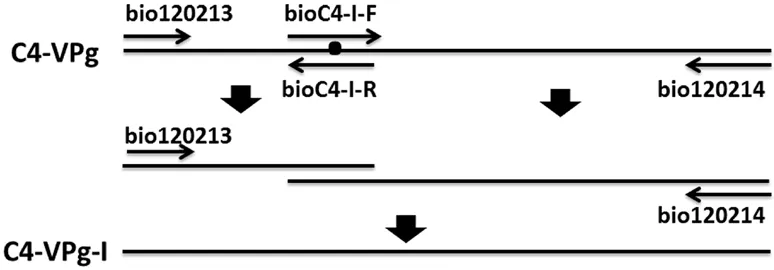
图1 重叠延伸PCR扩增示意图
利用2%琼脂糖凝胶电泳分别对P1和P23456的PCR扩增产物进行检测鉴定,并利用TIANGEN胶回收试剂盒回收目标条带DNA,等比例混合。取上述混合DNA为模板,以bio120213/bio120214为引物,扩增包含第1个突变位点的P1-23456片段。第2轮PCR反应体系亦为50 μL,其中包括10×PCR缓 冲 液 5 μL,0.8 mmol·L-1dNTPs 4 μL,1.0 μmol·L-1上、下游引物各1 μL,两端片段PCR产物都调至100 ng·L-1,各取5 μL,1 U Taq酶1 μL,ddH2O补齐50 μL。PCR反应程序:94 ℃变性5 min;94 ℃变性30 s,50~65 ℃退火(当两条片段融合时,通过设置退火温度梯度,寻找最合适的退火温度)30 s,72 ℃延伸40 s,35个循环。对PCR扩增产物进行切胶回收,回收的DNA片段作为目标基因与pEASY-T1载体重组,均匀涂抹在固体LB培养基上,37 ℃过夜培养12 h。挑取若干单菌落,重悬在1 mL液体LB培养基中,在37 ℃、200 r·min-1的摇床上摇菌4 h。取3 μL菌液为模板,以bio120213/bio120214为引物,进行PCR鉴定。克隆载体过程参考全式金(北京)有限公司关于克隆载体pEASY-T1 Cloning Kit的操作指南。
2 结果与分析
2.1 TuMV CDN1-VPg与TuMV C4-VPg氨基酸差异位点分析
利用DNAMAN 5.0软件对TuMV C4-VPg和TuMV CDN1-VPg氨基酸序列进行比对,发现二者存在5个差异氨基酸位点,即第52位异亮氨酸I/亮氨酸L,二者同为非极性疏水性氨基酸;第97位谷氨酸E/赖氨酸K,前者为酸性氨基酸,后者为碱性氨基酸;第101位和第105位天冬酰胺N/天冬氨酸D,前者为极性氨基酸,后者为酸性氨基酸;第117位异亮氨酸I/缬氨酸V,二者都为非极性疏水性氨基酸(图2)。
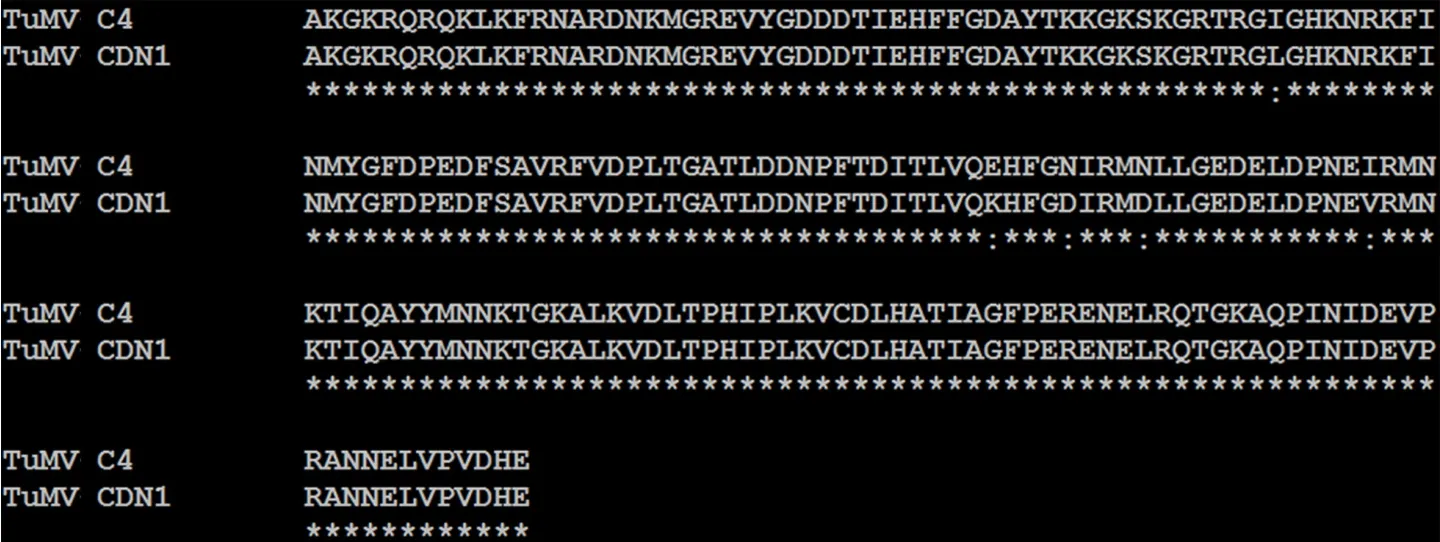
图2 TuMV CDN1/C4-VPg氨基酸序列比对结果
2.2 利用改良SOE-PCR技术定点突变TuMV C4-VPg-Ⅰ基因
经过序列比对,TuMV C4-VPg与TuMV CDN1-VPg蛋白间存在5个氨基酸差异位点,在这5个差异氨基酸位点所对应的核苷酸位点处,设计正、反向引物(表1),即bioC4-Ⅰ-R/F、bioC4-Ⅱ-R/F、bioC4-Ⅲ-R/F、bioC4-Ⅳ-R/F和bioC4-Ⅴ-R/F。第1轮PCR扩增获得P1(160 bp)和P23456(448 bp),第 2轮 PCR 扩增获得 P1-23456,即 C4 VPg-Ⅰ(576 bp)。两轮PCR扩增后,将获得的PCR产物通过2%琼脂糖凝胶电泳检测,确认在退火温度为53 ℃的PCR反应体系中,可以获得目标片段长度的产物(图3)。同时,通过梯度PCR仪,分别找到适于TuMV C4-VPg另外4个差异位点的退火温度,分别为58、50、55、55 ℃。
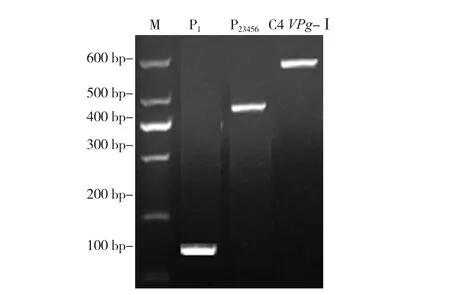
图3 P1、P23456以及C4 VPg-Ⅰ 目标片段电泳检测结果M,MarkⅠ。
第2轮PCR扩增后,将扩增产物通过2%琼脂糖凝胶电泳检测鉴定,采用天根胶回收试剂盒对目标长度的条带进行切胶回收纯化(由于第2轮PCR反应中会出现非特异性扩增,所以此时不宜用PCR产物纯化试剂盒进行纯化,应该通过琼脂糖凝胶电泳鉴定后,切取目标长度的条带进行回收),纯化产物连接到pEASY-T1载体,转化到大肠杆菌trans 5α。挑取2个阳性克隆菌液送美吉生物科技有限公司进行Sanger测序检测。通过上述方法,分别对TuMV C4/CDN1-VPg基因序列存在的5个核苷酸差异位点进行定点突变,经过Sanger测序检测,5个突变位点均达到预期要求,获得5个单点突变体即TuMV C4-VPg-Ⅰ、TuMV C4-VPg-Ⅱ、TuMV C4-VPg-Ⅲ、TuMV C4-VPg-Ⅳ和TuMV C4-VPg-Ⅴ(图 4)。
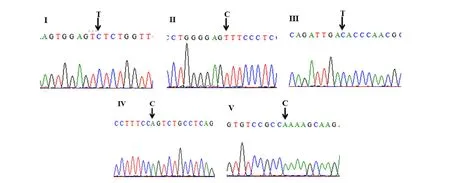
图4 5个单点突变体基因的测序检测Ⅰ,TuMV C4-VPg-Ⅰ;Ⅱ,TuMV C4-VPg-Ⅱ;Ⅲ,TuMV C4-VPg-Ⅲ;Ⅳ,TuMV C4-VPg-Ⅳ;Ⅴ,TuMV C4-VPg-Ⅴ。
3 结论与讨论
Rusholme等(2007)利用大白菜抗/感病亲本,定位克隆了retr01与ConTR01基因,其中retr01为隐性抗病基因,ConTR01为显性抗病基因,这2个基因分别位于R4和R8染色体上,共同控制TuMV CDN1株系;Qian等(2013)以大白菜感病材料极早春和抗病材料BP8407为亲本,采用BSA法,通过筛选SSR和InDel标记,最终定位克隆retr02基因,该基因为隐性抗病基因,具有广谱抗性,尤其对TuMV C4株系表现高度抗性。白菜类蔬菜中不同的抗病毒基因对TuMV不同株系的抗性也不一样,通过探究TuMV CDN1与C4株系间的差异,可以为揭示白菜类蔬菜抗病毒基因的抗病机制奠定基础。
李国亮等(2017)通过酵母双杂交试验和双分子荧光互补试验表明:TuMV-C4与白菜eIF(iso)4E.a可以相互作用,而与白菜eIF(iso)4E.c不能相互作用;TuMV-UK1与白菜eIF(iso)4E.c可以相互作用,而与白菜eIF(iso)4E.a不能相互作用,通过对TuMV-UK1 VPg与TuMV-C4 VPg氨基酸序列进行比对,发现二者间存在4个氨基酸差异位点,且相对集中,分别是第89位(F/L)、第105位(N/D)、第 114位(P/S)和第119位(M/V)氨基酸,因此推测,某个关键氨基酸位点的变化可以影响其功能的表达。重叠延伸PCR技术可以在体外定点突变核苷酸,制备单点突变体用于其功能研究,该技术已有很多报道,但其反应体系尚待优化。雒丽娜等(2012)采用重叠延伸PCR技术,以重组的人组织型纤溶酶原激活剂rPA基因为模板,成功实现3个位点的定点突变,为rPA基因的进一步克隆和功能研究奠定了基础。孟祥平等(2013)通过优化中间引物互补长度、SOE-PCR体系的模板浓度、起始模板的纯度以及循环次数等条件,成功获得特异性强和保真度高的BTRCP-Cyp A融合基因。
常规获得一段DNA的方法包括限制性内切酶直接分离法、文库筛选法、体外扩增法和人工合成法等。基因功能的研究往往集中于其中的若干个碱基变化,重叠延伸PCR技术对于研究体外基因突变的功能,提供了一种有利的方法。在该技术过程中经常出现扩增条带弥散和非特异性扩增等情况,因此需要整理一个优化的技术流程,来快速、准确地定点突变基因。重叠延伸PCR依据两条模板链中间的overlap进行重叠,互为模板进行延伸,因此overlap长度对第2轮PCR扩增比较重要,建议中间引物长度为30 bp左右,引物过短容易出现扩增条带弥散现象;引物中GC含量在55%以上,有利于第2轮PCR扩增过程中两段DNA片段融合;第2轮PCR扩增前,应将第1轮PCR扩增产物进行纯化,避免第1轮PCR扩增过程中剩余的中间引物对第2轮PCR扩增产生影响;在第2轮PCR扩增过程中,模板过多或过少都易产生弥散或非特异扩增,应将第1轮PCR扩增的两组产物等量混合(各取500 ng左右,50 μL扩增体系),作为第2轮PCR扩增的模板;另外,在第2轮PCR扩增过程中,通过设置退火温度梯度,可以快速找到扩增该位点的适宜退火温度,节约时间。本试验通过梯度PCR仪,找到适于TuMV C4-VPg 5个差异位点的退火温度,分别为53、58、50、55、55 ℃。
随着植物基因定位、克隆的不断发展,科学家们发现野生型个体和突变型个体往往只在某个基因上有若干个碱基的变化,最终导致其表型的巨大变化,但目前植物体内基因的定点突变技术受转基因技术及植物组织培养技术的影响,推广比较困难。重叠延伸PCR(SOE-PCR)技术是在植物体外对目标基因定点突变,成本低、简单易操作,可以高效用于验证目标氨基酸位点的功能。随着二代、三代高通量测序的成熟,对目标基因上的SNP位点不断深入挖掘,通过重叠延伸PCR技术,以SNP位点为桥梁,可以将基因定向转化为单点突变体,为深入研究氨基酸位点的功能奠定基础。
李国亮,钱伟,张淑江,李菲,章时藩,张慧,谢露露,武剑,王晓武,孙日飞.2017.白菜翻译起始因子eIF(iso)4E.a/c与芜菁花叶病毒TuMV-C4/UK1蛋白互作分析.园艺学报,44(7):1299-1308.
李诺敏,刘可夫,李灵芸,何放,顾文彬,董一名,庆宏.2013.改进重叠延伸PCR克隆tau基因6种同工异构体.北京理工大学学报,33(88):871-875.
雒丽娜,王盛,王玉炯.2012.利用重叠延伸PCR技术进行定点突变研究.安徽农业科学,40(4):719-722.
孟祥平,杨建英,乔晓岚,梁玲霞,席守民.2013.优化重叠延伸PCR条件构建BTRCP-CypA融合基因.生物技术,23(6):51-54.
帅勇,胡兴旺,易朵,王成,赵晓蒙,周畅.2009.重叠延伸PCR法构建小鼠Sumf1基因的定点突变真核表达载体.生命科学研究,13(5):430-436.
熊爱生,彭日荷,陈建民,李贤,姚泉洪.2000.透明颤菌血红蛋白(VHb)基因合成及原核生物中的效应.上海农业学报,16(3):19-24.
翟玲,董娜,张雅慧,黄勇,周岳华.2012.不需酶切位点的重叠延伸PCR在克隆表达中的应用.南昌大学学报:理科版,36(3):273-276.
Dinkova T D,Martinez-Castilla L,Cruz-Esp í ndola M A.2016.The diversification of eIF4E family members in plants and their role in the Plant-Virus interaction//Hern á ndez G,Rosemary J.Evolution of the Protein Synthesis Machinery and Its Regulation.〔S.l.〕:Springer International Publishing:187-205.
Duprat A,Caranta C,Revers F,Menand B,Browning K S,Robaglia C.2002.The Arabidopsis eukaryotic initiation factor(iso)4E is dispensable for plant growth but required for susceptibility to potyviruses.The Plant Journal,32(6):927-934.
Gallois J L,Charron C,S á nchez F,Pagny G,Houvenaghel M C,Moretti A.2010.Single amino acid changes in the Turnip mosaic virus viral genome-linked protein(VPg)confer virulence towards Arabidopsis thaliana mutants knocked out for eukaryotic initiation factors eIF(iso)4E and eIF(iso)4G.Journal of General Virology,91(1):288-293.
Gang H,Wen Q,Gao Q,Zhang F,Bai Y.2011.An efficient and rapid method for cDNA cloning from difficult templates using codon optimization and SOE-PCR:with human RANK and TIMP2 gene as examples.Biotechnology Letters,33(10):1939-1947.
Horton R M,Hunt H D,Ho S N,Pullen J K,Pease L R.1989.Engineering hybrid genes without the use of restriction enzymes:gene splicing by overlap extension.Gene,77(1):61-68.
Miyoshi H,Suehiro N,Tomoo K,Muto S,Takahashi T,Tsukamoto T,Ohmori T,Natsuaki T.2006.Binding analyses for the interaction between plant virus genome-linked protein(VPg)and plant translational initiation factors.Biochimie,88(3):329-340.
Miyoshi H,Okade H,Muto S,Suehiro N,Nakashima H,Tomoo K,Natsuaki T.2008.Turnip mosaic virus VPg interacts with Arabidopsis thaliana eIF(iso)4E and inhibits in vitro translation.Biochimie,90(10):1427-1434.
Qian W,Zhang S,Zhang S,Li F,Zhang H,Wu J,Wang X,Sun R.2013.Mapping and candidate-gene screening of the novel Turnip mosaic virus resistance gene retr02 in Chinese cabbage(Brassica rapa L.).Theoretical and Applied Genetics,126(1):179-188.Rusholme R L,Higgins E E,Walsh J A,Lydiate D J.2007.Genetic control of broad-spectrum resistance to Turnip mosaic virus in Brassica rapa(Chinese cabbage).Journal of General Virology,88(11):3177-3186.
Senanayake S D,Brian D A.1995.Precise large deletions by the PCR-based overlap extension method.Molecular Biotechnology,4(1):13.
Urban A,Neukirchen S,Jaeger K E.1997.A rapid and efficient method for site-directed mutagenesis using one-step overlap extension PCR.Nucleic Acids Research,25(11):2227.
Wittmann S,Chatel H,Fortin M G,Laliberte J.1997.Interaction of the viral protein genome linked of Turnip mosaic virus with the translational eukaryotic initiation Factor(iso)4E of Arabidopsis thaliana using the Yeast Two-Hybrid system.Virology,234(1):84-92.
Abstract:Turnip mosaic virus(TuMV)was an important disease for Brassica rapa L. ssp. pekinensis production,and the TuMV VPg gene had played a vital role infecting production process.While,the pathogenicity of different TuMV strains was diverse.This experiment adopted improved splicing by overlap extension PCR(SOE-PCR)technology,took TuMV-C4 VPg gene sequence as template,carried out sitedirected mutagenesis on 5 different single-nucleotides between TuMV C4-VPg and TuMV CDN1-VPg genes.The results indicated that 5 single point mutants of TuMV C4-VPg were obtained by the optimized SOE-PCR,i.e.TuMV C4-VPg-Ⅰ,TuMV C4-VPg-Ⅱ,TuMV C4-VPg-Ⅲ,TuMV C4-VPg-Ⅳ and TuMV C4-VPg-Ⅴ.
Key words:Brassica rapa L. ssp. pekinensis;Turnip mosaic virus(TuMV);VPg gene;Splicing by overlap extension PCR(SOE-PCR);Single point mutant
Site-directed Mutagenesis of TuMV C4-VPg Gene by Optimized Splicing by Overlap Extension PCR
LI Guo-liang,QIAN Wei,ZHANG Shu-jiang,LI Fei,ZHANG Shi-fan,ZHANG Hui,XIE Lu-lu,WU Jian,WANG Xiao-wu,SUN Ri-fei*
(Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
李国亮,博士研究生,专业方向:蔬菜遗传育种,E-mail:li_guo_liang@126.com
*通讯作者(Corresponding author):孙日飞,研究员,博士生导师,专业方向:蔬菜遗传育种,E-mail:sunrifei@caas.cn
2017-07-11;接受日期:2017-08-30
国家自然科学基金项目(31372069),“十二五”国家科技支撑计划项目(2013BAD01B04-03),农业部园艺作物生物学与种质创制重点实验室项目
