侵袭性纤维瘤病CT、MRI强化特征及病理基础
2017-10-19王晓霞WANGXiaoxia
王晓霞 WANG Xiaoxia
蒋 黎 JIANG Li
张林川 ZHANG Linchuan
侵袭性纤维瘤病CT、MRI强化特征及病理基础
王晓霞 WANG Xiaoxia
蒋 黎 JIANG Li
张林川 ZHANG Linchuan
作者单位新疆维吾尔自治区人民医院放射影像中心新疆乌鲁木齐 830000
目的 探讨侵袭性纤维瘤病(AF)的CT、MRI表现,重点分析其强化特征及病理关系,以提高诊断准确性。资料与方法 回顾性分析33例经病理证实的AF患者的影像资料,并与术后病理结果进行对照,探讨特征影像的病理基础。结果33例患者中,腹外型17例,腹壁型4例,腹内型12例;15例呈浸润性生长,18例呈膨胀性生长。CT扫描8例呈均匀渐进性强化;1例病灶周围强化,中心未见明显强化;1例病灶边缘包膜强化;23例病灶呈不均匀、渐进性强化,其中9例增强后稍低密度区明显强化,稍高密度区轻度强化,呈现密度“反转”特征。MRI示7例病灶信号不均,以稍长T1、稍长T2信号为主,其中5例可见不规则短T2信号区,增强后稍长T1、稍长T2信号区强化明显,短T2信号区轻度强化。病理镜下见肿瘤由不同比例的梭形成纤维细胞和胶原纤维组成,细胞密集区域对应稍低密度、长T2信号区,增强后明显强化;而胶原纤维丰富区对应稍高密度、短T2信号区,增强后轻度强化。结论 AF的CT和MRI强化方式具有一定的特征性,有助于术前诊断。
纤维瘤;磁共振成像;体层摄影术,X线计算机;病理学,外科
侵袭性纤维瘤病(aggressive fibromatosis,AF)是一类具有局部侵袭能力的成纤维细胞、肌成纤维细胞性肿瘤,又称为韧带样纤维瘤病等,具有局部侵袭、局部复发,但不向远处转移的特征。AF由于术前诊断不清,术中病理常为良性,以致切除范围不足,进而需要二次扩大切除或易短期内复发,CT及MRI可清楚地显示病变范围及与周围组织的关系,因此术前行CT及MRI检查,对于本病的诊断、治疗、降低复发风险具有重要意义。既往对AF影像学特征分析研究较多,但对其强化特征及CT、MRI联合检查分析较少,本研究结合相关文献及病理基础对33例AF患者的完整影像学资料进行分析,探讨其CT、MRI表现,提高对本病的影像诊断水平。
1 资料与方法
1.1 研究对象 收集新疆维吾尔自治区人民医院2012年1月-2016年9月收治的AF患者33例,男9例,女24例;年龄1岁10个月~65岁,中位年龄33.4岁。分型:腹外型17例,其中位于四肢8例(上肢5例、小腿3例),胸壁2例,胸腔内3例,臀部1例,腋窝1例,颈部1例,腹股沟区1例;腹壁型4例;腹内型12例。原发性29例,复发性4例。病程1个月~13年,临床主要表现为无痛性肿块26例,局部疼痛7例。33例行CT平扫加动态增强扫描,7例同时行CT及MRI扫描。
1.2 仪器与方法 采用Toshiba 320排CT机,扫描参数:电压100/120 kV,电流240~330 mAs,层厚与层距5 mm,薄层重建层厚和层距1 mm,同时行多角度二维重建。增强扫描采用高压注射器经肘前静脉注射非离子型对比剂碘海醇(350 mgI/ml),剂量1.0~ 1.5 ml/kg,注射速度2.5 ml/s。采用GE Signa 1.5T MR扫描机,常规平扫包括T1WI(TR 450~600 ms,TE 14 ms)、T2WI(TR 3000~4500 ms,TE 90~120 ms)压脂序列轴位、矢状位、冠状位(TR 2800~3200 ms,TE 42~150 ms)及表观扩散系数(DWI)(b值=0、600 s/mm2)。增强扫描对比剂为钆喷替酸葡甲胺,剂量为0.1 mmol/kg,静脉团注后均行轴位、矢状位、冠状位T1WI加脂肪抑制扫描。
1.3 图像分析 由2位影像科主任医师进行图像分析,并记录病灶的数量、大小、密度/信号、强化程度和方式及其与周围组织的关系。平扫时将肿块密度/信号与周围软组织进行对比,分为低、等、高密度/信号,若1个病灶内兼有2种或2种以上的密度/信号则认为是混杂密度/信号。CT选取静脉期为强化最大期,计算其与CT平扫值的差,根据强化值分为3组,①轻度强化:差值≤30 HU;②中度强化:30 HU<差值≤60 HU;③明显强化:60 HU<差值≤90 HU。MRI增强后信号与邻近正常肌肉相近者为轻度强化,明显高于肌肉但低于血管者为中度强化,接近血管强化密度或信号者为高度强化。强化形态分为5型,①均匀强化:增强后无肉眼可辨的密度不均匀区;②不均匀强化:增强后可见点、条状及片状强化显著区;③周围强化:指病灶外围部分强化而中心部分不强化;④包膜强化:指病灶边缘被薄层强化环绕,强化的包膜层厚度小于结节半径的1/2;⑤无强化。
1.4 组织病理学检查 33例患者肿块均行手术切除,分别行HE染色、特殊染色及免疫组织化学染色。
2 结果
2.1 影像学表现
2.1.1 分型、大小 33例患者肿瘤最大径2.2~25.5 cm,平均(7.9±4.6)cm。肿瘤最大径<5 cm 14例;>10 cm 10例,其中9例肿块巨大,占据整个腹、盆腔。肿块大小分布见表1。
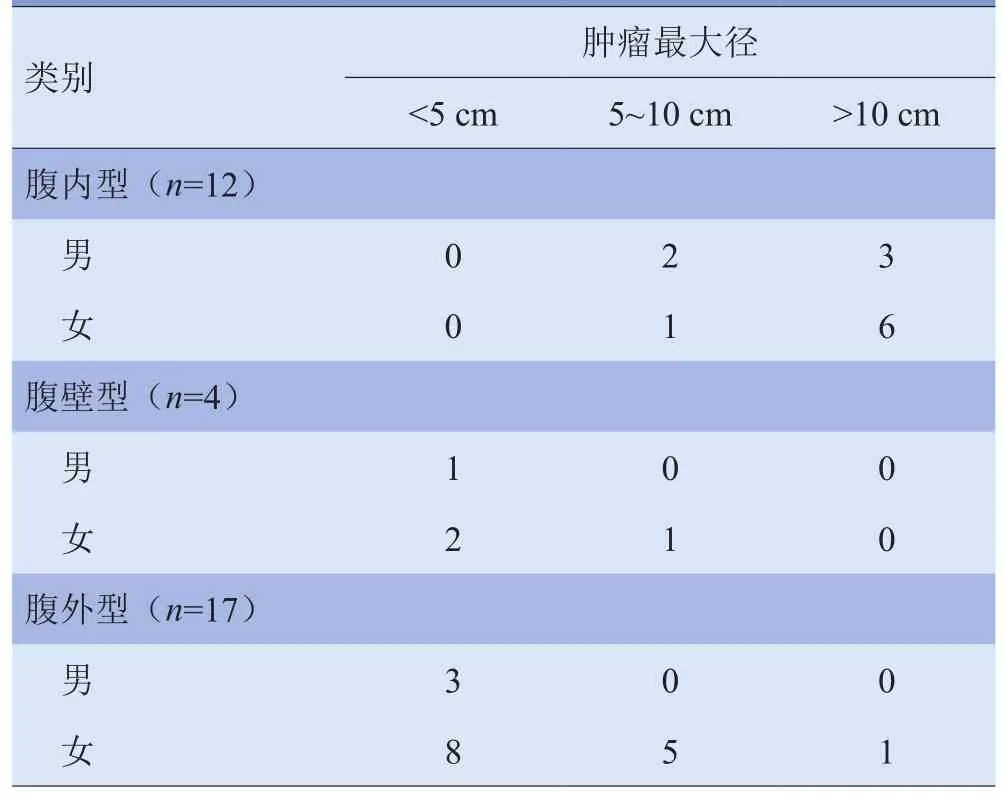
表1 不同类型AF患者不同性别的肿块大小分布(n=33)
2.1.2 形态、边界、生长方式及邻近结构情况 本研究中15例以膨胀性生长为主,呈梭形、类圆形,边界显示较清楚,包括2例腹壁型、8例腹内型及5例腹外型;18例以浸润性生长为主,与周围正常组织分界不清,包括2例腹壁型、4例腹内型及12例腹外型,其中1例腹壁型位于腹内斜肌,向内突向腹盆腔内。腹外型及腹壁型病灶体积相对较小,呈类圆形或沿肌肉长轴生长的肿块。腹内型呈不规则形、分叶状,与周围邻近肠系膜分界不清。
2.1.3 密度与强化方式 33例中,8例平扫密度均匀,25例密度不均匀。增强扫描8例呈均匀强化;1例病灶周围强化,中心未见明显强化;1例病灶边缘包膜强化;23例病灶呈不均匀、渐进性强化,见表2。
其中9例病变内低密度区明显强化,呈渐进性强化,至延迟期平均强化52 HU,稍高密度区呈轻度强化,平均强化约16 HU(图1)。延迟期在图像上显示可见密度“反转”的现象(图2)。
2.1.4 信号与强化特征 7例行MRI检查者,与邻近肌肉相比,以稍长T1、稍长T2信号为主,病灶T1WI呈低信号5例,等信号2例。T2WI上信号均略高或高于肌肉,脂肪抑制T2WI上信号更高,边界显示更清,5例病灶内可见不规则斑片、条索状短T2信号区,以STIR序列显示更为明显,增强扫描病灶均呈明显不均匀强化,以延迟扫描为明显,稍长T1、稍长T2信号区强化明显,低信号区轻度强化。3例病灶行DWI扫描,DWI上均呈稍高信号,1例病灶内见血管流空信号。周围软组织均未见水肿,邻近骨质未见明显吸收破坏,无论肿块大小,7例均未见坏死、液化、囊变区。见图3。

表2 33例AF患者病灶CT平扫及强化程度

图1 9例AF患者病灶内不同密度区强化平均CT值
2.2 组织病理学 AF病理大体标本:肿瘤质硬、韧,切面实性,呈灰白或灰红色,有编织状纹理,无明显液化、坏死;镜下见肿瘤主要由梭形成纤维细胞或肌成纤维细胞、纤维细胞和胶原纤维组成,排列成编织状、束状及平行片状;细胞丰富区,胶原纤维较少,逐渐过渡到少细胞区域,此区域细胞成分少,可见较多的胶原纤维,其间夹杂裂隙状血管,病变内血管多数为肌性动脉,呈裂隙状,及少数扩张的薄壁静脉,血管壁通常较完整;细胞异型性不明显,核分裂象罕见[1]。
2.3 病理与影像表现对照 由于肿瘤病理上无明显坏死液化,故CT未见明显水样低密度,MRI上亦无明显囊变信号。同一切片中,CT所示稍低密度区及MRI所示瘤内条状片状长T1短T2信号,镜下为局部细胞不丰富或致密纤维组织及胶原组织沉积,此外,CT所示稍高密度区及MRI上T2WI高信号区,镜下为富含不同形态的成纤维细胞、黏液及增生血管,病灶延迟强化明显区域内见较多血管壁完整的毛细血管。
3 讨论
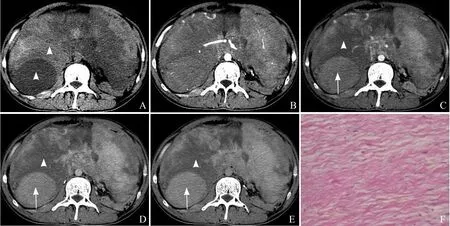
图2 男,26岁,腹内型AF。平扫见腹腔内巨大肿块影,密度不均,可见低密度区(箭)和稍高密度区(箭头),CT值45~58 HU,未见钙化及液化坏死(A);动脉期肿块强化不均,内可见供血动脉,起自肠系膜上动脉(箭,B);门静脉期平扫时相对低密度区明显强化(箭),稍高密度区轻度强化(箭头,C);延迟期肿块呈渐进性强化,可见密度“反转”现象(箭、箭头,D);延迟至3 min后见肿块仍呈渐进性强化,强化程度未见明显下降(箭、箭头,E);病理示肿瘤细胞呈束状、波浪状,细胞排列稀疏,间质有大量透明变性的胶原纤维(HE,×200,F)

图3 男,13岁,腹外型AF。CT平扫示右侧臀部不规则肿块,密度不均,CT值约28~61 HU,边缘及内部可见索条状、斑片状稍高密度影(箭,A);增强扫描示肿块呈不均匀渐进性强化,可见密度“反转”现象(箭,B);MRI平扫示信号不均匀, T2WI信号稍高,信号不均,肿块内可见不规则、条片状短T2信号区(箭头,C);增强扫描示肿块明显不均匀强化,短T2信号区轻度强化(D);CT(E)及MRI(F)冠状位重建可清楚地显示不规则稍高密度区与短T2信号区相对应(箭);病理示肿瘤富含大量梭形细胞及小血管(HE,×200,G)
AF起源于筋膜、肌肉或腱膜,首发体征为无痛性肿块[2],AF可发生于任何年龄,高发年龄为30~40岁,男女比约为 1∶2~1∶5[3]。本研究男女比为 1∶2.7,中位年龄为33.4岁,与文献报道基本一致。AF肿块通常大小不一,与病灶的发生部位有关,腹壁型及腹外型通常表浅,易于发现,故病变较小,主要表现为肌肉内或肌旁肿块,卵圆形呈浸润生长,一般肿块长轴与肌纤维走向平行,MRI软组织分辨率高,可以为外科手术范围提供更为准确的信息;腹内型病变不易发现,且无特殊不适症状,因此初诊时病变往往较大,有报道腹内型病灶极易包绕管腔结构[4],本研究中累及肠管3例、右侧输尿管1例、腹主动脉1例、肠系膜上、下动静脉5例及髂动脉1例,所有病例均未见肠管梗阻征象及血管内瘤栓。
AF的CT表现可以为均匀稍低、等或稍高密度,或者稍低密度内伴边缘及(或)内部条索、斑片状稍高密度[5],本研究8例平扫密度均匀,25例病灶密度不均匀,病灶内及(或)边缘见不规则、条片状稍高密度影;MRI信号亦多样,主要为T1WI上呈稍低信号,T2WI信号稍高,肿块内可见范围不等、形态不同的短T2信号区为其特征,5例病灶内可见特征性短T2信号区。本研究25例呈不均匀、渐进性强化,与文献报道[6]一致,原因是肿瘤内存在“漩涡”样排列的梭形细胞及细胞外胶原纤维,造成对比剂“易进难出”,大量存在于细胞间隙,使得随时间延迟肿瘤呈渐进性强化、范围扩大,细胞成分较多的区域强化明显,致密胶原纤维成分较多的区域强化程度较弱[7]。此外,肿瘤内显著扩张的裂隙状血管可能是肿瘤延迟强化的病理学基础。本研究发现肿块较大时,可包绕正常走行血管,病程越长,正常血管分支越多,肿块边缘及周围亦可见杂乱分布的小血管影,其原因可能为肿块在生长过程中需要大量血液供应,致使血管分支增多。与病理表现对照分析发现,病变的MRI信号特点主要与肿瘤细胞和胶原纤维的比例有关,肿瘤内细胞成分越丰富,胶原纤维的含量越少,T2WI序列上肿瘤的信号就越高。T2WI高信号区的主要病理成分为成纤维细胞、黏液成分和增生的血管;T2WI稍高信号区主要为成纤维细胞和胶原纤维,并可见厚壁扩张的小血管;而特征性条索状短T2信号为成熟的胶原纤维。本研究中9例病变CT平扫时低密度区明显强化,条片状稍高密度区轻度强化;7例患者同时行CT和MRI检查,对照2种检查图像,可以看到MRI显示特征性短T2信号区与CT上平扫稍高密度区对应,稍长T1、稍长T2信号区与稍低密度区对应,结合病理提示明显强化区富含梭形成纤维细胞及血管结构,而低强化区富含成熟胶原纤维等非细胞成分较多,病理成分不同导致病灶增强扫描后图像密度“反转”的特征。
Bauer等[8]认为病程较长患者的成熟胶原纤维较多与病程较长患者肿块较大、密度不均匀,其肿瘤内出现不强化或弱强化区几率较高的结论相符,本研究中10例肿块较大,最大径>10 cm,肿块内可见大片状弱强化区,病理镜下可见大片状成熟胶原纤维;冉云彩等[9]认为不同部位病灶大体形态和组织学形态相似,但复发潜能却不同,可能与梭形纤维细胞和胶原组织的比例不同有关,以浸润性生长或复发的病灶其细胞成分常多于胶原成分,本研究中4例复发,病变边界不清,平扫时密度不均,增强扫描明显不均匀强化,病理镜下可见大量梭形纤维细胞。
总之,AF常见于青年女性,密度、信号常不均匀,增强扫描后呈不均匀、渐进性强化,典型病例CT平扫稍低密度区对应稍长T1WI、稍长T2WI信号区,呈明显、渐进性强化,病理上对应富含梭形成纤维细胞及血管结构区域;稍高密度区对应短T2信号区,呈轻度强化,病理上对应富含成熟胶原纤维等非细胞成分,呈现密度“反转”现象。CT、MRI可显示肿瘤部位、大小、与周围组织结构的关系,通过其强化特点,对术前诊断具有重要价值,并且还可为选择治疗方法、确定手术切除范围及术后随访提供重要信息。
[1] 丁佩芬, 顾霞, 张咏英, 等. 腹内纤维瘤病10例临床病理分析. 诊断病理学杂志, 2015, 22(6): 328-331.
[2] 胡丽丽, 唐广山, 董浩. 侵袭性纤维瘤病的MRI表现与病理学相关性分析. 临床和实验医学杂志, 2014, 13(16):1384-1386.
[3] 李婷婷, 张永高, 王海洋, 等. 胸部腹外型侵袭性纤维瘤病的CT表现. 放射学实践, 2016, 31(4): 359-363.
[4] 梁汉欢, 张洪, 彭可雨. CT动态增强扫描对腹部侵袭性纤维瘤病的诊断价值. 中国临床医学影像杂志, 2014, 25(5):357-360.
[5] 罗振东, 陈卫国, 贾铭, 等. 侵袭性纤维瘤病CT表现及鉴别诊断. 中国医学影像学杂志, 2012, 20(6): 405-408.
[6] 郑红伟, 祁佩红, 薛鹏, 等. 腹外型韧带样型纤维瘤病的影像学表现及病理分析. 临床放射学杂志, 2014, 33(1): 100-103.
[7] Rhim JH, Kim JH, Moon KC, et al. Desmoid-type fibromatosis in the head and neck: CT and MR imaging characteristics.Neuroradiology, 2013, 55(3): 351-359.
[8] Bauer RW, Kerl JM, Weber E, et al. Lung perfusion analysis with dual energy CT in patients with suspected pulmonary embolism--influence of window settings on the diagnosis of underlying pathologies of perfusion defects. Eur J Radiol,2011, 80(3): e476-e482.
[9] 冉云彩, 程敬亮, 张勇. 儿童眶下缘侵袭性纤维瘤1例. 中国医学影像学杂志, 2015, 23(9): 672-673.
(本文编辑 周立波)
CT and MRI Enchancement Characteristics and Pathological Basis of Aggressive Fibromatosis
Purpose To explore CT and MRI representation of aggressive fibromatosis(AF) with key focus on analyzing its enhancement characteristics and pathological relations in order to improve diagnostic accuracy. Materials and Methods Imaging data of 33 AF patients confirmed by pathology was analyzed retrospectively and compared with postoperative pathological results to explore pathological basis of characteristics imaging.Results Of 33 patients, 17 were the type of outside abdomen, four abdominal wall and 12 within abdomen, 15 of infiltrative growth and 18 of expansive growth. Eight cases scanned by CT showed balanced and progressive enhancement. One case showed enhancement around the nidus but no obvious enhancement of the center. One case showed envelop enhancement of nidus edges. 23 cases showed unbalanced and progressive enhancement of the nidus, among which nine showed obvious enhancement on the lower density area after enhancement and slight enhancement of higher density area, representing characteristics of density reverse. MRI showed that unbalanced signal of seven nidus, most of which were with longer T1 and T2 signal. Among them, irregular short T2 signal area could be seen in five cases, with obvious enhancement of longer T1 and longer T2 signal area and slight enhancement of short T2 signal area after enhancement. Pathologically, tumor was comprised of spindle fibroblast and collagen fiber of different proportions. Cell dense region corresponds to long T2 signal area with relative lower density, which was obviously enhanced after enhancement. While collagen fiber rich region corresponded to short T2 signal area with relative higher density, which is slightly enhanced after enhancement.Conclusion CT and MRI enhancement method of AF are of certain characteristics, which are helpful for diagnosis before surgery.
Fibroma; Magnetic resonance imaging; Tomography, X-ray computed;Pathology, surgical
10.3969/j.issn.1005-5185.2017.09.008
张林川
Radiation Imaging Center, People's Hospital of Xinjiang Uygur Autonomous Region, Urumqi 830000, China
Address Correspondence to: ZHANG Linchuan E-mail: tomglinchuan@163.com
R730.49;R730.262
2017-03-19
修回日期:2017-06-24
中国医学影像学杂志
2017年 第25卷 第9期:666-670
Chinese Journal of Medical Imaging 2017 Volume 25 (9): 666-670
