α7神经型尼古丁受体激动剂PNU282987对APP/PS1小鼠海马组织中DYN-Ⅰ蛋白表达的影响
2017-10-17王晓玲邓于新董阳婷官志忠齐晓岚
王晓玲, 邓于新, 董阳婷, 官志忠,, 齐晓岚, 王 凡
α7神经型尼古丁受体激动剂PNU282987对APP/PS1小鼠海马组织中DYN-Ⅰ蛋白表达的影响
王晓玲1,2, 邓于新1,2, 董阳婷3, 官志忠1,2,3, 齐晓岚1,2, 王 凡4
目的研究特异性激动APP/PS1转基因小鼠脑组织中α7神经型尼古丁受体(α7 nAChR)水平后对海马组织DYN-Ⅰ蛋白的影响;探讨α7 nAChR在阿尔茨海默病 (Alzheimer disease,AD) 发病机制中的神经保护作用机制。方法实验动物分为对照组(Control)、野生加PNU282987组(WP)、APP/PS1转基因组(APP/PS1)和APP/PS1加PNU282987组(AP)各8只,WP和AP组给予α7 nAChRs 特异性激动剂PNU-282987,另两组给予生理盐水,给药方式为小鼠24 w龄时1 mg/kg腹腔注射PNU-282987,连续5 d。采用 Real-time PCR 法和蛋白免疫印迹 (Western Blot) 法分别测定小鼠海马组织中发动蛋白Ⅰ(DYN-Ⅰ) mRNA 和蛋白表达水平的变化。结果与control组相比,APP/PS1组海马组织中发动蛋白Ⅰ(DYN-Ⅰ) mRNA 和蛋白水平下降(P<0.05,P<0.01);而特异性激动α7 nAChR水平后,与对照组相比WP组中发动蛋白Ⅰ(DYN-Ⅰ) mRNA 和蛋白水平升高(P<0.05,P<0.01);与APP/PS1组相比AP组小鼠大脑海马组织中发动蛋白Ⅰ(DYN-Ⅰ) mRNA 和蛋白水平明显升高(P<0.01,P<0.01)。结论特异性激动APP/PS1转基因小鼠海马组织中α7 nAChR水平能够使网格蛋白内吞调节蛋白DYN-Ⅰ表达升高。这可能提示了α7 nAChR对突触有一定的保护作用,进一步说明α7 nAChR在阿尔茨海默病的发病中起着重要作用。
α7 神经型尼古丁受体; 阿尔茨海默病; APP/PS1转基因鼠; DYN-Ⅰ
Abstract:ObjectiveTo investigate the effect of specially agonism 7 neural nicotinic acetylcholine receptors (nAChR) on the expression of DYN-Ⅰ protein in the hippocampus of APP/PS1 transgenic mice,and to explore the neuroprotective role of 7nAChR in the pathogenesis of Alzheimer’s disease ( AD).MethodsExperimental animals were divided into four groups:Control group,Wild plus PNU282987 group (WP),APP/PS1 group and APP / PS1 plus PNU282987 group,8 mice each group,WP group and AP group were given with α7nAChRs specific agonist PNU-282987,the other two groups were given with saline for control,All groups were injected intraperitoneally for continuous 5 days at a dose of 1 ml / kg at 24 weeks old. After this the mRNA and protein level of dynamin Ⅰ (DYN-Ⅰ) in hippocampus of mice were detected by Real-time PCR and Western Blotting respectively.ResultsCompared with the control group,the mRNA and protein levels of dynamin Ⅰ (DYN-Ⅰ) in the hippocampus of the APP/PS1 group were decreased (P<0.05P<0.01);After specially agonism α7nAChRs with its specific agonist PNU282987,we validated the levels of dynamin Ⅰ (DYN-Ⅰ) mRNA and protein were increased compared with the control group (P<0.01P<0.01);Compared with the APP/PS1 group,the mRNA and protein levels of dynamin Ⅰ (DYN-Ⅰ) in the hippocampus of the AP group were increased (P<0.01P<0.01).ConclusionSpecially agonism the level of α7 nAChR in hippocampus of APP/PS1 transgenic mice can increase the expression of dendritic regulatory dynamin Ⅰ protein (DYN-Ⅰ). The result indicates that α7nAChR has a protective effect on synapse,suggesting that the receptor might play an important neuroprotective role in the pathogenesis of AD.
Keywords: α7 nAChR; AD; APP/PS1 transgenic mouse; DYN-Ⅰ
阿尔茨海默病 (Alzheimer’s disease,AD)是一种以智力缓慢性进行性丧失为特征的神经退行性变疾病,其主要临床表现为记忆力进行性降低,精神和性格异常,社会交往和适应能力降低。当前,AD 已成为继续心脑血管疾病后威胁我国老年人健康的又一重要病种。其主要神经病理特征为细胞外β-淀粉样蛋白 (β-Amyloid protein,Aβ)沉积所形成的老年斑、细胞内异常磷酸化的微管相关蛋白tau蛋白聚积所形成的神经原纤维缠结、中枢胆碱能神经元的丢失及累及皮质动脉和小动脉的血管淀粉样变性等[1]。目前对 AD 确切病因、发病机制尚未真正了解。近年来,由于 AD 转基因小鼠模型的成功培养,为研究 AD 提供了理想的工具。神经型乙酰胆碱受体(neuronal nicotinic acetylcholine receptor,nAChR)在AD中研究较多,α7 nAChR是分布最广的亚单位之一[2],具有调节认知、学习、记忆等功能[3,4],胆碱能系统障碍和神经损伤可能与α7 nAChR基因、结构及其功能异常有一定关联[5]。有报道指出在 AD 中最脆弱的神经元是那些高表达神经型尼古丁受体的神经元,特别是含有 α7 nAChR 亚单位,且在 AD患者胆碱能系统损伤与α7 nAChR 水平下降和突触损伤有关[6,7],其在调节神经可塑性方面具有独特的作用,在神经保护中起了重要的作用。有研究显示,阿尔茨海默病患者认知功能下降与突触联系丧失程度表现出较好的相关性,特别是与突触囊泡回收蛋白表达异常有关[8]。突触囊泡的循环回收过程主要是通过网格蛋白(clathrin)介导的内吞过程完成的,需要多种蛋白协调完成,而 DYN-Ⅰ就是其中一个重要蛋白。DYN-Ⅰ是Dynamin家族中的重要一员,它参与到网格蛋白介导的突触囊泡的内吞过程,在内吞回收突触囊泡过程中至关重要[9]。因此,本课题通过特异性激动APP/PS1转基因鼠脑组织α7 nAChR水平来研究在 AD 发病机制中,α7 nAChR的水平对DYN-Ⅰ蛋白表达的影响进行研究,进一步探讨这些改变之间是否具有一定的相关性,为进一步阐明 AD 发病机制提供一定的理论依据。
1 材料与方法
1.1 实验动物 AD转基因动物模型鉴定 雄性阿尔茨海默病APPswe/PSldE9双转基因模型小鼠(B6.Cg-Tg)及同背景雌性野生型小鼠,体重20~30 g,均购自上海南方模式生物公司[动物许可证号:SCXK(沪)2014-0002]。野生型小鼠和APP/PSl双转基因小鼠可配期为3~10 m,母鼠的妊娠期为 20 d左右,繁殖采用1只雄鼠与3只雌鼠同居的方式进行。成功繁殖后,当新生的小鼠年龄达到 2~3 w时剪鼠尾提取小鼠DNA,进行小鼠基因型鉴定。19~20 d后子鼠雌雄分笼饲养。实验动物遵照国家实验动物饲养和使用指南,采用独立通风柜饲养,动物房房常年温度控制在(24±2)℃,湿度40%~60%,光照时间8:00~21:30。所有动物均饲养于贵州医科大学实验动物中心 SPF 级环境。所有实验操作均获得贵州医科大学实验动物伦理委员会的许可。
1.2 试剂 α7 nAChRs 特异性激动剂PNU-282987购于sigma公司(美国);兔抗α7 nAChR(H-302)多克隆抗体、鼠抗β-actin单克隆抗体sc-81178、辣根过氧化物酶 (HRP) 标记的抗鼠二抗sc-2005均购于Santa Cruz 公司(美国);兔抗dynamin1单克隆抗体 (GTX61459)、高分子量蛋白 Marker (12-170kD)购于GeneTex公司(美国);辣根过氧化物酶 (HRP) 标记的抗兔二抗7074购于CST 公司(美国);5×蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒、PMSF蛋白酶抑制剂、抗体稀释液、封闭液均购自上海碧云天生物技术有限公司;超敏ECL化学发光试剂盒、聚乙烯二氟 (PVDF) 膜购于Amersham公司(美国);RNA逆转录试剂盒购于 Thermo 公司;Firststart Universal SYBR Green Master (Rox)购于 Roche 公司(德国);Trizol试剂购于Invitrogen 公司;2×Taq PCR MasterMix购于北京TIANGEN公司;DL2000 DNA Marker 购于日本TaKaRa公司;β-actin、DYN-Ⅰ定量PCR的引物均由上海生物工程有限公司设计并合成。
1.3 动物分组及药物处理 本实验将APPswe/PSldE9双转基因小鼠和同背景的野生小鼠分为4组各8只,雌雄各半。分别为A组:24 w野生型小鼠生理盐水对照组(Control);B组(WP组):24 w野生型小鼠1 mg/kg α7 nAChRs 特异性激动剂PNU-282987处理组;C组(APP/PS1组):24 w APPswe/PSldE9双转基因小鼠生理盐水对照组;D组(AP组):24 w APPswe/PSldE9双转基因小鼠α7 nAChRs 特异性激动剂PNU-282987处理组。
各组小鼠适应性饲养1 m后,B、D组在24 w龄大小时开始每日给予小鼠腹腔注射1 mg/kg α7nAChRs 特异性激动剂PNU-282987处理,A、C组只经小鼠腹腔注射等量的生理盐水,连续注射5 d。然后腹腔注射4%水合氯醛(0.2 ml/10 g)麻醉,开胸暴露小鼠心脏,穿刺针经左心室穿刺至升主动脉,用0.01 mol/L的PBS(pH 7.4)液40 ml灌注冲洗血管床约5 min,取出小鼠大脑组织,在冰上收集小鼠海马组织,于 -80 ℃ 冰箱保存备用。
1.4 方法
1.4.1 APP/PS1 转基因小鼠基因型鉴定 当新生的小鼠年龄达到2~3 w时剪取鼠尾:(1)DNA提取:剪取鼠尾0.5 cm,放入标记好的 EPP管中,每管加入500 μl鼠尾裂解液和50 μl的蛋白酶K(TaKaRa),56 ℃水浴锅过夜,酚/氯仿法提取和纯化基因组 DNA;(2)PCR反应:APP基因上游引物5’GACTGACCACTCGACCAGGTTCTG3’,APP基因下游引物5’CTTGTAAGTTGGATTCTCATATCCG3’,PS1基因上游引物5’AATAGAGAACGGCAGGAGC-
A3’PS1基因下游引物5’GCCATGAGGGCACTAATCAT3’,反应体系:上游、下游引物各0.5 μl,DNA 模板2 μl,2×Taq PCR MasterMix12.5 μl,ddH2O 8.5 μl。预变性 94 ℃ 3 min变性:94 ℃ 30 s;退火:55 ℃ 3 s;延伸:72 ℃ 1 min,共30个循环。最后延伸:72 ℃ 5 min,4 ℃保存,1.5%琼脂糖电泳观察PCR结果;(3) PCR产物的鉴定:PCR 产物用1.5%琼脂糖凝胶电泳后进行光密度扫描,用Syngene G:BOX EF2凝胶成像仪进行观察分析,观察琼脂糖凝胶上的PCR条带,同时有400 bp和600 bp出现条带者即为APP/PS1转基因小鼠。
1.4.2 实时荧光定量PCR 检测DYN-Ⅰ、β-actin mRNA 表达水平 采用Trizol一步法提取组织总 RNA,取3 μgRNA样品用RNA逆转录试剂盒将mRNA逆转录为cDNA,再以cDNA为模板进行实时荧光定量 PCR。其中DYN-Ⅰ、β-actin的引物序列见表1。用ABI Step One Plus型实时荧光定量PCR仪,采集DYN-Ⅰ、内参β-actin基因扩增各循环的荧光信号,以SDS2.1软件收集荧光信息和分析数据。分析结果时以β-actin为内参对照,计算DYN-Ⅰ基因在实验组与对照组的相对水平(RQ=2-△△Ct)。实验独立重复3次,每次3个复孔。

表1 荧光定量PCR引物序列及产物片段
1.4.3 Western印记检测实验小鼠海马组织中DYN-Ⅰ蛋白表达 取各组小鼠海马组织按RIPA∶PMSF=100∶1配制加入裂解液, 用冷冻离心机
12000 r/min、4 ℃、20 min离心,吸取上清液即为蛋白质。蛋白浓度采用BCA定量法测定;运用Western blotting法检测DYN-1蛋白表达水平及其内参的蛋白表达情况。用ImageJ软件进行图片像素灰度值分析结果,计算DYN-1蛋白条带与内参β-actin像素灰度的比值作为目的蛋白表达的相对水平。每组蛋白重复3次独立试验,每次3个复孔。

2 结 果
2.1 APPswe/PSldE9双转基因小鼠基因表型鉴定结果 见图1。以基因组 DNA 为模板扩增,当基因组DNA同时扩增出约400 bp及600 bp大小的条带即为APP/PS1转基因鼠。
2.2 各组中 DYN-Ⅰ mRNA 及蛋白表达水平 结果显示,用 Real-time PCR 和 Western blot 方法检测到与对照组相比,APP/PS1组小鼠海马组织中DYN-Ⅰ mRNA 及蛋白水平下降(P<0.05,P<0.01);而经特异性激动剂PNU-282987小鼠腹腔注射后,与对照组相比WP组小鼠大脑海马组织中DYN-Ⅰ mRNA 及蛋白表达水平升高(P<0.05,P<0.01);与APP/PS1组相比AP组小鼠大脑海马组织中DYN-Ⅰ mRNA 及蛋白表达水平明显升高(P<0.01,P<0.01)(图2A、2B)。

M为DL2000 DNA,Marker 1、3、4 是 APP/PS1 双转基因阳性小鼠APP基因片段为400 bp,PS1基因片段为600 bp
图1 APP/PS1双转基因小鼠基因表型的鉴定

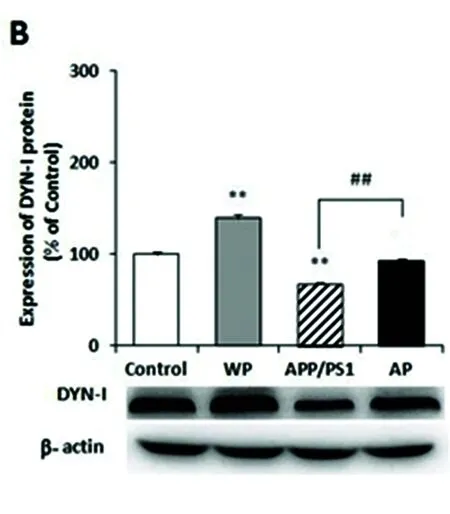
与对照组相比差异有统计学意义*P<0.05;与对照组相比差异有高度统计学意义**P<0.01;与APP/PS1模型组相比差异有高度统计学意义##P<0.01
图2 各组小鼠海马组织中DYN-Ⅰ mRNA (A)及蛋白表达水平(B)
3 讨 论
随着老年人口数量的逐年上升,老年性痴呆的发病率也呈现出逐年升高的趋势,加快对该病的探索及有效的防治研究已迫在眉睫[10]。APP/PS1双转基因小鼠可表达突变的人类早老素(DeltaE9)和人鼠淀粉样前蛋白(APPswe)融合体。已发现第21号染色体上有引起AD的基因,即突变的β淀粉样蛋白前体蛋白(amyloid procursor protein,APP)基因;第14号染色体上有导致AD 早期发作的早老素1 (Presenilin 1) 基因和第1号染色体上早老素2 (Presinilin 2) 基因等[11]。APP是一种跨膜糖蛋白,APP的突变使得其与Aβ形成过程中的β-分泌酶的结合位点发生结构改变,导致β-分泌酶的活性升高,从而Aβ的总量增加[12]。PS1是由467个氨基酸组成的蛋白,它与PS2,Aph-l和PEN-2共同构成使γ分泌酶激活的复合体,突变PS1的产物可引起γ分泌酶的活性改变,选择性地引起Aβ42的产生增加[13]。这说明APP/PS1双转基因小鼠APP和PSl基因的突变可以导致Aβ水平的升高,模拟AD的神经病理过程。
在AD病变研究中神经型尼古丁乙酰胆碱能受体(neuronal nicotinic acetylcholine receptor,nAChR)研究颇多,具有调节大脑记忆学习、智力发展、识别能力等功能和显著的神经保护作用,对指导AD治疗有一定帮助[14]。目前发现有12种nAChR 为配体门控的离子通道受体,包括α2~α10、β2~β4。α7nAChR 是脑内主要尼古丁受体,主要分布在海马和皮质,与老年斑的常见沉积部位一致。尸检AD患者脑中高亲和力的尼古丁受体数目明显降低,与大脑颞叶皮质老年斑的增多程度呈负相关[15]。报道指出在 AD 患者中观察到胆碱能损伤与 α7nAChR 表达水平下降和突触损伤有关,且最近有研究表明在老化过程中 α7nAChR对海马突触可塑性的重要性[16]。
近年来研究发现AD患者早期即可出现突触数量的减少,其认知障碍程度与突触结构和功能的改变密切相关。对AD患者的尸检标本检测显示了患者脑内多种突触蛋白表达含量下降,提示突触功能也发生了改变,突触功能低下或丢失可造成皮质-皮质之间的连接性受到影响或破坏,最终引起认知功能降低[17]。本课题组前期研究结果表明,稳定转染沉默SH-SY5Y细胞α7nAChR,能使细胞突触相关蛋白的表达减少,表明α7nAChR在SH-SY5Y细胞中的表达量的沉默将会影响突触相关蛋白的表达[18]。研究表明,α7nAChR 对改善阿尔茨海默症和精神分裂症患者的认知障碍有显著作用。因此,α7nAChR 已被确认为一种很有前途的治疗目标在治疗认知障碍与精神分裂症和 AD[19]。激活的 α7 nAChR 可以调节神经元兴奋性和神经递质释放、改变突触可塑性,对维持记忆及认知功能的十分重要[20]。PNU是α7nAChR激动剂中特异性较高的合成物,与其他nAchR亚单位结合微乎其微,与α7nAChR结合,提高和改善AD 动物模型的认知和记忆功能[21]。DYN-Ⅰ是Dynamin家族中的重要一员,是一种相对分子质量为95kDa的三磷酸鸟苷酶( guanosinetriphosphatase,GTPase ),主要存在于突触前囊泡膜上。现已证实 DYN-Ⅰ在细胞内吞和突触囊泡循环中发挥重要作用,当突触囊泡膜上网格蛋白包被后,DYN-Ⅰ对其进行机械挤压并剪切,使突触囊泡从突触前膜解离,为再次神经递质的释放做准备,而GTPase的水解可促进剪切的进行[22]。
尽管AD的主要病理学改变是Aβ沉积形成的老年斑和神经元纤维缠结,但近年的研究结果表明突触丢失是认知功能低下的主要危险因素之一。突触丢失致使突触联系障碍,神经元与神经元之间信息传递中断,学习、记忆和认知能力下降。本实验主要研究特异性激动APP/PS1转基因小鼠脑组织中α7nAChR水平后对海马组织DYN-Ⅰ蛋白的影响,从而探讨α7nAChR在阿尔茨海默病 (Alzheimer disease,AD) 发病机制中的神经保护作用机制。本研究选用24 w龄的 APP/PS1双转基因模型小鼠,实验结果显示APP/PS1双转基因模型小鼠海马组织中DYN-Ⅰ蛋白表达下降,这与Yao等[23]的研究结果一致,表明在AD早期即已出现突触蛋白表达含量下降。此外,本结果还显示特异性激动α7 nAChR水平后,与对照组相比WP组小鼠大脑海马组织中DYN-Ⅰ 蛋白表达水平升高;与APP/PS1组相比AP组小鼠大脑海马组织中DYN-Ⅰ蛋白表达水平明显升高。因此,我们推测可能原因是α7nAChR对突触有一定的神经保护作用,α7 nAChR与突触密切相关。因而,进一步研究α7nAChR对突触活动的调控有重要的研究意义,为AD的早期诊治提供一定的帮助。
[1]Ballard C,Gauthier S,Corbett A,et al. Alzheimer’s disease [J]. Lancet,2011,377(9770):1019-1031.
[2]Di Cesare ML,Pacini A,Matera C,et al. Involvement of alpha7 nAChR subtype in rat oxaliplatin-induced neuropahty:effects of selective activation[J]. Neuropharmacology,2014,79(4):37-48.
[3]Fan H,Gu R,Wei D. The alpha7 nAChR selective agonists as drug candidates for Alzheimer’s disease[J]. Adv Exp Med Biol,2015,827:353-365.
[4]Russo P,Del BA,Frustaci A,et al. Beyond acetylcholinesterase inhibitors for treating Alzheimer’s disease:alpha7-nAChR agonists in human clinical trials[J]. Curr Pharm Des,2014,20(38):6014-6021.
[5]Hurst R,Rollema H,Bertrand D. Nicotinic acetylcholine receptors:from basic science to therapeutics[J]. Pharmacol Ther,2013,137(1):22-54.
[6]Cao Y,Xiao Y,Ravid R,et al. Changed clathrin regulatory proteins in the brains of Alzheimer’s disease patients and animal models[J]. J Alzheimer’s Dis,2010,22(1):329-342.
[7]曹 颖,廖 媛,肖 雁,等. β淀粉样肽对人SH-SY5Y细胞突触素、发动蛋白及衔接蛋白180表达的影响[J]. 中华神经医学杂志,2011,10(8):774-778.
[8]Wu F,Yao PJ. Clathrin-mediated endocytosis and Alzheimer’s Disease:an update[J]. Ageing Res Rev,2009,8(3):147-149.
[9]王 亮,杨志华,弓景波,等. Dynamin1在应激致海马损伤中作用的初步探讨[J]. 生物物理学报,2009,25(2):93-98.
[10]Rhinn H,Fujita R,Qiang L,et al. Integrative genomics identifies APOE 4 effectors in Alzheimer’s disease[J]. Nature,2013,500(7460):45-50.
[11]Kumar A,Singh A,Ekavali I. A review on Alzheimer’s disease pathophysiology and its management:an update [J]. Pharmacol Rep,2015,67(2):195-203.
[12]Selkor DJ. Alzheimer’s disease:genes,Proteins,and therapy[J]. Physiol Rev,2001,81(2):741-766.
[13]Chui DH,Dobo E,Makifuehi T,et al. Apoptotic neurons in Alzheimer’s disease frequently show intracellular Abeta42 labeling [J]. J Alzheimers Dis,2001,3(2):231-239.
[14]Lombardo S,Maskos U. Role of the nicotinic acetylcholine receptor in Alzheimer’s disease pathology and treatment[J]. Neuropharmacology,2015,96(Pt B):255-262.
[15]易 旭,许志强,周华东,等. α7nAchR基因713T>C突变对AD小鼠认知功能和Aβ表达的影响[J]. 重庆医学,2017,46(12):1592-1594.
[16]Ma LY,Turner D,Zhang JF,et al. Deficits of synaptic functions in hippocampal slices prepared fromaged mice null α7 nicotinic acetylcholine receptors [J]. Neuroscience Letters,2014,570(6):97-101.
[17]Pham E,Crews L,Ubhi K,et al. Progressive accumulation of amyloid-beta oligomers in Alzheimer’s disease and in amyloid precursor protein transgenic mice is accompanied by selective alterations in synaptic scaffold proteins[J]. Federation of European Biochemical Societies,2010,277 (14):3051-3067.
[18]王晓玲,吕园园,张淑丽,等. SH-SY5Y细胞α7神经型尼古丁受体基因沉默对突触相关蛋白的影响[J]. 中风与神经疾病杂志,2016,33(12):1080-1083.
[19]Beinat C,Reekie T,Banister SD,et al. Structure-activity relationship studies of SEN12333 analogues:Determination of the optimal requirements for binding affinities at α7nAChRs through incorporation of known structural motifs [J]. European Journal of Medicinal Chemistry,2015,95(5):277-301.
[20]Nordman JC,Philips WS,Kodama N,et al. Axon targeting of the alpha 7 nicotinic receptor in developing hippocampal neurons by Gprinl regulates growth [J]. J Neurochemist,2014,129 (4):649-662.
[21]Vicens P,Heredia L,Torrente M,et al. Behavioural effects of PNU-282987 and stress in an animal model of Alzheimer’s disease[J]. Psychogeriatrics,2017,17(1):33-42.
[22]Ferguson SM,De CP. Dynamin,a membrane-remodelling GTPase[J]. Nat Rev Mol Cell Biol,2012,13(2):75-88.
[23]Yao PJ,Zhu M,Pyun EI,et al. Defects in expression of genes related to synaptic vesicle trafficking in frontal cortex of Alzheimer’s disease[J]. Neurobiol Dis,2003,12(2):97-109.
Theeffectsexpressionofα7neuronalnicotinereceptoragonistPNU282987onDYN-ⅠProteininhippocampusofAPP/PS1Mice
WANGXiaoling,DENGYuxin,DONGYangting,etal.
[KeyLaboratoryofEndemicandEthnicDiseases(GuizhouMedicalUniversity),Guiyang550004,China]
1003-2754(2017)09-0777-05
2017-07-20;
2017-08-30
国家自然科学基金(81360178);贵州省重大专项计划 {黔科合重大专项字[2014]6008号};贵州省创新计划项目{黔教合协同创新中心[2014]06};贵州省科技创新人才团队[黔科通(2016)161号];贵州省科技厅项目{黔科合LH字[2014]7153}
[1.地方病与少数民族疾病教育部重点实验室(贵州医科大学),贵州 贵阳 550004;2.贵州省医学分子生物学重点实验室(贵州医科大学),贵州 贵阳 550004;3.贵州医科大学附属医院病理科,贵州 贵阳 550004;4.贵州医科大学附属医院神经外科,贵州 贵阳 550004]
王 凡,E-mail:1034309115@qq.com
R749.01
A
