酪酸菌对珍珠龙胆石斑鱼生长、消化酶、血清抗氧化酶和溶菌酶活性的影响*
2017-10-17何瑞鹏田相利董双林李海东
何瑞鹏, 奉 杰, 田相利, 董双林, 李海东
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
酪酸菌对珍珠龙胆石斑鱼生长、消化酶、血清抗氧化酶和溶菌酶活性的影响*
何瑞鹏, 奉 杰, 田相利**, 董双林, 李海东
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
酪酸菌(Clostridiumbutyricum)是近年来新开发的益生菌菌种,具有多种重要的生理功能,但目前在水产动物中的研究相对较少。本文初步研究了饲料中添加不同浓度的酪酸菌CBYG01对珍珠龙胆石斑鱼(Epinephelusfuscoguttatus♀ ×Epinepheluslanceolatus♂)生长、消化酶、血清抗氧化酶和溶菌酶活性的影响。以基础饲料为对照组,在基础饲料中分别添加浓度为1×107cfu/kg(CB1组)、1×109cfu/kg(CB2组)、1×1011cfu/kg(CB3组)的酪酸菌活菌菌体以及1×109cfu/kg(CBM组)的酪酸菌发酵液。石斑鱼初始体重为(42.91±1.47) g,养殖60天后,分别测定其生长、消化酶活性以及血清超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、溶菌酶(LSZ)活性等指标。研究表明,CB3组石斑鱼末体重、特定生长率、摄食量和食物转化效率均显著高于对照组(P<0.05),胃蛋白酶、肠道胰蛋白酶、脂肪酶和前肠淀粉酶活性均显著高于对照组(P<0.05),胃蛋白酶、前肠脂肪酶和前肠淀粉酶活性显著高于CB1和CB2组(P<0.05),而与CBM组无显著差异(P>0.05)。CB3组石斑鱼血清SOD活性显著高于对照组(P<0.05),GPx、CAT和LSZ活性显著高于CB1、CB2组和对照组(P<0.05),SOD、CAT和LSZ活性与CBM组无显著差异(P>0.05);CBM组石斑鱼血清SOD、CAT、GPx和LSZ活性均显著高于对照组(P<0.05);CB2组GPx和LSZ活性显著高于对照组(P<0.05)。研究结果表明,饲料中补充添加不同浓度的酪酸菌活菌菌体和发酵液对珍珠龙胆石斑鱼的生长、消化酶活性和非特异性免疫酶活性具有不同的促进效果,其中以添加1×1011cfu/kg的活菌菌体效果最佳。
珍珠龙胆石斑鱼;酪酸菌;生长;消化酶;抗氧化酶;溶菌酶
珍珠龙胆石斑鱼(Epinephelusfuscoguttatus♀ ×Epinepheluslanceolatus♂)又称龙虎斑或珍珠斑,是用棕点石斑鱼(E.fuscoguttatus♀)和鞍带石斑鱼(E.lanceolatus♂)培育出来的杂交新品种石斑鱼[1-2],具有适应能力强、抗病力强、生长速度快、肉质细腻等优点[2-3],已成为我国南方沿海、香港以及马来西亚等东南亚国家重要的石斑鱼养殖品种[4-5]。同时,由于性格温驯和耐受能力强等特点,珍珠龙胆石斑鱼适合池塘、网箱和工厂化等多种养殖模式,特别适合高密度养殖[6]。但是,随着工厂化等高密度养殖模式的迅速发展,导致了细菌、病毒等传染病的频繁发生,继而给育苗和养殖业带来了严重的经济损失[7-9]。
水产养殖传统的预防和治疗疾病的方法多以投喂抗生素、注射疫苗、消毒等方式为主。近年来,由于抗生素滥用造成交叉抗药性、药物残留等,益生菌作为抗生素的重要替代品之一,越来越受到人们的关注。益生菌在水产养殖中可定义为“通过不同的作用机制对宿主或其生存环境产生有益影响的活性或灭活的微生物”[10]。目前,许多研究已证明益生菌具有促进生长、提高免疫力、增强抗病力等作用,成为最有潜力的抗生素替代品之一[10-12]。
益生菌主要的作用机理为:通过空间和营养物质竞争抑制致病菌生长;产生抑菌物质排斥致病菌;改善水质;提高机体抗氧化和免疫功能;自身提供营养物质以及通过产生消化酶促进宿主对营养物质的吸收等[13-14]。研究表明,饲料中添加不同水平的益生菌可提高青鱼(Mylopharyngodonpiceus)[15]、草鱼(Ctenopharyngodonidellus)[16-19]、鲤鱼(Cyprinuscarpio)[20]、军曹鱼(Rachycentroncanadum)[21]、金头鲷(Sparusaurata)[13]和点带石斑鱼(Epinepheluscoioides)[7,22]等的生长、消化酶活性、抗氧化酶活性和免疫水平。然而,有关益生菌对珍珠龙胆石斑鱼生长、消化酶和抗氧化酶活性等的研究尚未见报道。
酪酸菌(Clostridiumbutyricum)又名丁酸梭菌,是我国农业部于2009年7月批准的新一代微生物饲料添加剂[23],有关其研究主要集中在人和畜禽陆生养殖动物[24],目前在水产动物中的研究还少见报道[25-26]。酪酸菌为严格厌氧菌,同时因产生芽孢,所以具有高活性、高稳定性的特点。此外,它还是对常用抗生素具有耐受性的肠道正常菌群,易与其它益生菌共生,可纠正肠内的菌群紊乱,调节肠道微生态平衡等[27-29],因此具有较高的研究和应用价值。本研究以珍珠龙胆石斑鱼为研究对象,初步探讨了饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对珍珠龙胆石斑鱼生长、消化酶活性以及血清抗氧化酶和溶菌酶活性的影响,以期为其在珍珠龙胆石斑鱼养殖中的应用提供科学依据。
1 材料与方法
1.1 益生菌来源
本实验所使用的酪酸菌(菌株编号:CBYG01)为中国海洋大学水产养殖生态实验室筛选、保存的菌种。
1.2 实验饲料和实验设计
石斑鱼养殖使用的饲料为爱乐配合饲料(ALLER AQUA),含粗蛋白51%、脂肪12%、灰分1.1%。
研究前期与宏济堂文旅园区相关负责人进行多次沟通,包括参观园区与面对面访谈,共同筹划问卷设计与表达形式。确定调查顾客和企业员工以分层对比,采用同样问卷且内容涵盖中医药特色和旅游基础设施:地理和交通、环境结构与布局、价格、中医药特色资源、安全与卫生、设施与配套、服务水平、文化与形象、总体满意程度等,这些信息汇总对本研究奠定基础。问卷调查在2018年2月完成,收回有效问卷共367份,其中包括员工问卷179份,游客问卷188份。期间还访谈游客和工作人员,收集规章制度、园区介绍、游客须知、员工手册、图片视频、微信等内容,尽可能全面细致把握信息材料。
处理组饲料:按一定浓度将酪酸菌活菌菌体或发酵液菌液均匀喷洒在石斑鱼基础饲料的表面,揉搓阴干,再在其表面包裹一层褐藻酸钠和鱼油(比例同对照组饲料),分别制成酪酸菌活菌菌体添加量1×107cfu/kg(标记为CB1)、1×109cfu/kg(标记为CB2)和1×1011cfu/kg(标记为CB3)以及酪酸菌发酵液添加量为1×109cfu/kg(标记为CBM)的4种实验饲料,置于4 ℃冰箱保存备用。
酪酸菌活菌菌体的制备:酪酸菌接种于强化培养基(葡萄糖10 g,胰蛋白胨10 g,酵母粉5 g,牛肉浸膏3 g,硫酸铵1 g,硫酸锰0.2 g,硫酸镁0.5 g,K2HPO44 g,蒸馏水1 000 mL)中,37 ℃厌氧培养箱活化培养24 h,显微镜计数,确定细菌浓度,然后5 000 r/min离心10 min,无菌生理盐水梯度稀释制备1×1011、1×109、1×107cfu/kg 的菌悬液。
酪酸菌发酵液制备:酪酸菌接种于装有强化培养基(葡萄糖10 g,胰蛋白胨10 g,酵母粉5 g,牛肉浸膏3 g,硫酸铵1 g,硫酸锰0.2 g,硫酸镁0.5 g,K2HPO44 g,蒸馏水1 000 mL)的5 L三角瓶中,37 ℃厌氧发酵培养48 h,显微镜计数,确定细菌浓度,5 000 r/min离心10 min然后用0.22 μm滤膜过滤后的发酵液重悬菌体,制成1×109cfu/kg的菌悬液,其主要成分为酪酸菌及其代谢物。
1.3 实验鱼及饲养管理
本研究所用的珍珠龙胆石斑鱼购于山东莱州明波水产有限公司,运回后在玻璃缸水槽中28 ℃水温条件下暂养15 d。暂养期间,每天8:00和16:00饱食投喂基础饲料。暂养结束后饥饿24 h,以MS-222(40 mg/L)麻醉,挑选125尾健康、规格一致的石斑鱼(42.91 g± 1.47 g),随机分为5组,每组5个重复,每个重复5尾鱼,于规格为(50 cm×30 cm×35 cm)的玻璃缸中养殖60 d。实验期间,每天8:00和16:00饱食投喂实验饲料,投喂前后及时收集残饵和粪便,75 ℃烘干保存。
每天换水一次,换水量为3/4。实验期间,水温保持(28±0.5) ℃,盐度29±1,pH=8.0±0.1,连续增氧,溶氧保持在5 mg/L以上。
养殖实验在中国海洋大学鳌山卫实验基地进行,实验时间为2015年8月23日至10月21日。
1.4 样品采集及处理
实验结束后,饥饿24 h,MS-222(40 mg/L)麻醉,称量并记录每尾鱼的体重。每个处理取5尾鱼,用1 mL无菌注射器尾静脉取血置于1.5 mL离心管中,4 ℃冰箱静置24 h后,3 000 r/min离心10 min,取上层血清于-80 ℃冰箱保存。然后将鱼解剖,取胃和肠道,并将肠道分为前肠和后肠,置于离心管中液氮速冻后于-80 ℃冰箱保存。
1.5 测试指标及测定方法
1.5.1 生长指标 根据实验开始和结束时鱼的初始体重和末体重,以及实验过程中统计的投喂量和残饵量,计算特定生长率(Specific growth rate,SGR),日摄食量(Food consumption,FC)和食物转化效率(Food conversion efficiency,FCE)。
特定生长率(SGR)=(lnWt-lnW0)/t×100%,
日摄食量(FC,g·d-1·ind-1)=Cw/(N·t),
食物转化效率(FCE)=(Wt-W0)/Cw×100%。
式中:W0和Wt为鱼的初始体重和末体重(g);Cw为总摄食量(g);N为鱼的数量;t为实验时间(d)。
1.5.2 消化酶 称取适量胃和肠道组织, 并记下其准确重量, 按照组织样品与生理盐水 1∶9 的比例加入生理盐水, 并在冰水浴条件下匀浆, 制成 10% 组织匀浆液,4 ℃条件下 3 000 r/min 离心 10 min, 小心吸取上清液分装, 进行测定。胃蛋白酶(Pepsin)、胰蛋白酶(Trypsin)、脂肪酶(Lipase)、淀粉酶(Amylase)活性以及组织总蛋白含量等指标均采用南京建成生物工程研究所的试剂盒测定完成,酶活力单位为U·mgpro-1或U·gpro-1。
1.5.3 血清抗氧化酶和溶菌酶 超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)和溶菌酶(Lysozyme,LSZ)等血清酶活性均采用南京建成生物研究所的试剂盒测定,样品前处理、试剂配制和测定步骤严格按照操作说明书执行,酶活力单位为U·mL-1。
1.6 数据统计分析
实验数据采用SPSS Statistics 22软件进行单因素方差分析(ANOVA)和Duncan's多重比较进行差异显著性检验,并用独立样本t检验分析了前后肠消化酶活性差异,以P<0.05时为差异显著,统计结果用平均值±标准误(Mean±SE)表示。
2 结果
2.1 生长指标
2.1.1 生长及特定生长率 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼生长的影响见表1。所有处理组珍珠龙胆石斑鱼的初始体重与对照组之间无显著差异(P>0.05)。CB3处理组石斑鱼末体重和特定生长率显著高于对照组(P<0.05),而CB1、CB2、CB3、CBM各实验组之间没有显著差异(P>0.05)。随菌体浓度的增加,酪酸菌菌体添加处理组石斑鱼末体重和特定生长率逐渐增大。CBM处理组石斑鱼的末体重和特定生长率大于CB1、CB2处理组,小于CB3处理组,但差异不显著(P>0.05)。
2.1.2 日摄食量及食物转化效率 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼日摄食量和食物转化效率的影响见表1。CB3实验组石斑鱼的日摄食量和食物转化效率显著高于对照组(P<0.05),CB1、CB2、CB3、CBM处理组之间没有显著差异(P>0.05)。随菌体浓度的升高,酪酸菌菌体添加处理组石斑鱼日摄食量和食物转化效率逐渐升高。CBM处理组石斑鱼的日摄食量和食物转化效率高于CB1、CB2处理组,低于CB3处理组,但差异不显著(P>0.05)。

表1 珍珠龙胆石斑鱼的生长、日摄食量和食物转化效率Table 1 Growth, food consumption and food conversion efficiency of hybrid grouper
注: CB1、CB2、CB3和CBM为分别添加浓度为1×107、1×109和1×1011cfu/kg酪酸菌活菌菌体和1×109cfu/kg酪酸菌发酵液饲料投喂的石斑鱼,对照为不添加任何益生菌饲料投喂的石斑鱼;同一列中标不同字母的数据表示相互之间差异显著(P<0.05)。
Note: CB1, CB2 and CB3 were hybrid grouper fed diet with 1×107, 1×109and 1×1011cfu/kg live cell ofClostridiumbutyricum; CBM was hybrid grouper fed diet with 1×109cfu/kgClostridiumbutyricumfermentation broth; The control was hybrid grouper fed diet without probiotics; Data with different superscripts letters at the same column means significant difference each other (P<0.05).
①Treatments;②Initial body weight;③Final body weight;④Special growth rate;⑤Food consumption;⑥Food conversion efficiency;⑦Control
2.2 消化酶
2.2.1 胃蛋白酶 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼胃蛋白酶活性的影响见图1。CB3处理组石斑鱼胃蛋白酶活性显著高于CB1、CB2和对照组(P<0.05)。CBM处理组石斑鱼胃蛋白酶活性高于CB1、CB2处理组和对照组,低于CB3处理组,但差异不显著(P>0.05)。
2.2.2 胰蛋白酶 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼胰蛋白酶活性的影响见图2。CB3处理组石斑鱼前肠和后肠胰蛋白酶活性均显著高于对照组和其它实验组(P<0.05)。对照组和CB1、CB2、CBM处理组之间前后肠胰蛋白酶活性无显著差异(P>0.05)。对照组和各实验组石斑鱼前肠胰蛋白酶活性均显著高于后肠胰蛋白酶活性(P<0.01)。
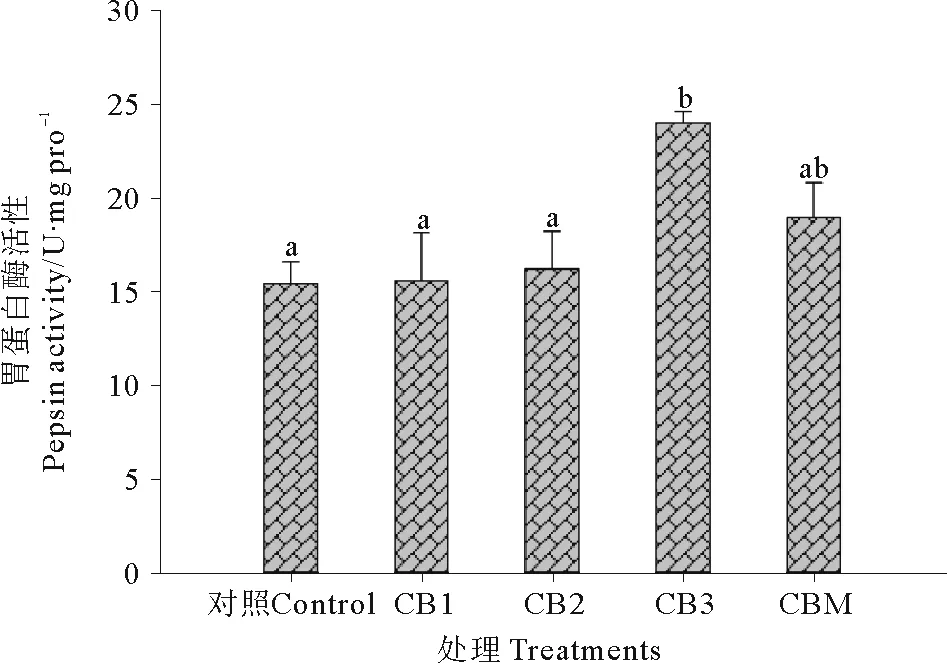
(CB1、CB2、CB3和CBM为分别添加浓度为1×107、1×109和1×1011cfu/kg酪酸菌活菌菌体和1×109cfu/kg酪酸菌发酵液饲料投喂的石斑鱼,对照为不添加任何益生菌饲料投喂的石斑鱼;标有不同字母的数据表示相互之间差异显著(P<0.05)。下同。CB1, CB2 and CB3 were hybrid grouper fed diet with 1×107, 1×109and 1×1011cfu/kg live cell ofClostridiumbutyricum; CBM was hybrid grouper fed diet with 1×109cfu/kgClostridiumbutyricumfermentation broth; Control was hybrid grouper fed diet without probiotics; Data with different letters at the same column means significant difference each other (P<0.05).The same as follows.)
图1 益生菌添加对珍珠龙胆石斑鱼胃蛋白酶活性的影响
Fig.1 Effect of probiotics on the pepsin activity of hybrid grouper

(标有不同大小写字母分别表示不同处理之间后肠和前肠酶活性差异显著(P<0.05),标有双星号的数据表示同一处理前肠和后肠之间酶活性差异极显著(P<0.01),单星号表示差异显著(P<0.05)。图3、4同图2。Data with different letters at the same column means significant difference each other (P<0.05). Bars with different lowercase or uppercase letters mean significant difference (P<0.05) in proximal and distal intestine, respectively. Bars with two asterisks mean extremely significant difference (P<0.01) between foreintestine and hindintestine, while one means significant difference (P<0.05). It is same for Fig.3 and Fig.4.)
图2 益生菌添加对珍珠龙胆石斑鱼胰蛋白酶活性的影响
Fig.2 Effects of probiotics on the trypsin of hybrid grouper
2.2.3 脂肪酶 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼脂肪酶活性的影响见图3。CB3处理组石斑鱼前肠脂肪酶活性显著高于CB1、CB2和对照组(P<0.05)。CBM处理组石斑鱼前肠脂肪酶活性与CB1、CB2、CB3处理组和对照组差异不显著(P>0.05)。CB3处理组后肠脂肪酶活性显著高于对照组和CB1处理组(P<0.05),CBM处理组后肠脂肪酶活性显著高于对照组(P<0.05),但与CB1、CB2和CB3处理组差异不显著(P>0.05)。
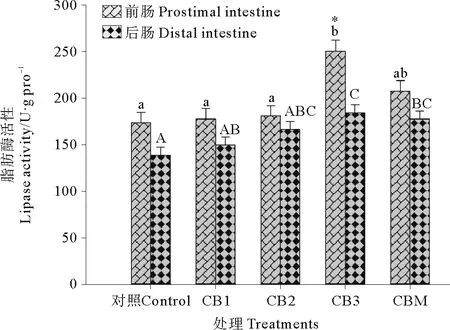
图3 益生菌添加对珍珠龙胆石斑鱼脂肪酶活性的影响Fig.3 Effect of probiotics on the lipase activity of hybrid grouper
2.2.4 淀粉酶 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼淀粉酶活性的影响见图4。CB3处理组石斑鱼前肠淀粉酶活性显著高于CB1、CB2和对照组(P<0.05)。CBM处理组石斑鱼前肠淀粉酶活性与CB1、CB2、CB3处理组和对照组差异不显著(P>0.05)。CB1、CB2、CB3和CBM处理组与对照组之间石斑鱼后肠淀粉酶活性均无显著差异(P>0.05),但均显著高于前肠淀粉酶活性(P<0.05)。
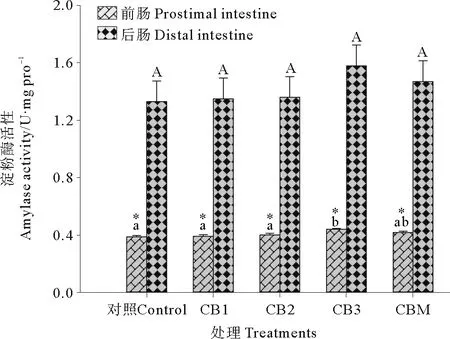
图4 益生菌添加对珍珠龙胆石斑鱼淀粉酶活性的影响Fig.4 Effect of probiotics on the amylase activity of hybrid grouper
2.3 血清抗氧化酶和溶菌酶
2.3.1 超氧化物歧化酶 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼血清SOD活性的影响见图5。CB3和CBM处理组SOD活性显著高于对照组(P<0.05),但与CB1、CB2处理组差异不显著(P>0.05)。
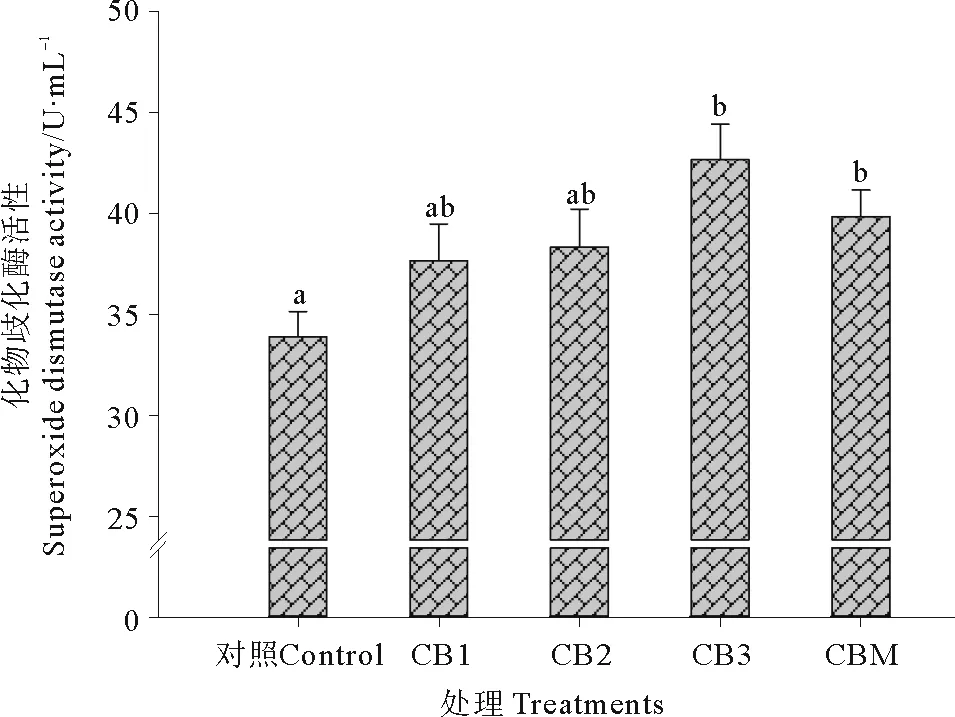
图5 益生菌添加对珍珠龙胆石斑鱼血清超氧化物歧化酶活性的影响Fig.5 Effect of probiotics on the serum superoxide dismutase activity of hybrid grouper
2.3.2 过氧化物酶 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼血清CAT活性的影响见图6。CB3处理组CAT活性显著高于CB1、CB2和对照组(P<0.05),CBM处理组CAT活性显著高于对照组(P<0.05),CB1、CB2、CBM处理组之间CAT活性差异不显著(P>0.05)。

图6 益生菌添加对珍珠龙胆石斑鱼血清过氧化物酶活性的影响
2.3.3 谷胱甘肽过氧化物酶 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼血清GPx活性的影响见图7。CB2、CB3和CBM处理组GPx活性显著高于CB1和对照组(P<0.05),且CB2、CB3、CBM处理组之间GPx活性差异显著(P<0.05),活性高低依次为CB3>CBM>CB2。
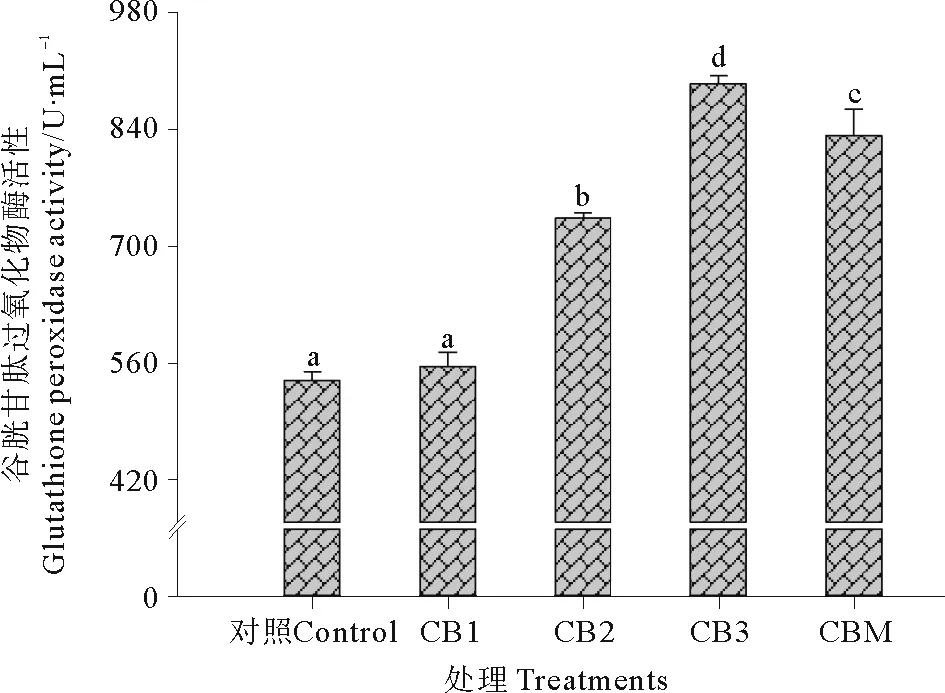
图7 益生菌添加对珍珠龙胆石斑鱼血清谷胱甘肽过氧化物酶活性的影响Fig.7 The effect of probiotics on the serum glutathione peroxidase activity of hybrid grouper
2.3.4 溶菌酶 饲料中添加酪酸菌活菌菌体和酪酸菌发酵液对石斑鱼血清LSZ活性的影响见图8。CB3处理组LSZ活性显著高于CB1、CB2和对照组(P<0.05)。CBM处理组LSZ活性显著高于对照组(P<0.05),但与CB1、CB2、CB3处理组差异不显著(P>0.05)。
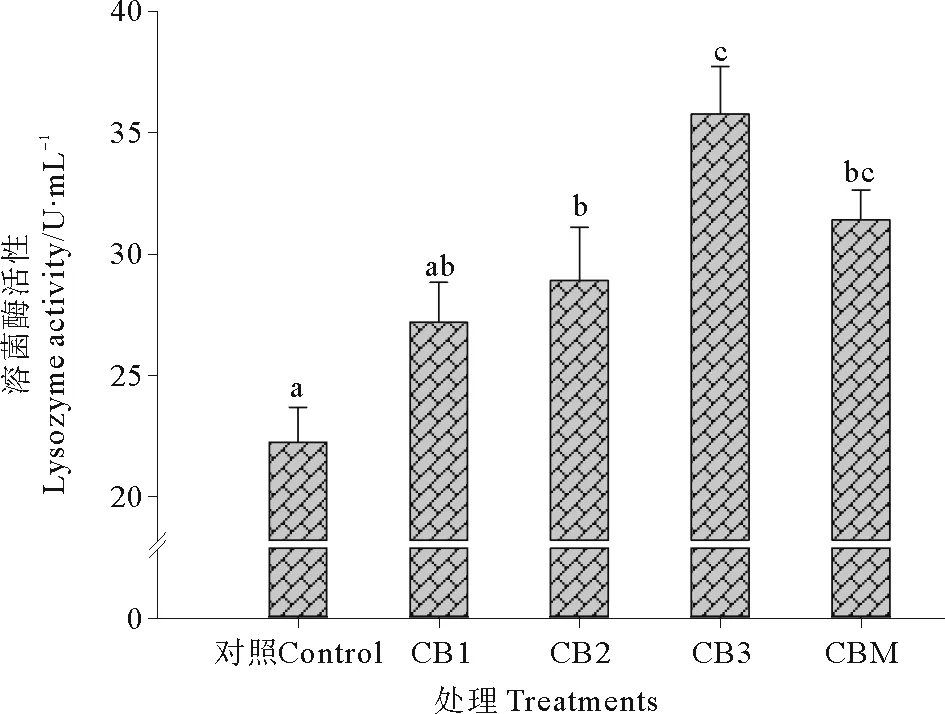
图8 益生菌添加对珍珠龙胆石斑鱼血清溶菌酶活性的影响Fig.8 Effect of probiotics on the serum lysozyme activity of hybrid grouper
3 讨论
3.1 酪酸菌对珍珠龙胆石斑鱼生长的影响
益生菌增进动物生长性能的作用已受到广泛研究。张彩云等[30]研究发现,1‰的酪酸菌能显著提高断奶仔猪的平均日增重,当添加量提高到3‰时,料重比显著下降。贾聪慧等[23]研究表明,饲料中添加108cfu/kg的酪酸菌能显著提高肉鸡的生长性能。Yang等[31]、Zhang等[32]和Liao等[33]均报道饲料中添加合适剂量的酪酸菌可显著提高肉鸡的平均日增重,且促长效果与抗生素添加组无显著差异。目前,关于酪酸菌在水产养殖动物上的应用研究还少见报道,公开报道仅见于酪酸菌对鮸鱼(Miichthysmiiuy)影响的相关研究[25]。Song等[25]发现1012cfu/g的酪酸菌可显著提高鮸鱼的总增重、相对增重率、食物利用率和特定生长率,且作用效果与酪酸菌剂量呈正相关。在本研究中,添加1×1011cfu/kg的酪酸菌CBYG01活菌菌体显著提高了石斑鱼的末体重、特定生长率、日摄食量和食物转化效率。然而,也有少数研究表明,饲料添加酪酸菌对动物的生长性能并不产生影响。例如,Zhang等[34]报道酪酸菌对肉鸡的生长并无显著影响。这些结果的差异性可能与动物种类、基础饲料、益生菌添加剂量和动物自身的健康状况有关[23,33,35]。从现有的报道看,酪酸菌在水产动物上应用的适宜剂量可能要远高于陆生动物,例如在猪和肉鸡上的适宜添加量多在108~109cfu/kg,而在鮸鱼、珍珠龙胆石斑鱼和凡纳滨对虾(Litopenaeusvanamei,未发表数据)上适宜的浓度则达1011~1012cfu/kg。酪酸菌促进动物生长的准确作用机制尚无法确定,但可能与其生物学特性有密切关系。酪酸菌能够产生孢子,耐受胃液、胆汁液和消化液的作用,从而有利于其在肠道内定植,还能产生活性物质抑制病原菌及腐败菌在肠道内异常增殖而促进有益菌的增殖发育,进而纠正肠道菌群紊乱,调节肠道微生态平衡[36-37]。同时,酪酸菌主要代谢产物丁酸对维持动物肠道形态结构的完整性和促进肠道细胞增殖与成熟发挥重要作用[23]。此外,酪酸菌产生的氨基酸、B族维生素和维生素K,能促进VE吸收,补充必要的营养物质;分泌淀粉酶、糖苷酶和纤维素酶等酶类促进营养物质的消化吸收[23-24,36-37]。
3.2 酪酸菌对珍珠龙胆石斑鱼消化酶活性的影响
研究表明,在饲料中添加适量的益生菌如酵母、芽孢杆菌和乳酸菌等,可提高水产动物的消化酶活性,从而改善鱼类对饲料的消化,提高了饲料的利用水平[41]。Tovar-Ramirez等[42]报道,饲料中添加活性酵母(Debaryomyceshansenii)有效提高了欧洲鲈(Dicentrarchuslabrax)幼鱼的胰蛋白酶、脂肪酶和淀粉酶等消化酶活性。而Wang和Xu[20]则发现芽孢杆菌(Bacillussp.)作为益生菌添加剂能显著提高鲤鱼(Cyprinuscarpio)的蛋白酶、脂肪酶和淀粉酶等消化酶活性。Suzer等[13]也报道了饲料中添加乳酸菌(Lactobacillusspp.)能显著提高了金头鲷(Sparusaurata)幼鱼肠道碱性磷酸酶、亮氨酸-丙氨酸肽酶和胰腺蛋白酶、脂肪酶、淀粉酶活性。本研究结果表明,添加1×1011cfu/kg的酪酸菌活菌显著提高了石斑鱼的胃蛋白酶、肠道胰蛋白酶、肠道脂肪酶和前肠淀粉酶的活性。由此推测,添加酪酸菌同添加酵母、芽孢杆菌、乳酸菌等益生菌相似,可以有效提高鱼类消化器官的消化酶活性,促进食物大分子分解为易于被细胞吸收的小分子,从而提高对蛋白、脂肪和淀粉等营养物质的吸收。酪酸菌是肠道有益菌群,在消化道中定植后萌发生长成具有代谢活性的“营养型”细胞后,可以调节肠道微生物群,改善肠道微生态环境以及肠道的生理活动。同时,微生物通过在肠道内分泌多种酶类,进入宿主肠道的“酶池”中,从而提高宿主肠道消化酶活性[41]。值得注意的是,在肠道不同部位,蛋白酶、脂肪酶和淀粉酶活性存在明显差异。Wang[17]报道了在草鱼(Ctenopharyngodonidella)鱼苗的益生菌研究中发现,草鱼前肠蛋白酶活性显著高于后肠,而后肠纤维素酶活性则显著高于前肠。从本研究结果看,石斑鱼前肠胰蛋白酶活性显著高于后肠,后肠淀粉酶活性显著高于前肠,前肠脂肪酶活性也高于后肠,这表明不同的肠道部位对营养物质的消化能力可能存在差异,如前肠可能对蛋白和脂肪等物质的消化能力高于后肠,而后肠可能对淀粉等物质的消化能力高于前肠,这种差异是否与珍珠龙胆石斑鱼的肉食性有关尚需进一步研究确定。
3.3 酪酸菌对珍珠龙胆石斑鱼血清抗氧化和溶菌酶活性的影响
细胞在正常代谢过程中会产生活性氧,而细胞抗氧化防御系统会及时清理细胞内的自由基,二者一般处于动态平衡中。但当体内自由基过多时,就会对细胞DNA、蛋白和细胞膜脂类造成损伤[38-39]。超氧化物歧化酶、过氧化物酶和谷胱甘肽过氧化物酶是生物体内重要的抗氧化酶类,主要功能是清除体和分解体内的自由基。已有的研究表明,乳酸菌和双歧杆菌作为益生菌添加剂具有抗氧化功能,能够抑制脂质氧化和活性氧累积,从而减弱动物氧化胁迫[39]。然而,有关酪酸菌添加对水产动物抗氧化功能影响的研究还尚未见报道。本研究结果表明,添加1×1011cfu/kg的酪酸菌菌体和1×109cfu/kg酪酸菌发酵液能显著提高血清抗氧化酶活性。研究表明,酪酸菌能够产生 T-SOD 和还原型辅酶Ⅰ/还原型辅酶Ⅱ(NADH /NADPH) 过氧化物酶,可以直接清除体内活性氧[23,40]。此外,其代谢产物丁酸和氢气则具有通过增加抗氧化酶活性和减少活性氧产物,进而调节氧化胁迫的功能。酪酸菌抗氧化作用的机制可能与丁酸和氢气影响抗氧化酶的基因表达、减少活性氧产生、刺激机体免疫系统减少炎症反应和氧化损伤等原因有关[33]。
溶菌酶是脊椎动物和非脊椎动物免疫防御系统的重要组成部分之一,能水解革兰氏阳性菌细胞壁中的肽聚糖而使之细胞裂解,从而杀灭病原微生物。它存在于大多数鱼类的黏液、淋巴组织、血清和其它组织液中,在病原菌入侵宿主时,发挥重要的防御功能[25]。很多研究表明,鱼类摄入添加益生菌的饲料时,其血清溶菌酶活性会升高[7,25-26]。Song等[25]在其研究发现,饲料中添加酪酸菌可显著提高鮸鱼血清溶菌酶活性,且随添加剂量的增加溶菌酶活性也呈升高趋势。Pan等[26]也发现鮸鱼摄食有活性或灭活的酪酸菌添加的饲料之后,黏液和血清中溶菌酶活性均显著升高。本研究中,添加1×109、1×1011cfu/kg的酪酸菌活菌菌体以及1×109cfu/kg酪酸菌发酵液后,石斑鱼血清溶菌酶活性均显著升高,表明酪酸菌能够有效提高石斑鱼的非特异性免疫反应。
4 结语
饲料中添加酪酸菌活菌菌体和酪酸菌发酵液可以促进珍珠龙胆石斑鱼的生长,提高消化酶、血清抗氧化酶和溶菌酶的活性。酪酸菌活菌菌体的最佳添加量为1×1011cfu/kg,而酪酸菌发酵液的最佳添加浓度有待进一步研究确定。
[1] Choon Looi Ch’ng Shigeharu Senoo. Egg and Larval Development of a New Hybrid Grouper, Tiger GrouperEpinephelusfuscoguttatus×Giant GrouperE.lanceolatus[J]. Aquaculture Science, 2008, 56(4): 505-512.
[2] 梁华芳, 黄东科, 吴耀华, 等. 温度和盐度对龙虎斑存活与摄食的影响[J]. 广东海洋大学学报, 2013(4): 22-26. Liang H F, Huang D K, Wu Y H, et al. Effects of Temperature and Salinity on Survival and Food Intake of Hybrid Grouper (Epinephelusfuscoguttatus♀×Epinepheluslanceolatus♂) [J]. Journal of Guangdong Ocean University, 2013(4): 22-26.
[3] 梁华芳, 黄东科, 吴耀华, 等. 温度和盐度对龙虎斑(♀×♂)耗氧率和排氨率的影响[J]. 渔业科学进展, 2014, 35(2): 30-34. Liang H F, Huang D K, WU Y H, et al. Effects of temperature and salinity on oxygen consumption and ammonia excretion of hybrid grouper (Epinephelusfuscoguttatus♀×Epinepheluslanceolatus♂) [J]. Progress in Fishery Sciences, 2014, 35(2): 30-34.
[4] Luo Y, Wu X, Li W, et al. Effects of Different Corn Starch Levels on Growth, Protein Input, and Feed Utilization of Juvenile Hybrid Grouper (maleEpinepheluslanceolatus×femaleE.fuscoguttatus) [J]. North American Journal of Aquaculture, 2016, 78(2): 168-173.
[5] De M, Mazlan A G, Bakar Y, et al. Optimum temperature for the growth form of Tiger grouper (Epinephelusfuscoguttatus♀) × Giant grouper (E.lanceolatus♂) hybrid [J]. Sains Malaysiana, 2016, 45(4): 541-549.
[6] 本刊综合. 养殖业新秀——珍珠龙胆石斑鱼[J]. 农家之友, 2016(2): 50. Comprehensive journal. The breeding rookie-hybrid grouper (Epinephelusfuscoguttatus♀×Epinepheluslanceolatus♂) [J]. Friends of Farmhouse, 2016(2): 50.
[7] Son V M, Chang C C, Wu M C, et al. Dietary ad ministration of the probiotic,Lactobacillusplantarum, enhanced the growth, innate immune responses, and disease resistance of the grouperEpinepheluscoioides[J]. Fish & Shellfish Immunology, 2009, 26(5): 691-698.
[8] Harikrishnan R, Balasundaram C, Heo M S. Molecular studies, disease status and prophylactic measures in grouper aquaculture: Economic importance, diseases and immunology [J]. Aquaculture, 2010, 309(1-4): 1-14.
[9] Harikrishnan R, Balasundaram C, Heo M S. Fish health aspects in grouper aquaculture [J]. Aquaculture, 2011, 320(s1-2): 1-21.
[10] Zorriehzahra M J, Delshad S T, Adel M, et al. Probiotics as beneficial microbes in aquaculture: an update on their multiple modes of action: a review [J]. Veterinary Quarterly, 2016, 36(4): 228-241.
[11] Ayyat M S, Labib H M, Mahmoud H K. A probiotic cocktail as a growth promoter in nile tilapia (Oreochromisniloticus) [J]. Journal of Applied Aquaculture, 2014, 26(3): 208-215.
[12] Tan T H, Chan K G, Lee L H, et al. Streptomyces bacteria as potential probiotics in aquaculture [J]. Frontiers in Microbiology, 2016, 7: 79.
[13] Suzer C, Çoban D, Kamaci H O, et al.Lactobacillusspp. bacteria as probiotics in gilthead sea bream (Sparusaurata) larvae: Effects on growth performance and digestive enzyme activities [J]. Aquaculture, 2008, 280(1-4): 140-145.
[14] Hai N V. The use of probiotics in aquaculture[J]. Journal of Applied Microbiology, 2015, 119(4): 917-935.
[15] 沈斌乾, 陈建明, 郭建林, 等. 饲料中添加枯草芽孢杆菌对青鱼生长、消化酶活性和鱼体组成的影响[J]. 水生生物学报, 2013, 37(1): 48-53. Shen B Q, Chen J M, Guo J L, et al. Effect of addingBacillussubtilisto diets on growth performance, digestive enzymes activity and body composition of fingerling black carp (Mylopharyngodonpiceus) [J]. Acta Hydrobiologica Sinica, 2013, 37(1): 48-53.
[16] 沈文英, 李卫芬, 梁权, 等. 饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响[J]. 动物营养学报, 2011, 23(5): 881-886. Shen W Y, Li W F, Liang Q, et al. Effects of dietaryBacillussubtilison growth performance, immunity and antioxidant function of grass carp (Ctenopharyngodonidellus) [J]. Chinese Journal of Animal Nutrition, 2011, 23(5): 881-886.
[17] Wang Y. Use of probioticsBacilluscoagulans,RhodopseudomonaspalustrisandLactobacillusacidophilusas growth promoters in grass carp (Ctenopharyngodonidella) fingerlings [J]. Aquaculture Nutrition, 2011, 17(2): 372-378.
[18] Wu Z X, Feng X, Xie L L, et al. Effect of probioticBacillussubtilis, Ch9 for grass carp,Ctenopharyngodonidella, (Valenciennes, 1844), on growth performance, digestive enzyme activities and intestinal microflora [J]. Journal of Applied Ichthyology, 2012, 28(5): 721-727.
[19] 桂琳, 王晓清, 康银, 等. 一种复合益生菌对草鱼生长和抗氧化功能的影响[J]. 淡水渔业, 2015, 45(5): 83-87. Gui L, Wang X Q, Kang Y, et al. Effects of one compound probiotics on growth and antioxidant function ofCtenopharyngodonidellus[J]. Freshwater Fisheries, 2015, 45(5): 83-87.
[20] Wang Y, Xu Z. Effect of probiotics for common carp (Cyprinuscarpio) based on growth performance and digestive enzyme activities [J]. Animal Feed Science & Technology, 2006, 127(4): 283-292.
[21] 何伟聪, 董晓慧, 谭北平, 等. 益生菌对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响[J]. 动物营养学报, 2015, 27(12): 3821-3830. He W C, Dong X H, Tan B P, et al. Effects of probiotics on growth performance, digestive enzyme and immune enzyme activities of juvenile cobia (Rachycentroncanadum) [J]. Chinese Journal of Animal Nutrition, 2015, 27(12): 3821-3830.
[22] Sun Y Z, Yang H L, Ma R L, et al. Probiotic applications of two do minant gutBacillusstrainswith antagonistic activity improved the growth performance and immune responses of grouperEpinepheluscoioides[J]. Fish & Shellfish Immunology, 2010, 29(5): 803-809.
[23] 贾聪慧, 杨彩梅, 曾新福, 等. 丁酸梭菌对肉鸡生长性能、抗氧化能力、免疫功能和血清生化指标的影响[J]. 动物营养学报, 2016, 28(3): 908-915. Jia C H, Yang C M, Zeng X F, et al. Effects ofClostridiumbutyricumon growth performance, antioxidant capacity, immune function and serum biochemical parameters of broilers [J]. Chinese Journal of Animal Nutrition, 2016, 28(3): 908-915.
[24] 张善亭, 史燕, 张淑丽, 等. 丁酸梭菌的研究应用进展[J]. 生物技术通报, 2013(9): 27-33. Zhang S T, Shi Y, Zhang S L, et al. Progress on the studies and application ofClostridiumbutyricum[J]. Biotechnology Bulletin, 2013(9): 27-33.
[25] Song, Zeng-fu, Tian-xing, et al. Effects of dietary supplementation withClostridiumbutyricumon the growth performance and humoral immune response inMiichthysmiiuy[J]. Journal of Zhejiang University-Science B, 2006, 7(7): 596-602.
[26] Pan X, Wu T, Song Z, et al. Immune responses and enhanced disease resistance in Chinese drum,Miichthysmiiuy(Basilewsky), after oral ad ministration of live or dead cells ofClostridiumbutyriumCB2 [J]. Journal of Fish Diseases, 2008, 31(9): 679-686.
[27] 唐宝英, 朱晓慧. 新一代微生态制剂——酷酸菌的研究和开发前景[J]. 中国微生态学杂志, 2000, 12(5): 297. Tang B Y, Zhu X H. A new generation of probiotics-Research and development prospect ofClostridiumbutyricum[J]. Chinese Journal of Microecology, 2000, 12(5): 297.
[28] 王永军. 动物微生态制剂酪酸菌的研究与发展[J]. 中国饲料添加剂, 2006(3): 18-19. Wang Y J. Research and development of animal probiotics,Clostridiumbutyricum[J]. China Feed Addictive, 2006(3): 18-19.
[29] 宋会仪, 吴天星. 酪酸菌微生态制剂的生物学功能及在饲料中的应用[J]. 饲料工业, 2006, 27(12): 10-11. Song H Y, Wu T X. Biological function ofClostridiumbutyricumand its application in feed industry [J]. Feed Industry, 2006, 27(12): 10-11.
[30] 张彩云, 刘来亭, 杜灵广, 等. 酪酸芽孢杆菌对断奶仔猪生产性能和血清生化指标的影响[J]. 中国畜牧杂志, 2009, 45(13): 43-45. Zhang C Y, Liu L T, Du G L, et al. Effects ofClostridiumbutyricumon the production performance and serum biochemical indexes of weaned piglets [J]. Chinese Journal of Animal Science, 2009, 45(13): 43-45.
[31] Yang C M, Cao G T, Ferket P R, et al. Effects of probiotic,Clostridiumbutyricum, on growth performance, immune function, and cecal microflora in broiler chickens [J]. Poultry Science, 2012, 91(9): 2121-2129.
[32] Zhang L, Cao G T, Zeng X F, et al. Effects ofClostridiumbutyricumon growth performance, immune function, and cecal microflora in broiler chickens challenged withEscherichiacoliK88 [J]. Poultry Science, 2014, 93(1): 46-53.
[33] Liao X D, Ma G, Cai J, et al. Effects ofClostridiumbutyricumon growth performance, antioxidation, and immune function of broilers [J]. Poultry Science, 2015, 94(4): 662-667.
[34] Zhang B, Yang X, Guo Y, et al. Effects of dietary lipids andClostridiumbutyricumon the performance and the digestive tract of broiler chickens [J]. Archives of Animal Nutrition, 2011, 65(4): 329-339.
[35] Hossain M M, Begum M, Kim I H. Effect ofBacillussubtilis,ClostridiumbutyricumandLactobacillusacidophilusendospores on growth performance, nutrient digestibility, meat quality, relative organ weight, microbial shedding and excreta noxious gas emission in broilers [J]. Veterinární Medicína, 2015, 60(2): 77-86.
[36] 刘亭婷, 王晓霞. 酪酸梭菌的作用机理及其在动物生产中的应用[J]. 中国饲料, 2012(4): 9-11. Liu T T, Wang X X. The mechanism ofClostridiumbutyricumand its application in animal production [J]. China Feed, 2012(4): 9-11.
[37] 易中华. 饲用微生态制剂丁酸梭菌的研究与应用进展[J]. 饲料研究, 2012(2): 14-17. Yi Z H. Progress on the studies and application ofClostridiumbutyricum[J]. Feed Research, 2012(2): 14-17.
[38] Yu B P. Cellular defenses against damage from reactive oxygen species [J]. Physiological Reviews, 1994, 74(1): 139-162.
[39] Zhuang S, Jiang F B, Jia Z X, et al.Clostridiumbutyricumcan be used as a potential alternative for the antibiotic in Cherry Valley ducks [J]. Journal of Animal & Plant Sciences, 2015, 25(5): 1227-1232.
[40] Kawasaki S, Nakagawa T, Nishiyama Y, et al. Effect of oxygen on the growth ofClostridiumbutyricum, (type species of the genusClostridium), and the distribution of enzymes for oxygen and for active oxygen species in Clostridia [J]. Journal of Fermentation & Bioengineering, 1998, 86(4): 368-372.
[41] 宋增福. 丁酸梭菌C_2菌株对鮸鱼肠道微生态调控作用与机理研究[D]. 杭州: 浙江大学, 2006. Song Z F. Study of Manipulation and Approach to the Mechanism ofClostridiumbutyricummStrain C2on the Intestinal Microecology inMiichthysmiiuy[D]. Hangzhou: Zhejiang University, 2006.
[42] Tovar D, Zambonino J, Cahu C, et al. Effect of live yeast incorporation in compound diet on digestive enzyme activity in sea bass (Dicentrarchuslabrax) larvae [J]. Aquaculture, 2002, 204(1): 113-123.
Abstract:Clostridiumbutyricumis a new potential probiotic bacterium with important physiological function, but fewer studies about it in aquatic organisms have been done. This study investigated the effects of dietary supplement ofC.butyricumCBYG01 on the growth and activities of digestive and serum antioxidant enzymes and lysozyme of hybrid grouper (Epinephelusfuscoguttatus♀×E.lanceolatus♂). Four treatments were designed,i.e., hybrid grouper fed diet with 1×107, 1×109and 1×1011cfu/kg live cells ofC.butyricum(CB1, CB2 and CB3), respectively; hybrid grouper fed diet with 1×109cfu/kg C. butyricum fermentation broth (CBM); and hybrid grouper fed diet without probiotics (Control). After 60 days of feeding trail, the body weight, specific growth rate, food consumption and food conversion efficiency of fish in CB3 were significantly higher than those of control (P<0.05) as well as the pepsin, trypsin, lipase activities and amylase activity in proximal intestine. The pepsin activity, lipase and amylase activities in proximal intestine of fish in CB3 were significantly higher relative to CB1 and CB2 (P<0.05), while which were not significantly different with those in CBM (P>0.05). The superoxide dismutase of fish in CB3 was significantly higher than that of control (P<0.05), the glutathione peroxidase, catalase and lysozyme activities were significantly higher than those of CB1, CB2 and control (P<0.05), while the superoxide dismutase, catalase and lysozyme activities were not significantly different with those of CBM (P>0.05). The glutathione peroxidase and lysozyme activities of fish in CB2 were significantly higher in comparison with control (P<0.05). These findings indicated thatC.butyricum-supplementation could improve the growth and the activities of digestive and serum antioxidant enzymes and lysozyme of hybrid grouper, and the optimal dosage was 1×1011cfu/kg.
Key words:Epinephelusfuscoguttatus(♀) ×E.lanceolatus(♂);Clostridiumbutyricum; growth; digestive enzyme; antioxidant enzyme; lysozyme
责任编辑 朱宝象
Effects of Dietary Supplementation ofClostridiumbutyricumon the Growth and Activities of Digestive and Serum Antioxidant Enzymes and Lysozyme of Hybrid Grouper (Epinephelusfuscoguttatus♀×E.lanceolatus♂)
HE Rui-Peng, FENG Jie, TIAN Xiang-Li, DONG Shuang-Lin, LI Hai-Dong
(The Key Laboratory of Mariculture (Ocean University of China), Ministry of Education, Qingdao 266003, China)
S917.1
A
1672-5174(2017)11-015-09
10.16441/j.cnki.hdxb. 20160400
何瑞鹏, 奉杰, 田相利, 等. 酪酸菌对珍珠龙胆石斑鱼生长、消化酶、血清抗氧化酶和溶菌酶活性的影响[J]. 中国海洋大学学报(自然科学版), 2017, 47(11): 15-23.
HE Rui-Peng, FENG Jie, TIAN Xiang-Li, et al. Effects of dietary supplementation ofClostridiumbutyricumon the growth and activities of digestive and serum antioxidant enzymes and lysozyme of hybrid grouper (Epinephelusfuscoguttatus♀ ×E.lanceolatus♂) [J].Periodical of Ocean University of China, 2017, 47(11): 15-23.
山东省杰出青年基金项目(JQ201009);广东省海洋经济创新发展区域示范专项(GDHY2013-B03-005); 青岛市民生科技计划项目(15-9-2-96-NSH)资助 Supported by the Program for Excellent Youth Foundation of Shandong Province (JQ201009); The Specialized Project of Regional Demonstration for the Innovation and Development of Marine Economy of Guangdong Province (GDHY2013-B03-005); The Scientific and Technical Programs for People's Livelihood of Qingdao (15-9-2-96-NSH)
2016-12-07;
2017-03-27
何瑞鹏(1988-),男,博士生,从事水产养殖生态学研究。E-mail:heruip.happy@163.com
** 通讯作者:E-mail:xianglitian@ouc.edu.cn
