鼠尾藻hsp70基因的克隆及温度、盐度对其表达的影响*
2017-10-17宫庆礼
徐 群, 刘 岩, 宫庆礼
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
鼠尾藻hsp70基因的克隆及温度、盐度对其表达的影响*
徐 群, 刘 岩**, 宫庆礼
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
为研究温度、盐度及其处理时间对鼠尾藻(Sargassumthunbergii)hsp70表达水平的影响,以β-actin为内参基因,通过RT-qPCR测定不同处理下鼠尾藻幼苗的hsp70表达水平。温度实验设置7个处理组(5、10、15、25、30、35和40℃)、盐度实验设置5个处理组(0、10、20、40和50),以温度20℃、盐度31为对照组;温度处理时间实验在温度35℃下热激不同时间(0、1、2、3、4、6、8、10和12 h),盐度处理时间实验在盐度50下处理不同时间(0、1、2、3、4、6、8、10和12 h)。研究显示:(1)在不同温度下处理鼠尾藻幼苗1 h,40℃组的hsp70表达水平最高,是对照组(20℃)的8.6倍,恢复处理1 h后,5℃组与对照组差异不显著,35、40℃组与对照组仍差异显著;(2)鼠尾藻幼苗在(0、10、20、31、40、50)盐度下处理2 h,发现0、10、40、50盐度组的hsp70表达水平显著高于对照组,恢复处理2 h后,0盐度组鼠尾藻幼苗的hsp70表达水平最高;(3)将鼠尾藻幼苗在35℃下热激不同时间,样品的hsp70表达水平先上升后下降,热激4 h时表达量最大,不同热激时间处理组在20℃中恢复1 h后,处理1、2和3 h的实验组在恢复后hsp70表达水平高于相应的处理组;(4)将鼠尾藻幼苗在盐度50中培养不同时间,样品的hsp70表达水平先升高后下降,在6 h时达到最高,不同盐度时间处理组在盐度31下恢复2 h后,其hsp70表达水平变化情况与35℃热激不同时间各处理组的变化趋势相同。研究结果表明,在本研究中,鼠尾藻hsp70表达水平在温度40℃、盐度50、高温热激4 h和高盐处理6 h情况下分别达到最大值,调控效果显著,说明HSP70可能参与了各胁迫下的生物代谢和抗逆反应。
鼠尾藻;hsp70基因;温度;盐度;胁迫;荧光定量PCR
鼠尾藻(Sargassumthunbergii)属于褐藻门(Phaeophyta)马尾藻科(Sargassaceae)马尾藻属(Sargassum),是一种分布在我国北起辽东半岛的南至雷州半岛潮间带的广温广盐物种,具有重要的经济和生态价值[1]。鼠尾藻营养价值较高,是鲍鱼、海参等海洋珍品的天然饵料,且其具有较强的吸收营养盐和富集重金属的能力,是潮间带海藻床的重要组成部分,在修复和保护海洋生态系统中发挥重要作用[2-4]。
HSP70家族是热休克蛋白(HSPs)中研究最广泛的和最重要的一个家族,具有高度的保守性,在正常情况下与应激条件下都发挥重要的生理功能,包括组成型的HSC70和诱导型的HSP70[5]。在正常情况下,HSC70在生物体中起着控制跨膜转运新生蛋白质进入细胞器,折叠新翻译的蛋白等重要作用。在热应激或其他应激原的刺激下,HSP70高度诱导表达,参与变性蛋白的重新折叠,修复错误折叠的蛋白,并帮助受损的蛋白质降解,具有维持细胞稳态,提高生物对环境胁迫的耐受性,保护生物免受损伤的作用。
昼夜、季节、气候变化等原因会导致潮间带的温度、盐度、光照等环境因子剧烈变化。作为潮间带的典型物种,鼠尾藻在长期的进化过程中,其必然发展了应对环境胁迫的机制。近年来,HSP70在大藻[6-11]应激中的研究已陆续开展,但褐藻中仅有齿缘墨角藻(Fucusserratus)[12]、海带(Saccharinajaponica)和裙带菜(Undariapinnatifida)[13]的hsp70基因的应激反应报道。目前,关于鼠尾藻的研究多集中在抵御环境胁迫的生理生态学方面[14-15],关于鼠尾藻hsp70基因的研究尚未见报道。本文采用RT-qPCR技术研究了2种重要环境因子温度、盐度及其处理时间对鼠尾藻hsp70表达水平的影响,旨在为海藻抗逆生理机制研究和培育抗逆经济藻类新品种提供科学依据。
1 材料与方法
1.1 材料与暂养
2015年9月下旬在青岛太平角潮间带礁石采集鼠尾藻幼苗,去除杂藻及附生生物,用灭菌海水反复冲洗干净,切取尖端1 cm长短的藻段,在20℃,90 μE·m-1·s-1,12 h∶12 h光周期下,过滤灭菌海水充气暂养3 d。
1.2 胁迫处理
鼠尾藻幼苗在30 ℃下热激1 h,迅速吸干水分,放入液氮中冷冻,-80 ℃保存,用于提取RNA,克隆hsp70、β-actin基因片段。
温度实验设置7个温度组(5、10、15、25、30、35和40 ℃)与对照组(20 ℃),每个组3个平行。培养条件为90 μE·m-1·s-1,光周期为12 h∶12 h,盐度为31,1/8 PESI培养基。分别测定培养1 h后和在对照条件下恢复1 h后鼠尾藻幼苗的hsp70的表达量。
盐度实验设置5个盐度组(0、10、20、40和50)与对照组(盐度31),每个组3个平行。培养条件为90 μE·m-1·s-1,光周期为12 h∶12 h,温度为20℃,1/8 PESI培养基。分别测定培养2 h后和在对照条件下恢复2 h后鼠尾藻幼苗的hsp70表达量。
温度处理时间实验,35℃热激不同时间(0、1、2、3、4、6、8、10和12 h),每个时间点设置3个平行。培养条件为90 μE·m-1·s-1,光周期为12 h∶12 h,盐度为31,1/8 PESI培养基。分别测定热激后和恢复培养1 h后鼠尾藻幼苗的hsp70表达量。
盐度处理时间实验,盐度50处理不同时间(0、1、2、3、4、6、8、10和12 h),每个时间点设置3个平行。培养条件为90 μE·m-1·s-1,光周期为12 h∶12 h,温度为20℃,1/8 PESI培养基。分别测定盐度胁迫后和恢复培养2h后鼠尾藻幼苗的hsp70表达量。
1.3 鼠尾藻RNA的提取
液氮研磨鼠尾藻样品,按照OMEGA R6827-01试剂盒说明书提取RNA,用NanoDrop测定提取的RNA的浓度和纯度(0D260/OD280),琼脂糖凝胶电泳确认RNA完整性后,按照TaKaRa 047A试剂盒说明书,反转录成cDNA。
1.4 引物的设计与hsp70、β-actin基因片段的克隆
参考Fu等[16]一文中设计的hsp70的一对简并引物HSP70F/R(见表1),根据已知物种的β-actin序列(AB053215.1、AB097503.1 、FJ375360、 AY305726、KC469585、JX310002),利用CodeHop原理[17]设计β-actin的一对简并引物β-actinF/R(见表1),进行PCR,分别扩增hsp70cDNA片段和β-actincDNA片段。PCR反应体系10 μL,包含1 μL cDNA模板,1μL 10×PCR buffer,0.8μLdNTP,5.15 μL dH2O,0.05 μL的TaKaRa Ex Taq和1 μL×2引物(10 mmol/L)。94℃预变性3min;94℃ 30s,60℃ 30s,72℃ 30s,35个循环;最后72℃延伸10min。1.5%琼脂糖凝胶电泳检测扩增结果,PCR产物由北京六合华大基因科技股份有限公司测序。
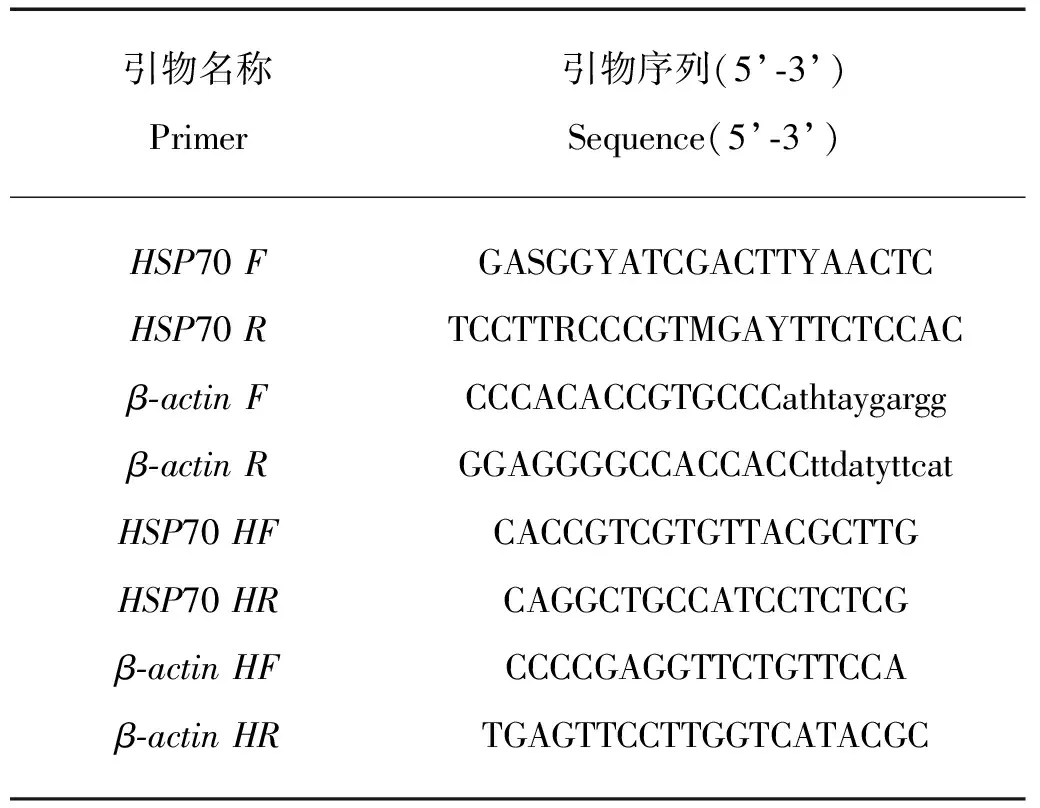
表1 实验中所用的引物序列
1.5 hsp70基因的表达分析
获得的基因序列为模板,利用Primer5.0软件设计特异引物HSP70HF/HR和β-actinHF/HR,扩增片段长度分别为138和182 bp(见表1),对不同温度、盐度、温度时间、盐度时间处理的鼠尾藻幼苗的hsp70基因的表达进行检测。荧光定量PCR扩增体系为20μL,包括:SYBR Premix Ex TaqTMⅡ(2×)10 μL;PCR Forward Primer(10 μmol/L)0.4μL;PCR Reverse Primer(10 μmol/L)0.4 μL;cDNA 模板2.0 μL;DEPC水7.2 μL。反应程序为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40 个循环;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。将荧光定量PCR检测结果导出,采用2-ΔΔCt法,用SPSS11.0软件进行分析。
2 结果
2.1 鼠尾藻RNA提取
1.5%的琼脂糖凝胶电泳检测所提取的RNA的质量(见图1)。从图中可以看到2条清晰的条带28S和18S,还能看到模糊的5S条带,28S RNA条带的亮度是18S RNA条带亮度的2倍,说明提取的总RNA没有降解。用NanoDrop测得的总RNA的OD260/OD280范围在1.8~2.0之间,说明提取的RNA质量较好,符合RT-qPCR的要求。
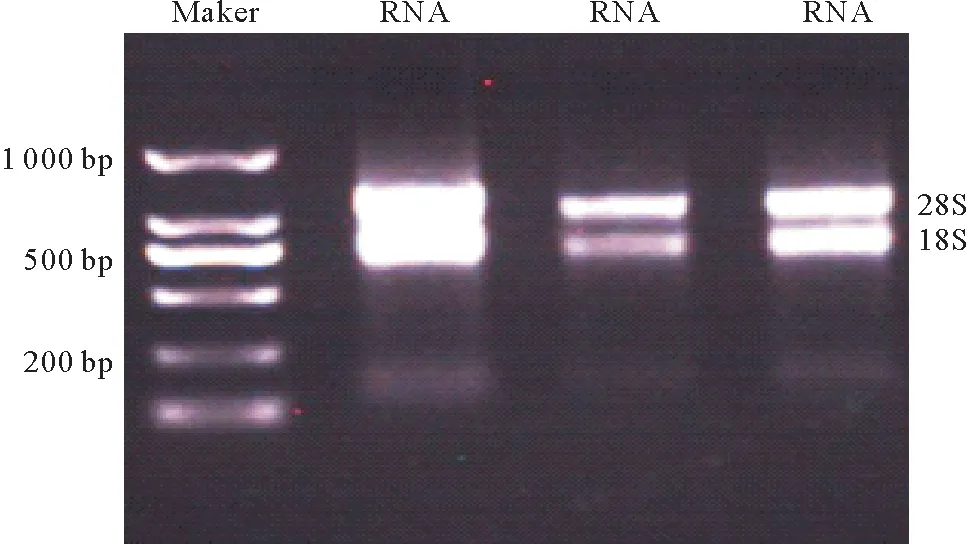
图1 鼠尾藻总RNA提取电泳图Fig.1 Total RNA of Sargassum thunbergii
2.2 hsp70 cDNA和β-actin cDNA序列
将鼠尾藻总RNA进行RT-PCR,利用引物HSP70F/R和β-actinF/R进行扩增,分别得到620 bp左右的条带(见图2a)和530 bp左右的条带(见图2b)。经克隆后测序,得到633 bp的hsp70片段和522 bp的β-actin片段。测序结果经过BLAST分析,表明克隆得到的序列和已报道的齿缘墨角藻(Fucusserratus)hsp70基因(EU780017.1)相似性很高,表明克隆得到的片段为鼠尾藻hsp70基因片段。
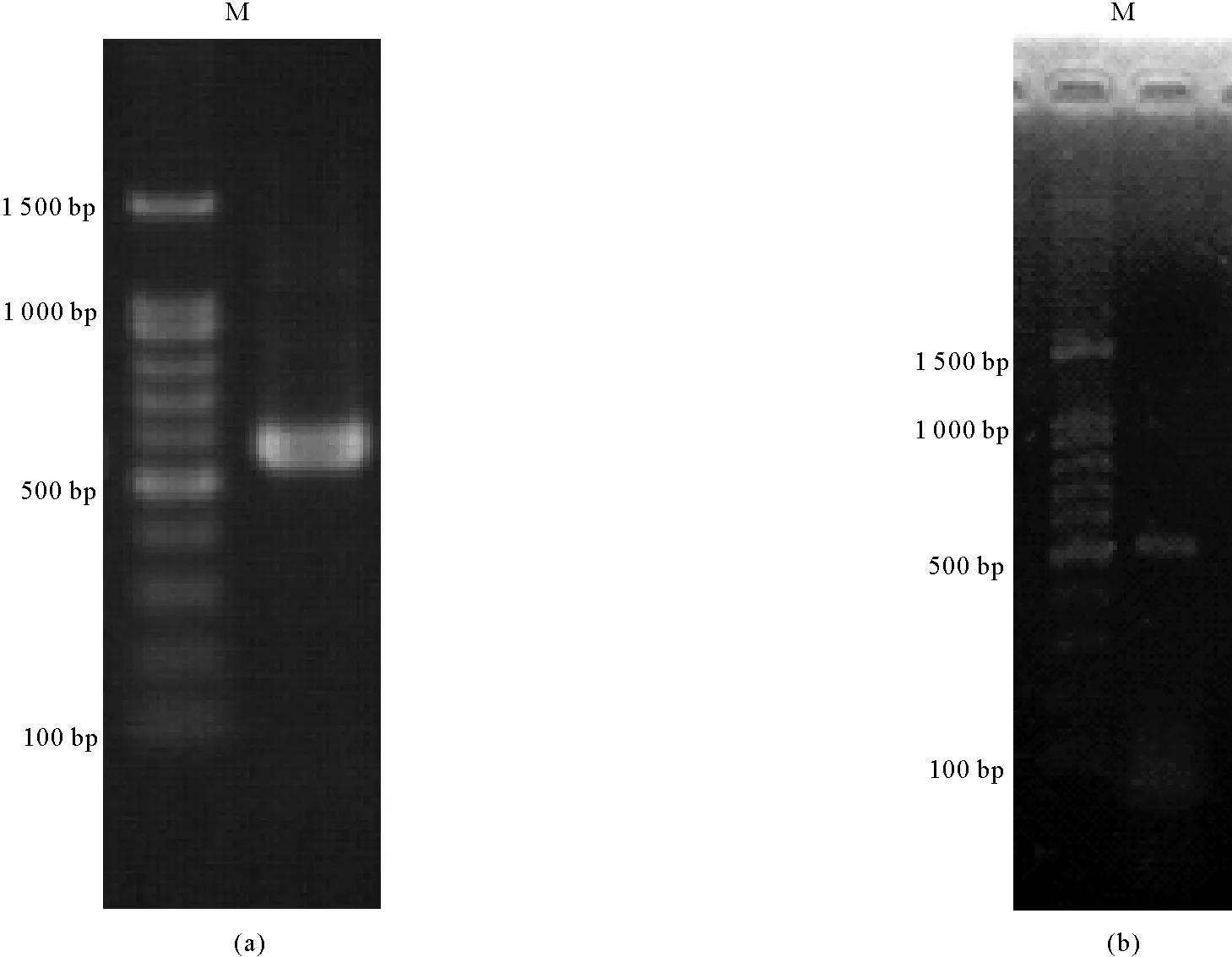
( (a)hsp70基因cDNA片段; (a)hsp70 gene cDNA sequence ofSargassumthunbergii;(b)β-actin基因cDNA片段;(b) β-actin gene cDNA sequence ofSargassumthunbergii。M:Maker DNA分子量。M:Marker DNA ladder.)
图2 鼠尾藻hsp70基因、β-actin基因cDNA扩增结果
Fig.2 The amplification result of Sargassum thunbergii heat shock protein 70 gene and β-actin gene cDNA sequence
2.3 鼠尾藻hsp70基因的表达分析
不同温度处理鼠尾藻幼苗1 h后,hsp70表达量随着温度升高出现先降低后升高的趋势(见图3)。10~30 ℃处理组中,hsp70表达水平相对较低,与对照组相比差异不显著(P>0.05)。5、35和40℃组,hsp70表达量分别是对照组的4.4、3.9和8.6倍,差异极显著(P<0.01)。恢复处理1 h后,35和40 ℃组hsp70表达量与对照组相比差异极显著(P<0.01),而5 ℃组的可基本恢复正常(P>0.05)。
不同盐度处理鼠尾藻幼苗2 h后,hsp70表达量随盐度升高出现先降低后升高的趋势(见图4)。除了20盐度组,其他处理组与对照组相比差异显著(P<0.05)。恢复处理2 h后,0、10和50恢复组与对照组相比差异显著(P<0.05)。0和10恢复组与处理组相比,hsp70表达量有所升高,这可能与HSP70参与损伤后修复相关。40和50恢复组与处理组相比hsp70表达量有所降低。
图5显示了35 ℃不同热激时间处理和恢复后,鼠尾藻hsp70表达量的变化。35 ℃热激1 h后,鼠尾藻hsp70表达量是对照组的4.8倍,差异极显著(P<0.01)。之后hsp70表达量逐渐升高,4 h后达到最高,之后随着时间的推移表达量逐渐降低,10 h后与对照组相比差异不显著(P>0.05)。恢复处理组与对照组相比hsp70表达量增加,1、2、3、4、6和8 h差异显著,10和12 h差异不显著。1、2和3 h恢复组hsp70表达量高于处理组。

(*表示该处理下hsp70表达量与对照组相比差异显著(P<0.05);**表示该处理下hsp70表达量与对照组相比差异极显著(P<0.01)。*Means significant difference between the treatment groups and control group at 0.05 level; ** Means significant difference between the treatment groups and control group at 0.01 level.)
图3 在不同热激温度下鼠尾藻hsp70表达水平定量PCR分析
Fig.3 Under different heat shock temperatures,Sargassumthunbergiihsp70 expression levels analyzed by real-time quantitative RT-PCR
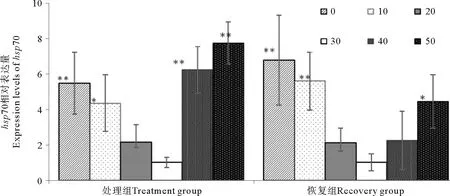
(*表示该处理下hsp70表达量与对照组相比差异显著(P<0.05); **表示该处理下hsp70表达量与对照组相比差异极显著(P<0.01)。*Means significant difference between the treatment groups and control group at 0.05 level; ** Means significant difference between the treatment groups and control group at 0.01 level.)
图4 在不同盐度胁迫下鼠尾藻hsp70表达水平定量PCR分析
Fig.4 Under different salt concentration stresses,Sargassumthunbergiihsp70 expression levels analyzed by real-time quantitative RT-PCR
图6为50盐度下处理不同时间和恢复2 h后,鼠尾藻hsp70表达量的变化。50盐度胁迫1 h后,鼠尾藻hsp70表达量是对照组的3.2倍,之后随着时间的推移表达量先升高后降低,6 h时达到最大值。其中2、3、4、6和8 h与0 h对照组相比差异显著。处理6 h,恢复2 h后,鼠尾藻hsp70表达量与对照组相比增加。
3 讨论
热休克蛋白是一类从细菌、植物到动物中广泛存在的热激类蛋白质。其中HSP70在生物体受到逆境胁迫时作为分子伴侣可以保护细胞蛋白质,提高机体的耐受性,减轻逆境胁迫对机体的伤害[20]。目前,已有大量研究表明,在重金属、盐度、温度等胁迫条件下潮间带无脊椎动物[21-24]和陆生植物[25-28]生物体中hsp70快速表达,但对胁迫下大型海藻的热休克反应研究还比较少,其中褐藻中仅克隆出了齿缘墨角藻、海带和裙带菜hsp70基因全长并分析了其在逆境胁迫条件下hsp70的表达水平。本研究克隆了潮间带非移动生物鼠尾藻hsp70基因片段,研究了其在温、盐胁迫条件处理下表达水平的变化情况,为研究鼠尾藻抗逆分子机制提供科学数据。
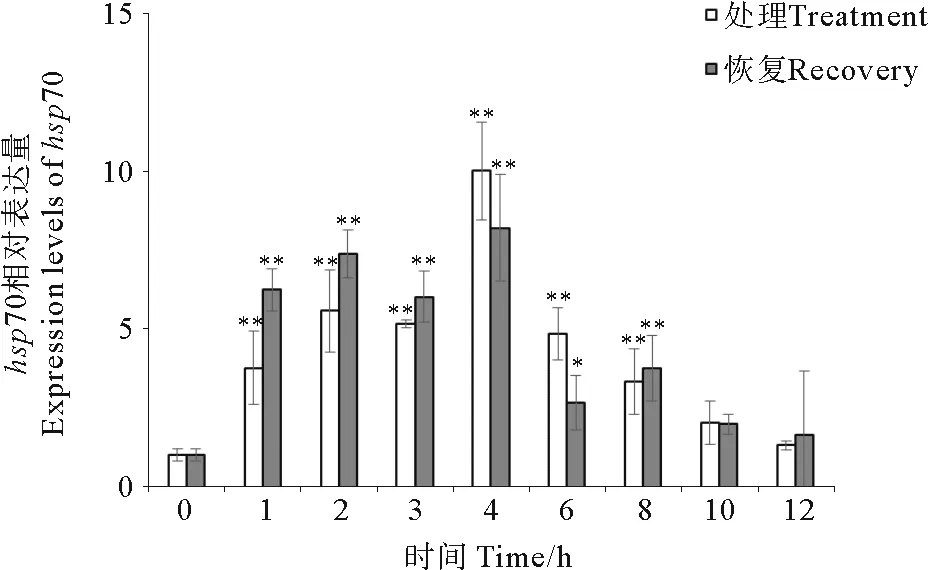
(*表示该处理下hsp70表达量与对照组相比差异显著(P<0.05);**表示该处理下hsp70表达量与对照组相比差异极显著(P<0.01)。*Means significant difference between the treatment groups and control group at 0.05 level; **Means significant difference between the treatment groups and control group at 0.01 level.)
图5 在不同温度处理时间下鼠尾藻hsp70表达水平定量PCR分析
Fig.5 Under different heat shock times,Sargassumthunbergiihsp70 expression levels analyzed by real-time quantitative RT-PCR
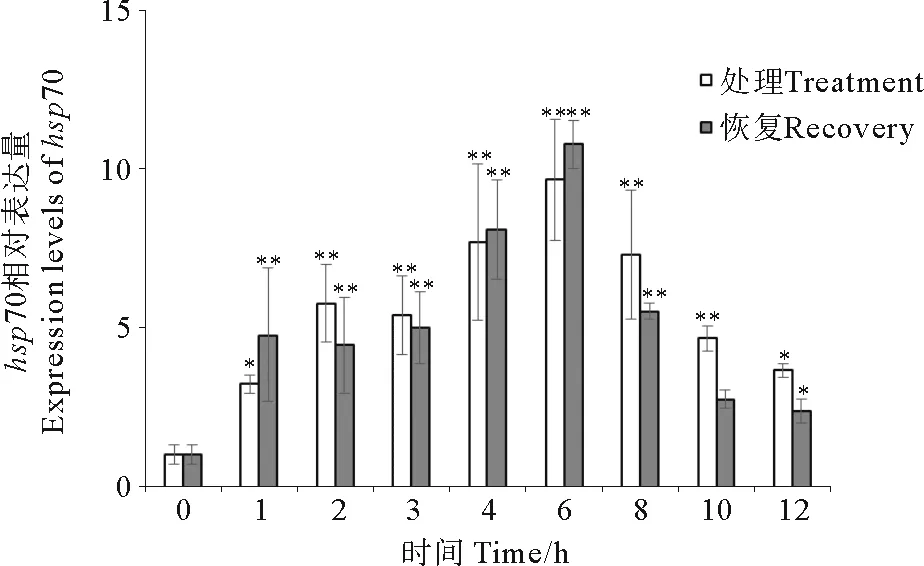
(*表示该处理下hsp70表达量与对照组相比差异显著(P<0.05);**表示该处理下hsp70表达量与对照组相比差异极显著(P<0.01)。*Means significant difference between the treatment groups and control group at 0.05 level; **Means significant difference between the treatment groups and control group at 0.01 level.)
图6 在不同盐度时间胁迫下鼠尾藻hsp70表达水平定量PCR分析
Fig.6 Under different salt concentration times,Sargassumthunbergiihsp70 expression levels analyzed by real-time quantitative RT-PCR
在大型海藻中,短时间的热激胁迫诱导HSPs的表达,其表达量随着温度的升高达到峰值后逐渐下降[12]。本实验结果发现,不同温度处理鼠尾藻1h后,低温和高温组鼠尾藻hsp70表达量显著高于对照组,表明鼠尾藻hsp70的表达量受温度胁迫调节。恢复培养1h后,低温处理组hsp70表达量下降,与对照组相比差异不显著,高温处理组hsp70表达量有所下降且与对照组相比差异极显著,说明高温胁迫处理后的鼠尾藻HSP70可以持续的作用,参与高温损伤后修复。高温处理鼠尾藻幼苗1 h后,hsp70表达量随着温度的升高逐渐升高,与同为褐藻属的海带在高温下的表达模式不同,海带孢子体在35或40 ℃下处理1 h后hsp70表达水平显着低于25或30 ℃处理1 h后的表达水平;但与同为潮间带海藻的绿藻孔石莼(Ulvapertusa)高温下的表达模式相同,35或40 ℃下处理1 h后hsp70表达水平显著高于25或30 ℃处理1h后的表达水平[13]。出现这种差异的原因可能是鼠尾藻和孔石莼同属潮间带海藻,在适应复杂多变的环境过程中产生了相同的应对高温胁迫机制,相比于潮下带的海带可以耐受更高的温度。在恢复处理后,高温组hsp70的表达量仍很高,表明HSP70可以持续作用以修复高温造成的损伤。此外,在热激时间胁迫处理中,hsp70的表达量先升高后下降,可能是因为长时间的高温胁迫造成HSP70及其他酶类失活或相关的mRNA的合成等受到抑制等原因[29]。
由于水分蒸发、降雨、径流等原因,生长在潮间带的鼠尾藻会遭受到盐度胁迫。在高等植物中的研究表明,盐度胁迫可以由核心转录因子调控其下游分子伴侣hsp基因的表达[30]。本研究表明鼠尾藻hsp70的表达受盐度以及盐度胁迫时间的影响,HSP70有可能在抗逆机制中扮演重要角色。在自然条件下,鼠尾藻更容易遇到低盐的环境,藻体的细胞骨架和细胞膜会遭受低渗透的胁迫,藻体迅速提高HSP70蛋白的量以维持细胞内环境稳定,减轻细胞损伤,帮助藻体度过不良环境。
4 结语
本研究克隆了鼠尾藻hsp70基因的片段序列,并首次分析了鼠尾藻在温度、盐度胁迫下hsp70基因的表达变化。研究表明hsp70基因的表达受温度、盐度影响显著,HSP70有可能参与了胁迫下的生物代谢和抗逆反应。hsp70基因片段的克隆及表达分析为鼠尾藻优良种质资源的开发和利用提供了基础资料。
[1] 原永党, 张少华, 孙爱凤, 等. 鼠尾藻劈叉筏式养殖试验[J]. 海洋湖沼通报, 2006(2): 125-128. YUAN Yong-Dang, ZHANG Shao-Hua, SUN Ai-Feng et al. Culture ofSargassumthunbergiiwith long line rafts[J]. Transactions of Oceanology and Limnology, 2006(2): 125-128.
[2] Park P J, Heo S J, Park E J, et al. Reactive oxygen scavenging effect of enzymatic extracts fromSargassumthunbergii[J]. Journal of Agricultural and Food Chemistry, 2005, 53(17): 6666-6672.
[3] 詹冬梅, 李美真, 丁刚, 等. 鼠尾藻有性繁育及人工育苗技术的初步研究[J]. 海洋水产研究, 2006, 27(6): 55-59. ZHAN Dong-Mei, LI Mei-Zhen, DING Gang, et al. Study on reproduction biology and artificial breeding techniques ofSargassumthunbergii[J]. Marine Fisheries Research, 2006, 27(6): 55-59.
[4] 包杰, 田相利, 董双林, 等. 温度、盐度和光照强度对鼠尾藻氮、磷吸收的影响[J]. 中国水产科学, 2008, 15(2): 293-299. BAO Jie, TIAN Xiang-li, DONG Shuang-lin et al. Effect of temperature, salinity and light intensity on phosphorus uptake bySargassumthunbergii[J]. Journal of Fishery Sciences of China, 2008, 15(2): 293-299.
[5] 明建华, 谢骏, 刘波, 等. 团头鲂 HSP70 cDNA的克隆, 序列分析以及热应激对其mRNA表达的影响[J]. 中国水产科学, 2009(5): 635-648. MING Jian-hua, XIE Jun, LIU Bo et al. Cloning, sequence analysis of HSP70 cDNA and effects of heat stress on its mRNA expression inMegalobramaamblycephala[J]. Journal of Fishery Sciences of China, 2009(5): 635-648.
[6] Vayda M E, Yuan M L. The heat shock response of an Antarcticalga is evident at 5℃[J]. Plant Molecular Biology, 1994, 24(1): 229-233.
[7] Lewis S, May S, Donkin M E, et al. Theinfluenceof copper and heat shock on the physiology and cellular stress response ofEnteromorphaintestinalis[J]. Marine Environmental Research, 1998, 46(1): 421-424.
[8] Li R, Brawley S H. Improved survival under heat stress inintertidal embryos (Fucus spp.) simultaneously exposed tohyper salinity and the effect of parental thermal history[J]. Marine Biology, 2004, 144(2): 205-213.
[9] Roeder V, Collén J, Rousvoal S, et al. Identification of stress genes fromLaminariadigitata(Phaeophyceae) protoplast cultures by expressed sequence taganalysis[J]. Journal of Phycology, 2005, 41(6): 1227-1235.
[10] Collén J, Guisle-Marsollier I, Leger J J, et al. Response ofthe transcriptome of the intertidal red seaweedChondruscrispusto controlled and natural stresses[J]. New Phytologist, 2007, 176(1): 45-55.
[11] Henkel S K, Hofmann G E. Differing patterns of hsp70 gene expression in invasive and native kelp species: evidence for acclimation-induced variation[J]. Journal of Applied Phycology, 2008, 20(5): 915-924.
[12] Ireland H E, Harding S J, Bonwick G A, et al. Evaluation of heat shock protein 70 as a biomarker of environmental stress inFucusserratusandLemnaminor[J]. Biomarkers, 2004, 9(2): 139-155.
[13] 付万冬. 四种海藻热休克蛋白70(HSP70)基因的克隆与表达分析[D]. 青岛: 中国科学院研究生院 (海洋研究所), 2009. FU Wan-Dong. Molecular Cloning and Expression Analysis of Cytosolic HSP70 Genes from Four Kinds of Seaweeds[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2009.
[14] Deane E E, Woo N Y S. Cloning and characterization of the hsp70 multigene family from silver sea bream: modulated gene expression between warm and cold temperature acclimation[J]. Biochemical and Biophysical Research Communications, 2005, 330(3): 776-783.
[15] Franzellitti S, Fabbri E. Differential HSP70 gene expression in the Mediterranean mussel exposed to various stressors[J]. Biochemical and Biophysical Research Communications, 2005, 336(4): 1157-1163.
[16] Fu W, Yao J, Wang X, et al. Molecular cloning and expression analysis of a cytosolic Hsp70 gene fromLaminariajaponica(Laminariaceae, Phaeophyta)[J]. Marine Biotechnology, 2009, 11(6): 738-747.
[17] Rose T M, Schultz E R, Henikoff J G, et al. Consensus-degenerate hybrid oligonucleotide primers for amplification of distantly related sequences[J]. Nucleic Acids Research, 1998, 26(7): 1628-1635.
[18] Thompson J D, Gibson T J, Plewniak F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25(24): 4876-4882.
[19] Kumar S, Tamura K, Nei M. MEGA3: Integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics, 2004, 5(2): 150-163.
[20] 顾颖慧. 龙须菜热激蛋白70(HSP70)基因克隆及热激下的表达模式分析[D]. 青岛: 中国海洋大学, 2011. GU Ying-Hui. Molecular Cloning and Expression Analysis of Heat-Shock-Protein 70 (HSP70) Genes fromGracilarialemanei-formisUnder Heat Shock[D]. Qingdao: Ocean University of China, 2011.
[21] Hofmann G E. Ecologically relevant variation in induction andfunction of heat shock proteins in marine organisms[J]. American Zoologist, 1999, 39(6): 889-900.
[22] Halpin P M, Sorte C J, Hofmann G E, et al. Patterns ofvariation in levels of Hsp70 in natural rocky shore populationsfrom microscales to mesoscales[J]. Integrative and Comparative Biology, 2002, 42(4): 815-824.
[23] Hamdoun A M, Cheney D P, Cherr G N. Phenotypic plasticity of HSP70 and HSP70 gene expression in the pacific oyster(Crassostreagigas): Implications for thermal limits and inductionof thermal tolerance[J]. Biological Bulletin, 2003, 205(2): 160-169.
[24] Sagarin R D, Somero G N. Complex patterns of expression ofheat-shock protein 70 across the southern biogeographical rangesof the intertidal musselMytiluscalifornianusand snailNucellaostrina[J]. Journal of Biogeography, 2006, 33(4): 622-630.
[25] Howarth C J. Molecular responses of plants to an increasedincidence of heat-shock[J]. Plant, Cell& Environment, 1991, 14(8): 831-841.
[26] Downs C A, Heckthorn S A, Bryan J K, et al. Themethionine-rich low-molecular-weight chloroplast heat shockprotein: evolutionary conservation and accumulation in relationto thermotolerance[J]. American Journal of Botany, 1998, 85(2): 175-183.
[27] Hong S W, Vierling E. Mutants ofArabidopsisthalianadefective in the acquisition of tolerance to high temperaturestress[J]. Proceedings of the National Academyof Sciences, 2000, 97(8): 4392-4397.
[29] Fu W, Shuai L, Yao J, et al. Molecular cloning and expression analysis of a cytosolic Hsp70 gene fromUlvapertusa(Ulvophyceae, Chlorophyta)[J]. Journal of Applied Phycology, 2011, 23(4): 681-690.
[30] 吴运荣, 林宏伟, 莫肖蓉. 植物抗盐分子机制及作物遗传改良耐盐性的研究进展[J]. 植物生理学报, 2014, 50(11): 1621-1629. WU Yun-Rong, LIN Hong-Wei, MO Xiao-Rong. Research progress in the mechanism of plant salt tolerance and genetic engineering of salt resistant crops[J]. Plant Physiology Journal, 2014, 50(11): 1621-1629.
Abstract: A cDNA fragment encoding the HSP70 ofSargassumthunbergiiwas isolated using RT-PCR technique. Withβ-actinas the internal control, relative abundance ofhsp70transcripts ofS.thunbergiiat different temperatures and salinities was determinedwithRT-qPCR.S.thunbergiiwas cultured at different temperatures for 1h or different salinities for 2h. It was also kept at 35℃ or at 50psu salinity for different durations. The results showed that (1) at different temperatures (5, 10, 15, 20, 25, 30, 35 and 40℃)for 1h, the abundance ofhsp70transcripts at 40℃ was the highest, 8. 6folds higher than that at 20℃. After an 1hrecovery, the difference between 5℃and control was not significant while that between 35℃and 40℃was significant; (2) at different salinities (0, 10, 20, 31, 40 and 50) for 2h, the abundance ofhsp70transcripts at 0, 10, 40 and 50psu was significantly higher than that at 30psu while that after recoveryat 0psu for 2h was the highest; (3) at 35℃ for different durations (0, 1, 2, 3, 4, 6, 8, 10 and 12), the expression ofhsp70showed a trend of rising first and falling then, reaching the top at 4h, and for less than 3h, the expression increased after an 1hrecovery; and (4) at 50psu for different durations (0, 1, 2, 3, 4, 6, 8, 10 and 12h), the abundance ofhsp70transcripts showed a trend of rising first and falling then, reaching the highest after 6h while after recovery at 30psu for 2h, the expression ofhsp70showed the same trend as that at 35℃. The results showed that the expression ofhsp70 was influenced by high temperatures and salinities. Such response may participate in the physiology processes of stress resistance.
Key words:Sargassumthunbergii;hsp70; temperature; salinity; stress; RT-qPCR
责任编辑 朱宝象
Isolation ofSargassumthunbergiihsp70 Gene and Its Expression Analysis at Different Temperatures and Salinities
XU Qun, LIU Yan, GONG Qing-Li
(The Key Laboratory of Mariculture(Ocean University of China), Ministry of Education, Qingdao 266003, China)
S968.42
A
1672-5174(2017)11-024-07
10.16441/j.cnki.hdxb.20160148
徐群,刘岩,宫庆礼.鼠尾藻hsp70基因的克隆及温度、盐度对其表达的影响[J].中国海洋大学学报(自然科学版),2017,47(11): 24-30.
XU Qun,LIU Yan,GONG Qing-Li. Isolation ofSargassumthunbergiihsp70 gene and its expression analysis at different temperatures and salinities [J].Periodical of Ocean University of China, 2017,47(11): 24-30.
海洋公益性行业科研专项经费项目(201405040-4)资助 Supported by Public Science and Technology Research Funds Projects of Ocean(201405040-4)
2016-04-27;
2016-12-06
徐 群(1990-),女,硕士生,研究方向为藻类生理学。E-mail:xuqun09111628@163.com
** 通讯作者:E-mail:qd-liuyan@ouc.edu.cn
