高蛋白藻类两步水热液化制备生物油的研究进展
2017-10-16庄修政黄艳琴阴秀丽吴创之
庄修政, 黄艳琴, 阴秀丽, 吴创之
(1.中国科学院 广州能源研究所, 广东 广州 510640; 2.中国科学院可再生能源重点实验室, 广东 广州 510640;3.广东省新能源和可再生能源研究开发与应用重点实验室, 广东 广州 510640; 4.中国科学院大学, 北京 100049)
高蛋白藻类两步水热液化制备生物油的研究进展
庄修政1,2,3,4, 黄艳琴1,2,3, 阴秀丽1,2,3, 吴创之1,2,3
(1.中国科学院 广州能源研究所, 广东 广州 510640; 2.中国科学院可再生能源重点实验室, 广东 广州 510640;3.广东省新能源和可再生能源研究开发与应用重点实验室, 广东 广州 510640; 4.中国科学院大学, 北京 100049)
介绍了高蛋白藻类的组分及生长特点、高蛋白藻类水热液化制备生物油的研究现状,在分析直接水热液化不足之处的基础上,指出了两步水热液化处理高蛋白藻类生物质的优势,总结了国内外对于藻类两步水热液化制备生物油的相关研究,重点分析了蛋白质、脂质和碳水化合物在水热液化中的转化过程及其两步液化的可行性。最后,提出基于两步法处理高蛋白藻类的重点研究方向。
高蛋白; 藻类生物质; 生物油; 两步法; 水热液化
Abstract: The studies on one-step hydrothermal liquefaction and its disadvantage were reviewed and summarized. At the same time, a two-step hydrothermal liquefaction was proposed. The latest study on bio-oil produced from high-protein algae via two-step hydrothermal liquefaction and the liquefaction pathway of protein, lipid and carbohydrate were reported to evaluate the feasibility of this liquefaction. Finally, a number of research directions were suggested based on the findings.
Keywords:high-protein; algae; bio-oil; two-step; hydrothermal liquefaction
随着工业社会的发展,人们对石油和煤炭等化石能源的过度开采造成环境的严重污染,并且化石能源的储备量有限,不能满足人类可持续发展的需求。因此,对包括生物质能在内的各种可再生能源的开发利用显得尤其重要,其中藻类生物质具有生长速度快、不占用耕地、可高效固定CO2、吸收水体中的N、P营养元素等显著优势被认为是未来能源的重点开发对象[1-6]。
藻类生物质种类繁多,按形态可分为微藻与巨藻两大类。其中巨藻的碳水化合物含量较高(质量分数为12%~65%),一般用于发酵制备沼气、糖化发酵制备乙醇等[7-9];而微藻按组分特点可分为高蛋白类(质量分数为30%~70%)和高脂质类(质量分数为10%~40%)[9],根据微藻中组分含量的差异,其适宜的能源化利用技术也有所差异,目前微藻可通过脂交换转化法、催化转化法和热化学法等制备生物燃油,其中热化学法中的水热液化法以其能充分利用各组分、运行能耗低和无须干燥等优势,成为近年来研究藻类能源化利用的热点。
研究发现脂质是制备生物油的最有效组分,其次是蛋白质和碳水化合物[10]。因此目前对于藻类制备生物油的研究大多集中在高油脂藻类。然而,高油脂藻类一般对培养环境要求苛刻且单位年产率相对较低,而高蛋白藻类能够生长在废水等严峻环境中,年产量高(可达350 m3/(ha·a)[11]),并且能在生长过程中吸收废水中过量的有机物以及氮磷元素等,实现废水的净化。美国伊利罗伊大学分校张源辉教授课题组[12]提出“环境增强型能源”(E2-Energy, Enviroment enhancing energy)模型,在废水中培养高蛋白藻类,通过该藻吸收二氧化碳并且释放氧气,处理废水的同时实现藻类生物质的增长,再通过水热技术将高蛋白藻类转化为生物油,将能源再生与环境改善整合在一个“环境增强型能源”系统中。因此,开展对于低油脂高蛋白藻类水热液化制备生物油的研究具有重要意义。
1 高蛋白藻类直接水热液化的研究现状
1990年日本资源与环境国际研究所的Minowa就提出了藻类水热液化制备生物油的技术[13-15]。随着藻类作为能源原料的开发利用,以藻类为原料的第3代生物油得到越来越多的关注,表1列出了近年来对于高蛋白藻类直接水热液化制备生物油的相关研究[9-10,12,16-23]。

表1 不同藻类直接水热液化制备生物油的性能Table 1 The properties of bio-oil from different algaes via single-step hydrothermal liquefaction
1)All data expect O (calculated by different) are determined based on dry base
HHV—Higher heating value
从表1可以看出,针对高蛋白藻类直接液化制备生物油的热值在28~39 MJ/kg之间,与石油的热值相近(42 MJ/kg)。Biller等[10]在350℃亚临界水条件下分别以Na2CO3和CHOOH为催化剂直接液化4种高蛋白藻类制备生物油,其生物油热值比藻类提高59.9%~147%,达到22~36 MJ/kg。同时,发现蛋白质与脂质组分在不使用Na2CO3和CHOOH作为催化剂的情况下液化效果最好,而碳水化合物则在Na2CO3的作用下最优。通过GC-MS发现,蛋白质在液化过程中主要产生大量氮杂环化合物、吡咯和吲哚等,碳水化合物主要产生环酮和苯酚,而脂质则主要产生脂肪酸。Li等[18]以低脂质高蛋白微拟球藻(Nannochloropsis;52% Protein)和高脂质低蛋白小球藻(Chlorella;12% Lipid)为原料进行直接液化对比试验,得到生物油的氮含量分别为5.4%和0.3%;该结果也与Biller等[10]的研究结果相符,说明生物油中的含氮化合物主要由蛋白质降解产生。同时,以高脂质小球藻为原料在较佳条件下可得到82.9%的生物油,而以低脂质微拟球藻为原料的生物油产率仅55%,说明脂质转化为生物油的效率要比蛋白质与碳水化合物好。
水热液化法能有效地将高蛋白藻类转化为高热值生物油,是一条切实可行的高蛋白藻类能源化利用途径。但是,相比于以高脂质藻类为原料的生物油,高蛋白藻类生物油存在着产率低、氮氧含量高、成分复杂等劣势;除了包括酮类、醛类、酚类化合物、烯烃、脂肪酸、酯类、芳烃等外,高蛋白藻类生物油含有较多的氮氧杂环化合物[24],这些化合物会通过酸化、聚合反应进一步降低生物油的品质[25-26],从而影响其燃烧性能、储存稳定性以及后续提质成本等。
2 高蛋白藻类两步水热液化的研究现状
虽然以蛋白质为主的3种组分都能有效地通过水热液化转化为生物油,但三者的转化机理和路径各不相同。此外,脂质与碳水化合物的水解产物如脂肪酸和还原糖等也会与蛋白质发生复杂的交联反应生成氮氧化合物。为了充分利用藻类各组分并提高生物质油的品质,可通过两步液化法降低生物油中的氮氧化合物或提取高价值的副产品。因此,对于藻类蛋白质、脂质和碳水化合物的液化过程以及其模拟物两步液化的研究尤其重要。
2.1蛋白质组分的两步水热液化
蛋白质是生物油中的氮杂环化合物的主要来源。Gai等[27]通过实验推断出蛋白质的水热液化反应过程如图1所示。在0~100℃内,蛋白质首先发生水解反应生成各种氨基酸。随着温度的上升,生成的氨基酸进一步发生各种反应,其中Sato等[28]通过研究5种氨基酸的降解发现脱羧基反应与脱氨基反应是2个主要反应,这与Peterson等[26]的结论一致。在100~200℃之间,一部分氨基酸中羧基官能团通过脱羧反应生成胺类化合物,其中羧基以CO2等气相产物形式释放。另外一部分氨基酸通过脱氨基反应生成有机酸,其中氨基以NH3形式释放,在脱羧基与脱氨基过程中使部分氮原子与氧原子脱除[29]。Changi等[30]与Chen等[31]均在220~350℃下利用苯丙氨酸作为藻类中蛋白质的模拟化合物进行水热液化反应,结果一致表明苯乙胺为主要产物,并进一步建立上述反应路线的动力学模型。
除此之外,氨基酸还会与碳水化合物的水解产物如还原糖等发生Maillard反应,生成多种杂环氮氧化合物,包括吡咯、吡咯烷酮、吡啶、咪唑等,最后形成一种富含氮的聚合物,称之为蛋白黑素(Melanoidins)[32-34]。该类杂环氮氧化合物一旦形成,即使是在超临界条件下也很难被降解[10,35-36]。Peterson等[37]以葡萄糖与氨基醋酸为例研究水热过程中的Maillard反应动力学与机理,如图2所示。当温度超过200℃时,蛋白黑素降解生成气体、不溶性焦、氨以及水溶性有机物。超过250℃时,由于含氮化合物如嘧啶和对二氮杂苯等形成使得生物油的产率上升。此外,该阶段可通过生成更多的自由基从而抑制焦和气体的形成[33]。因此,Maillard反应在超过250℃能有效增加生物油产量[38],不过同时也会在一定程度上增加生物油的氮含量。

图1 蛋白质的水热液化过程[27]Fig.1 The hydrothermal liquefaction pathway of protein[27]
Biller等[10]通过研究藻类3大组分的模拟化合物发现,以氨基酸(天冬酰胺和谷氨酰胺)为原料制备生物油的氮含量比以大豆蛋白制备出的生物油低6%~7%,指出对高蛋白含量的藻类在液化前进行水解预处理能有效减少生物油中的氮含量。Du等[17]首先在水热低温段(150~225℃)中水解藻类中的蛋白质,发现其藻类残渣的碳含量和热值比未处理藻类分别提高28%~69%和29%~95%,并且其氮含量只有未处理藻类的58%~94%。随后用藻类残渣进行500℃热解液化制备生物油,发现所得生物油中含氮化合物的种类和数量都比直接用高蛋白藻类制备的生物油有所降低,这与Costanzo等[39]的结果相符。Luo等[40]在研究大豆蛋白水热液化动力学时发现,在低温段200℃下处理60min时,液相中氮回收率可达60%。Jazrawi等[20]也通过两步液化法制备生物油,并研究以均相催化剂对高蛋白藻类液化效果的影响。发现在低温段(<200℃)下高蛋白藻类约有50%的氮进入水相中,以低温段所得藻类残渣通过高温段(250~350℃)制得生物油的氮含量相比于直接液化法所得的生物油低55%。Levine等[41]也认为,这种预处理能有效破坏藻类细胞壁,在减少生物油氮含量的同时免去了其他需要脱水和分离的产物。Sunphorka等[42-43]设计了一套“水液-热解”连续液化装置,通过以藻类为原料在低温水热条件下进行预处理,然后将藻类残渣直接送入管式炉进行热解制备生物油,发现两步法在最优条件(320℃,2 h,12 MPa)下热解液化得到的总生物油产率比一步法制得的生物油产率高8%。他们认为这主要是因为轻组分的碳氢化合物能在低温段被提取出来,而重组分的碳氢化合物则在高温段被提取。因此,Sunphorka等认为,两步法能减少轻组分在高温段中的降解从而提高生物油产率。Barreiro等[44]设计“酶解蛋白-水热液化”两步流程对

图2 Maillard反应过程[2,37]Fig.2 Maillard reaction network[2,37]
2种藻类(Nannochloropsis和Scenedesmus)进行水热液化(350℃)制备生物油,发现与直接液化相比,以Nannochloropsis为原料的生物油氮含量由5.1%降至4.2%。一般而言,通过两步液化法制备生物油,其氮氧含量均能比直接液化法所制得的生物油低20%左右,若改变有机溶剂或者调节pH值则能进一步改善生物油品质[20,44]。此外,相对于直接液化,两步液化法每获得1 kg的生物油可节省15 MJ的能量,并且能源回收率提高4%[45]。
两步液化法中的低温段预处理也被认为是提取生物质高价值产物的有效手段。Kang等[46-47]在水热条件下以250℃处理鱼类废弃物60 min得到137 mg/g 的氨基酸,同时Kang等也发现,在200℃下对生物质进行水热处理可有效提取其中的氨基酸;但当温度超过250℃时,由于氨基酸降解为有机酸的速率加快使得其产率减少。此外,一些高蛋白质含量的藻类可以相同方法提取含氮营养物[48]。亚临界水被认为是提取蛋白质和氨基酸的合适媒体[47],有研究表明,水热过程中高达70%的氮营养物可从原料转移到水相中,因此对水热液化过程后的液相产品进行提纯可得到高价值副产品[49]。
2.2脂质组分的两步水热液化
脂质是藻类三大组分中最接近生物油的组分,并且脂质转化为生物油的效率也是最高的[10],是制备生物油的理想组分。通过总结Gai[27]与Long等[50]的分析结果推断出脂质的水热液化反应过程,如图3 所示。在0~100℃内,脂质水解生成丙三醇和长链脂肪酸。随着温度的上升,部分脂肪酸转化为长链碳氢化合物。此外,脂肪酸与氨基酸的水解中间产物也发生脱羧基反应和聚合反应生成烷烃类和烯烃类碳氢化合物。在水热液化过程中,水解反应与聚合反应共同作用于藻类的三大组分[51]。在200℃以上时,长链脂肪酸与氨基酸脱氨基后产物反应生成脂肪胺类有机物和酯类有机物。另外,氨基酸与还原糖通过Maillard反应生成的杂环氮氧化合物也会与长链脂肪酸反应生成吡咯基脂肪酸。同时,在亚/超临界水条件下对丙三醇的酸碱催化水解有促进作用[52]。Long等[50]总结了丙三醇在水热条件下的主要反应。此外,丙三醇、乙醇等有机溶剂也可作为溶剂与生物质进行共液化反应[53-57]。

图3 脂质的水热液化过程[27,34,50]Fig.3 The hydrothermal liquefaction pathway of lipid[27,34,50]
李法杜[58]以油脂为原料,通过“亚临界水-超临界甲醇”两步法制备生物油。发现第一步水解反应最佳条件是在亚临界水(290℃)下反应40 min,在第二步脂化反应中最佳条件是在超临界甲醇(290℃)下反应30 min。通过水解预处理将脂质转化为长链脂肪酸不仅可以为第二步的酯化反应提供原料,也无须提前处理油脂中的游离脂肪酸。因为直接液化制备生物油中,若油脂所含游离脂肪酸含量过高,会影响油脂与甲醇的脂交换反应,产生副反应导致生成产物成分复杂。Du等[17]在150~225℃之间水热预处理藻类,发现预处理后其藻类氮含量减少,但其脂肪酸含量仍保持在原来的73%~99%之间;相似的高脂肪酸保持率也在Levine等[41]的研究中出现。低温预处理后藻类具有较高脂质和低氮含量,表明了两步水热液化法在降低氮含量的同时不会减少原有的脂肪族化合物,保证了生物油的产率和品质。
2.3碳水化合物组分的两步水热液化
碳水化合物是藻类三大组分中最不易转化为生物油的组分。Gai等[27]通过试验推断出碳水化合物的水热液化反应过程,如图4所示。在0~100℃内,碳水化合物水解生成还原糖与非还原糖。随着温度的上升,还原糖与非还原糖分子键断裂并重聚生成环氧化合物。在200℃以上,还原糖通过Maillard反应与氨基酸生成多种杂环氮氧化合物,包括吡咯、吡咯烷酮、吡啶和咪唑等[37,59]。除此之外,藻类还包含着一小部分纤维素。该类纤维素能在水热条件下水解生成葡萄糖和果糖,Kruse等[60]和Deniel等[34]进一步总结了纤维素在水热条件下的反应过程。
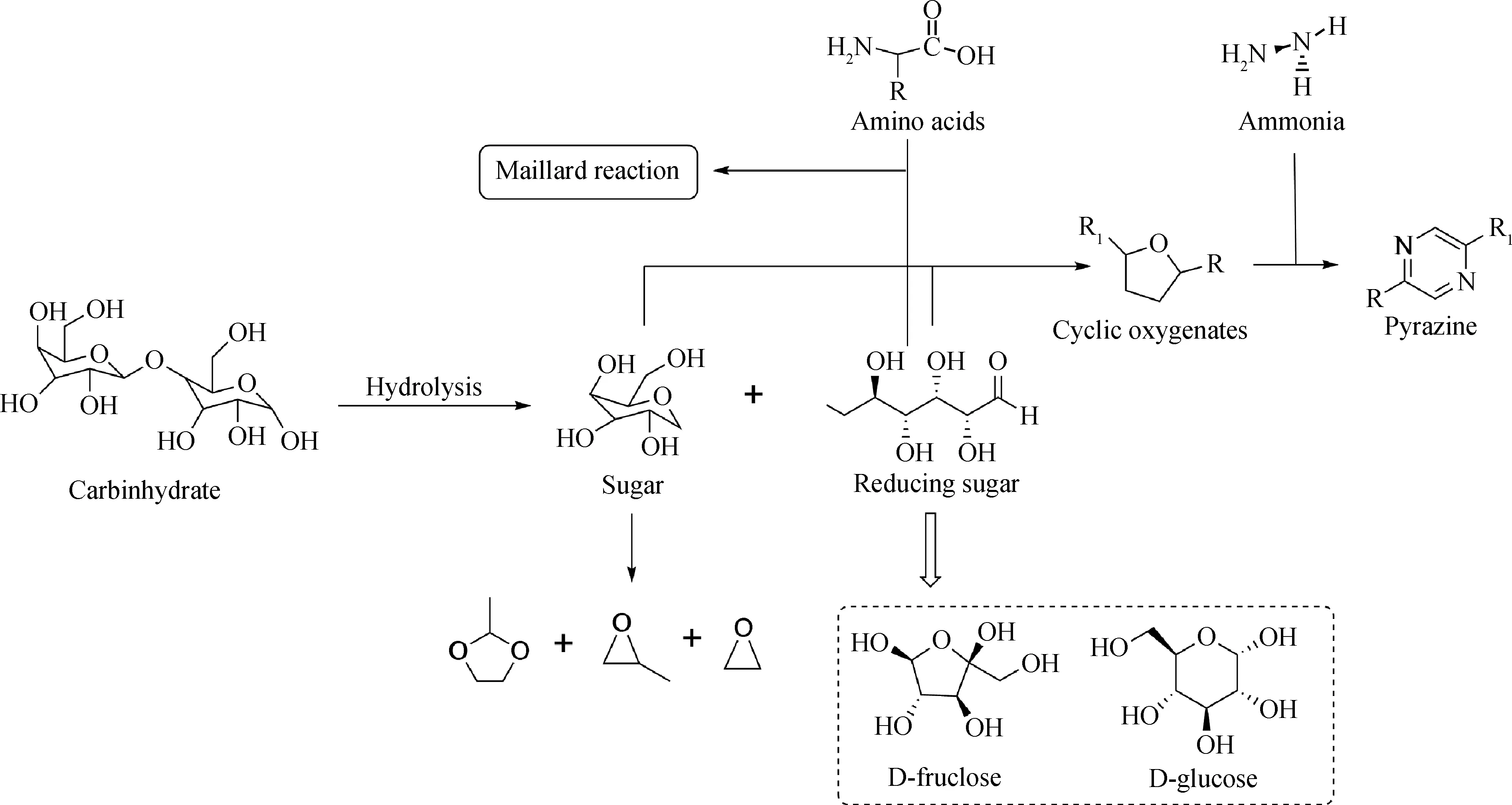
图4 碳水化合物的水热液化过程[27]Fig.4 The hydrothermal liquefaction pathway of carbohydrate[27]
Chakraborty等[61]在160℃下水热处理藻类及提取多糖,并利用预处理后藻类残渣在300℃高温下制备生物油和进一步提取多糖。结果发现,通过两步法制备生物油的热值与直接液化制得的生物油热值差别不大,均可达40~43 MJ/kg;同时通过两步法能提取出31.8%的多糖。刘慧屏等[62]设计了“亚临界低温段水解+超临界高温段水解”两步法水解生物质的工艺路线提取还原糖,结果发现,与一步法水解工艺相比,亚/超临界水两步水解法下能获得最大还原糖总产率为58%,比超临界水一步法获得的最大还原糖产率高17%。Kruse等[33]发现,葡萄糖能进一步降解甲醇、乙醇、乳酸、丙烯酸和糠醛,这类极性化合物易溶于液相溶剂中,并不会成为生物油的组成成分,这与Srokol等[63]的结果一致。同时,Chakraborty等[61]和Minowa等[64]发现,在水热过程中有部分糖类转化为油相、水相和气相,但大部分糖类化合物都是转化为固相。因此认为,以两步液化法先提取藻类中糖类化合物后制备生物油并不会降低生物油的品质。
综上所述,藻类是一种复杂的生物大分子混合物。通过Alba等[65]的研究发现,藻类中各组分的交联反应十分复杂,某一特定的化合物能通过不同的反应路径生成。例如,生物油中的长链烃能通过脂质水解后的长链脂肪酸和蛋白质水解后的氨基酸脱碳酸基形成;同时,相关研究[26,51,65]发现,藻类中碳水化合物水解后的中间产物如乙醛和苯等也能进一步生成大分子烃。因此,需要说明的是,在本研究中所提及的反应路径只是解释一些藻类确切组分在水热过程中可能存在的反应过程。
3 结论与展望
(1)藻类水热液化制备生物油是藻类能源化利用中一项非常有潜力的技术。目前对于藻类的利用大多局限在高脂质含量的藻类上,但该藻类产量较低,养殖成本高;而高蛋白藻类产率高,且能在废水中培养从而实现废水的净化处理,是一种具有潜力的藻类原料。但以高蛋白藻类为原料进行直接液化制备生物油,其生物油会由于其较高的氮氧含量而降低其燃烧性能、储存稳定性和后续提质成本等。通过两步液化法制备生物油能有效减少生物油中的氮氧含量,为高蛋白含量的藻类提供一条新的液化工艺。
(2)目前对于藻类两步液化法制备高品质生物油的相关研究仍比较匮乏,现有的相关研究重点关注在通过两步液化法提取藻类等生物质的高价值产物如氨基酸和还原糖等。针对高蛋白藻类制备生物油的两步液化法研究,可以从以下几个方面入手:1)研究蛋白质在水热液化低温段和高温段时的转化过程和机理,从而优化液化条件;2)研究在低温段预处理高蛋白藻类的同时将蛋白质与糖类组分转化为其他高附加值产物,进一步提高经济效益;3)研究不同的催化剂和液化介质在水热过程中的作用,提高生物油的产率和品质。
[1] CHISTI Y. Biodiesel from microalgae[J].Biotechnology Advances, 2007, 25(3): 294-306.
[2] GUO Y,YEH T, SONG W H, et al. A review of bio-oil production from hydrothermal liquefaction of algae[J].Renewable & Sustainable Energy Reviews, 2015, 48: 776-790.
[3] RAWAT I, KUMAR R R, MUTANDA T, et al. Dual role of microalgae: Phycoremediation of domestic wastewater and biomass production for sustainable biofuels production[J].Applied Energy, 2011, 88(10): 3411-3424.
[4] SINGH A,OLSEN S I. A critical review of biochemical conversion, sustainability and life cycle assessment of algal biofuels[J].Applied Energy, 2011, 88(10): 3548-3555.
[5] TRAN N H, BARTLETT J R, KANNANGRA G S K, et al. Catalytic upgrading of biorefinery oil from micro-algae[J].Fuel, 2010, 89(2): 265-274.
[6] WIJFFELS R H,BARBOSA M J. An outlook on microalgal biofuels[J].Science, 2010, 329(5993): 796-799.
[7] ANASTASAKIS K,ROSS A B. Hydrothermal liquefaction of four brown macro-algae commonly found on the UK coasts: An energetic analysis of the process and comparison with bio-chemical conversion methods[J].Fuel, 2015, 139(1): 546-553.
[8] SUGANYA T, VARMAN M, MASJUKI H H, et al. Macroalgae and microalgae as a potential source for commercial applications along with biofuels production: A biorefinery approach[J].Renewable & Sustainable Energy Reviews, 2016, 55: 909-941.
[9] ZHOU D, ZHANG L A, ZHANG S C, et al. Hydrothermal liquefaction of macroalgae enteromorpha prolifera to bio-oil[J].Energy & Fuels, 2010, 24: 4054-4061.
[10] BILLER P,ROSS A B. Potential yields and properties of oil from the hydrothermal liquefaction of microalgae with different biochemical content[J].Bioresource Technology, 2011, 102(1): 215-225.
[11] QUNINN J C,DAVIS R. The potentials and challenges of algae based biofuels: A review of the techno-economic, life cycle, and resource assessment modeling[J].Bioresource Technology, 2015, 184: 444-452.
[12] 张冀翔.生物油在亚临界、超临界流体中的制备与提质改性研究[D].浙江: 浙江大学, 2013.
[13] DOTE Y, SAWAYAMA S, INOUE S, et al. Recovery of liquid fuel from hydrocarbon-rich microalgae by thermochemical liquefaction[J].Fuel, 1994, 73(12): 1855-1857.
[14] INOUE S, DOTE Y, SAWAYAMA S, et al. Analysis of oil derived from liquefaction of botryococcus-braunii[J].Biomass & Bioenergy, 1994, 6(4): 269-274.
[15] MINOWA T, YOKOYAMA S, KISHIMOTO M, et al. Oil production from algal cells of dunaliella-tertiolecta by direct thermochemical liquefaction[J].Fuel, 1995, 74(12): 1735-1738.
[16] BRENNAN L,OWENDE P. Biofuels from microalgae——A review of technologies for production, processing, and extractions of biofuels and co-products[J].Renewable & Sustainable Energy Reviews, 2010, 14(2): 557-577.
[17] DU Z Y, MOHR M, MA X C, et al. Hydrothermal pretreatment of microalgae for production of pyrolytic bio-oil with a low nitrogen content[J].Bioresource Technology, 2012, 120: 13-18.
[18] LI H, LIU Z D, ZHANG Y H, et al. Conversion efficiency and oil quality of low-lipid high-protein and high-lipid low-protein microalgae via hydrothermal liquefaction[J].Bioresource Technology, 2014, 154: 322-329.
[19] TOOR S S, REDDY H, DENG S G, et al. Hydrothermal liquefaction ofSpirulinaandNannochloropsissalina under subcritical and supercritical water conditions[J].Bioresource Technology, 2013, 131: 413-419.
[20] JAZRAWI C, BILLER P, HE Y Y, et al. Two-stage hydrothermal liquefaction of a high-protein microalga[J].Algal Research-Biomass Biofuels and Bioproducts, 2015, 8: 15-22.
[21] VARDON D R, SHARMA BK, BLAZINA G V, et al. Thermochemical conversion of raw and defatted algal biomass via hydrothermal liquefaction and slow pyrolysis[J].Bioresource Technology, 2012, 109: 178-187.
[22] ZHAO S, GAO B Y, YUE Q Y, et al. Influence ofEnteromorphapolysaccharideson variation of coagulation behavior, flocs properties and membrane fouling in coagulation-ultrafiltration process[J].Journal of Hazardous Materials, 2015, 285: 294-303.
[23] HUANG Y, CHEN Y, XIE J, et al. Bio-oil production from hydrothermal liquefaction of high-protein high-ash microalgae including wildCyanobacteriasp and cultivatedBacillariophytasp[J].Fuel, 2016, 183(1): 9-19.
[24] BROWN T M, DUAN P G,SAVAGE P E. Hydrothermal liquefaction and gasification ofNannochloropsissp[J].Energy & Fuels, 2010, 24: 3639-3646.
[25] DEMIRBAS A. Use of algae as biofuel sources[J].Energy Conversion and Management, 2010, 51(12): 2738-2749.
[26] PETERSON A A, VOGEL F, LACHANCE R P, et al. Thermochemical biofuel production in hydrothermal media: A review of sub- and supercritical water technologies[J].Energy & Environmental Science, 2008, 1(1): 32-65.
[27] GAI C, ZHANG Y H, CHEN W T, et al. An investigation of reaction pathways of hydrothermal liquefaction usingChlorellapyrenoidosaandSpirulinaplatensis[J].Energy Conversion and Management, 2015, 96(15): 330-339.
[28] SATO N, QUITAIN A T, KANG K, et al. Reaction kinetics of amino acid decomposition in high-temperature and high-pressure water[J].Industrial & Engineering Chemistry Research, 2004, 43(13): 3217-3222.
[29] DEMIRBAS A. Mechanisms of liquefaction and pyrolysis reactions of biomass[J].Energy Conversion and Management, 2000, 41(6): 633-646.
[30] CHABGI S, ZHU M H,SAVAGE P E. Hydrothermal reaction kinetics and pathways of phenylalanine alone and in binary mixtures[J].Chemsuschem, 2012, 5(9): 1743-1757.
[31] CHEN Y P, HUANG Y Q, XIE J J, et al. Hydrothermal reaction of phenylalanine as a model compound of algal protein[J].Journal of Fuel Chemistry & Technology, 2014, 42(1): 61-67.
[32] JOOS U, WERMKER K, KRUSE-LOSLER B, et al. Influence of treatment concept, velopharyngoplasty, gender and age on hypernasality in patients with cleft lip, alveolus and palate[J].Journal of Cranio-Maxillofacial Surgery, 2006, 34(8): 472-477.
[33] KRUSE A, KRUOKA A, SCHWARZKOPF V, et al. Influence of proteins on the hydrothermal gasification and liquefaction of biomass 1 Comparison of different feedstocks[J].Industrial & Engineering Chemistry Research, 2005, 44(9): 3013-3020.
[34] DENIEL M, HAARLEMMER G, ROUBAUD A, et al. Energy valorisation of food processing residues and model compounds by hydrothermal liquefaction[J].Renewable & Sustainable Energy Reviews, 2016, 54: 1632-1652.
[35] GUO Y, WANG S Z, HUELSMAN C M, et al. Products, pathways, and kinetics for reactions of indole under supercritical water gasification conditions[J].Journal of Supercritical Fluids, 2013, 73: 161-170.
[36] VALDEZ P J, DICKINSON J G,SAVAGE P E. Characterization of product fractions from hydrothermal liquefaction ofNannochloropsissp and the influence of solvents[J].Energy & Fuels, 2011, 25(7): 3235-3243.
[37] PETERSON A A, LACHANCE R P,TESTER J W. Kinetic evidence of the maillard reaction in hydrothermal biomass processing: Glucose-glycine interactions in high-temperature, high-pressure water[J].Industrial & Engineering Chemistry Research, 2010, 49(5): 2107-2117.
[38] TERI G, LUO L G,SAVAGE P E. Hydrothermal treatment of protein, polysaccharide, and lipids alone and in mixtures[J].Energy & Fuels, 2014, 28(12): 7501-7509.
[39] COSTANZO W, JENA U, HILTEN R, et al. Low temperature hydrothermal pretreatment of algae to reduce nitrogen heteroatoms and generate nutrient recycle streams[J].Algal Research-Biomass Biofuels and Bioproducts, 2015, 12: 377-387.
[40] LUO L G, SHEEHAN J D, DAI L Y, et al. Products and kinetics for isothermal hydrothermal liquefaction of soy protein concentrate[J].ACS Sustainable Chemistry & Engineering, 2016, 4(5): 2725-2733.
[41] LEVINE R B, PINNARAT T,SAVAGE P E. Biodiesel production from wet algal biomass through in situ lipid hydrolysis and supercritical transesterification[J].Energy & Fuels, 2010, 24: 5235-5243.
[42] PRAPAIWATCHARAPAN K, SUNPHORKA S, KUCHNOTHARA P, et al. Single- and two-step hydrothermal liquefaction of microalgae in a semi-continuous reactor: Effect of the operating parameters[J].Bioresource Technology, 2015, 191: 426-432.
[43] SUNPHORKA S, PRAPAIWATCHARAPAN K, HINCHIRANAN N, et al. Biocrude oil production and nutrient recovery from algae by two-step hydrothermal liquefaction using a semi-continuous reactor[J].Korean Journal of Chemical Engineering, 2015, 32(1): 79-87.
[44] BARREIRO D L, SAMORI C, TERRANELLA G, et al. Assessing microalgae biorefinery routes for the production of biofuels via hydrothermal liquefaction[J].Bioresource Technology, 2014, 174: 256-265.
[45] 陈裕鹏, 黄艳琴, 阴秀丽, 等. 藻类生物质水热液化制备生物油的研究进展[J].石油学报(石油加工), 2014, 30(4): 756-763. (CHEN Yunpeng, HUANGYanqin, YIN Xiuli, et al. Research progress of producing bio-oil from hydrothermal liquefaction of algae[J].Acta Petrolei Sinica (Petroleum Processing Section), 2014, 30(4): 756-763.)
[46] KANG K, QUITAIN A T, DAIMON H, et al. Optimization of amino acids production from waste fish entrails by hydrolysis in sub- and supercritical water[J].Canadian Journal of Chemical Engineering, 2001, 79(1): 65-70.
[47] KANG K Y,CHUN B S. Behavior of amino acid production from hydrothermal treatment of fish-derived wastes[J].Korean Journal of Chemical Engineering, 2004, 21(6): 1147-1152.
[48] HARMAN-WARE A E, MORGAN T, WILSON M, et al. Microalgae as a renewable fuel source: Fast pyrolysis ofScenedesmussp.[J].Renewable Energy, 2013, 60: 625-632.
[49] YU G, ZHANG Y H, SCHIDEMAN L, et al. Distributions of carbon and nitrogen in the products from hydrothermal liquefaction of low-lipid microalgae[J].Energy & Environmental Science, 2011, 4(11): 4587-4595.
[50] LONG Y D,FANG Z. Hydrothermal conversion of glycerol to chemicals and hydrogen: Review and perspective[J].Biofuels Bioproducts & Biorefining, 2012, 6(6): 686-702.
[51] TOOR S S, ROSEMDAHL L,RUDOLF A. Hydrothermal liquefaction of biomass: A review of subcritical water technologies[J].Energy, 2011, 36(5): 2328-2342.
[52]FAETH J L, VALDEZ P J, SAVAGE P E. Fast hydrothermal liquefaction ofnannochloropsissp to produce biocrude[J].Energy &Fuels, 2013, 27(3): 1391-1398.
[53] DESHPANDE A, ANITESCU G, RICE P A, et al. Supercritical biodiesel production and power cogeneration: Technical and economic feasibilities[J].Bioresource Technology, 2010, 101(6): 1834-1843.
[54] ZHANG J X, CHEN W T, ZHANG P, et al. Hydrothermal liquefaction ofChlorellapyrenoidosain sub- and supercritical ethanol with heterogeneous catalysts[J].Bioresource Technology, 2013, 133: 389-397.
[55] CHANGI S, PINNARAT T,SAVAGE P E. Mechanistic modeling of hydrolysis and esterification for biofuel processes[J].Industrial & Engineering Chemistry Research, 2011, 50(22): 12471-12478.
[56] CHANGI S, PINNARAT T,SAVAGE P E. Modeling hydrolysis and esterification kinetics for biofuel processes[J].Industrial & Engineering Chemistry Research, 2011, 50(6): 3206-3211.
[57] YANG L, LI Y D,SAVAGE P E. Near- and supercritical ethanol treatment of biocrude from hydrothermal liquefaction of microalgae[J].Bioresource Technology, 2016, 211: 779-782.
[58] 李法社.小桐子生物柴油的超临界两步法制备及其抗氧化耐低温性的研究[D].云南: 昆明理工大学, 2011.
[59] VIRAG D, KISS A, FORGO P, et al. Study on Maillard-reaction driven transformations and increase of antioxidant activity in lysine fortified biscuits[J].Microchemical Journal, 2013, 107: 172-177.
[60] KRUSE A, MANIAM P,SPIELER F. Influence of proteins on the hydrothermal gasification and liquefaction of biomass. 2.Model compounds[J].Industrial & Engineering Chemistry Research, 2007, 46(1): 87-96.
[61] CHAKRABORTY M, MIAO C,MUCONALD A, et al. Concomitant extraction of bio-oil and value added polysaccharides fromChlorellasorokinianausing a unique sequential hydrothermal extraction technology[J].Fuel, 2012, 95(1): 63-70.
[62] 刘慧屏, 银建中, 徐刚. 超/亚临界水两步法水解玉米秸秆制备还原糖[J].化学与生物工程, 2010, 27(11): 47-50. (LIU Huiping, YIN Jianzhong, XU Gang. Production of reduced sugars from corn stalk hydrolysis by two-step method of supercritical/subcritical water process[J].Chemistry & Bioengineering, 2010, 27(11): 47-50.)
[63] SROKOL Z, BOUCHE A G, VAN ESTRIK A, et al. Hydrothermal upgrading of biomass to biofuel; studies on some monosaccharide model compounds[J].Carbohydrate Research, 2004, 339(10): 1717-1726.
[64] MINOWA T, ZHEN F, OGI T. Cellulose decomposition in hot-compressed water with alkali or nickel catalyst[J].Journal of Supercritical Fluids, 1998, 13(1-3): 253-259.
[65] ALBA L G, TORRI C, SAMORI C, et al. Hydrothermal treatment (HIT) of microalgae: Evaluation of the process as conversion method in an algae biorefinery concept[J].Energy & Fuels, 2012, 26(1): 642-657.
ResearchonBio-OilProductionFromHigh-ProteinAlgaeviaTwo-StepHydrothermalLiquefaction
ZHUANG Xiuzheng1,2,3,4, HUANG Yanqin1,2,3, YIN Xiuli1,2,3, WU Chuangzhi1,2,3
(1.GuangzhouInstituteofEnergyConversion,ChineseAcademyofSciences,Guangzhou510640,China; 2.CASKeyLaboratoryofRenewableEnergy,Guangzhou510640,China; 3.GuangdongProvincialKeyLaboratoryofNewandRenewableEnergyResearchandDevelopment,Guangzhou510640,China; 4.UniversityofChineseAcademyofSciences,Beijing100049,China)
2016-09-13
国家自然科学基金项目(51106164)资助
庄修政,男,硕士研究生,研究方向为生物质燃料制备与转化;Tel:020-87057150;E-mail:zhuangxz@ms.giec.ac.cn
黄艳琴,女,副研究员,博士,研究方向为生物质热化学转化利用;Tel:020-87057150;E-mail:huangyq@ms.giec.ac.cn
1001-8719(2017)05-1007-10
TK6
A
10.3969/j.issn.1001-8719.2017.05.025
