雨生红球藻虾青素对小鼠免疫调节的研究
2017-10-16刘颖芬辛乃宏李炳乾张云泽钟贞蔡祥焜乔秋爽郑立新
刘颖芬,辛乃宏,李炳乾,张云泽,钟贞,蔡祥焜,乔秋爽,郑立新,*
(1.中盐工程技术研究院有限公司,天津300450;2.中国检验检疫科学研究院综合检测中心,北京100121)
雨生红球藻虾青素对小鼠免疫调节的研究
刘颖芬1,辛乃宏1,李炳乾1,张云泽1,钟贞2,蔡祥焜2,乔秋爽2,郑立新2,*
(1.中盐工程技术研究院有限公司,天津300450;2.中国检验检疫科学研究院综合检测中心,北京100121)
评价雨生红球藻虾青素对小鼠免疫功能的调节作用。选用雌性ICR小鼠,试验分为4个免疫组,分别进行,每组设置低、中、高剂量及对照组。低、中、高剂量分别为0.083、0.167、0.5 g/kg·BW,对照组喂服植物油,试验周期30 d。结果:在细胞免疫功能、体液免疫功能、单核-巨噬细胞功能3个方面有增强免疫力功能。结果表明:雨生红球藻虾青素有增强小鼠免疫力功能。
雨生红球藻;虾青素;免疫调节
Abstract:To study the effect of astaxanthin on immune regulation in mice.Female ICR mice were selected and divided into 4 groups.Each group was divided into different dose gavage(Low dose=0.083 g/kg·BW,medium dose=0.167 g/kg·BW,high doses=0.5 g/kg·BW,controlgroupwasfedwithvegetableoil),andthetestperiodwas 30d.Conclusionshowedthat:astaxanthinfromHaematococcuspluvialiscouldenhanceimmunefunctionofmice.
Key words:Haematococcus pluvialis;astaxanthin;immune regulation
雨生红球藻(Haematococcus pluvialis),属团藻目,红球藻科。当前,雨生红球藻被公认为自然界中生产天然虾青素的最好生物[1]。虾青素(Astaxanthin)是一种酮基类胡萝卜素,天然虾青素比角黄素、β-胡萝卜素和玉米黄素能更有效地阻止不饱和脂肪酸甲酯的过度氧化[2],被誉为“超级维生素 E”、“超级抗氧化剂”[3]。有研究表明:虾青素具有抗氧化[4]、增强免疫[5-7]、保护视力和中枢神经系统[8-9]、预防心血管疾病[10]、抑制肿瘤[11-13]、拮抗小鼠DNA损伤[14]等功能。随着虾青素消费市场的不断扩展,已有机构围绕其预防与治疗疾病潜在机理开展探索性研究[15-16]。本试验旨在依据我国《保健食品检验与评价技术规范(2003版)》的免疫学相关指标规定,通过雨生红球藻虾青素对雌性ICR小鼠细胞免疫、体液免疫、单核-巨噬细胞以及NK细胞活性指标的影响,探究其增强小鼠免疫力的作用,为今后雨生红球藻虾青素的免疫活性研究提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
雨生红球藻虾青素(虾青素含量为1%):中盐工程技术研究院有限公司。
1.1.2 实验动物
SPF级雌性ICR小鼠,240只,体重18 g~22 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。
1.1.3 试验试剂
YAC-1细胞:中国科学研究院;文齐氏试剂:天津市现代高科技研究院中山研究所;刀豆蛋白A(ConA):美国sigma公司。
1.2 仪器与设备
恒温水浴锅(HH-2型):常州中捷实验仪器制造有限公司;酶标仪(Multiskan MK3型):雷勃公司ThermoLabsystems。
1.3 方法
1.3.1 剂量选择和实验动物分组
本实验分为低、中、高剂量3个剂量,分别为0.083、0.167、0.5 g/kg·BW,阴性对照组灌胃植物油,灌胃量均为10 mL/kg·BW。喂服采用灌胃方法,连续喂服30 d。240只SPF级ICR小鼠,分别进行4组免疫实验:免疫一组60只(每只体重18 g~22 g),随机分为低、中、高剂量及对照组,每组15只,进行迟发型变态反应试验、半数溶血值测定和抗体生成细胞检测;免疫二组60只(每只体重18 g~22 g),随机分为低、中、高剂量及对照组,每组15只,进行碳廓清试验;免疫三组 60 只(每只体重 18 g~22 g),随机分为低、中、高剂量及对照组,每组15只,进行巨噬细胞吞噬鸡红细胞能力试验;免疫四组60只(每只体重18 g~22 g)随机分为低、中、高剂量及对照组,每组15只,进行ConA诱导小鼠淋巴细胞转化试验和NK活性测定试验。
1.3.2 细胞免疫功能测定
1.3.2.1 迟发型变态反应(足跖增厚法,DTH)
取新鲜的脱纤维羊血,生理盐水洗涤3次,每只鼠腹腔注射2%压积SRBC 0.2 mL,致敏后4 d,测量左后足跖部厚度,同一部位测量3次,取平均值。然后在测量部位皮下注射20%SRBC 20 μL,24 h后测量左后足跖部厚度,同一部位测量3次,取平均值,以攻击前后足跖厚度的差值(足跖肿胀度)来表示DTH的程度。
1.3.2.2 ConA诱导的小鼠淋巴细胞转化实验(MTT法)
无菌取脾,制成单细胞悬液,用Hank’s液冲洗,3次后计数,调整细胞浓度致5×106个/mL。将细胞悬液分两孔加入24孔板中,每孔1 mL,其中一孔中加入75 μL ConA液,将孔板置于5%CO2,37℃培养68 h后,每孔轻轻吸取上清液0.7 mL,加入0.7 mL不含小牛血清的RPMI1640 培养液,同时加入 MTT(5 mg/mL)50 μL/孔,继续培养4 h。培养结束后,每孔加入1 mL酸性异丙醇,移入96孔板中,在酶标仪上进行测定,波长为570 nm。淋巴细胞的增殖能力用加ConA孔的光密度值减去不加ConA孔的光密度值表示。
1.3.3 体液免疫功能测定
1.3.3.1 抗体生成细胞检测实验(Jerme改良玻片法)
取新鲜羊血,每只鼠腹腔注射2%(用生理盐水配制)压积SRBC 0.2 mL,致敏后4 d处死小鼠,取全脾,制成细胞悬液,定容在8 mL Hank’s。将琼脂糖加热溶解后,与等量双倍Hank’s液混合,分装小试管,每管0.5 mL,再向管内加10%(用SA缓冲液配制)压积SRBC 50 μL,脾细胞悬液 20 μL,迅速混匀,倾倒至已刷琼脂糖薄层的玻片上;待琼脂凝固后,将玻片放入CO2培养箱中继续孵育1.5 h,然后用SA缓冲液稀释的补体(1∶8)放入玻片架凹槽内,继续孵育1.5 h,计数溶血空斑数。
1.3.3.2 血清溶血素半数溶血值(HC50)的测定
取新鲜羊血,每只鼠腹腔注射2%(用生理盐水配制)压积SRBC 0.2 mL,致敏后4 d,摘除眼球取血于1.5 mL离心管内,放置约1 h后离心,取血清。用SA缓冲液稀释300倍,取0.1 mL置96孔板内,依次加入10%SRBC 0.05 mL,补体0.1 mL(按1∶8用SA缓冲液稀释),置于37℃恒温水浴保温30 min后,冰浴。离心取上清液0.05 mL,加文齐氏试剂0.15 mL,同时取10%,用SA缓冲液配制)压积SRBC 0.012 5 mL,加文齐氏试剂至0.2 mL于至另一96孔板,充分混匀。静置10 min,在540 nm波长下,用酶标仪分别测定各孔光密度值。溶血素的量以半数溶血值(HC50)表示,按以下公式计算:
样品HC50=(样品光密度值/SRBC半数溶血时的光密度值)×稀释倍数
1.3.4 单核-巨噬细胞功能测定
1.3.4.1 小鼠碳廓清试验
小鼠尾静脉注射1∶3用生理盐水稀释的印度墨汁,注入后立即计时。分别2 min和10 min后,从眼内静脉取血20 μL,加到2 mL 0.1%Na2CO3溶液中,用酶标仪在600 nm波长处测定OD值,以Na2CO3溶液作空白对照。小鼠称重,取肝脏、脾脏称重。根据动物体重、肝重和脾重计算吞噬指数,按以下公式计算:

式中:OD1为2 min时测定的吸光度值;OD2为10 min时测定的吸光度值;t1为2 min;t2为10 min。
1.3.4.2 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法)
小鼠腹腔注射5%压积鸡红细胞悬液1 mL。2.5 h后,颈椎脱臼处死动物,腹腔注射生理盐水2 mL。取腹腔洗液1 mL,平均分滴于2片载玻片上,放入垫有湿纱布的搪瓷盒内,37℃孵箱孵育30 min。孵毕,生理盐水漂洗,晾干。以1∶1丙酮甲醇溶液固定(1∶1配制,体积比),4%Giemsa-磷酸盐冲液染色3 min,蒸馏水漂洗晾干。油镜下计数,每张片计数100个,按以下公式计算吞噬百分率和吞噬指数。
吞噬率/%=吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞数×100
吞噬指数=被吞噬的鸡红细胞总数/计数的巨噬细胞数
1.3.5 NK细胞活性测定(乳酸脱氢酶LDH测定法)
实验前24 h将靶细胞YAC-1进行传代培养,Hank’s洗3次,用含胎牛血清的RPMI1640培养液调整细胞浓度致4×105个/mL。小鼠颈椎脱臼处死,无菌取脾,制成脾细胞悬液,Hank’s液冲洗3次,离心,再用2 mL含小牛血清的RPMI1640培养基重悬,计数调整细胞浓度致2×107个/mL。取靶细胞和效应细胞各100 μL,加入U型96孔培养板中,靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和1%NP40各100 μL,上述均设3个平行孔,37℃,5%CO2培养4 h,96孔培养板离心,每孔吸取上清100 μL置平底96孔培养板,加入LDH基质液100 μL,避光反应10 min,然后每孔加入1 mol/L的HCL溶液30 μL终止反应,在酶标仪492 nm处测OD值。NK活性按下式计算:
NK活性/%=(反应孔OD-自然释放孔OD)/(最大释放孔OD-自然释放孔OD)×100
2 结果与分析
2.1 雨生红球藻虾青素对小鼠细胞免疫功能的影响
雨生红球藻虾青素对小鼠细胞免疫功能的影响见表1、表2。
表1 雨生红球藻虾青素对小鼠迟发型变态反应(DTH)的影响(±SD)Table 1 The effect of astaxanthinon delayed type hypersensitivity in mice(±SD)
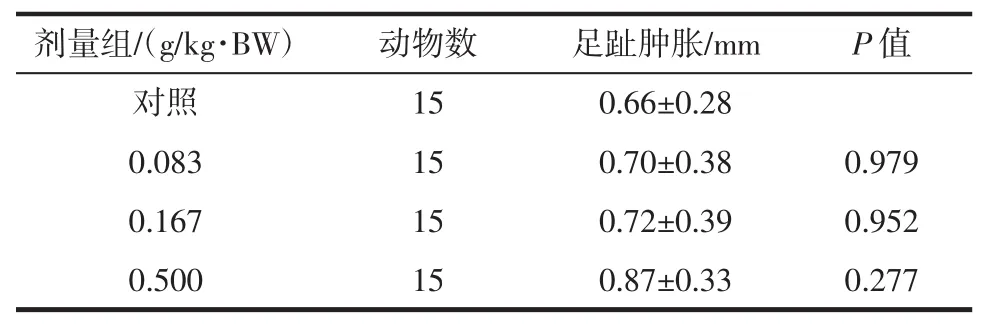
表1 雨生红球藻虾青素对小鼠迟发型变态反应(DTH)的影响(±SD)Table 1 The effect of astaxanthinon delayed type hypersensitivity in mice(±SD)
剂量组/(g/kg·BW)动物数足趾肿胀/mmP值对照 15 0.66±0.28 0.083 15 0.70±0.38 0.979 0.167 15 0.72±0.39 0.952 0.500 15 0.87±0.33 0.277
表2 雨生红球藻虾青素对ConA诱导的小鼠淋巴细胞转化实验的影响(±SD)Table 2 The effect of astaxanthinon lymphocyte transforming which inducing by the ConA in mice(±SD)

表2 雨生红球藻虾青素对ConA诱导的小鼠淋巴细胞转化实验的影响(±SD)Table 2 The effect of astaxanthinon lymphocyte transforming which inducing by the ConA in mice(±SD)
注:与对照组比较,*P<0.05,**P<0.01。
剂量组/(g/kg·BW)动物数淋巴细胞增殖能力(OD差值) P值对照 15 0.078±0.068 0.083 15 0.160±0.087* 0.044 0.167 15 0.180±0.131* 0.037 0.500 15 0.210±0.138** 0.009
由表1可见,经口给予小鼠不同剂量的雨生红球藻虾青素30 d,经统计学分析,足趾肿胀度在各剂量组与对照组比较无显著性差异(P>0.05)。由表2可见,经口给予小鼠不同剂量的雨生红球藻虾青素30 d,经统计学分析,其淋巴细胞增殖能力在低、中、高剂量组与对照组比较有显著性差异(低、中剂量P<0.05,高剂量P<0.01),判定细胞免疫功能阳性。
2.2 雨生红球藻虾青素对体液免疫的影响
雨生红球藻虾青素对体液免疫的影响见表3、表4。
表3 雨生红球藻虾青素对抗体生成细胞数的影响(±SD)Table 3 The effect of astaxanthinon on antibody forming cells(±SD)

表3 雨生红球藻虾青素对抗体生成细胞数的影响(±SD)Table 3 The effect of astaxanthinon on antibody forming cells(±SD)
剂量组/(g/kg·BW)动物数溶血空斑数(×103全脾) P值对照 15 101.33±30.34 0.083 15 119.93±26.68 0.244 0.167 15 127.80±35.54 0.058 0.500 15 128.27±30.24 0.053
表4 雨生红球藻虾青素对小鼠半数溶血值(HC50)的影响(±SD)Table 4 The effect of astaxanthinon HC50in mice(±SD)
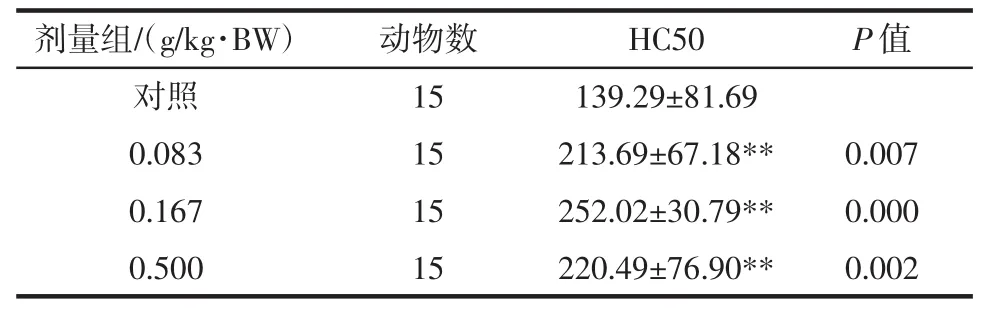
表4 雨生红球藻虾青素对小鼠半数溶血值(HC50)的影响(±SD)Table 4 The effect of astaxanthinon HC50in mice(±SD)
注:与对照组比较,**P<0.01。
剂量组/(g/kg·BW)动物数HC50P值对照 15 139.29±81.69 0.083 15 213.69±67.18** 0.007 0.167 15 252.02±30.79** 0.000 0.500 15 220.49±76.90** 0.002
由表3可见,经口给予小鼠不同剂量的雨生红球藻虾青素30 d,经统计学分析,其抗体生成细胞数在各剂量组与对照组间比较无显著性差异(P>0.05)。由表4可见,经口给予小鼠不同剂量的雨生红球藻虾青素30 d,经统计学分析,其半数溶血值(HC50)在低、中、高剂量组与对照组间比较有显著性差异(P<0.01),判定体液免疫功能阳性。
2.3 雨生红球藻虾青素对小鼠单核-巨噬细胞吞噬功能的影响
雨生红球藻虾青素对小鼠单核-巨噬细胞吞噬功能的影响见表5、表6。
由表5可见,经口给予小鼠不同剂量的雨生红球藻虾青素30 d,经统计学分析,其碳廓清功能在各剂量与对照组间比较无显著性差异(P>0.05)。由表6可见,经口给予小鼠不同剂量的雨生红球藻虾青素30 d,经统计学分析,其吞噬率在高剂量组与对照组间比较有显著性差异(P<0.01),吞噬指数在中、高剂量组与对照组间比较有显著性差异(P<0.01),判定单核-巨噬细胞吞噬功能阳性。
表5 雨生红球藻虾青素对小鼠单核-巨噬细胞碳廓清能力的影响(±SD)Table 5 The effect of astaxanthin on carbon clearance ability of mice mononuclear macrophage(±SD)

表5 雨生红球藻虾青素对小鼠单核-巨噬细胞碳廓清能力的影响(±SD)Table 5 The effect of astaxanthin on carbon clearance ability of mice mononuclear macrophage(±SD)
剂量组/(g/kg·BW)动物数吞噬指数aP值对照 15 6.33±0.98 0.083 15 7.25±1.43 0.063 0.167 15 7.06±0.81 0.177 0.500 15 6.86±1.06 0.418
表6 雨生红球藻虾青素对小鼠巨噬细胞吞噬鸡红细胞能力的影响(±SD)Table 6 The effect of astaxanthin on phagocytosis of chicken red blood cells and macrophages in mice(±SD)
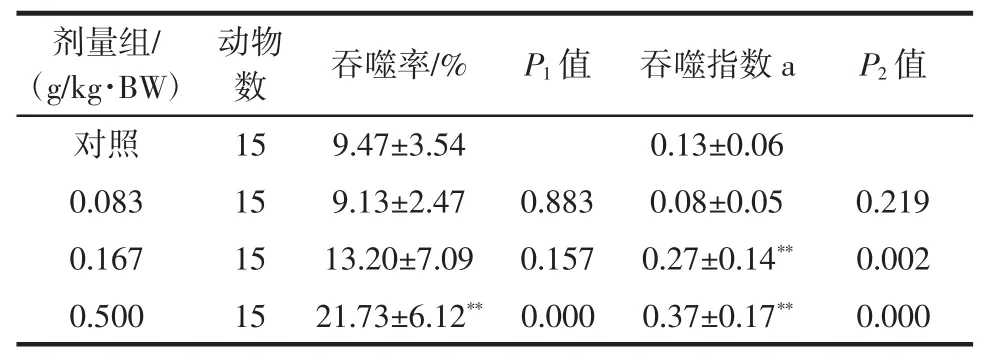
表6 雨生红球藻虾青素对小鼠巨噬细胞吞噬鸡红细胞能力的影响(±SD)Table 6 The effect of astaxanthin on phagocytosis of chicken red blood cells and macrophages in mice(±SD)
注:与对照组比较,**P<0.01。
剂量组/(g/kg·BW)动物数 吞噬率/% P1值 吞噬指数a P2值对照 15 9.47±3.54 0.13±0.06 0.083 15 9.13±2.47 0.883 0.08±0.05 0.219 0.167 15 13.20±7.09 0.157 0.27±0.14** 0.002 0.500 15 21.73±6.12** 0.000 0.37±0.17** 0.000
2.4 雨生红球藻虾青素对小鼠NK细胞活性的影响
雨生红球藻虾青素对小鼠NK细胞活性的影响见表7。
表7 雨生红球藻虾青素对小鼠NK细胞活性的影响(±SD)Table 7 The effect of astaxanthin on NK cell activity in mice(±SD)

表7 雨生红球藻虾青素对小鼠NK细胞活性的影响(±SD)Table 7 The effect of astaxanthin on NK cell activity in mice(±SD)
注:与对照组比较,**P<0.01。
剂量组/(g/kg·BW)动物数NK细胞活性/%P值对照 15 56.70±9.93 0.083 15 52.96±5.99 0.604 0.167 15 67.43±16.58 0.078 0.500 15 71.83±9.24** 0.001
由表7可见,经口给予小鼠不同剂量的雨生红球藻虾青素30 d,经统计学分析,NK细胞活性在高剂量组与对照组间比较有显著性差异(P<0.01)。
3 讨论
雨生红球藻(Haematococcus pluvialis)是卫生部2010年第17号公布的新食品原料,其富含的天然虾青素具有抗氧化和增强免疫力的作用。国外已利用该功能将虾青素作为药物预防氧化性组织损伤和配制保健食品[17]。近年来虾青素的免疫功能正引起学者的广泛关注,国内对虾青素的需求量也越来越大,其被广泛开发应用于食品、医药、化妆品及饲料等的生产[18]。
依据《保健食品检验与评价技术规范》[19](2003年版),在细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK细胞活性4项中任2项呈阳性,则可判定受试样品具有增强免疫力功能作用;认为雨生红球藻虾青素有增强免疫力功能。实验结果显示:淋巴细胞增殖能力在3个剂量组与对照组比较均有显著性差异(低、中剂量 P<0.05,高剂量 P<0.01),判定细胞免疫功能阳性;半数溶血值(HC50)在3个剂量组与对照组间比较均有显著性差异(P<0.01),判定体液免疫功能阳性;小鼠巨噬细胞吞噬鸡红细胞能力其吞噬率在高剂量组与对照组间比较有显著性差异(P<0.01),吞噬指数在中、高剂量组与对照组间比较有显著性差异(P<0.01),判定单核-巨噬细胞吞噬功能阳性;NK细胞活性在高剂量组与对照组间比较有显著性差异(P<0.01)。因此可认定雨生红球藻虾青素对小鼠的免疫功能有显著的提高作用。
目前对于雨生红球藻虾青素的研究大多集中在其增强免疫力和抗氧化的作用上,通过本研究进一步证明了雨生红球藻虾青素增强免疫力的功效,且研究效果与前人得出一致的结论,为下一步进行增强免疫力的机理研究提供了参考。
[1]高桂玲,成家杨,马炯,等.雨生红球藻和虾青素的研究[J].水产学报,2014,38(2):297-304
[2]Jorgensen K,Skibsted L.Carotenoid scavenging radicals.Effect of carotenoid structure and oxygen partialpressure on antioxidativeactivity[J].Z LebensmUntersForsch,1993,196:423
[3]Shimidzu N,Goto M,Miki W.Carotenoids as sin-glet oxygen quenchers in marine organisms[J].Fisheries Science,1996,62(1):134
[4]曹秀明,祁小倩,王珊珊,等.虾青素对活性氧所致海马神经细胞氧化损伤的保护作用[J].中国海洋药物杂志,2012,31(6):45-49
[5]Tso M,Lam T T.Method of retarding and amelioration central nervous system and eye damage.5527533[P].1996-06-18
[6]陈立武,曾维铨.虾青素抗肝肿瘤生长的实验研究[J].中国医药导报,2012,9(4):21-23
[7]裴凌鹏.虾青素体内抗肿瘤及其免疫调节作用的实验研究[J].上海中医药杂志,2009,43(6):68-69
[8]Murillo E.Hypercholesterolemic effect of canthaxanthin and astaxanthin in rats[J].ArchivosLatinoamericanos de Nutricion,1992,42(4):409-413
[9]石焕琦,张晓梅.虾青素在眼科疾病及全身疾病的应用进展[J].现代中西医结合杂志,2013,22(9):1017-1019
[10]Guerin M,Huntley M E,OlaizolaM.Haematococcusastaxanthin:applications for human health and nutrition[J].Trends Biotechnol,2003,21(5):210-216
[11]Snodderly DM.Evidence for portection against age-related macular degeneration by carotenoids and an-tioxidantvitamins[J].Amer J Clinical Nutr,1995,62(S):1448S
[12]海璇隽,凌雪萍,卢英华,等.虾青素对正常小鼠与衰老模型大鼠免疫指标的影响[J].厦门大学学报,2013,52(5):703-709
[13]项荣,丁栋博,李杰,等,虾青素抑癌作用机制研究进展[J].天然产物研究与开发,2013(25):1011-1015
[14]闫建国,周亚莉,邢雪琨,等.虾青素对辛硫磷所致小鼠DNA损伤的拮抗作用[J].环境与健康杂志,2013,30(2):132-134
[15]宋立人,王锦鸿,阿不都热依木.卡地尔,等.中华本草:维吾尔药卷[M].上海:上海科学技术出版社,2005:145-150
[16]王远志.虾青素对人癌细胞体外增殖影响的比较研究[J].辽宁中医杂志,2008,15(6):51-53
[17]张样娥.基于代谢分析的虾青素发酵条件优化[D].武汉:华中科技大学,2008:8-9
[18]王菊芳,吴振强,梁世中,等.虾青素的生理功能及其应用[J].食品与发酵工业,1999,26(2):66-69
[19]中华人民共和国卫生部.保健食品检验与评价技术规范[M].北京:中华人民共和国卫生部,2003
Study of Astaxanthin from Haematococcus pluvialis on Immune Regulation Function in Mice
LIU Ying-fen1,XIN Nai-hong1,LI Bing-qian1,ZHANG Yun-ze1,ZHONG Zhen2,CAI Xiang-kun2,QIAO Qiu-shuang2,ZHENG Li-xin2,*
(1.Salt Research Institute,CNSIC,Tianjin 300450,China;2.Chinese Academy of Inspection and Quarantine,Beijing 100121,China)
2017-03-03
10.3969/j.issn.1005-6521.2017.20.038
刘颖芬(1983—),女(汉),工程师,硕士,研究方向:海洋生物及食品营养。
*通信作者:郑立新(1980—),女,工程师,硕士,研究方向:保健食品功能。
