乙酰化辣木多糖的制备及其抗氧化活性研究
2017-10-16,,,
,,,
(连云港师范高等专科学校生命科学系,江苏连云港 222006)
乙酰化辣木多糖的制备及其抗氧化活性研究
马波,朱建国,邵世光,王薇
(连云港师范高等专科学校生命科学系,江苏连云港222006)
以辣木为原料,采用水提醇沉法制备辣木多糖。利用乙酸酐为乙酰化试剂,对辣木多糖进行乙酰化修饰。通过单因素实验和正交实验,确定了辣木多糖乙酰化修饰的最佳工艺条件。在此基础上,对乙酰化辣木多糖进行抗氧化性实验。结果表明,制备乙酰化辣木多糖的最优实验条件为反应时间6 h,反应温度60 ℃,乙酸酐用量5 mL。抗氧化活性研究结果显示,辣木多糖乙酰化改性后清除羟自由基和超氧阴离子自由基的能力显著增加。表明乙酰化修饰可显著提高辣木多糖的抗氧化性。
辣木,多糖,乙酰化,抗氧化
Abstract:TakingMoringaoleiferaas the material,the polysaccharides were obtained by water extraction and alcohol precipitation. The acetylatedMoringaoleiferapolysaccharide derivatives were prepared by using acetic anhydride as acetylating agent. The technical conditions of acetylated modification were optimized with single factor experiment and orthogonal experiments,and the antioxidant activity was studied at the same time. The results indicated that the preparation optimal acetylated conditions forMoringaoleiferapolysaccharides were as follows:reaction time 6 h,reaction temperature 60 ℃,acetylating reagent dosage 5 mL. The oxidation resistance research showed that the ability of removal hydroxyl free radicals and remove super oxide anion free radical ability were significantly enhanced. Acetylation could significantly improve the antioxidant activities ofMoringaoleifera.
Keywords:Moringaoleifera;polysaccharide;acetylated;antioxidant
辣木(Moringaoleifera)又称鼓槌树,是辣木科(Moringaceae)辣木属(Moringa)热带落叶乔木。辣木含有丰富的氨基酸、维生素、矿物质等营养成分,具有抗氧化、降血压、血糖和胆固醇、消炎抑菌作用,已被欧美国家视为新兴的健康食品[1]。辣木多糖是辣木中重要的有效成分之一,有明显抗氧化等生物活性等[2]。目前对于辣木多糖的研究主要局限于粗提物上[3-4],而对其进行衍生化方面的研究尚未见报道。
利用化学的方法对多糖的分子结构进行修饰,可能会使其具有一些新的理化性质或生物活性[5-6]。多糖的乙酰化是一种重要的多糖结构修饰方法。杨春瑜等对黑木耳多糖进行乙酰化修饰后,其抗氧化活性增加[7]。李淑琴等研究发现,乙酰化乌龙茶多糖溶解性增强,多糖活性明显升高[8]。刘莹等研究表明,金针菇多糖经乙酰化修饰后具有较强的抗氧化活性[9]。本文对辣木多糖进行乙酰化修饰,并对其体外抗氧化活性进行比较,为拓宽辣木的应用范围提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
辣木叶 产于云南保山,购于云南满泽生物科技有限公司;硫酸亚铁、邻苯三酚、乙醇、TCA(三氯乙酸)、甲酰胺、乙酸酐(含1%NBS)、水杨酸、过氧化氢、盐酸等 均为国产分析纯。
CPA225D分析天平 赛多利斯科学仪器北京有限公司;岛津UV2550分光光度计 日本岛津;30B型万能粉碎机 无锡市中银机械制造有限公司;LD5-10台式离心机 北京医用离心机厂;ALPHA1-4型真空冷冻干燥机 德国CHRIST公司;VERTEX 70红外光谱仪 德国BRUKER。
1.2 实验方法
1.2.1 辣木多糖的提取及纯化 将辣木叶在70 ℃下干燥、粉碎后过60目筛,加20倍蒸馏水(w/w)于80 ℃水浴上提取2次,1.5 h/次,合并提取液。采用真空浓缩,浓缩至原体积的1/5,采用TCA法除蛋白后醇沉过夜,离心取沉淀干燥后研磨成粉末备用[10]。
1.2.2 辣木多糖的乙酰化 称取0.2 g多糖溶解于8 mL甲酰胺中,加入一定量的乙酸酐(含1% NBS),恒温搅拌反应。结束后用95%的乙醇沉淀,将沉淀溶于100~200 mL的蒸馏水中,透析8 h,95%乙醇沉淀过夜,离心取沉淀干燥即得乙酰化辣木多糖成品[7]。
1.2.3 抗氧化活性研究
1.2.3.1 羟基自由基(·OH)的清除率测定 取干净的10 mL纳氏比色管,依次向其中加入1 mL样品液(对照以蒸馏水代替样品液),1 mL的6 mmoL/L FeSO4,1 mL的6 mmoL/L水杨酸,最后加入1 mL的6 mmoL/L H2O2启动反应,摇匀置于37 ℃水浴下反应1 h。在波长510 nm处测定吸光度。对照组吸光度值记为A0,样品吸光度值记为AX。
羟基自由基的清除率(%)=[(A0-Ax)/A0]×100[11]
式中,A0:空白对照组的吸光度值;Ax:样品溶液的吸光度值。
式中,A0:空白对照组的吸光度值;Ax:样品溶液的吸光度值。
1.2.4 总糖及乙酰基含量的测定 以D-葡萄糖为标准品,采用苯酚-硫酸法测定总糖含量[12];采用酸碱滴定法测定乙酰基含量[13],将20 g乙酰化辣木多糖加入到10 mL 0.01 mol/L NaOH溶液中,50 ℃加热2 h。以酚酞作为指示剂,用0.01 mol/L HCl溶液滴定至红色消失。
乙酰基含量(%)=(V0C0- V1C1)×0.043×100/m
式中,V0:消耗NaOH溶液体积;C0:消耗的NaOH溶液浓度;V1:消耗的盐酸溶液体积;C1:消耗的盐酸溶液浓度;m:样品质量。
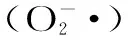
1.2.5.1 乙酸酐用量对辣木多糖乙酰化的抗氧化活性影响 将0.2 g辣木多糖溶于8 mL甲酰胺中,分别加入1.5、3、5、7 mL的乙酸酐(含1% NBS),在60 ℃下分别反应2 h。反应结束后,分别测定不同浓度乙酰化辣木多糖的抗氧化活性。
1.2.5.2 反应温度对辣木多糖乙酰化的抗氧化活性影响 将0.2 g辣木多糖溶于8 mL甲酰胺中,加入5 mL乙酸酐(含1% NBS),在40、60、80、100 ℃下,分别反应2 h。反应结束后,分别测定不同浓度乙酰化辣木多糖的抗氧化活性。
1.2.5.3 反应时间对辣木多糖乙酰化的抗氧化活性影响 将0.2 g辣木多糖溶于8 mL甲酰胺中,加入5 mL乙酸酐(含1% NBS),在60 ℃下分别反应2、4、6、8 h。反应结束后,分别测定不同浓度乙酰化辣木多糖的抗氧化活性。
1.2.6 辣木多糖乙酰化工艺正交优化实验 根据单因素实验结果,以时间(A)、温度(B)、乙酸酐用量(C)为自变量,以羟自由基清除率为指标,进行正交实验,同时测定实验中每个样品的总糖含量和乙酰基含量。因素水平表见表1。
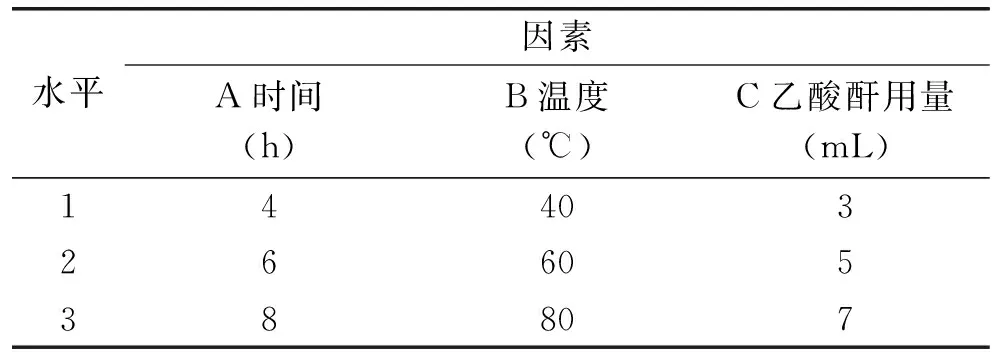
表1 因素水平表Table 1 The factors and levels table
1.2.7 红外光谱检测 利用正交实验得到的最优实验方案,制备乙酰化辣木多糖。取10 mg左右的辣木多糖、乙酰化辣木多糖,用KBr研磨压片后,在4000~500 cm-1范围内进行扫描。
1.3 数据处理
采用SPSS数据处理软件,对结果进行分析。
2 结果与分析
2.1 辣木多糖乙酰化工艺单因素实验
2.1.1 乙酸酐试剂用量对乙酰化辣木多糖的抗氧化性的影响 如图1(A、B)所示,乙酰化辣木多糖对羟自由基和超氧阴离子自由基的清除能力均明显高于辣木多糖。多糖的结构影响多糖的生物学活性[14],辣木多糖经乙酰化修饰后,可能其空间构象发生变化,使其更易于提供羟基,从而有利于捕捉自由基,提高抗氧化活性[15]。随乙酸酐用量的增加,乙酰化辣木多糖对羟基自由基和超氧阴离子自由基的清除率逐渐升高,当乙酸酐试剂用量增加到5 mL时,升高趋势趋于平缓。

图1 乙酰化试剂用量对辣木多糖乙酰化的影响Fig.1 Effect of acetylated reagent addition on the polysaccharide acetylated of Moringa oleifera

图2 反应温度对辣木多糖乙酰化的影响Fig.2 Effect of reaction temperature on the polysaccharide acetylated of Moringa oleifera
2.1.2 反应温度对乙酰化辣木多糖的抗氧化性的影响 如图2(A、B)所示,随着反应温度的升高,多糖的抗氧化活性先增加后减弱,当温度为60 ℃时,对羟自由基和超氧阴离子自由基的清除率都达到最高。在较高的温度条件下,多糖的活性可能受到破坏[16],导致羟自由基和超氧阴离子自由基的清除率降低。
2.1.3 反应时间对乙酰化辣木多糖的抗氧化性的影响 如图3(A、B)所示,当反应时间在2~6 h,乙酰化辣木多糖对羟自由基清除率和超氧阴离子自由基的清除率均逐步增大,6 h时达到最大。随着时间的进一步延长,抗氧化性开始下降,原因可能是反应时间过长导致多糖的结构改变,产生其他的副产物,引起抗氧化活性的下降[17]。

图3 反应时间对辣木多糖乙酰化的影响Fig.3 Effect of reaction time on the polysaccharide acetylated of Moringa oleifera
由图1~图3均可见,辣木多糖与乙酰化辣木多糖对羟自由基和超氧阴离子自由基清除率均随着质量浓度的增加而增加,呈一定的剂量关系。同时羟自由基和超氧阴离子自由基的清除率随反应因素变化趋势是一致的。因此在后续的实验中,以羟自由基的清除率为指标来探索最适反应条件
2.2 辣木多糖乙酰化合成工艺条件优化
按照表1进行正交实验,实验结果见表2。

表2 正交实验结果Table 2 Orthogonal experiment results
由极差分析结果可以看出,各因素作用主次顺序排序如下:C>B>A,即乙酸酐用量影响最大,其次依次是温度和时间。由K值可知最佳组合为A2B2C2,即乙酸酐5 mL,温度为60 ℃时,时间6 h。此条件下羟自由基清除率最高,达99.7%,超氧阴离子自由基的清除率87.4%,略低于同浓度下VC的清除能力(99.8%)。

表3 不同实验组样品中总糖含量和乙酰基含量(%)Table 3 The contents of total sugar and acetyl group of different test samples(%)
表3是上述不同实验组样品中总糖和乙酰基含量。由表3可知,随着乙酰基含量的增大,羟自由基清除率上升。实验结果说明在实验范围内乙酰基含量与抗氧化正相关。乙酰基的取代位置、空间构象等均影响生物活性[18],目前其构效关系和作用规律尚不清楚,仍有待深入探讨。
2.3 辣木多糖与乙酰化辣木多糖的红外光谱分析结果
如图4所示,与辣木多糖的IR谱图相比,乙酰化的辣木多糖在1723 cm-1出现了C=O的双键伸缩振动峰,1260 cm-1处有酯基C-O的伸缩振动,这表明样品的乙酰化是成功的[19]。
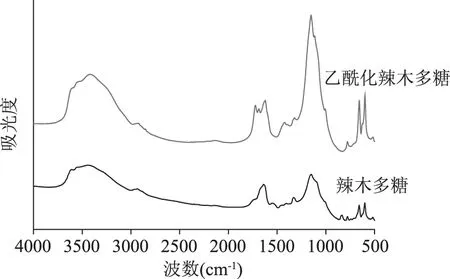
图4 辣木多糖和乙酰化辣木多糖的红外谱图Fig.4 IR spectrum of Moringa oleifera polysaccharide and acetylated Moringa oleifera polysaccharide
3 结论
采用乙酸酐对辣木多糖进行乙酰化修饰,并使用正交实验得到了最适的反应条件,即反应时间6 h,反应温度60 ℃,乙酸酐用量5 mL。经过乙酰化修饰后的辣木多糖对羟自由基(99.7%)和超氧阴离子自由基(87.4%)清除能力均显著提高,本研究表明乙酰化修饰适用于辣木多糖的结构改性,为其构效关系研究提供新的思路。
[1]高秋玉,邓小宽,刘丽琼,等. 辣木叶抗氧化活性研究及活性成分含量测定[J]. 食品工业科技,2016,37(23):324-327.
[2]梁鹏,甄润英. 辣木茎叶中水溶性多糖的提取及抗氧化活性的研究[J]. 食品研究与开发,2013,34(14):26-29.
[3]Brahma N Singh,B R Singh,R L Singh,et al. Oxidative DNA damage protective activity,antioxidant and anti-quorum sensing potentials ofMoringaoleifera[J]. Food and Chemical Toxicology,2009,47(6):1109-1116.
[4]B Moyo,S Oyedemi,P J Masika,et al. Polyphenolic content and antioxidant properties ofMoringaoleiferaleaf extracts and enzymatic activity of liver from goats supplemented withMoringaoleiferaleaves/sunflower seed cake[J]. Meat Science,2012,91(4):441-447.
[5]Qi HM,Zhang QB,Zhao TT,et al.Invitroantioxidant activity of acetylated and benzoylated derivatives of polysaccharide extracted from ulva pertusa(Chlorophyta)[J]. Bio Med Chem Lett,2006,16(9):2441-2445.
[6]Qi HM,Zhao TT,Zhang QB,et al. Antioxidant activity of different molecular weight sulfated polysaccharides from ulva pertusa kjellm[J]. J App Phy,2005,17(6):527-534.
[7]杨春瑜,杨春莉,刘海玲,等. 乙酰化黑木耳多糖的制备及其抗氧化活性研究[J]. 食品工业科技,2015,36(23):105-115.
[8]李淑琴,陈海霞,曲志爽. 乌龙茶多糖的化学修饰及其理化性质和活性研究[J]. 食品安全质量检测学报,2015,6(5):1764-1769.
[9]刘莹,赵杰,许琳. 乙酰化修饰金针菇多糖衍生物的抗氧化性研究[J]. 食品与发酵工业,2014,40(7):88-91.
[10]陈瑞娇,彭珊珊,王玉珍,等. 辣木叶中多糖含量的测定[J].时珍国医国药,2007,18(7):1700-1701.
[11]徐斌,宋春梅,杜娟,等. 天荞总黄酮的体外抗氧化活性研究[J]. 中国兽医杂志,2015,51(10):53-56.
[12]赵莹,刘飞,于之伦. 苯酚-硫酸法测定柳芽中多糖含量的研究[J]. 中国西部科技,2014(12):64-65.
[13]黄丹菲,聂少平,江乐明,等. 乙酰化大粒车前子多糖的制备及其活性研究[J]. 食品科学,2013,34(22):1-4.
[14]Frazier C E,Wendler S L,Glasser W. Long chain branched celluloses by mild trans-glycosidation[J]. Carbohydrate Polymers,1996,31(1-2):11-18.

[16]刘玉凤,贾淑颖,刘飞飞,等. 不同取代度的硫酸化肠浒苔多糖抗氧化活性研究[J]. 食品工业科技,2016,37(19):142-152.
[17]李馥邑,王文侠,徐伟丽. 玉米皮多糖硫酸酯化工艺优化及抗氧化活性研究[J]. 中国粮油学报,2014,29(11):104-107.
[18]潘欣欣,江曙,朱悦,等. 黄蜀葵茎叶多糖的乙酰化修饰及其免疫调节活性研究[J]. 南京中医药大学学报,2017,33(2):167-172.
[19]Young-Choon Kim,Tae-Wuk Bae,Hyuk-Ju Kwon,et al. Infrared(IR)image synthesis method of IR real background and Modeled IR target[J]. Infrared Physics and Technology,2014,63(11):54-61.
PreparationandantioxidantactivityofacetylatedpolysaccharidefromMoringaoleifera
MABo,ZHUJian-guo,SHAOShi-guang,WANGWei
(Department of Life Sciences of Lianyungang Teacher’s College,Lianyungang 222006,China)
TS201.2
B
1002-0306(2017)18-0207-04
2017-02-23
马波(1975-),男,硕士,讲师,研究方向:植物多糖的研究与开发,E-mail:mabo7512@163.com。
10.13386/j.issn1002-0306.2017.18.039
