新疆南疆地区链格孢的分离鉴定及抗链格孢乳酸菌的筛选
2017-10-16,,,
,, ,
(塔里木大学生命科学学院,南疆特色农产品深加工兵团重点实验室,新疆阿拉尔 843300)
新疆南疆地区链格孢的分离鉴定及抗链格孢乳酸菌的筛选
李明杨,谢婷婷,李建,张锐利*
(塔里木大学生命科学学院,南疆特色农产品深加工兵团重点实验室,新疆阿拉尔843300)
链格孢是引起果实黑斑病的主要致病菌之一,严重危害果实的采后贮藏过程。从新疆南疆某果园患病果实分离链格孢,结合形态学特征和分子生物学方法对其进行鉴定,同时从分离自新疆特色乳制品的110株乳酸菌(Lactic acid bacteria,LAB)中筛选具有抑制链格孢活性的乳酸菌,并采用固态菌饼、静态发酵及摇床发酵3种方式探索最佳的发酵方式。结果表明共分离获得2株链格孢,经鉴定分别为梨黑斑链格孢(Alternariagaisen)和细极链格孢(Alternariatenuissima);筛选获得4株对相应链格孢具有抑制活性的乳酸菌,其中3株为戊糖乳杆菌(Lactobacilluspentosus),1株为副干酪乳杆菌(Lactobacillusparacasei),同时发现摇床发酵方式所产生的代谢产物抑制链格孢活性相对最强,抑菌圈直径最大可达21.17 mm。这为将乳源乳酸菌用于水果采后防治链格孢引起的黑斑病提供了理论依据。
黑斑病,链格孢,乳酸菌,抑制,发酵方式
Abstract:Alternariais one of the main pathogenic bacteria of fruit black spot and severely impairs the postharvest storage process of fruit.Alternariawas isolated from the pear and apple of a orchard in south Xinjiang and identified by morphological characteristics and molecular biological methods. 110 strains of lactic acid bacteria(LAB)from Xinjiang dairy products were performed to detect the inhibitory activity onAlternariaand solid cake,stationary and shaker broth were used for fermentation. The results showed that 2 strains ofAlternarianamedAlternariagaisenandAlternariatenuissimawere obtained. 4 strains of LAB with inhibitory activity onAlternariawere screened out and 3 of them wereLactobacilluspentosus,the other one namedLactobacillusparacasei. At the same time,the highest inhibitory activity onAlternariawas from shaker fermentation broth and the diameter of the zone of inhibition was up to 21.17 mm. It provided a theoretical basis to apply LAB from dairy products to control the black spot disease caused byAlternariain the postharvest.
Keywords:black spot disease;Alternaria;lactic acid bacteria;inhibition;fermentation methods
黑斑病是梨、苹果、红枣、杏、柑橘等水果的一类重要病害,该病害主要由链格孢(Alternariaalternata)的侵染引起[1]。链格孢引起的黑斑病可导致叶斑和果实组织腐烂,对梨、苹果、红枣、芒果等果实贮藏危害较大[2],被侵染水果果实的表皮会形成黑色斑块,凹陷,最终导致果实腐烂,对贮藏、运输和销售造成影响,严重影响水果的食用价值和商品价值,引起巨大经济损失[3]。
目前主要采用化学农药对该病原菌进行防治,但是随着人们生活水平的逐步提高,对农药残留危害人类健康认识的逐步深入,迫切需要非化学的、无公害的杀菌剂来防治果蔬的采后病害。同时由于病原菌耐药性的增强,使生物法防治果蔬采后病害得到越来越多的关注[4]。生物防治作为一种效果明显、安全无毒且成本低廉的防治病害新途径被人们接受和重视,并成为国内外学者的研究热点。

表1 引物序列及其扩增ITS区域的相应位点[15]Table 1 Primer sequences and sites for ITS amplification region[15]

表2 PCR反应扩增体系(50 μL)Table 2 PCR reaction amplification system(50 μL)
赵超等[5]从芒果叶片及果实上分离采后主要病原菌及其拮抗菌,发现菌株A1菌液对芒果炭疽病和蒂腐病的平均防效达到77.12%;耿海峰等[6]从土壤中分离获得11株对冬枣细交链格孢病菌、多隔镰孢霉和美澳核果褐腐串珠霉具有较好抑制作用的拮抗菌,抑菌效果最显著的B26的抑制率高达78.8%。乳酸菌(Lactic acid bacteria,LAB)是一类产乳酸细菌的统称,是被国际公认为安全且被欧盟食品安全局所推荐的益生菌[7]。乳酸菌能够产生多种代谢产物并广泛应用于抑制病原性真菌相关研究[8]。但是对于将乳源乳酸菌应用于抑制黑斑病病原菌链格孢的相关研究鲜有报道。
本研究从新疆南疆地区阿拉尔市某果园中的黑斑病香梨及苹果中分离链格孢,同时将分离自新疆特色乳制品中的乳酸菌用于抗链格孢活性筛选,以期为果蔬采后保鲜提供新的技术途径,并为无公害防治黑斑病奠定理论依据。
1 材料与方法
1.1 材料与仪器
发病香梨和苹果 均来自新疆南疆阿拉尔市周边某果园;细极链格孢(Alternariatenuissima)CGMCC3.3546 购自中国普通微生物菌种保藏管理中心;乳酸菌 本课题组前期从新疆传统乳制品中分离获得的110株乳酸菌(均已鉴定)[9];MRS肉汤培养基及PDA固体培养基 北京奥博星生物技术有限公司;PCR相关试剂 均购自Takara公司;其他实验相关试剂均为国产分析纯。
Chem Doc XRS+凝胶成像系统 美国Bio-Rad公司;PCR仪 德国SensoQuest;Leica DM1000显微镜 德国徕卡微系统有限公司;ZW-CJ-2FD无菌工作台 博讯实业公司医疗设备厂;DNP-9082A电热恒温培养箱 扬州鸿都电子有限公司;PC2002电子分析天平 梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 病原菌的分离 参照郭东起[10]及范瑛阁[11]等的方法对具有典型黑斑病症状的香梨和苹果的链格孢进行分离。果实表皮清洗干净后置于75%的酒精中浸泡60 s,无菌水冲洗5次,取病健接壤处组织,切成5 mm3组织放在PDA平板上,28 ℃恒温培养5~7 d,以点植法接种分离至菌落单一。
1.2.2 病原菌的鉴定
1.2.2.1 病原菌细胞形态观察 将分离纯化获得的病原菌接种于PDA培养基,28 ℃培养5~7 d,观察菌落特征并于显微镜下观察菌丝和孢子形态。鉴定标准参照文献[12-13]的方法。
1.2.2.2 病原菌DNA的提取 参照白逢彦等[14]的方法并略作修改,对所分离病原菌提取总DNA,具体如下:活化所分离的病原菌至PDA平板培养基,28 ℃恒温培养5~7 d;挑取少量菌丝体至无菌离心管,加入100 μL裂解液(100 mmol/L Tris,30 mmol/L EDTA,0.5% SDS,pH8.0),剧烈振荡后100 ℃水浴15 min;加入100 μL、2.5 mol/L的醋酸钾,冰浴0.5~1 h;4 ℃、13000 r/min离心5 min,上清加入等体积氯仿∶异戊醇(24∶1),12000 r/min离心15 min;上清加入等体积预冷的异丙醇,-20 ℃静置15 min;12000 r/min离心15 min,收集DNA沉淀,100 μL 70%的乙醇洗涤沉淀后自然晾干;加入50 μL TE溶解DNA,-20 ℃冷藏备用。
1.2.2.3 PCR扩增及鉴定 rDNA-ITS序列扩增的引物序列(表1)及PCR反应体系(表2)如下。
PCR反应程序:第一步,95 ℃预变性4 min;第二步,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸45 s,共35个循环;第三步,72 ℃延伸10 min后,4 ℃保存。
PCR扩增结束后,120 V电泳30 min,EB染色,凝胶成像系统成像,将扩增出较亮目的条带的菌株送上海生工测序分析,测序结果用DNAMAN进行编辑,然后将所获得的基因序列提交至NCBI,与Genebank中的序列进行同源性比对(http://www.ncbi.nlm.nih.gov/BLAST/),将比对结果作为菌株最终的鉴定结果,同时采用MEGA建立系统进化树,对所用链格孢进行系统发育分析。
1.2.3 乳酸菌的活化及不同发酵方式对乳酸菌抗链格孢活性的影响 将110株乳酸菌分别接种至MRS培养基进行活化,37 ℃培养48 h至MRS平板长出单菌落,挑取单菌落接入MRS液体培养基,37 ℃过夜培养,为乳酸菌母液。分别采用固态菌饼、静态发酵及摇床发酵3种发酵方式,获取发酵产物,从中筛选具有抗链格孢活性的乳酸菌。
1.2.3.1 固态发酵 取30 μL乳酸菌母液至MRS固体平板中,涂布均匀,37 ℃培养48 h。
1.2.3.2 静态发酵 取相同乳酸菌母液按1∶100比例加入装有10 mL MRS液体培养基的三角瓶中,37 ℃静置培养48 h。
1.2.3.3 摇床发酵 取相同乳酸菌母液按1∶100比例加入装有10 mL MRS液体培养基的三角瓶中,37 ℃,185 r/min摇床培养48 h。
1.2.3.4 乳酸菌抗链格孢活性研究 无菌条件下挑取新鲜链格孢孢子至无菌水中,镜检悬浮液中孢子情况,制成106个孢子/mL的孢子悬浮液,移取100 μL孢子悬浮液至PDA平板,涂布均匀后用打孔器打孔(直径6 mm);分别移取乳酸菌固态发酵菌饼、100 μL乳酸菌静态发酵产物及100 μL乳酸菌摇床发酵产物至PDA平板相应孔中,PDA平板置于28 ℃恒温培养4~5 d,观察链格孢长势及抑菌圈的形成情况,测量各组抑菌圈直径。每组实验设置重复平行3个,设置空培养基为空白对照。
1.2.4 数据分析 对所得实验结果采用SPSS 22进行单因素ANOVA统计分析。
2 结果与分析
2.1 链格孢的分离及显微观察
果实黑斑病发病症状:黑斑病是香梨或苹果等水果在贮藏6个月左右开始发病的。发病期持续时间较长,发病较缓慢。症状:首先是果皮出现黑褐色斑点和表皮组织开始褐变硬化并收缩,从果皮蔓延到核心,最后呈现黑色棕色凹形。
致病菌菌落形态:黑斑病病原菌在PDA培养基上菌丝生长较慢,28 ℃培养5~7 d,菌落形态为黑色椭圆状,菌丝灰色至黑色(图1,两株链格孢菌落形态相同),菌落底部为黑色。

图1 香梨链格孢Ap1菌落形态Fig.1 The colony morphology of the Alternaria(Ap1)from pear
共分离获得2株病原菌,根据来源分别暂命名为香梨链格孢(Ap1)和苹果链格孢(Am1),对所分离获得致病菌进行光学显微镜观察,结果如图2。可以明显看出其孢子呈卵形、手榴弹状,单生或簇生等形态。

图2 香梨链格孢Ap1(A)和苹果链格孢Am1(B)微观结构观察Fig.2 The micro structure of the Alternaria from pear(Ap1,A)and apple(Am1,B)
2.2 链格孢的分子生物学鉴定
分别对所分离获得的2株链格孢进行分子生物学鉴定,采用A.tenuissimaCGMCC3.3546作为对照。通过琼脂糖凝胶电泳检测,3株链格孢的rDNA-ITS序列大小在600 bp左右,结果如图3所示。

图3 3株链格孢rDNA-ITS序列扩增结果Fig.3 The rDNA-ITS sequence amplification results of 3 Alternaria strains注:1:A. Tenuissima CGMCC3.3546 rDNA-ITS序列条带;2:苹果链格孢Am1 rDNA-ITS序列条带;3:香梨链格孢Ap1 rDNA-ITS序列条带;M:marker。
将分离获得的Ap1及Am1的ITS区rDNA基因部分序列与NCBI基因数据库进行比对分析,序列通过Clustal X软件进行排列,利用MEGA 6.0以及Neighbor-Joining法构建系统发育进化树(图4)。从图4所示系统发育分析结果中可以看出,菌株Ap1与梨黑斑链格孢(Alternariagaisen)在同一分支,而Am1与A.tenuissimaCGMCC3.3546及细极链格孢(Alternariatenuissima)在同一分支,结合序列比对结果,Ap1与梨黑斑链格孢、Am1与细极链格孢相似性均在99%以上。
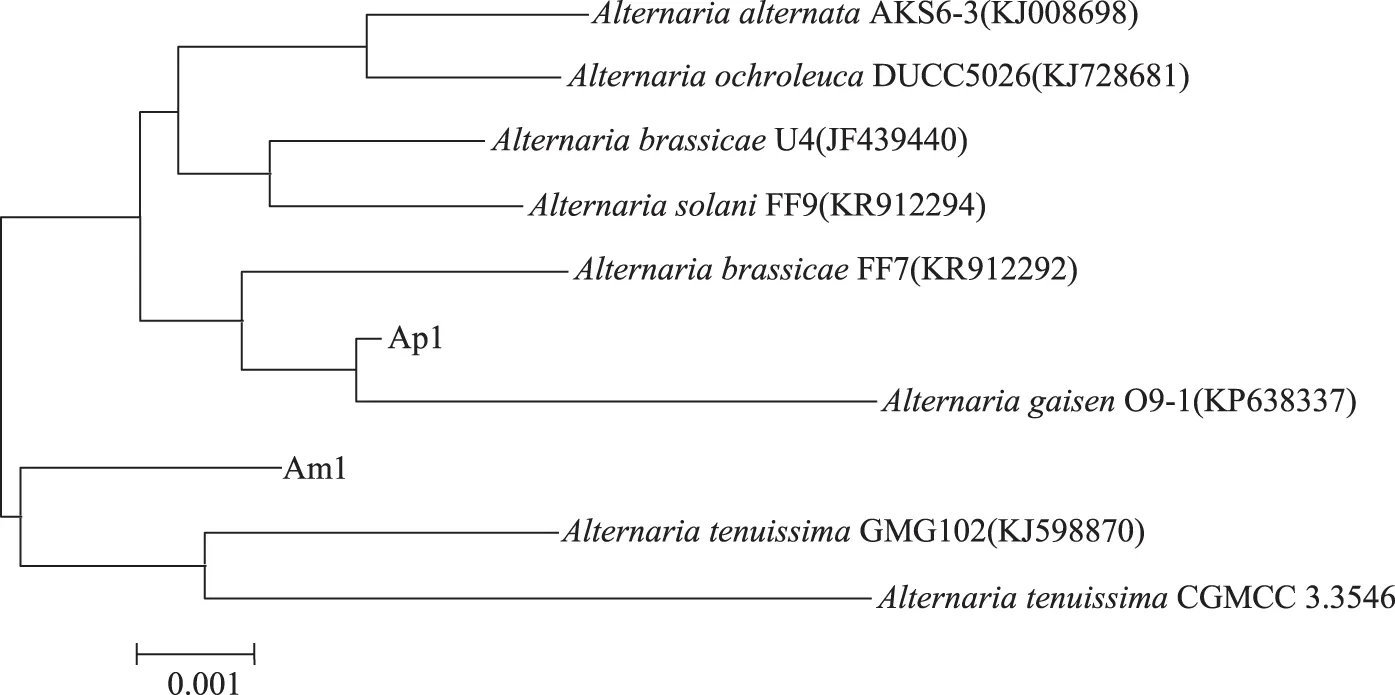
图4 所分离链格孢的系统发育分析Fig.4 Phylogenetic analysis of isolated Alternaria

表3 不同发酵方式对乳酸菌(LAB)抗链格孢效果的影响Table 3 Effects of different fermentation methods on the resistance of LAB against Alternaria
注:结果表示为平均值±标准差;同行字母不同表示差异显著(p<0.05)。真菌鉴定的主要方法为形态学鉴定和分子生物学鉴定[16],从以上形态学和分子生物学结果均表明:Ap1为梨黑斑链格孢(A.gaisen),Am1为细极链格孢(A.tenuissima)。所分离2株链格孢分别代表不同的链格孢菌种,实验具有一定的实际指导意义。
2.3 抗链格孢乳酸菌的筛选及不同发酵方式对乳酸菌抗链格孢活性的影响
分别以A.tenuissimaCGMCC 3.3546、A.gaisenAp1及A.tenuissimaAm1为靶标,采用固体发酵、静态发酵及摇床发酵3种不同的发酵方式对110株乳酸菌发酵产物抑制链格孢活性检测。共获得4株对不同靶标菌株有抑制活性的乳酸菌(表3),乳酸菌68(LAB 68)、乳酸菌86(LAB 86)、乳酸菌91(LAB 91)对A.tenuissimaCGMCC 3.3546具有较好的抑菌活性,结果如图5所示。LAB 68、乳酸菌37(LAB 37)对A.tenuissimaAm1具有较好的活性,结果如图6所示。LAB 86对A.gaisenAp1具有明显的抑菌活性,结果如图7所示。其中LAB 68、LAB 86、LAB 91为戊糖乳杆菌(Lactobacilluspentosus),LAB 37为副干酪乳杆菌(Lactobacillusparacasei)。以上结果说明不同的乳酸菌代谢产物对不同的链格孢菌株的抑菌活性各不相同。同时,分别对比固态发酵、静态发酵及摇床发酵的发酵产物活性,从表3中可以看出,不同的发酵方式对乳酸菌的抗链格孢活性有显著影响(p<0.05)。固态发酵菌饼的抗链格孢活性显著低于静态发酵组和摇床发酵组(p<0.05),并且静态发酵组的抑菌圈直径显著低于摇床发酵组(p<0.05),摇床发酵组的抑菌圈直径最大为21.17 mm。图5~图7中可以明显看出摇床发酵组(3)的抑菌圈直径明显大于其他两组。PDA平板上的链格孢长势均匀,抑菌圈明显(白色部分即为抑菌圈)。

图5 不同发酵方式及不同乳酸菌发酵产物的抗A. tenuissima CGMCC3.3546活性Fig.5 The inhibitory activity on A. tenuissima CGMCC3.3546 of fermentation products from different lactic acid bacteria with different fermentation methods注:1:固态发酵菌饼,2:静态发酵液,3:摇床发酵液,图6、图7同;A:LAB 86;B:LAB 91;C:LAB 68。

图6 不同发酵方式及不同乳酸菌发酵产物的抗A.tenuissima Am1活性Fig.6 The inhibitory activity on A.tenuissima Am1 of fermentation products from different lactic acid bacteria with different fermentation methods注:A:LAB 68;B:LAB 37。

图7 不同发酵方式对LAB 86发酵产物的抗A. gaisen Ap1活性的影响Fig.7 The inhibitory activity on A. gaisen Ap1 of fermentation products from lactic acid bacteria 86 with different fermentation methods
3 讨论
许多学者对链格孢的致病性进行了报道研究。郝莉花等[17]对红枣干果贮藏期间的真菌病害进行了深入研究,指出红枣因真菌病害侵染而导致的腐烂率达到30%以上,链格孢(Alternariaspp.)是红枣干果贮藏期的优势病原菌,也是引起红枣鲜果病害的主要病原菌。常有宏等[18]采用喷雾及涂抹法对梨接种黑斑病病原菌,得出此病原菌很容易使梨患病的结论,同时获得了病原菌侵染的最适条件并指出梨黑斑病病原菌致病性的强弱可能与其产生色素有关。本研究分别从新疆南疆本地区果园采集的香梨和苹果上分离获得了一株链格孢,并鉴定为梨黑斑链格孢(A.gaisen)和细极链格孢(A.tenuissima),这对于本地区的针对性防治黑斑病病害起到了一定的指导和鉴别作用。
蔡文韬等[4]从柿子椒中分离获得了一株黏质红酵母(Rhodotorulamucilaginosa)具有较好的抑制链格孢的活性,该菌株发酵液的75%乙醇沉淀物和乙酸乙酯提取物对链格孢产孢、萌发和菌丝的生长等方面都具有较好的抑菌效果,并且发现将其应用于辣椒和番茄采后防腐保鲜方面也具有一定的效果,能够大大降低果蔬的腐烂率。郭东起等[10]对新疆南疆地区引起骏枣黑斑病的病原菌进行了分离鉴定,并筛选出10株具有较好抑制链格孢的酵母菌,为防治红枣黑斑病提供了理论依据。乳酸菌的抗真菌活性也已被多位学者证实,如副干酪乳杆菌(L.paracasei)能够抑制层生镰刀菌(Fusariumproliferatum)和禾谷镰刀菌(Fusariumgraminearum)[19];Rouse S等[20]从麦芽中分离的戊糖片球菌(Pediococcuspentosaceus)可抑制扩展青霉(Penicilliumexpansum)等。本研究中所筛选出的4株乳酸菌分别为戊糖乳杆菌(L.pentosus)和副干酪乳杆菌(L.paracasei),均分离自新疆传统乳制品,并且LAB 86对A.tenuissimaCGMCC3.3546的抑菌圈直径为21.17 mm,明显高于耿海峰等[6]所分离获得的抗链格孢乳酸菌的抑菌活性,表明新疆牧区极为丰富的民族特色乳制品蕴藏着众多的乳酸菌资源,这为乳酸菌防治链格孢提供了物质基础。
乳酸菌抗真菌活性物质种类繁多,不同乳酸菌产生的抗菌物质不同,即使同一株乳酸菌在不同的发酵条件下所产生的活性物质种类也有明显差异。从本研究中即可看出,对于同一株乳酸菌,摇床发酵组的抗链格孢活性相对最强,推测可能原因是抗链格孢活性产物的产生与乳酸菌培养过程中的氧供应有密切联系,摇床发酵使乳酸菌与氧气的接触面积增大,这为乳酸菌的生长和活性产物的产生提供足量的氧气供应。对于乳酸菌的抗真菌活性物质,有多位学者对现已知的不同乳酸菌产生的主要抗真菌物质进行了系统阐述[8,21],这类物质主要包括有机酸(例如乳酸及醋酸等)、双乙酰、过氧化氢、苯乳酸、蛋白类物质、罗伊氏菌素、羟基脂肪酸、环状肽等。关于乳酸菌对真菌毒素的抑制机制目前主要集中在3个方面:一是乳酸菌的代谢产物对真菌菌株的抑制;二是乳酸菌在生长过程中产生了抑制复合物,可抑制毒素的合成,同时降解已产生的毒素;三是真菌毒素与乳酸菌细胞壁之间的物理结合效果[22-23]。但是由于不同活性物质之间存在着普通而复杂的协同作用关系,因此很难精确地阐明乳酸菌的抗菌作用机制,目前的研究主要是在生物体外直接分离鉴定具有抗菌作用的活性物质。这也将是本研究后续的主要研究内容,探明所筛选4株乳酸菌体外抑制链格孢的活性物质并对其进行分离鉴定,为进一步实现生物防治链格孢引起的果实黑斑病提供技术支持。
4 结论
从新疆南疆阿拉尔市某果园的黑斑病香梨和苹果上分离获得2株链格孢病原菌,经形态观察及分子生物学鉴定分别为梨黑斑链格孢(A.gaisen)和细极链格孢(A.tenuissima),这也再次证明链格孢是引发水果黑斑病的主要致病菌之一。
以所分离的2株链格孢及1株链格孢标准菌株为靶标,从课题组前期分离自新疆传统民族特色乳制品的110株乳酸菌中筛选抑制链格孢活性的乳酸菌,结果获得了4株对相应链格孢有抑制活性的乳酸菌,分别为戊糖乳杆菌(LAB 68、LAB 86和LAB 91)和副干酪乳杆菌(LAB 37),可作为后续乳酸菌抗真菌活性物质的深入研究的菌株材料。
摇床发酵所获得的发酵产物具有更好的抑菌活性,为后续相关活性菌株发酵条件的优化提供前期研究基础。
[1]Koliler I,Akerman M,Huberman L,et al. Integration of pre-and postharvest treatment for the control of black spot caused byAlternariaalternatain stored persimmon fruit[J]. Postharvest Biology and Technology,2011,59(2):166-171.
[2]李文波,张新华,辛甜甜,等. 果实采后黑斑病及其防治研究进展[J]. 河南农业科学,2012,41(10):6-9.
[3]王迪,李永才,毕阳,等. 外源一氧化氮对苹果采后黑斑病的控制[J]. 食品工业科技,2015,36(18):358-361.
[4]蔡文韬,夏延斌,夏菠,等. 黏质红酵母的鉴定及链格孢菌抑菌机制的研究[J]. 食品与机械,2013,29(2):54-59.
[5]赵超,胡美姣,李敏,等. 芒果采后病害拮抗菌的筛选、鉴定及其生防效果研究[J]. 西南农业学报,2016,29(2):385-389.
[6]耿海峰,张丽珍,牛伟. 冬枣采后病害拮抗菌的筛选和鉴定[J]. 食品科学,2010,31(9):150-155.
[7]Hempel S,Newberry S,Ruelaz A,et al. Safety of Probiotics to Reduce Risk and Prevent or Treat Disease[J]. Evidence Report/Technology Assessment,2011,22(1):1-7.
[8]白凤翎,励建荣. 抗真菌性乳酸菌生物保护剂的研究进展[J]. 现代食品科技,2014(5):311-319.
[9]任晓镤,妥彦峰,梁月慧,等. 新疆民族特色酸奶及酸奶疙瘩中乳酸菌的分离鉴定及其生物膜形成能力检测[J]. 塔里木大学学报,2014,26(4):1-7.
[10]郭东起,蒋卉,牛宁宁,等. 南疆骏枣黑斑病病原菌的分离、鉴定及控制研究[J]. 中国植保导刊,2015,35(12):5-8.
[11]范瑛阁,赵静,黄克强,等. 新疆阿克苏地区红枣黑斑病病原的鉴定及拮抗菌筛选[J]. 江苏农业科学,2015,43(12):175-177.
[12]魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979:566-571.
[13]戴芳澜. 中国真菌总汇[M]. 北京:科学出版社,1979:819-828.
[14]白逢彦,贾建华,梁慧燕. 假丝酵母属疑难菌株大亚基rDNA D1/D2区域序列分析及其分类学意义[J]. 菌物学报,2002,21(1):27-32.
[15]Kurtzman C P,Robnett C J. Identification of clinically important ascomycetous yeasts based on nucleotide divergence in the 5′ end of the large-subunit(26S)ribosomal DNA gene[J]. Journal of Clinical Microbiology,1997,35(5):1216-1223.
[16]王端礼. 医学真菌学[M]. 北京:人民卫生出版社,2004:318-321.
[17]郝莉花,董彩文,陈春生,等. 红枣贮藏期间主要病原真菌的分离、鉴定与ITS序列分析[J]. 江苏农业科学,2016,44(2):304-307.
[18]常有宏,刘永锋,王宏,等. 梨黑斑病病菌的致病条件[J]. 江苏农业学报,2008,24(3):316-320.
[19]Hassan Y I,Bullerman L B. Antifungal activity ofLactobacillusparacaseissp. tolerans isolated from a sourdough bread culture[J]. International Journal of Food Microbiology,2008,121(1):112-115.
[20]Rouse S,Harnett D,Vaughan A,et al. Lactic acid bacteria with potential to eliminate fungal spoilage in foods[J]. Journal of Applied Microbiology,2008,104(3):915-923.
[21]程璐,缪铭,张涛,等. 食品生物防腐剂——抗真菌乳酸菌研究进展[J]. 食品与发酵工业,2010(9):129-133.
[22]张柏林,张若鸿,吴风亮,等. 乳酸菌抗真菌活性及其抑制真菌毒素的效果[J]. 中国乳品工业,2005,33(6):31-37.
[23]Batish V K,Roy U,Lal R,et al. Antifungal attributes of lactic acid bacteria-A review[J]. Critical Reviews in Biotechnology,1997,17(3):209-225.
IdentificationoftheAlternariaandscreeningofthelacticacidbacteriaagainstAlternariainsouthXinjiang
LIMing-yang,XIETing-ting,LIJian,ZHANGRui-li*
(College of Life Sciences of Tarim University,Production & Construction Group Key Laboratory of Special Agricultural Products Further Processing in Southern Xinjiang,Tarim University,Alar 843300,China)
TS201.3
A
1002-0306(2017)18-0145-06
2017-02-27
李明杨(1986-),女,硕士研究生,研究方向:农产品贮藏与加工,E-mail:lmy564181@163.com。
*通讯作者:张锐利(1975-),男,硕士,副教授,研究方向:农产品贮藏与加工,E-mail:zrl_p@sina.com。
新疆生产建设兵团应用基础研究计划(2015AG003);新疆维吾尔族自治区科技攻关计划(2016AB009)。
10.13386/j.issn1002-0306.2017.18.028
