豆腐酸浆中干酪乳杆菌的分离、鉴定及作为豆腐凝固剂的应用
2017-10-16,,,*
,,,*
(1.锦州医科大学食品科学与工程学院,辽宁锦州 121000;2.锦州医科大学畜牧兽医学院,辽宁锦州 121000)
豆腐酸浆中干酪乳杆菌的分离、鉴定及作为豆腐凝固剂的应用
叶青1,许云贺2,张莉力1,*
(1.锦州医科大学食品科学与工程学院,辽宁锦州121000;2.锦州医科大学畜牧兽医学院,辽宁锦州121000)
通过平板涂布法和高效液相色谱法,以pH和产乳酸量为指标,从自然发酵酸浆中分离筛选出一株乳酸菌YQ336,对其进行菌株形态观察、菌落形态观察、生理生化鉴定以及16S rDNA序列分析,结果表明,该乳酸菌属于乳杆菌属的干酪乳杆菌。将分离出的干酪乳杆菌YQ336接种于豆腐黄浆水中纯种发酵制成豆腐凝固剂点制豆腐,与自然发酵酸浆点制的豆腐进行比较,发现两者的感官评分差异不显著(p>0.05),说明干酪乳杆菌YQ336可以作为新型豆腐凝固剂开发并使用。
黄浆水,干酪乳杆菌,高效液相色谱,豆腐凝固剂,分离鉴定,酸浆豆腐
Abstract:A strain of lactic acid bacteria was screened out from the tofu acid pulp by the plate coating method and high performance liquid chromatography with the pH and lactic acid yield as indexes. The morphological observation,colony morphological observation,physiological and biochemical identification and 16S rDNA sequence analysis of the strain were carried out,and the results showed that the lactic acid bacteria belonged toLactobacilluscasei. The isolatedLactobacilluscaseiYQ336 was inoculated into bean curd water and fermented into tofu coagulant to make tofu,compared with tofu made from natural fermented acid pulp,it was found that there was no significant difference between the two sensory scores(p>0.05). The result indicated thatLactobacilluscaseiYQ336 can be developed and used as a new tofu coagulant.
Keywords:bean curd water;Lactobacilluscasei;high performance liquid chromatography(HPLC);tofu coagulant;isolation and identification;acid slurry bean curd
黄浆水是豆腐生产过程中的副产物,含有丰富的蛋白质、脂肪、糖类、盐类等物质,通常被直接排放,既浪费资源又污染环境[1]。近年来,黄浆废水的利用主要有功能性成分的回收和直接利用[2-3]两种方式。Xijun Chai[4]等利用膜处理法过滤黄浆废水,使浓缩物可以回到生产线重新利用,过滤后的水可以直接排放。而我国传统酸浆豆腐是利用黄浆水直接自然发酵,形成酸浆作为豆腐凝固剂[5-6],并进行循环使用。酸浆豆腐口感细腻,味甘甜,是纯绿色食品[7-8]。但是,传统酸浆都是由小作坊自然发酵制成,容易受外界因素影响,导致酸浆的酸度不易控制。外界温度足够时,微生物繁殖迅速,酸浆可以很快达到点豆腐所需的酸度,而外界温度过低时,酸度则需要很长时间才能达到。而且由于环境不稳定,酸浆的酸度就不容易控制,造成生产的酸浆豆腐品质不稳定。另一方面,酸浆在自然发酵过程中,除有益菌外,还有许多腐败杂菌的存在,从而会导致所生产的酸浆豆腐货架期短[9]。若将酸浆的生产由自然发酵改为纯种发酵,将会解决以上两方面的问题。
本研究是利用豆腐生产后剩余的黄浆水加适量碳源为培养基[10],通过平板涂布法从自然发酵黄浆水中分离乳酸菌,再以pH为指标筛选出pH较低的菌株利用高效液相色谱法(HPLC)测菌株发酵液的乳酸量,最终筛选出产乳酸能力强的菌株,对其进行形态学观察,生理生化实验以及16S rDNA序列分析鉴定其菌种,然后用该菌种进行纯种发酵制作成豆腐凝固剂进行点制豆腐,以感官评分为指标,与自然发酵酸浆点制的豆腐进行比较[11],分析两种豆腐的优缺点,旨在研究本文所筛菌株是否可以作为新型酸浆豆腐凝固剂进行推广使用。
1 材料与方法
1.1 材料与仪器
食品级大豆 锦州新玛特超市;黄浆水 酸浆豆腐制作过程中的副产物,实验室自制;黄浆水培养基 新鲜黄浆水添加2%葡萄糖;黄浆水固体培养基 黄浆水培养基添加2%琼脂;AxyPrep细菌基因组DNA小量制备试剂盒 Axygen,AP-MN-BT-GDNA-50;DNA凝胶回收试剂盒 上海桑尼生物科技有限公司;TaqDNA 聚合酶 上海桑尼生物科技有限公司;DNAmarker 上海桑尼生物科技有限公司。
FA2104N型分析天平 兰州中西仪器;BOXUN立式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;JB-VS-1300超净工作台 金坛市鑫鑫实验仪器厂;DHP-9082电热恒温培养箱 苏州佳宝净化工程设备有限公司;PHS-3B精密pH计 上海雷磁仪器厂;YH-3880乐创多功能料理机 锦州新玛特超市;数码生物显微镜 OLYMPUS;720型Thermal Cycler PCR仪、3730-XL型测序仪 美国ABI公司;5804R型离心机 Eppendorf公司;Tanon2500凝胶成像系统 天能公司。
1.2 实验方法
1.2.1 实验黄浆水的制备 首先在实验室以醋酸为凝固剂点制豆腐,留压制豆腐后剩余的黄浆水200 mL,加2%葡萄糖,调pH6.0,37 ℃自然发酵72 h左右,待黄浆水pH降至3.8以下时为一代酸浆,由于一代酸浆未接种,酸浆在自然发酵过程中其内菌种生长缓慢,故达到点豆腐所需酸度时间较长,后续实验黄浆水均发酵24 h。以一代酸浆为豆腐凝固剂点制豆腐,留压制豆腐后剩余的黄浆水200 mL,加2%葡萄糖,调pH6.0,接种3%一代酸浆,37 ℃自然发酵24 h为二代酸浆。以二代酸浆为豆腐凝固剂点制豆腐,留压制豆腐后剩余的黄浆水200 mL,加2%葡萄糖,调pH6.0,接种3%二代酸浆,37 ℃自然发酵24 h为三代酸浆,如此可以消除醋酸对后续实验的影响[12]。三代后的酸浆即可作为本实验所用的豆腐凝固剂,用三代后的酸浆点制豆腐后剩余的黄浆水即为本实验所用的黄浆水。自制黄浆水pH在5.4~5.8之间,在大豆蛋白的等电点附近,蛋白质含量在0.9%~1.5%之间。
1.2.2 菌株筛选
1.2.2.1 初筛 采用平板涂布法,分离纯化样品中的细菌。将样品以3%的接种量接入黄浆水培养基中进行富集培养,37 ℃厌氧培养48 h。然后将富集培养的菌液稀释成10-1~10-77个梯度,各取10-5、10-6、10-7三个稀释梯度样品的0.1 mL涂布到含有2% CaCO3的黄浆水固体培养基[13]上,37 ℃恒温发酵48 h。挑取溶钙圈较大的菌落在灭菌后的黄浆水固体培养基上划线分离,于37 ℃培养48 h,如此反复划线分离2~3次,显微镜观察各菌落形态,直到确定为单菌落后编号[14]。
1.2.2.2 复筛 将编好号的菌株接种到黄浆水培养基中37 ℃恒温培养24 h后,分别测各菌株的pH和产乳酸量。选择pH较低的三株菌,利用HPLC法测其乳酸产量,选择乳酸产量最多的一株菌进行革兰氏染色,在显微镜下观察菌体形态,记录结果。
1.2.2.3 产乳酸量的测定 用HPLC[15]法测定,色谱分析条件:色谱柱为WondaSil C18-WR(250 mm×4.6 mm,5 μL),色谱条件为:检测波长210 nm,流动相为乙腈∶pH2.0磷酸=10∶90,柱温为35 ℃,进样量10 μL,流速0.8 mL/min。流动相配制好后分别过0.45 μm滤膜待用。乳酸标准品制备:经过预实验后,将标准品稀释到0.5、1、2、3、4 mg/mL五个梯度,4 ℃保存。样品处理:将样品于50 ℃超声提取20 min,稀释10倍后过0.22 μm滤膜待用。
1.2.3 菌株鉴定
1.2.3.1 生理生化实验 参照《伯杰细菌鉴定手册》[16],对筛选出的菌株进行常规生理生化鉴定,包括观察菌体运动性实验、过氧化氢酶实验、硫化氢实验、硝酸盐还原实验、明胶液化实验以及各种糖发酵实验等。
1.2.3.2 16S rDNA鉴定 细菌基因组DNA的提取:采用CTAB 法提取供试菌株基因组DNA。
细菌基因组PCR扩增:引物设计:27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-CTACGGCTACCTTGTTACGA-3′。PCR扩增反应体系(50 μL):上下游引物各1.5 μL,基因组DNA(20 ng/μL)1 μL,10×Buffer 5 μL,dNTP 1 μL,超纯水39 μL,Taq聚合酶 1 μL。确定PCR 扩增反应程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1.5 min,循环35次;72 ℃终延伸7 min,4 ℃保温。反应完成后,取3 μL PCR产物进行1%琼脂凝胶电泳检测,确认PCR扩增片段。PCR产物的回收:PCR产物用AxyPrep DNA 凝胶回收试剂盒回收,具体操作按试剂盒说明书进行。序列测定:取各个菌种纯化后的PCR产物,使用测序仪ABI3730-XL进行DNA测序。序列分析:用 NCBI Blast 程序将拼接后的序列文件与NCBI ribosomal RNA sequence(Bacteria and Archaea)数据库中的数据进行比对,得到与待测菌种序列相似性最大的菌种信息,即为16S rDNA的鉴定结果[17-18]。
1.2.4 菌株YQ336作为豆腐凝固剂的应用
1.2.4.1 纯种豆腐凝固剂的制作 将菌种YQ336接种于黄浆水培养基中37 ℃恒温发酵24 h,即为纯种酸浆豆腐凝固剂。
1.2.4.2 豆腐的制作工艺 将食品级大豆25 ℃下蒸馏水浸泡10~16 h,豆水比1∶10打浆,用100目尼龙筛布除渣并收集生豆浆,电磁炉煮沸后持沸5 min,当豆浆温度降至80~90 ℃时,轻搅下徐徐加入纯种酸浆豆腐凝固剂,直至出现均匀脑花,90 ℃养浆10 min后加热煮沸1 min,将豆花倒入豆腐模具中1000 Pa压强下压制30 min成型[12]。
1.2.4.3 微生物检验 分别按GB 4789.2-2010和GB 4789.3-2010方法测纯种菌发酵浆与自然发酵酸浆的菌落总数和大肠菌群数。
1.2.4.4 感官评定 将纯种豆腐凝固剂与自然发酵酸浆点制的豆腐成品进行色香味的粗比较。由10名感官鉴定人员对其色香味按百分制评分[12]。具体方法见表1。

表1 豆腐感官评定表Table 1 Tofu sensory evaluation table
1.3 数据处理
数据标准曲线采用 Excel2007制作,数据统计采用SPSS 19.0 进行ANOVA单因素方差分析及LSD多重检验(p<0.05),数值以均值±标准差表示,利用Phylip 3.695软件构建系统发育树。
2 结果与分析
2.1 初筛
经过挑取在黄浆水固体培养基上溶钙圈较大的菌落,对其进行纯培养,显微镜观察发酵液中菌体形态,直到确定为单菌落后,共选出10株产酸较多菌株,并进行编号。
2.2 复筛
将初筛选出的10株菌接种于黄浆水培养基培养24 h后,进行pH测定,结果见表2。
由表2可以看出,经24 h发酵后,菌株114、336、116的pH较低,与其他各组菌株pH差异显著(p<0.05),因此,将这三株菌接种于黄浆水培养基发酵24 h后,分别对其发酵液进行乳酸含量的测定,乳酸标准品色谱图见图1,乳酸标样的标准曲线见图2,三菌株发酵液乳酸色谱图见图3~图5。

表2 10株菌发酵24 h的pHTable 2 The pH of 10 strains fermented for 24 h
注:小写字母不同表示各组之间pH呈显著性差异(p<0.05)。

图1 乳酸标准样品的HPLC色谱图Fig.1 HPLC chromatogram of lactic acid standard samples

图2 乳酸标准样品的标准曲线Fig.2 Standard curve of lactic acid standard sample
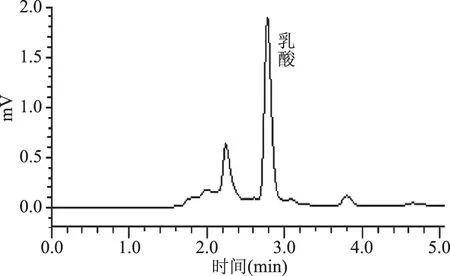
图3 细菌114发酵液的乳酸色谱图Fig.3 Lactic acid chromatogram of bacteria 114 fermentation broth

图4 细菌116发酵液的乳酸色谱图Fig.4 Lactic acid chromatogram of bacteria 116 fermentation broth

图5 细菌336发酵液的乳酸色谱图Fig.5 Lactic acid chromatogram of bacteria 336 fermentation broth
由图1可以看出,乳酸标样出峰时间为2.776 min,根据乳酸标样各浓度梯度的峰面积做出如图2所示的标准曲线Y=281.1X-124.4,R2=0.9998,结果表明这种色谱条件下测出的乳酸线性关系很好。根据三株菌色谱图的峰面积计算出其产乳酸量见表3。

表3 三株菌发酵液的乳酸含量Table 3 The lactic acid content of fermentation broth of three strains
注:小写字母不同表示各组之间产乳酸量呈显著差异(p<0.05)。
从表3可以看出,菌株336的产乳酸量显著高于其他两株菌,为24.48 g/L,是刘冬梅[19]等人测定干酪乳杆菌在泡菜液中发酵24 h后产乳酸量13.64 g/L的1.79倍。
2.3 形态特征
通过油镜观察,菌株336大小为(0.7~1.1 μm)×(2.0~4.0 μm),呈杆状或长杆状,细胞分裂后的排布方式为链状,革兰氏染色结果为阳性,无芽孢,不运动,其菌落大小为1~3 mm,呈乳白色圆形低凸不透明,边缘整齐,表面光滑有光泽。菌株形态特征见图6,菌株镜检特征见图7。

图6 菌株336的菌落特征Fig.6 The colony characteristics of strain 336
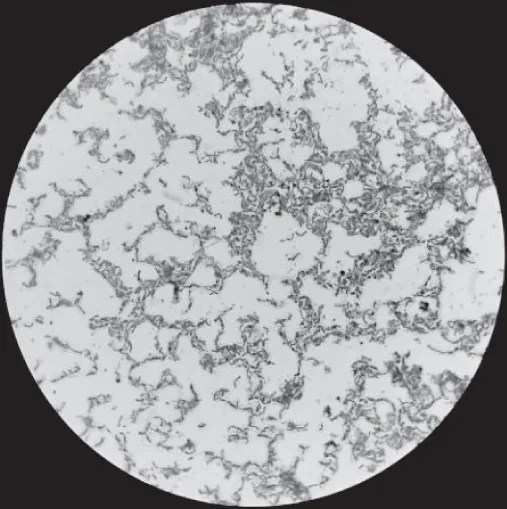
图7 菌株336的革兰染色形态(100×)Fig.7 Gram stain morphology of strain 336(100×)
2.4 生化实验结果
参照《伯杰细菌鉴定手册》,菌株336的生理生化鉴定结果见表4。
从表4可以看出,菌株336不运动,不含过氧化氢酶,不能产生硫化氢,不能还原硝酸盐为亚硝酸盐,不能分解明胶,15~45 ℃范围内均能生长,能利用大多数糖进行发酵。

表4 菌株生理生化特性Table 4 Strain physiological and biochemical characteristics
注:+:阳性;-:阴性。
2.5 16S rDNA鉴定
原核生物的核糖体DNA有23S、16S和5S 3种,由于16S rDNA 的信息量大,序列大小适中(15 kbp),因而被选为生物进化过程的标尺,用于生物的系统分类,是目前所知系统发育研究中最好的标记。目前,细菌学家普遍认为,当16S rDNA 序列同源性高于97%时,可以认为是属内的同种[20]。
经16S rDNA鉴定,菌株336的16S rDNA序列全长为1483 bp,经Genbank比对与Lactobacilluscasei相似性达到99%。利用Phylip 3.695软件构建系统发育树,菌株YQ336与Lb.caseiNR_113333.1亲缘关系最近,结果如图8所示。
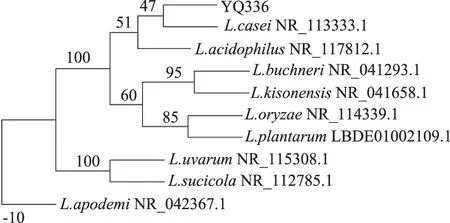
图8 利用 16S rDNA序列进行构建系统发育树Fig.8 Phylogenetic tree based on the 16S rDNA sequence
结合其菌体的群体形态特征、个体形态特征、生理生化实验结果及菌株的16S rDNA 序列比对,确定细菌336为干酪乳杆菌,命名为LactobacilluscaseiYQ336,现已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No. 12796。
2.6 纯种菌发酵浆与自然发酵酸浆点豆腐品质的比较
2.6.1 微生物检验 自然发酵酸浆的微生物检验结果为细菌总数6.4×109cfu/mL,大肠菌群检出为4 cfu/100 mL。纯种发酵酸浆的微生物检验结果为细菌总数5.2×109cfu/mL,大肠菌群未检出。
2.6.2 感官评价 10名感官鉴定人员对两种豆腐的色、香、味进行评分,结果见表5。

表5 两种豆腐的感官评分Table 5 The sensory evaluation scores of the two tofu types
注:小写字母不同表示同行感官评分之间差异显著(p<0.05)。
由表5可知,用两种酸浆点制出的豆腐其色泽均偏白,有明显豆香味无明显酸味,块形完整软硬适宜,质地较细腻,较有弹性表面不粘,细腻爽滑弹性好,断面整齐表面光滑。纯菌发酵酸浆点制的豆腐总感官评分结果略高于自然发酵酸浆点制的豆腐,但是两种豆腐的各项感官评分结果均无显著差异(p>0.05)。说明纯种酸浆发酵豆腐既拥有传统酸浆豆腐独特的色香味,又无有害菌存在,绿色健康,保质期更长,可以作为新型酸浆豆腐凝固剂并广泛使用。
3 结论
利用黄浆水添加少量葡萄糖为培养基,通过平板涂布法和高效液相色谱法,经过初筛、复筛、菌落形态观察、生理生化鉴定以及16S rDNA序列分析等步骤,从自然发酵豆腐黄浆水中分离纯化出一株产乳酸能力强的干酪乳杆菌YQ336,该菌37 ℃恒温发酵24 h可产乳酸24.48 g/L,pH可达3.55。然后利用其纯种发酵制成豆腐凝固剂点制豆腐,与自然发酵酸浆点制的豆腐进行比较,发现前者感官评分优于后者,但差异不显著(p>0.05)。此外,自然发酵酸浆中有大肠杆菌和腐败菌存在[9],导致生产的酸浆豆腐保质期短且存在危害人体健康的隐患,而纯种发酵酸浆不含腐败菌,经过实验比对,本文筛选出的干酪乳杆菌YQ336纯种发酵酸浆可以作为一种新型豆腐凝固剂并广泛使用。
[1]李里特. 大豆加工与应用[M]. 北京:化学出版社,2003.
[2]刘力. 豆腐酸浆中乳酸菌的分离鉴定、代谢研究及高密度培养[D].广州:华南理工大学,2015.
[3]李娟. 黄浆水的综合开发利用[D].济南:山东轻工业学院,2012.
[4]Xijun Chai,Yongli Mi,Po-Lock Yue,et al. Bean curd wastewater treatment by membrane separation[J]. Separation and Purification Technology,1999,15(2):175-180.
[5]王国良. 酸浆野生菌发酵黄浆水生产天然凝固剂的研究[D]. 济南:山东轻工业学院,2005.
[6]吕博,黎晨晨,刘宁,等. 双菌发酵黄浆水制备豆腐凝固剂培养条件优化[J]. 食品工业科技,2015(2):212-216.
[7]C G Vinderola,P Mocchiutti,J A Reinheimer. Interactions among lactic acid starter and probiotic bacteria used for fermented dairy products[J]. J Dairy Sci,2002,85(3):721-729.
[8]王爱伟,孙冰洁.酸浆豆腐废水中发酵假丝酵母的研究[J].中国酿造,2009(10):44-46.
[9]乔支红,闫佳,陈虹,等. 酸浆标准化生产工艺的研究[J]. 食品工业科技,2015,36(12):162-164.
[10]赵贵丽,罗爱平,廖娅凡,等. 酸浆最适自然发酵条件优化[J]. 食品科学,2013,34(17):201-204.
[11]王荣荣,王家东,周丽萍,等. 豆腐凝固剂的研究进展[J].畜牧兽医科技信息,2006(1):78-79.
[12]张影,刘志明,刘卫,等. 酸浆豆腐的工艺研究[J]. 农产品加工(学刊),2014(4):21-23,26.
[13]华鹤良. 乳酸菌的分离鉴定及其抗菌肽与发酵性能研究[D].扬州:扬州大学,2014.
[14]刘晶. Viili中乳酸菌的分离及其胞外多糖的研究[D].保定:河北农业大学,2015.
[15]郭子好,方华,夏志生,等. 反相高效液相色谱法测定发酵豆粕中的乳酸含量[J]. 饲料工业,2014,S1:121-123.
[16]R. E. 布坎南. 伯杰细菌鉴定手册(第八版)[M]. 北京:中国农业出版社,1995.
[17]乌日娜. 内蒙古传统酸马奶中乳杆菌的分离鉴定及16S rDNA序列同源性分析[D]. 呼和浩特:内蒙古农业大学,2005.
[18]K H Wilson,R B Blitchington. Human colonic biota studied by ribosomal DNA sequence analysis[J].Applied and Environmental Microbiology,1996,62(4):2273-2278.
[19]刘冬梅,吴晖,余以刚,等. 高效液相色谱法对泡菜中L-乳酸和D-乳酸的手性分离和测定[J]. 现代食品科技,2007(8):74-76.
[20]Kolbert C P,Persing D H. Ribosomal DNA sequencing as a tool for identification of bacterial pathogens[J].Current Opinion in Microbiology,1999,2(3):299-305.
IsolationandidentificationofLactobacilluscaseiintofuacidpulpanditsapplicationastofucoagulant
YEQing1,XUYun-he2,ZHANGLi-li1,*
(1.College of Food Science and Engineering,Jinzhou Medical University,Jinzhou 121000,China;2.College of Animal Science and Veterinary Medicine,Jinzhou Medical University,Jinzhou 121000,China)
TS201.3
A
1002-0306(2017)18-0094-06
2017-04-05
叶青(1993-),女,硕士研究生,研究方向:食品微生物,E-mail:18741650927@163.com。
*通讯作者:张莉力(1977-),女,博士,副教授,研究方向:食品微生物,E-mail:lilyzhang1977@163.com。
国家自然科学基金项目(31301499);辽宁省自然科学基金项目(2014022052);辽宁省自然科学基金项目(2014022046)。
10.13386/j.issn1002-0306.2017.18.019
