流化床气相水解制备高纯二氧化钛
2017-10-16赵玉仲孙建军李军朱庆山
赵玉仲,孙建军,李军,朱庆山
(1中国科学院过程工程研究所,多相复杂系统国家重点实验室,北京 100190;2北京化工大学化学工程学院,北京 100029)
流化床气相水解制备高纯二氧化钛
赵玉仲1,2,孙建军2,李军1,朱庆山1
(1中国科学院过程工程研究所,多相复杂系统国家重点实验室,北京 100190;2北京化工大学化学工程学院,北京 100029)
针对TiCl4气相水解制备TiO2粉体存在Cl含量高的问题,开展了流化床TiCl4气相水解制备高纯TiO2。系统地研究了反应条件、煅烧后处理对TiO2粉体的纯度、形貌、晶型、比表面积的影响。结果表明,TiO2内部结构和晶型的转变有利于Cl的脱除;提高煅烧温度使TiO2的内部结构由多孔疏松向致密结构转变,晶型结构由锐钛矿相向金红石相转变,从而有利于提高Cl的脱除率;与空气煅烧比较,水蒸气气氛下的脱氯效率明显提高,归因于水蒸气与TiO2颗粒内残余的多羟基氯化物进一步反应;氢气气氛下可进一步提高Cl的脱除率,800℃煅烧2 h后Cl的脱除率达到95%,主要归因于氢气还原TiO2使其晶型结构发生转变。
流化床;水解;二氧化钛;超细粉体;团聚
Abstract:Synthesis of high purity TiO2powder by fluidized gas hydrolysis method is investigated.To tackle the problem of high Cl content remained in the TiO2powder,the hydrolysis reaction conditions and subsequently calcination at air,steam and H2are mainly investigated for dechlorination.The results show that the structure and phase transition of TiO2are two key factors that affect the efficiency of dechlorination.With the increase of the calcination temperature,the internal structure of TiO2is changed from porous to dense structure,and the crystalline structure is transformed from anatase to rutile.The structure and phase transition of TiO2are beneficial to increasing the removal rate of Cl.Compared with the air calcination,the dechlorination efficiency in water vapor atmosphere is obviously improved,which is attributed to the further reaction of water vapor and the multi hydroxyl chloride in the TiO2particles.Compared with air and steam calcination,the removal rate of Cl can be further improved up to 95% under the atmosphere of hydrogen at 800℃ for 2h,which is mainly attributed to the reduction of TiO2structure by hydrogen reduction.
Key words:fluidized-bed; hydrolysis; TiO2; ultrafine powders; agglomeration
引 言
高纯二氧化钛具有优良的光、电和力学特性,是制造硬质合金、热敏电阻、功能陶瓷、化妆品、颜料等工业的重要基础原料[1],同时也可作为重要催化剂载体应用于脱硫脱硝、光电转化等催化过程[2-3]。目前,作为颜料用高纯二氧化钛时,要求其具有TiO2纯度高和杂质含量低等化学特性。此外,电子级高纯二氧化钛还对二氧化钛的形状、粒度大小等物理特性提出了具体指标。这就对高纯二氧化钛的制备技术提出了更高的要求。
现有国内外高纯二氧化钛制备技术主要包括硫酸法[4]、氯化法[5]、液相水解法[6]、钛醇盐水解法[7]等。以上4种制备技术中,除硫酸法外,其余3种制备技术均采用了以TiCl4为前体合成TiO2,其不同之处在于氧化或水解方式。氯化法采用了高温气相氧化法合成TiO2,技术难度大,对设备材质及内部结构要求苛刻,生产过程中需要加入 AlCl3成核剂,影响产品的纯度[5,8]。液相水解法具有工艺流程短、杂质含量低等优点,但产物颗粒易于团聚使得粒度大小不易控制[6]。钛醇盐水解法存在工艺流程长,原料和辅助材料价格较高,而且产物中存在积碳的问题[7]。此外,少数研究者采用气相水解法合成 TiO2[9-11],着重于研究水解反应时间、温度及H2O/TiCl4摩尔比等反应条件对TiO2的晶型、粒径、杂质含量等物化性质的影响。研究表明气相水解产物中的杂质主要是SiO2和Cl,特别是Cl的脱除是提高TiO2纯度的关键因素,但对脱除Cl的影响因素没有深入研究。
近年来,采用流化床方法制备高性能粉体成为超细粉体制备过程研究的热点[12-18],其高效的气固接触效率将有利于Cl的脱除。本文采用流化床气相水解合成超细TiO2粉体,着重于研究气相水解及煅烧后处理过程中杂质Cl的脱除,通过改变反应条件控制超细TiO2粉体的粒径大小,同时采用煅烧后处理的方法脱氯,得到了分散性良好的具有混合晶型的高纯二氧化钛。
1 实验部分
1.1 实验原料及装置
气相水解采用的原料为四氯化钛(TiCl4)液体(纯度 98%,国药集团化学试剂有限公司),高纯氮气和高纯氢气(≥99.999%,北京市北温气体制造厂)。
气相水解反应装置如图1所示,由进气系统、流化床反应器、加热炉和尾气净化系统4部分构成。流化床反应器由直径为20 mm的内管和直径为35 mm的外管构成。气路系统由氮气携带的TiCl4蒸气和氮气携带的水蒸气两路气体管路组成,通过质量流量计(北京七星华创电子股份有限公司)控制氮气流量,采用天津市泰斯特仪器有限公司生产的数显电加热套控制 TiCl4蒸气和水蒸气的逸出温度。过滤器(石家庄乾煌过滤设备有限公司)主要用于收集少量被气体带出的固体产物。
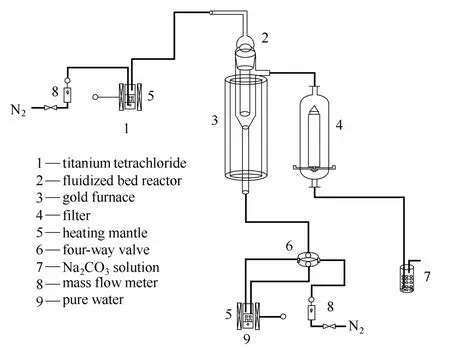
图1 流化床气相水解装置Fig.1 Fluidized bed gas phase hydrolysis apparatus
1.2 二氧化钛粉体的制备及表征方法
实验时,首先将流化床反应器置于预先加热的透明加热炉中,TiCl4蒸气从流化床反应器的顶部进入流化床反应器的内管,水蒸气从流化床反应器的底部进入流化床反应器。通入 TiCl4蒸气和水蒸气的含量通过氮气流量和温度加以调控。两路气体在流化床反应器的底部混合并发生反应,反应后的大部分固相产物在流化床反应器内管和外管的环隙区沉积,少量固体产物被气体带出反应器,经过滤器过滤后的尾气通入饱和碳酸钠溶液以除去盐酸。为了防止 TiCl4蒸气在管路上冷凝,气路通过加热带对导气管进行保温。过滤器的温度设为 140℃,以避免水蒸气在过滤器中冷凝而导致管路堵塞。
水解反应5 h后,停止通入TiCl4蒸气,继续通入水蒸气30 min后,停止加热。取下反应器,将反应器内管和外管的环隙区沉积的二氧化钛产物收集到坩锅中,在较高温度下(400~1000℃)煅烧处理2 h,获得TiO2粉体约10 g,产物收率约80%。考察煅烧温度对颗粒形貌、粒径大小及 Cl含量的影响,同时对比了空气、水蒸气和氢气气氛下对脱氯效果的影响。
采用X'pert PRO MPD型X射线衍射仪(XRD,荷兰帕纳科公司)测定反应产物的晶型结构。通过Lab center XRF-1700型X射线荧光分析仪(XRF,荷兰帕纳科公司)测定反应产物的Cl含量。采用粉末压片制样法,以硼酸为衬底,将TiO2粉末压制成片,进行XRF测试。所有样品均重复测量两次,测量误差低于 2%。产物的表面形貌和内部结构分析分别采用热场发射扫描电子显微镜(JSM-7100F+INCA X-MAX)和高分辨率透射电子显微镜(JEM-2100F)进行分析。同时使用全自动比表面积分析仪(NOVA3200e)测定粉体颗粒的比表面积。
2 实验结果与讨论
2.1 水解温度的影响
在 300~635℃范围内考察了水解温度对二氧化钛纯度的影响。图2为不同水解温度下得到的二氧化钛粉体产物XRD谱图。可以看出,在300℃时,二氧化钛的衍射峰强度很弱,说明主要以无定形TiO2存在;随着水解温度的升高,由无定形 TiO2向锐钛矿TiO2转变,这与Xia等[9]报道的结果一致。然而,当水解温度超过550℃后,其锐钛矿相TiO2衍射峰有所减弱,但没有金红石相TiO2出现,文献[9]也报道了 TiO2在 1000℃下没有相态转变。说明在水解条件下TiO2晶型转变速率非常缓慢。通常情况下,TiO2晶型转变温度为610~915℃[19],但其转变速率受颗粒尺寸、TiCl4进料速率、烧结气氛和掺杂等因素的影响较大[20-23]。

图2 不同温度下产物的XRD谱图Fig.2 XRD patterns of TiO2powder under different hydrolysis temperatures
图3为对应水解温度下获得二氧化钛中Cl含量,可以看出,在300~550℃范围内,二氧化钛产物中Cl含量与水解温度呈线性关系,随着制备温度的升高而降低,Cl含量从300℃时的7.25%(质量)降低到 550℃的 0.29%(质量)。说明在 300~550℃范围内,水解温度的提高有利于降低二氧化钛产物中Cl含量。然而,当水解温度超过550℃后,产物中Cl含量没有明显变化。结合图2中TiO2的晶型转变,推断TiO2的晶型对Cl的脱除有较大影响。
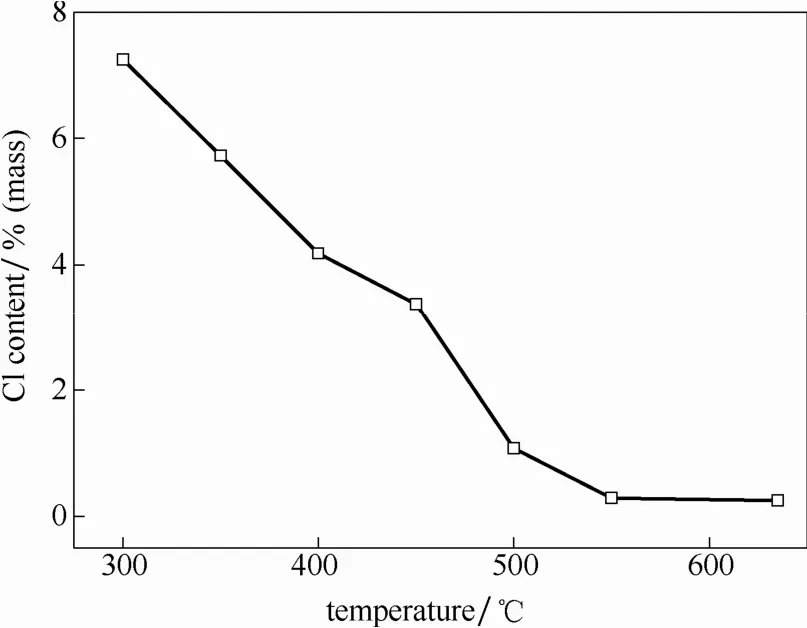
图3 不同水解温度下产物二氧化钛颗粒的氯含量Fig.3 Chlorine content of TiO2particle under different hydrolysis temperatures

图4 不同水解温度下产物二氧化钛颗粒的SEM图Fig.4 SEM images of TiO2particle under different hydrolysis temperatures
图4给出了不同水解温度下二氧化钛颗粒的SEM图片,从图4可以看出,随着水解温度的升高,二氧化钛颗粒的一次粒径逐渐减小。然而,当水解温度高于 450℃后,形成的二氧化钛颗粒球形度明显变差[图4(c)~4(d)]。而且二氧化钛颗粒之间产生了相互团聚现象,形成了较大的团聚物。团聚颗粒粒径范围在100~300 nm,分布不均匀。说明水解温度改变了产物的颗粒大小和形貌。进一步对二氧化钛颗粒进行了BET比表面积分析发现,随着水解温度的升高,二氧化钛颗粒的BET比表面积呈下降趋势(图5)。同时看出,在400℃处二氧化钛颗粒的BET比表面积存在一个明显下降台阶。结合图4中发生的团聚现象,说明二氧化钛颗粒BET比表面积的显著降低是由二氧化钛颗粒的团聚导致的。而这种团聚现象的发生将会影响气固传质效率[24],可能对后续二氧化钛颗粒煅烧脱氯造成不利影响。
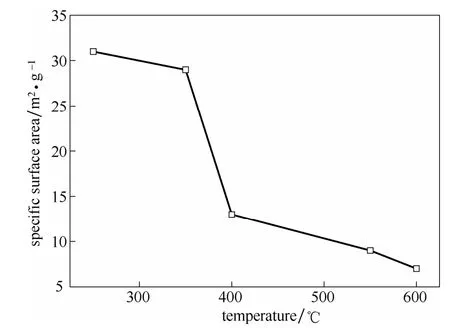
图5 不同水解温度下产物二氧化钛颗粒的比表面积Fig.5 Specific surface area of TiO2particle under different hydrolysis temperatures
2.2 煅烧处理
从前面分析可以得出,在 TiCl4水解过程中,残留的Cl是影响TiO2纯度的主要元素。因此,如何有效脱除产物中的Cl是制备高纯度TiO2的关键。文献[25-26]报道,四氯化钛的气相水解过程中,Cl主要以羟基氯化物的形式存在,如 TiOCl2、TiCl3OH、TiCl2(OH)2、TiCl(OH)3等。陈瑞澄[27]通过密度泛函理论计算了TiCl4水解过程,认为TiCl4水解是分布进行的,中间形成了多种羟基氯化钛中间物种,反应方程如下
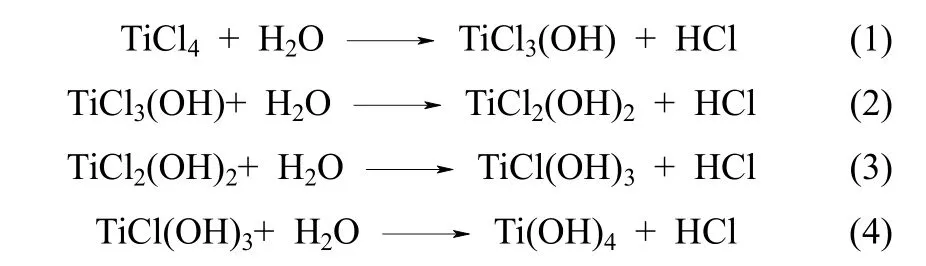
可以看出,TiO2中 Cl元素主要以多羟基氯化钛及HCl中氯离子形态存在[28]。因此,通过改变实验条件和对产物进行后处理减少产品中中间产物的含量是减少氯含量的有效途径。为此,重点研究了煅烧温度、气氛对脱除Cl的影响。
2.2.1 煅烧温度的影响 取250℃水解得到的TiO2颗粒,在400~1000℃下煅烧处理2 h,观察煅烧处理后产物的氯含量,结果如图6所示。可以看出,随着煅烧温度的升高,产物中Cl含量显著降低,从原来的7.22%(质量)降低到1000℃的0.02%(质量)。说明提高煅烧温度有利于脱除产物中残余的 Cl元素。然而,但是随着煅烧温度的升高,TiO2颗粒的粒径逐渐增加,特别是当煅烧温度>800℃时,TiO2颗粒直径显著增加(图7)。进而,随着 TiO2颗粒直径的增加,其比表面积明显降低(图7)。从对应的不同煅烧温度下TiO2颗粒的SEM图和TEM图(图8和图9)可以看出,TiO2颗粒在400和600℃煅烧2 h后依然能够保持球形结构。然而,当煅烧温度提高到 800℃时,TiO2颗粒的形状发生了明显变化,呈现出不规则多面体结构;当煅烧温度进一步提高到1000℃时,TiO2颗粒之间发生了明显的烧结现象。
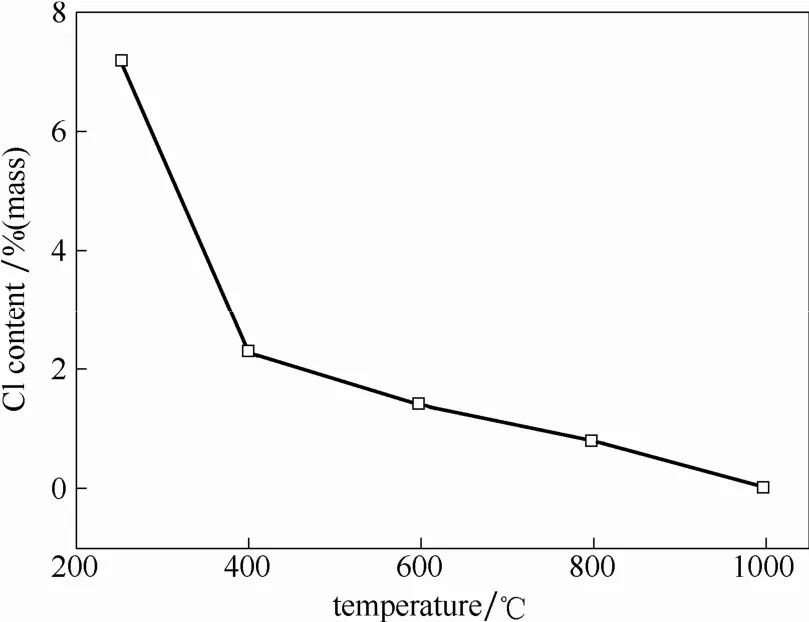
图6 不同煅烧温度处理后二氧化钛的Cl含量Fig.6 Chlorine content of TiO2after calcined treatment at different temperatures for 2 h
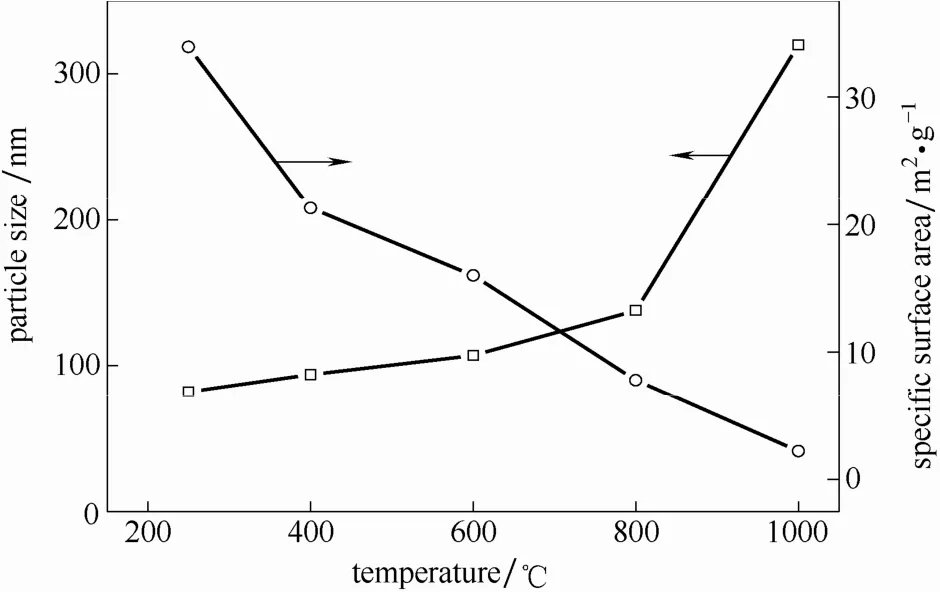
图7 不同煅烧温度处理后二氧化钛颗粒的粒径大小和比表面积Fig.7 Particle size and BET area of TiO2particles after calcined at different temperatures
从图9还可以看出,随着煅烧温度的升高,颗粒内部结构由多孔状疏松结构逐渐转变为致密结构,粒径从100 nm左右增大至300~500 nm。这与图7中的颗粒比表面积及粒径大小的变化规律一致。同时也表明,随着TiO2颗粒内部结构由多孔状疏松结构转变为致密结构,使其Cl含量不断降低。此外,对比煅烧前后TiO2颗粒的XRD谱图发现(图10),随着煅烧温度的升高,锐钛矿相谱峰强度增强,说明二氧化钛颗粒直径逐渐增加,这一结果与图8的结果一致。同时看到,当煅烧温度大于 600℃,出现了金红石型TiO2衍射峰,并且随着煅烧温度的升高,金红石型TiO2衍射峰逐渐增强。当温度为1000℃时,锐钛矿相TiO2谱峰消失,这说明此时TiO2晶体由锐钛矿相 TiO2已经完全转变为金红石相TiO2。以上结果表明,高温煅烧使TiO2颗粒内部结构和晶体结构发生变化,从而使得颗粒内部残余的多羟基氯化钛及HCl向外迁移,残余的多羟基氯化钛与水蒸气进一步接触反应转化为HCl,达到脱除Cl元素的目的。

图8 不同煅烧温度处理后二氧化钛的SEM图Fig.8 SEM images of TiO2particles after calcined at different temperatures

图9 不同煅烧温度处理后二氧化钛的TEM图Fig.9 TEM images of TiO2particles after calcinedat different temperatures

图10 不同煅烧温度处理后二氧化钛的XRD谱图Fig.10 XRD patterns of TiO2particles prepared at 250℃ and TiO2particles after calcined at different temperatures
2.2.2 煅烧气氛的影响 以上是在空气气氛下考察了煅烧温度对脱除Cl的影响,可以看出,高温煅烧能够促进二氧化钛的晶型和结构变化,从而使 Cl发生迁移而脱除。然而,煅烧温度过高导致了二氧化钛颗粒长大,并且发生了严重烧结。能否在较低温度下通过化学反应诱导二氧化钛的晶型和结构转变,进而使Cl脱除成为制备高纯二氧化钛的关键。为此,进一步考察了水蒸气、氢气气氛下煅烧处理对Cl脱除的影响,并与空气气氛进行了对比,结果列于表1中。可以看出,与空气煅烧比较,通入水蒸气和氢气能够显著提高Cl的脱除率。

表1 不同煅烧气氛下二氧化钛的Cl含量和Cl脱除率Table 1 Content and removal efficiency of Cl of TiO2powders obtained under different calcination atmosphere
在水蒸气气氛下,由于通入的水蒸气可与TiO2颗粒内残余的中间产物 TiCl3(OH)、TiCl2(OH)2、TiCl(OH)3反应使其转化为Ti(OH)4和HCl,从而有利于提高Cl的脱除率。进一步从空气煅烧和水蒸气煅烧处理后产物的SEM图可以看出(图11),两种处理条件下颗粒表面形貌没有发生明显变化。但从图12所示的XRD图中可以看出,与空气煅烧相比,在水蒸气存在下,其金红石晶型峰明显增强,说明水蒸气的存在促进了 TiO2晶型从锐钛矿型向金红石型转变。

图11 空气煅烧和水蒸气煅烧的后TiO2颗粒SEM图对比Fig.11 SEM images of TiO2powders after calcination with air and steam at different temperatures,respectively
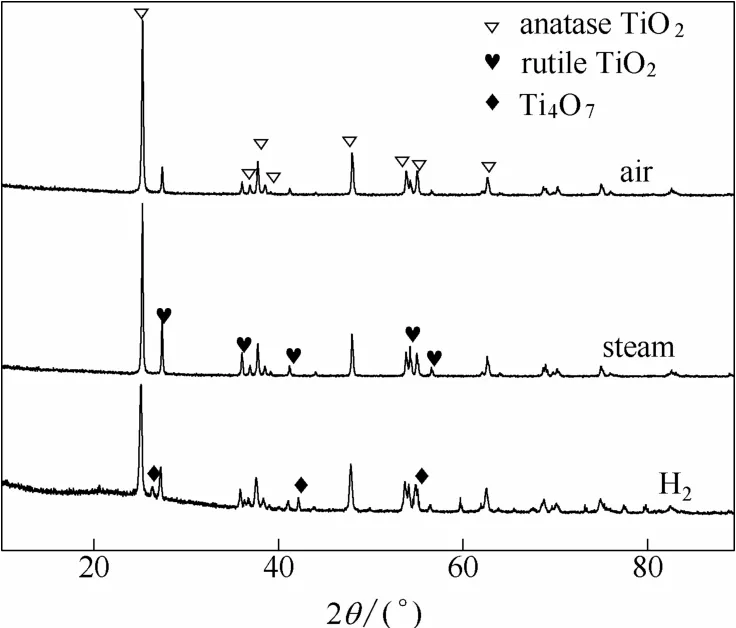
图12 空气煅烧和水蒸气煅烧后TiO2颗粒的XRD谱图比较Fig.12 XRD patterns of TiO2powders after calcination with different atmosphere at 800℃ for 2 h
与空气和水蒸气气氛比较,氢气气氛下的脱除Cl效果更好。采用氢气处理后的TiO2中Cl含量进一步降低到600℃时的1.48%(质量)和800℃时的0.24%(质量),Cl的脱除率分别提高到600℃时的69%和800℃时的95%(表1)。从图12可以看出,经过800℃氢气处理后TiO2的XRD谱图中除了含有锐钛矿和金红石二氧化钛的谱峰外,还出现了Magneli相Ti4O7衍射峰[29]。这说明经800℃氢气处理后,使二氧化钛的晶体结构发生了变化,部分二氧化钛失去了氧原子形成了Ti4O7。这种晶体结构变化有利于其晶体内部吸附的多羟基氯化钛及HCl的向外迁移,从而促进多羟基氯化钛和水蒸气反应而脱除Cl元素。实验过程中发现在800℃氢气处理后的二氧化钛由白色粉末变成了灰色粉末,该灰色粉末经氧化后可变为白色粉末[30]。
3 结 论
针对 TiCl4气相水解法制备二氧化钛中氯含量高的问题,采用流化床 TiCl4气相水解的方法制备二氧化钛粉体,进一步对比了空气、水蒸气和氢气气氛下煅烧后处理对 Cl脱除率的影响。结果表明TiO2内部结构对 Cl的脱除有重要影响,提高煅烧温度,改变了TiO2的表面形貌和内部结构,由多孔疏松结构转变为致密结构,有利于提高 Cl的脱除率;与空气煅烧比较,水蒸气气氛下的脱氯效率明显提高,主要原因是水蒸气与TiO2颗粒内残余的多羟基氯化物进一步反应,从而有利于提高Cl的脱除率;与空气和水蒸气煅烧比较,氢气气氛下可进一步提高Cl的脱除率,在800℃煅烧2 h后Cl的脱除率达到95%。主要归因于氢气还原TiO2使其晶型结构发生转变。流化床气相水解法可用于大批量制备高纯度的二氧化钛粉体,但高温下处理易使颗粒长大和团聚,还需要进一步开发低温高效脱氯的方法。
[1]MA T,AKUYAMA M,ABE E,et al.High-efficiency dye-sensitized solar cell based on a nitrogen-doped nanostructured titania electrode[J].Nano.lett.,2005,12(5): 2543-2547.
[2]廖永进,张亚平,余岳溪,等.MnOx/WO3/TiO2低温选择性催化还原 NOx机理的原位红外研究[J].化工学报,2016,67(12):5031-5039.LIAO Y J,ZHANG Y P,YU Y X,et al.In situFT-IR studies on low temperature NH3-SCR mechanism of NOxover MnOx/WO3/TiO2catalyst[J].CIESC Journal,2016,67(12): 5031-5039.
[3]刘芳,樊丰涛,吕玉翠,等.石墨烯/TiO2复合材料光催化降解有机污染物的研究进展[J].化工学报,2016,67(5): 1635-1643.LIU F,FAN F T,LÜ Y C,et al.Research progress on photocatalytic degradation of organic pollutants by graphene/TiO2composite materials[J].CIESC Journal,2016,67(5): 1635-1643.
[4]LIANG B,LI C,ZHANG C G,et al.Leaching kinetics of panzhihuailmenite in sulfuric acid[J].Hydrometallurgy,2005,76(3/4): 173-179.
[5]罗志强,杜剑桥.电子用高纯二氧化钛制备方法研究[J].涂料工业,2011,41(8): 31-38.LUO Z Q,DU J Q.Research on preparation of high-purity TiO2for electronic industry[J].Paint and Coatings Industry,2011,41(8):31-38.
[6]方世杰,徐明霞,纳米 TiO2光催化剂的制备方法[J].硅酸盐通报,2002,21(2): 38-42.FANG S J,XU M X.Preparation of nanocrystalline TiO2photocatalyst[J].Bulletin of the Chinese Ceramic Society,2002,21(2): 38-42.
[7]HANAOR D A H,CHIRONI I,KARATCHEVTSEVA I,et al.Single and mixed phase TiO2powders prepared by excess hydrolysis of titanium alkoxide[J].Advances in Applied Ceramics,2012,111(3):149-158.
[8]AKHTAR M K,XIONG Y,PRATSINIS S E.Vapor synthesis of titania powder by titanium tetrachloride oxidation [J].American Institute of Chemical Engineers,1991,37(10): 1561-1570.
[9]XIA B,LI W B,ZHANG B,et al.Low temperature vapor phase preparation of TiO2nanopowders[J].J.Mat.Sci.,1999,34(14):3505-3511.
[10]YEOM S M,KIM K H,SHIN D W,et al.Preparation and characterization of fine TiO2powders by vapor-phase hydrolysis of TiCl4[J].Journal of the Korean Ceramic Society,1992,29(7):525-532.
[11]JOHN A K,SAVITHRI S,SURENDER G D.Characterization of titania nanoparticles synthesized through low temperature aerosol process[J].Aerosol and Air Quality Research,2005,5(1): 1-13.
[12]ZHU X L,ZHANG Q,WANG Y,et al.Review on the nanoparticle fl uidization science and technology[J].Chinese J.Chem.Eng.,2016,24(1): 9-22.
[13]陆金东,陈爱平,马磊,等.流化床CVD法原位合成CNTs-Ni-TiO2及其光催化性能[J].化工学报,2012,63(4): 1070-1075.LU J D,CHEN A P,MA L,et al.Synthesis of CNTs-Ni-TiO2nanocomposites byin-situfluidized bed CVD and its photocatalytic activity[J].CIESC Journal,2012,63(4): 1070-1075.
[14]LI J,KONG J,ZHU Q S,et al.Efficient synthesis of iron nanoparticles by self-agglomeration in a fluidized bed[J].AIChE Journal[J].2017,63(2): 459-468.
[15]LI J,LIU X W,ZHOU L,et al.A two-stage reduction process for production of high purity ultrafine Ni particle in a micro-fluidized bed reactor[J].Particuology,2015,19(2): 27-34.
[16]LI J,ZHOU L,ZHU Q S,et al.Decoupling reduction-sulfurization synthesis of inorganic fullerene-like WS2nanoparticles in a particulately fluidized bed[J].Chem.Eng.J.,2014,249(1): 54-62.
[17]ZHANG Q,ZHAO M Q,HUANG J Q,et al.Mass production of aligned carbon nanotube arrays by fluidized bed catalytic chemical vapor deposition[J].Carbon,2010,48(4): 1196-1209.
[18]WANG C J,WANG T F,LI P L,et al.Recycling of SiCl4in the manufacture of granular polysilicon in a fluidized bed reactor[J].Chem.Eng.J.,2013,220(6): 81-88.
[19]PEAN D A,UPHADE B S,SMIMIOTIS P G.TiO2-supported metal oxide catalysts for low-temperature selective catalytic reduction of NO with NH3: evaluation and characterization of first row transition metals[J].J.Catal.,2004,221(2): 421-431.
[20]姜贵民,严继康,杨钢,等.TiO2晶型转变(AR)的影响因素[J].材料导报A,2016,30(10): 95-100.JIANG G M,YAN J K,YANG G,et al.Influencing factors of crystal phase transformation (AR) of TiO2[J].Materials Review A,2016,30(10): 95-100.
[21]唐爱东,任艳萍.二氧化钛催化剂晶型调控技术的研究进展[J].中国粉体技术,2010,16(3): 69-73.TANG A D,REN Y P.Recent advances in phase transition of titania cayalyst[J].China Powder Science and Technology,2010,16(3):69-73.
[22]MACKENZIE K J D,MELLING P J.The calcination of titania.Ⅱ.Influence of atmosphere on crystal growth in anatase powders [J].Trans.J.Br.Ceram.Soc.,1974,73(6): 179-183.
[23]刘秀红,赵尹,姜海波,等.扩散火焰法制备 TiO2纳米晶及其光催化活性[J].华东理工大学学报(自然科学版),2007,33(2):200-204.LIU X H,ZHAO Y,JIANG H B,et al.Preparation of TiO2nanocrystallite by co-flow diffusion flames and their photocatalytic activity [J].Journal of East China University of Science and Technology (Natural Science Edition),2007,33(2): 200-204.
[24]吕林英,蓝兴英,吴迎亚,等.FCC提升管反应器中颗粒聚团对裂化反应的影响[J].化工学报,2015,66(8): 2920-2928.LÜ L Y,LAN X Y,WU Y Y,et al.Effect of particles cluster on behavior of catalytic cracking reaction in FCC riser[J].CIESC Journal,2015,66(8): 2920-2928.
[25]JOHN A K,SAVITHRI S,KUNDUCHI P,et al.Density functional theory study of gas phase hydrolysis of titanium tetrachloride[J].Bull.Chem.Soc.Jpn.,2010,83(9): 1030-1036.
[26]LEE K R,KIM S J,SONG J S,et al.Effect of vapor pressure of H2O on the formation of nano-crystalline TiO2ultrafine powders[J].MRS Online Proceedings Library,1999,58(1): 33-39.
[27]陈瑞澄.四氯化钛水解过程的研究[J].湿法冶金,1999,71(3): 1-7.CHEN R C.Study on the hydrolysis of four titanium chloride[J].Hydrometallurgy of China,1999,71(3): 1-7.
[28]张煜昌.3D-TiO2-Ag复合材料对水体中碘离子的吸附性能研究[D].天津: 天津大学,2013.ZHANG Y C.A study on the adsorption properties of iodine ion on 3D-TiO2-Ag composites in water solution[D].Tianjin: Tianjin University,2013.
[29]ZHANG X Y,LIU Y,YE J W.Fabrication and characterisation of magneli phase Ti4O7nanoparticles[J].Micro & Nano Letters,2013,8(5): 251-253.
[30]操小鑫,陈亦琳,林碧洲,等.氧缺陷型 TiO2-x可见光催化性能的研究[J].无机材料学报,2012,27(12): 1301-1305.CAO X X,CHEN Y L,LIN B Z,et al.Study of the photocatalytic performance of oxygen-deficient TiO2active in visible light[J].Journal of Inorganic Materials,2012,27(12): 1301-1305.
Synthesis of high purity TiO2powders by fluidized gas hydrolysis
ZHAO Yuzhong1,2,SUN Jianjun2,LI Jun1,ZHU Qingshan1
(1State Key Laboratory of Multiphase Complex Systems,Institute of Process Engineering,Chinese Academic Sciences,Beijing100190,China;2College of Chemical Engineering,Beijing University of Chemical Technology,Beijing100029,China)
TQ 031.5
A
0438—1157(2017)10—3978—07
10.11949/j.issn.0438-1157.20170515
2017-05-02收到初稿,2017-07-06收到修改稿。
联系人:李军。
赵玉仲(1989—),男,硕士研究生。
国家自然科学基金项目(21325628,U1462128);国家重点基础研究发展计划项目(2015CB251402);国家重大科学仪器设备开发专项项目(2011YQ12003908)。
Received date:2017-05-02.
Corresponding author:LI Jun,junli@ipe.ac.cn
Foundation item:supported by the National Natural Science Foundation of China (21325628,U1462128),the National Basic Research Program of China (2015CB251402) and the National Special Project for Development of Major Scientific Equipment (2011YQ12003908).
