基于重测序的染色体片段代换系定位水稻抽穗期QTL
2017-10-14王军朱金燕陶亚军周勇范方军李文奇王芳权仲维功杨杰梁国华
王军 朱金燕 陶亚军 周勇 范方军 李文奇 王芳权 仲维功 杨杰,* 梁国华,*
基于重测序的染色体片段代换系定位水稻抽穗期QTL
王军1,2朱金燕2陶亚军1周勇1范方军2李文奇2王芳权2仲维功2杨杰2,*梁国华1,*
(1扬州大学江苏省粮食作物现代产业技术协同创新中心/教育部植物功能基因组学重点实验室, 江苏扬州 225009;2江苏省农业科学院粮食作物研究所/国家水稻改良中心南京分中心, 南京210014;*通讯联系人, E-mail:ricegb@yzu.edu.cn)
【目的】水稻的抽穗期是决定水稻产量及其适用性的重要农艺性状之一,是由多基因控制的数量性状。染色体片段代换系减少了个体间遗传背景的干扰,已经成为定位和克隆复杂性状QTL的重要材料。【方法】本研究以9311为受体,日本晴为供体构建的128个重测序的染色体片段代换系群体为试验材料,利用多元回归,结合Bin-map图谱,【结果】鉴定到6个在南京、扬州不同年份间稳定表达的抽穗期QTL,其中,被定位在第2染色体上的759 848 bp区间内;被定位在第2染色体上的45 286 bp区间内;被定位在第3染色体上的147 931 bp区间内;被定位在第5染色体上的213 351 bp区间内;被定位在第5染色体上的442 305 bp区间内;被定位在第8染色体上的538 176 bp区间内。【结论】本研究为精细定位并克隆相应QTL,进而探明抽穗期QTL的分子调控机制奠定了基础。
水稻;染色体片段代换系;重测序;抽穗期
水稻是全世界最重要的粮食作物之一,全球有超过100个国家种植水稻[1]。稻米为全世界人口提供了21%的热量和15%的蛋白质[1-2],为我国人口提供70%热量和65%的蛋白质[3],保障水稻产量对全世界尤其对我国粮食安全至关重要。抽穗期是水稻重要农艺性状之一,抽穗期通过决定营养生长期的长短,影响光合生产和物质积累,最终直接或间接地影响水稻的产量。水稻抽穗期受感光性、感温性和基本营养生长性的影响,三者相互作用决定了水稻品种对地域和季节的适应性。水稻抽穗期遗传基础较为复杂,一般认为抽穗期是由主效基因和微效多基因共同控制,遗传方式既有数量性状遗传特点,也有质量性状遗传特性,不同品种表现出不同的遗传特点,即使同一品种的抽穗期也会由于温光条件的不同而表现出不同的遗传方式[4]。
水稻品种的抽穗期长短由其内在的遗传发育机制和外在的环境因素(光照和温度)共同决定的,这使得水稻抽穗期的遗传机制非常复杂。截至目前,国内外的研究者利用F2/F3、BC1、DHs和RILs等传统群体发现了618个抽穗期相关的基因(QTL),分布于水稻全部12条染色体上,其中,只有20多个抽穗期相关基因(QTL)被克隆。究其原因是因为这些传统的定位群体内QTL之间存在较复杂的互作和个体间遗传背景的干扰,使对QTL的估计不准确,很难实现QTL的精细定位和克隆。染色体单片段代换系是利用分子标记辅助选择技术建立起来的一套近等基因系,与其受体亲本之间除代换片段存在差异外,其余部分均相同。通过比较染色体片段代换系与其受体亲本之间的性状差异,就可以定位到代换片段上的QTL。染色体片段代换系可以消除群体内遗传背景的干扰,将复杂性状分解为简单性状,已经成为复杂性状QTL精细定位与克隆的最主要群体。在利用染色体片段代换系进行抽穗期QTL定位研究方面,Qiao等[5]利用198个9311为受体,普通野生稻为供体的染色体片段代换系定位了3个抽穗期相关QTL,位于第2和第10染色体上。Shen等[6]利用1套Zhenshan 97为受体,Minghui 63为供体的染色体片段代换系定位了12个抽穗期相关的QTL,分布在除了第5、10染色体外的其余10条染色体上。王军等[7]利用广陆矮4号为受体,日本晴为供体的85个染色体单片段代换系在南京和海南不同温光条件下共定位到40个抽穗期相关的QTL,分布于水稻的全部12条染色体上。杨德卫等[8]利用9311为受体,日本晴为供体构建的94个染色体片段置换系定位了4个控制水稻抽穗期的QTL,分别位于第3、第4、第5和第8染色体。王韵等[9]利用Lemont和特青的双向回交导入系群体在北京和海南2个环境下共定位了16个影响抽穗期的QTL,其中6个QTL在2个环境下都能检测到。何凤华等[10]以华粳籼74为受体,6个水稻品种为供体的52个单片段代换系鉴定出20个抽穗期QTL,这些QTL分布于水稻除第5、第6染色体外的10条染色体上。
染色体片段代换系大大提高了QTL定位的精确度,但由于染色体片段代换系构建是建立在分子标记检测的基础上,分子标记数量的有限性、分布的不均匀性及双交换等问题的存在,可能导致一些小片段漏检从而使得QTL定位不准确。本实验室在前期研究中,分别以全基因组测序的籼稻品种9311、粳稻品种日本晴为受体和供体,构建了一套染色体单片段代换系群体并借助高通量全基因组重测序的方式对所有染色体片段代换系进行了精确的基因型鉴定[11],所选用的材料遗传背景清晰,导入片段和背景片段大小已知,可以准确地用于QTL定位研究。本研究利用这一套重测序的染色体片段代换系,于2012、2016年在扬州、南京共定位了6个稳定表达的抽穗期QTL,为进一步精细定位并克隆相应的QTL和选育适宜生育期的优质水稻新品种提供理论依据。
1 材料与方法
1.1 供试材料
以籼稻品种9311为受体亲本,粳稻品种日本晴为供体亲本,在回交和自交过程中利用覆盖水稻全基因组分子标记进行辅助选择,构建的128个染色体片段代换系及受体亲本9311、供体亲本日本晴为试验材料。参考Huang等[12]的方法,通过高通量测序,对128个染色体片段代换系进行了重测序,每一个系的代换片段在染色体上的位置及长度都准确获知,代换片段在水稻全基因组的覆盖率为93.3%。
1.2 试验方法
分别于2012年5月5日在扬州大学试验农场(E1);2016年5月15日在江苏省农业科学院院部试验田(E2)、5月5日在扬州大学试验农场(E3) 3个生长环境种植128个染色体片段代换系群体以及2个亲本。分别于6月5日、6月15日、6月5日进行移栽,每个系栽4行,每行15株,行、株距分别为26.7 cm和13.3 cm。3个环境下均种植对照,对照在田间均匀分布,每隔30个染色体片段代换系种植一个轮回亲本9311作为对照小区,间比法顺序排列。选取每个小区的中间2行的10株作为调查对象。在水稻刚开始抽穗的时候,调查每一株的最早穗的见穗日期,每天调查一次。抽穗期为从播种期到抽出第一个穗的天数。
1.3 QTL分析
Bin-map的制作参考Paran等[13]。对于整个群体而言,代换片段存在重叠区段,根据重叠和非重叠的区段,将供体片段切割并编码,每一个切割后的小区段称为Bin,根据整个群体的Bin信息绘制覆盖基因组的Bin-map。根据128个染色体片段代换系的测序物理图谱及代换片段的切割信息,绘制了代换片段的Bin-map,总共包括401个Bin,定义为X1~X401。Bin的长度为13 213~10 654 035 bp,平均长度为889 652 bp。QTL分析利用多元回归分析方法,参考Xu等[11]的方法,结合Bin-map,每一个Bin作为一个变量,利用方差分析精确估计误差,提高遗传分析效率,采用多元回归实现QTL的精确定位,回归模型如下:

y为第系的性状平均值;0为模型均值;是bin的总数;b为第个bin的偏回归系数;x为第个体第个bin基因型的指示变量,依bin的基因型来源不同而取值,来自供体的bin取-1,来自受体亲本的bin取1;e为随机误差。
1.4 QTL效应分析
QTL加性效应值的计算,参照Eshed等[14]的方法估算各个QTL 的加性效应值及加性效应贡献率。加性效应值=(片段代换系的表型值-9311的表型值)/2;加性效应百分率=(加性效应值/9311的表型值)×100%。QTL的命名依照McCouch等[15]。
2 结果与分析
2.1 亲本及128个染色体片段置换系的抽穗期
128个染色体片段代换系2012年在扬州(E1)的抽穗期为82.7~133.6 d(图1-A);受体亲本9311的抽穗期为(108.0±1.2) d,供体亲本日本晴的抽穗期为(97.7±1.3) d(图1-D),亲本间抽穗期差异达到极显著水平(<0.01)。128个染色体片段代换系2016年在南京(E2)的抽穗期为80.1~122.6 d(图1-B);受体亲本9311的抽穗期为(99.1±1.5) d,供体亲本日本晴的抽穗期为(86.1±1.2) d(图1-D),亲本间抽穗期差异达到极显著水平(<0.01)。128个染色体片段代换系2016年在扬州(E3)的抽穗期为75.2~120.8 d(图1-C);受体亲本9311的抽穗期为(98.1±1.3) d,供体亲本日本晴的抽穗期为(88.6±1.5) d(图1-D),亲本间抽穗期差异达到极显著水平(<0.01)。
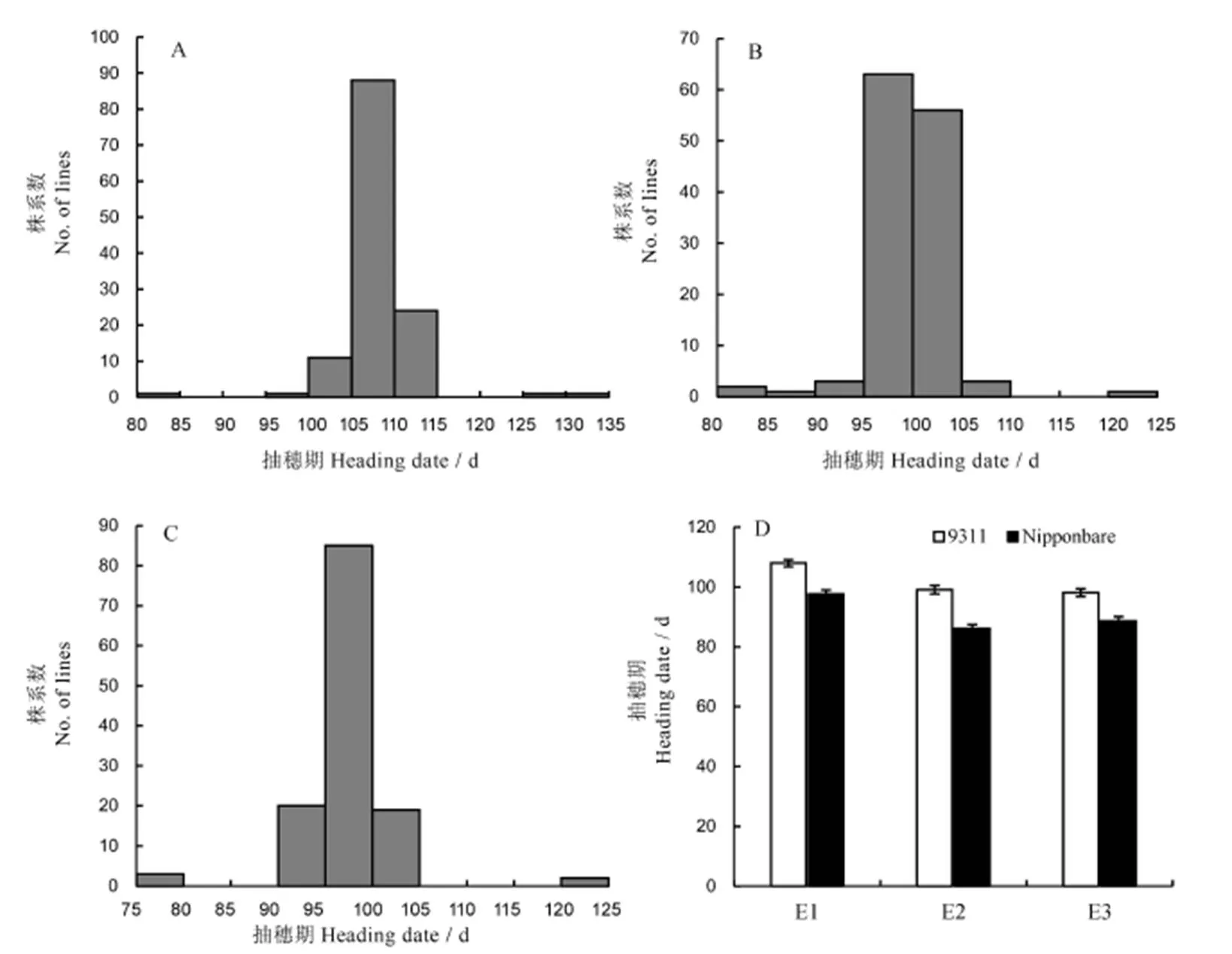
A-E1环境中抽穗期分布; B-E2环境中抽穗期的分布; C-E3环境中抽穗期的分布; D-9311日本晴在不同环境中抽穗期的表型。
Fig. 1. Distribution of heading date in the chromosome segment substitution lines and parents in different environments.
2.2 抽穗期QTL分析
根据128个染色体片段代换系和9311抽穗期的表型值,结合Bin的图谱,基于多元回归分析方法,共定位到6个在3个环境中均能被检测到的QTL(表1)。其中,第2和第5染色体上各有2个;第3和第8染色体上各有1个。被定位在第2染色体上的759 848 bp区间内;被定位在第2染色体上的45 286 bp区间内。这两个QTL位于相邻区间。被定位在第3染色体上的147 931 bp区间内;被定位在第5染色体上的213 351 bp区间内;被定位在第5染色体上的442 305 bp区间内;被定位在第8染色体上的538 176 bp区间内。
2.3 抽穗期QTL效应分析
对128个重测序片段进行分析,获得了6个抽穗期QTL中5个抽穗期的单片段代换系。利用这5个染色体单片段代换系对QTL效应进行分析(表2)。表现为减效作用,在3个环境中加性效应分别为-11.5、-7.2和-10.5 d,加性效应百分率分别为-10.7%、-7.3%和-10.7%。表现为减效作用,在3个环境中加性效应分别-4.4、 -3.1和-3.6 d,加性效应百分率分别为-3.8%、-3.1%和-3.7%。表现为增效作用,在3个环境中加性效应分别1.4、2.5和1.6 d,加性效应百分率分别为1.3%、2.5%和1.6%。表现为增效作用,在3个环境中加性效应分别12.8、3.0和11.3 d,加性效应百分率分别为11.9%、3.0%和11.5%。表现为减效作用,在3个环境中加性效应分别-12.7、-8.4、-11.5 d,加性效应百分率分别为-11.7%、-8.5%和-11.7%。
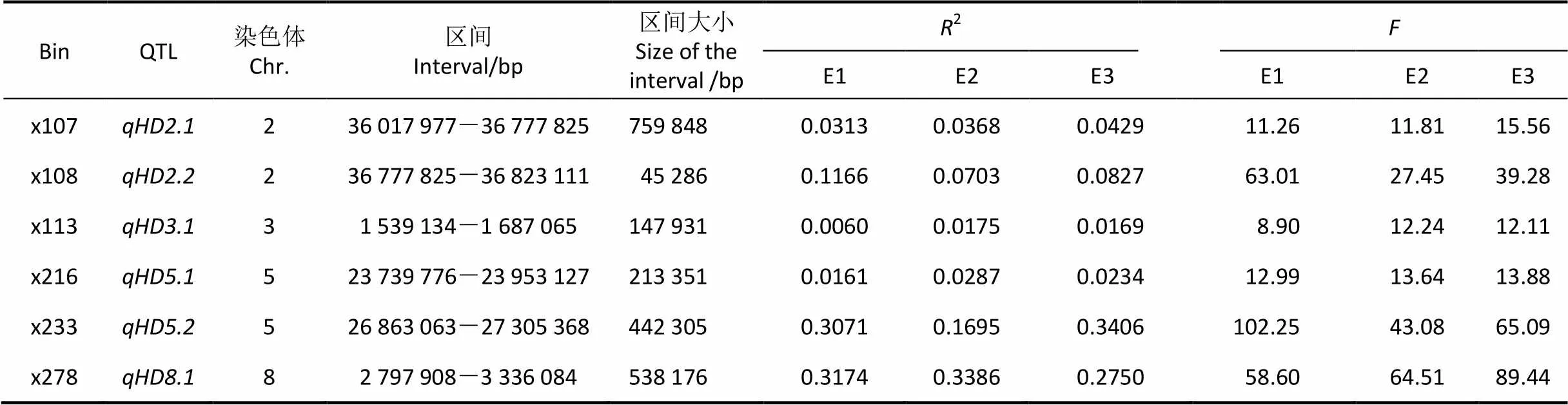
表1 抽穗期 QTL的定位
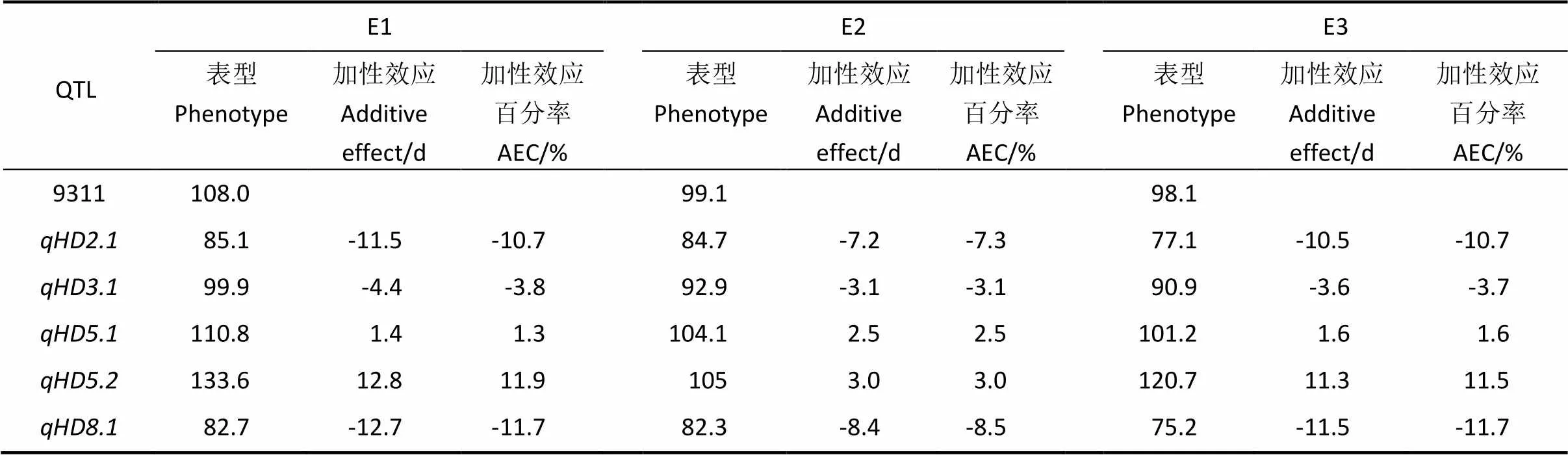
表2 不同环境中抽穗期QTL效应分析
AEC, Additive effect contribution.
3 讨论
水稻产量、品质、抗性等重要农艺性状都是由数量性状控制的,研究这些数量性状的遗传机制对于水稻遗传育种具有非常重要的意义。用于数量性状基因位点定位的群体包括传统定位群体和次级群体。传统定位群体主要包括F2、F3、BC1、DH、RILs等,是将2个遗传差异很大的原始亲本相互杂交而建立的分离群体,其特点是全基因组均发生分离,但QTL之间存在较复杂的互作和个体间遗传背景的干扰。次级群体主要包括染色体片段代换系、近等基因系、导入系等,是在传统群体的基础上,通过回交结合分子标记辅助选择构建的群体,其特点是与其受体亲本之间只存在导入片段的差异,从而可以消除群体内遗传背景的干扰,将复杂性状分解为简单性状。Yano等[16]利用日本晴和Kasalath杂交后不同的后代群体控制水稻抽穗QTL进行研究,发现次级群体检出的目标抽穗期QTL数量多于传统的定位群体,究其原因主要是由于遗传背景的干扰,大效应QTL对小效应QTL的掩盖作用,传统的定位群体很难检测到效应小的QTL;另一个原因可能是因为QTL上位性互作效应的影响;次级群体在相似的遗传背景下对数量性状的QTL进行分析,消除了大部分遗传背景的干扰,提高了分析的灵敏度,检出了较多的QTL。
在利用次级群体进行抽穗期QTL精细定位和克隆研究方面,周勇等[17]利用染色体单片段代换系及其衍生群体将精细定位在第8染色体上的S8111和S849之间约59.9 kb的区间内。Pei等[18]利用染色体单片段代换系构建的F2及其衍生群体将定位在第8染色体上的RM22492 和 P23之间26 kb区间内。Wang等[19]利用染色体单片段代换系及其衍生的分离群体将精细定位在第4染色体上的WB05和WB06之间约20.7 kb的区间内,该区间内共有3个候选基因。Yano等[20-21]利用日本晴为受体亲本,Kasalath为供体的近等基因系构建分离群体,精细定位并克隆了编码产物包含395个氨基酸,含有锌指结构域,是拟南芥带有锌指结构域的家族的一员。在以日本晴为受体亲本,Kasalath为供体亲本的高世代回交群体中精细定位并克隆了抽穗期QTL,编码酪蛋白激酶CK2的α亚基,日本晴的等位基因可以看作是一个自然发生的座位上的CK2α无效突变。与水稻光周期敏感性有关,来自Kasalath的等位基因在长日照和自然生长条件下延迟水稻抽穗,而在短日照下则不能延迟水稻抽穗[22-23]。Hori等[24]分别利用日本晴、Koshihikari为受体,Koshihikari和日本晴为供体构建了抽穗期QTL,编码酪蛋白激酶CKI,长日条件下通过磷酸化,从而增强其功能来下调和其下游基因如和的转录水平,最终延迟开花。[25]利用以Kitaake为背景导入PA64S片段的38个近等基因系克隆到抽穗期QTL。控制水稻光周期敏感性和谷粒产量的主效遗传位点,编码一个PRR(pseudo-response regulator)蛋白,其表达受到光周期调控。
染色体片段代换系大大提高了QTL定位的准确性和精确性,但由于分子标记数目的有限性和染色体双交换的客观存在,基于分子标记检测来确定代换系的遗传背景和代换片段的信息总是有限的,有可能造成QTL定位的误差。随着新一代测序技术的快速发展,通过全基因组重测序,准确鉴定染色体片段代换系的遗传背景和代换片段的信息,绘制基于染色体片段的覆盖基因组的Bin-map图谱,实现QTL精确定位。
本实验室对籼稻品种9311为受体、粳稻品种日本晴为供体构建的128个染色体片段代换系进行高通量全基因组重测序,根据测序物理图谱及代换片段的切割信息,绘制了包含401个Bin的代换片段Bin-map图谱,利用该套重测序的染色体片段代换系群体准确定位了8个粒形相关的QTL和14个剑叶形态相关的QTL[26-27]。本研究利用这个染色体片段代换系群体在扬州和南京2个环境,不同年份对水稻抽穗期进行鉴定,定位了6个在不同地区和年度间稳定表达的抽穗期QTL,并将他们界定到具体的染色体区段上。根据整合分子标记的物理图谱,对本研究定位到的抽穗期QTL与前人研究结果进行比较,发现与王军等[7]定位的抽穗期QTL、Lee等[28]定位的抽穗期QTL在同一染色体区段上;与王军等[7]定位的抽穗期QTL在相同的染色体区段上;与王军等[28]定位的抽穗期QTL、何凤华等[10]定位的抽穗期QTL、张永生等[29]定位的抽穗期QTL、Pei等[18]定位的抽穗期QTL在相同或位置相近的染色体区段上。与前人相比,利用重测序构建的染色体片段代换系Bin-map图谱可以将QTL定位在更小的区段内,本研究中的6个抽穗期QTL被定位在45~760 kb的区段内,其中被定位在第2染色体上约45 kb区间内;被定位在第3染色体上约148 kb区间内;被定位在第5染色体上约213 kb区间内,这充分证明了重测序染色体片段代换系群体在QTL鉴定和定位方面的优势。利用带有目标QTL的染色体片段代换系与受体亲本9311杂交,构建F2及其衍生分离群体,有望快速实现这些QTL的精细定位和克隆,为进一步探明抽穗期QTL的调控机制奠定基础。
[1] Fitzgerald M A, McCouch S R, Hall R D. Not just a grain of rice: the quest for quality.Trends Plant Sci, 2009, 14(3): 133-139.
[2] Miura K, Ashikari M, Matsuoka M. The role of QTLs in the breeding of high-yielding rice. Trends Plant Sci, 2011, 16(6): 319-326.
[3] 谢新华, 肖昕, 李晓方, 刘邻渭. 稻米蛋白质的研究进展. 广东农业科学, 2003, 30(6): 2-4.
Xie X H, Xiao X, Liu X F. Research progress on rice protein. Guangdong Agric Sci, 2003, 30(6): 2-4. (in Chinese)
[4] 胡时开, 苏岩, 叶卫军, 郭龙彪. 水稻抽穗期遗传与分子调控机理研究进展. 中国水稻科学, 2012, 26(3): 373-382.
Hu S K, Su Y, Ye W J, Guo L B. Advances in Genetic analysis and molecular regulation mechanism of heading date in rice (L.)., 2012, 26(3): 373-382. (in Chinese with English abstract)
[5] Qiao W H, Qi L, Cheng Z J, Su L, Li J, Sun Y, Ren J F, Zheng X M, Yang Q W. Development and characterization of chromosome segment substitution lines derived fromin the genetic background ofspp.cultivar 9311., 2016, 17(1): 580-591.
[6] Shen G J, Xing Y Z. Two novel QTLs for heading date are identified using a set of chromosome segment substitution lines in rice (Oryza sativa L.). J Genet Genomics, 2014, 41(12): 659-662.
[7] 王军, 朱金燕, 周勇, 杨杰, 范方军, 李文奇, 王芳权, 仲维功, 梁国华. 不同温光条件下水稻抽穗期QTL的定位与分析. 中国水稻科学, 2016, 30(3): 247-255.
Wang J, Zhu J Y, Zhou Y, Yang J, Fan F J, Li W Q, Wang F Q, Zhong W G, Liang G H. QTL analysis for heading date in rice (L.) under different temperatures and light intensities., 2016, 30(3): 247-255. (in Chinese with English abstract)
[8] 杨德卫, 张亚东, 朱镇, 赵凌, 林静, 陈涛, 朱文银, 王才林. 基于CSSL的水稻抽穗期QTL定位及遗传分析. 植物学报, 2010, 45 (2): 189-197.
Yang D W, Zhang Y D, Zhu Z, Zhao L, Lin J, Chen T, Zhu W Y, Wang C L. Mapping and genetic analysis of quantitative trait loci for heading date with chromosome segment substitution lines in, 2010, 45 (2): 189-197. (in Chinese with English abstract)
[9] 王韵, 程立锐, 孙勇, 周政, 朱苓华, 徐正进, 徐建龙, 黎志康. 利用双向导入系解析水稻抽穗期和株高QTL及其与环境互作表达的遗传背景效应. 作物学报, 2009, 5(8): 1386-1394.
Wang Y, Cheng L R, Sun Y, Zhou Z, Zhu L H, Xu Z J, Xu J L, Li Z K.Genetic background effect on QTL Expression of heading date and plant height and their interaction with environment in reciprocal introgression lines of rice., 2009, 5(8): 1386-1394. (in Chinese with English abstract)
[10] 何风华, 席章营, 曾瑞珍, Akshay T, 张桂权. 利用单片段代换系定位水稻抽穗期QTL. 中国农业科学, 2005, 38(8): 1505-1513.
He F H, Xi Z Y, Zeng R Z, Akshay T, Zhang G Q. Mapping of heading date QTLs in rice (L.) using single segment substitution lines.2005, 38(8): 1505-1513. (in Chinese with English abstract)
[11] Xu J J, Zhao Q, Du P N, Xu C W, Wang B H, Feng Q, Liu Q Q, Tang S Z, Gu M H, Han B, Liang G H. Developing high throughput genotyped chromosome segment substitution lines based on population whole-genome re-sequencing in rice (L.)., 2010, 11(1): 656-670.
[12] Huang X H, Feng Q, Qian Q, Zhao Q, Wang L, Wang A H, Guan J P, Fan D L, Weng Q J, Huang T, Dong G J, Sang T, Han B. High-throughput genotyping by whole-genome resequencing., 2009, 19(6): 1068-1076.
[13] Paran I, Zamir D. Quantitative traits in plants: beyond the QTL., 2003, 19(6): 303-306.
[14] Eshed Y, Zamir D. An introgression line population ofin the cultivated tomato enables the identification and fine mapping of yield-associated QTL., 1995, 141(3): 1147-1162.
[15] McCouch S R, CGSNL. Gene nomenclature system for rice., 2008, 1(1): 72-84.
[16] Yano M, Kojima S, Takahashi Y, Lin H X, Sasaki T. Genetic control of flowering time in rice, a short-day plant., 2001, 127(4): 1425-1429.
[17] 周勇, 崔国昆, 张言周, 关成冉, 常思源, 顾铭洪, 梁国华. 水稻抽穗期主效QTL的精细定位. 中国水稻科学, 2012, 26(1): 43-48.
Zhou Y, Cui G K, Zhang Y Z, Guan C R, Chang S Y, Gu M H, Liang G H. Fine mapping of a major QTLfor heading date in rice., 2012, 26(1): 43-48. (in Chinese with English abstract)
[18] Pei C G, Liu X, Wang W Y, Ding H F, Jiang M S, Li G X, Zhu C X, Wen F J, Yao F Y. Fine mapping of, a QTL controlling the heading date, to a 26-kb DNA fragment in rice (L.)., 2011, 54(3): 190-198.
[19] Wang B B, Zhu C X, Liu X, Wang W Y, Ding H F, Jiang M S, Li G X, Liu W, Yao F Y. Fine mapping of, a QTL controlling the heading date, to a 20.7-kb DNA fragment in rice (L.)., 2011, 29(3): 702-713.
[20] Yano M, Harushima Y, Nagamura Y, Kurata N, Minobe Y, Sasaki T. Identification of quantitative trait loci controlling heading date in rice using a high-density linkage map., 1997, 95(7): 1025-1032.
[21] Yano M, Katayose Y, Ashikari M, Yamanouchi U, Monna L, Fuse T, Baba T, Yamamoto K, Umehara Y, Nagamura Y, Sasaki T., a major photoperiod sensitivity quantitative trait locus in rice, is closely related to theflowering time gene., 2000, 12(12): 2473-2484.
[22] Yamamoto T, Lin H X, Sasaki T, Yano M. Identification of heading date quantitative trait locusand characterization of its epistatic interactions within rice using advanced backcross progeny., 2000, 154(2): 885-891.
[23] Takahashi Y, Shomura A, Sasaki T, Yano M., a rice quantitative trait locus involved in photoperiod sensitivity, encodes the α subunit of protein kinase CK2., 2001, 98(14): 7922-7927.
[24] Hori K, Ogiso-Tanaka E, Matsubara K, Yamanouchi U, Ebana K, Yano M., a gene for casein kinase I, is involved in the control of rice flowering time by modulating the day-length response., 2013, 76(1): 36-46.
[25] Gao H, Jin M N, Zheng X M, Chen J, Yuan D Y, Xin Y Y, Wang M Q, Huang D Y, Zhang Z, Zhou K N, Sheng P K, Ma J, Ma W W, Deng H F, Jiang L, Liu S J, Wang H Y, Wu C Y, Yuan L P, Wan J M., a major quantitative locus determining photoperiod sensitivity and regional adaptation in rice., 2014, 111(46): 16337-16342.
[26] 徐建军, 赵强, 汤在祥, 赵元凤, 朱磊, 徐辰武, 顾铭洪, 韩斌, 梁国华. 利用重测序的染色体片段代换系群体定位水稻粒型QTL. 中国水稻科学, 2011, 25(4): 365-369.
Xu J J, Zhao Q, Tang Z X, Zhao Y F, Zhu L, Xu C W, Gu M H, Han B, Liang G H. Mapping of QTLs for grain shape using wholegenome resequenced chromosome segment substitution lines in rice., 2011, 25(4): 365-369. (in Chinese with English abstract)
[27] 徐建军, 赵强, 赵元凤, 朱磊, 徐辰武, 顾铭洪, 韩斌, 梁国华. 利用重测序的水稻染色体片段代换系群体定位剑叶形态QTL. 中国水稻科学, 2011, 25(5): 483-487.
Xu J J, Zhao Q, Zhao Y F, Zhu L, Xu C W, Gu M H, Han B, Liang G H. Mapping of QTLs for flag leaf shape using whole genome re-sequenced chromosome segment substitution lines in rice., 2011, 25(5): 483-487. (in Chinese with English abstract)
[28] Lee S, Jia M H, Jia Y L, Liu G. Tagging quantitative trait loci for heading date and plant height in important breeding parents of rice ()., 2014, 197(2):191-200.
[29] 张永生, 江玲, 刘喜, 陈亮明, 刘世家, 翟虎渠, 万建民. 控制水稻品种Koshihikari抽穗期的数量性状位点. 作物学报, 2008, 34(11): 1869-1876.
Zhang Y S, Jiang L, Liu X, Chen L M, Liu S J, Zhai H Q, Wan J M. Quantitative trait loci for rice heading time in Koshihikari., 2008, 34(11): 1869-1876. (in Chinese with English abstract)
Mapping of QTLs for Heading Date Using Whole-genome Re-sequenced Chromosome Segment Substitution Lines in Rice
WANG Jun1,2, ZHU Jinyan2, TAO Yajun1, ZHOU Yong1, FAN Fangjun2, LI Wenqi2, WANG Fangquan2, ZHONG Weigong2, YANG Jie2,*, LIANG Guohua1,*
(1Jiangsu Co-Innovation Center for Modern Production Technology of Grain Crops/Key Laboratory of Plant Function Genomics, Ministry of Education Yangzhou University, Yangzhou 225009, China;2Institute of Food Crops, Jiangsu Academy of Agricultural Sciences/Nanjing Branch of Chinese National Center for Rice Improvement, Nanjing 210014, China;*Corresponding author, E-mail: ricegb@yzu.edu.cn)
【Objective】Heading date is an important agronomic trait in rice, it is a typical quantitative trait controlled by multiple genes. As novel research material, chromosome segment substitution lines are useful in QTL fine mapping and cloning because of minimizing the interference of genetic background among plants. 【Method】In this study, 128 whole-genome re-sequenced chromosome segment substitution lines derived from Nipponbare as donor parent in the background of 9311, were used for mapping QTLs for heading date by combining the sequencing-based Bin-map with multiple linear regression analysis. 【Result】Six QTLs for heading date were identified in two environments and two years.was mapped in the region of 759848 bp on the chromosome 2;was mapped in the region of 45286 bp on the chromosome 2;was mapped in the region of 147931 bp on the chromosome 3;was mapped in the region of 213351 bp on the chromosome 5;was mapped in the region of 442305 bp on the chromosome 5;was mapped in the region of 538176 bp on the chromosome 8. 【Conclusion】The results are important for the QTLs cloning and providea foundation for understanding molecular regulation mechanism of heading date in rice.
rice; chromosome segment substitution lines; re-sequenced; heading date
10.16819/j.1001-7216.2017.7017
Q343.1+5; S511.01
A
1001-7216(2017)04-0364-07
2017-02-08;
国家973计划资助项目(2013CBA01405);公益性行业科研专项(201303102);江苏省现代农业重点研发项目(BE2015355,BE2015341); 扬州市农业前瞻性研究资助项目(YZ2014165)。
修改稿收到日期:2017-03-08。
