水稻干尖线虫的环介导恒温扩增技术(LAMP)快速检测方法
2017-07-31白宗师秦萌赵立荣韩玉春王东伟徐春玲谢辉
白宗师 秦萌 赵立荣 韩玉春 王东伟 徐春玲 谢辉, *
水稻干尖线虫的环介导恒温扩增技术(LAMP)快速检测方法
白宗师1秦萌2赵立荣3韩玉春4王东伟1徐春玲1谢辉1, *
(1华南农业大学农学院植物线虫研究室/植物检疫线虫检测与防疫研究中心,广州 510642;2全国农业技术推广服务中心,北京100125;3广东出入境检验检疫局检验检疫技术中心植物检疫实验室,广州510623;4海南出入境检验检疫局热带植物隔离检疫中心,海口 570311;*通讯联系人,E-mail:xiehui@scau.edu.cn)
【目的】本研究旨在为水稻干尖线虫(Christie, 1942)的快速检测鉴定和早期诊断提供一个新的检测方法。【方法】利用水稻干尖线虫18S核糖体RNA基因,设计了水稻干尖线虫LAMP的特异引物,该引物包括1对外引物、1对内引物和1对环引物,以LAMP特异引物对待测样品DNA进行恒温扩增,扩增产物通过电泳法和荧光染料法进行检测,电泳检测出现阶梯状条带或加入荧光染料显现绿色荧光,则证明待检样品中含有水稻干尖线虫。【结果】本方法可以检测鉴定水稻干尖线虫不同虫态(雌虫、雄虫、幼虫或卵)的个体,可以从多种线虫混合的样品和植物组织样品中直接检测出水稻干尖线虫,检测灵敏度达到1/1000条虫DNA。【结论】本检测方法具有准确、灵敏、稳定和结果直观的优点,且操作简便、实用性强。
水稻干尖线虫;LAMP;快速检测;灵敏度
水稻干尖线虫(Christie, 1942)是一种寄生在植物地上部,并引起危害的一种叶线虫,最初在草莓上发现,之后发现该线虫导致水稻发生干尖病。水稻干尖线虫能寄生200多种植物,每年为害水稻造成约16亿美元的严重损失[1]。水稻干尖线虫是种传作物病原线虫,广泛分布于世界大多数水稻种植区[2-3],造成水稻田间产量损失10%~30%,为害严重的减产高达50%以上[4-5]。在20世纪40年代,水稻干尖线虫由日本传入中国。在20世纪50-60年代,我国水稻干尖线虫病发生严重,被列为检疫线虫[6],后因采取严格检疫和种子处理措施,该病害在20世纪80年代基本受到控制。但是近10多年,该病害的发生范围和为害严重度又开始加大,目前在我国主要稻区均有分布,局部地区发生和为害严重[2, 7-10]。
水稻干尖线虫的形态学鉴定主要根据雌虫的体长、侧线数、后阴子宫囊长、尾部形态和雄虫的交合刺长[11]。这些特征需要用高倍显微镜才可以观察到,并且卵和幼虫均不适用于用形态学方法鉴定。此外,水稻干尖线虫所隶属的滑刃属()有100多个种,虫体都非常细小,长度通常只有0.2~1.3 mm,根据形态学特征鉴定大量相似的滑刃属线虫的种类非常困难[12]。因此,研究和使用分子生物学方法快速准确地检测鉴定水稻干尖线虫是非常有必要的。目前已有根据水稻干尖线虫的rDNA-ITS序列,设计水稻干尖线虫的特异性引物,利用PCR技术对水稻干尖线虫进行分子鉴定的方法[13],该方法具有准确、灵敏的优点,但仍然存在着一定的限制。比如需要用精密的PCR仪,检测过程复杂、时间较长,结果必须通过琼脂糖凝胶电泳检测才可以判定,不能满足口岸和调运检疫以及田间监测的需求。
环介导恒温扩增技术(Loop-mediated isothermal amplication, LAMP)是2000年开发的一种新型循环恒温扩增技术[14]。该技术具有特异性强、灵敏度高、扩增速度快、对实验设备要求低以及检测结果易于观察等特点[15]。LAMP技术的出现为病原微生物的检测提供了一种方便快捷的途径[16-21]。目前已报道将LAMP应用于检测松材线虫()[22-23]、象耳豆根结线虫()[24]、禾谷胞囊线虫()[25]、香蕉穿孔线虫()[26]、北方根结线虫()[27]和苹果根结线虫()[28]等植物线虫。本研究基于水稻干尖线虫的18S核糖体RNA基因设计了对该种线虫进行LAMP的特异引物,并利用所设计的LAMP引物研究建立了具有特异性强、稳定性好、灵敏度高和可操作性强的水稻干尖线虫LAMP检测方法。
1 材料与方法
1.1 材料
1.1.1 供试线虫和植物材料
供试线虫包括26个水稻干尖线虫()种群(表1)和菊花叶枯线虫()种群,以及滑刃属线虫未定种1(sp. 1)、滑刃属线虫未定种2(sp. 2)、松材线虫()、水稻潜根线虫()、南方根结线虫()和香蕉穿孔线虫()。其中,除了水稻潜根线虫和滑刃属线虫未定种种群是直接从华南农业大学实验田中采集土壤分离获得以外,其他线虫均是本实验室培养保存。新鲜胡萝卜购买于市场,水稻叶片采集于田间。
1.1.2 供试试剂及配制
LAMP试剂盒、钙黄绿素、SYRB Green Ⅰ荧光染料及其他相关试剂均购自广州东胜生物科技有公司,软体动物DNA微量提取试剂盒购自Magen公司,植物组织DNA提取试剂盒(Omega)购自广州迈发生物科技有限公司,引物的合成由英潍捷基(上海)贸易有限公司合成。
本研究使用的荧光染料为钙黄绿素,钙黄绿素与锰离子配比参照张跃伟等[29],终浓度为0.05mmol/L钙黄绿素和0.6mmol/L锰离子。将钙黄绿素溶液(1mmol/L)和MnCl2溶液(1mmol/L)以体积比1∶12的比例混合配制成荧光染料。反应前将4 μL荧光染料加在离心管盖的内侧,LAMP反应结束后,摇动离心管将盖上的染料混入扩增产物,显现绿色荧光为阳性,显现橙色(与反应前颜色相同)为阴性。
1.2 方法
1.2.1 水稻干尖线虫的培养
胡萝卜愈伤组织的制备主要参照陈淳等[30]和Reise等[31]的方法制备,水稻干尖线虫的消毒和接种参照裴艳艳等[32]和彭晓放等[33]的方法。
1.2.2 DNA的提取
单条线虫DNA提取参照王江岭等[34]的方法,混合虫态线虫的微量DNA提取参照Magen公司的软体动物组织DNA提取试剂盒(HiPure Mollusc DNA Mini Kit)说明书进行操作。混有水稻干尖线虫植物组织的DNA提取参照Omega公司的植物DNA提取试剂盒(HP Plant DNA Kit)说明书进行。
1.2.3 水稻干尖线虫LAMP引物设计、扩增和检测
为了得到LAMP引物,本研究在NCBI上下载水稻干尖线虫18S核糖体RNA基因序列(GenBank登录号:JF826519.1),通过Primer Premier 5软件设计水稻干尖线虫18S核糖体RNA基因的PCR引物,对其进行PCR扩增,将扩增产物进行测序和比对确定其序列。然后基于该基因序列通过LAMP引物在线设计网站(http://primerexplorer.jp/e/)设计获得一对LAMP引物。利用该引物,在恒温条件下对供试样品DNA进行扩增。水稻干尖线虫LAMP反应体系为2.5 μL 10×Thermopol缓冲液、1 μL F3/B3(25×)、1 μL FIP/BIP(25×)、1 μL LB/LF(25×)、6 μL dNTPs (10 mmol/L)、1.5 μL MgSO4(100 mmol/L)、1 μL Bst2.0 Warmstart DNA聚合酶(8 U/μL)、1 μL 模板 DNA、4 μL 甜菜碱和6 μL ddH2O(引物25倍混合液包括40 μmol/L FIP、40 μmol/L BIP、5 μmol/L F3、5 μmol/L B3、10 μmol/L LB和10 μmol/L LF)。LAMP反应条件如下:65℃下温育60min,80℃保温 10min。LAMP扩增产物的检测方法为琼脂糖凝胶电泳法和荧光染料直观目测法。琼脂糖凝胶电泳检测方法:使用1%琼脂糖凝胶在5~10 V/cm 电压下电泳25 min检测LAMP扩增产物,出现LAMP特征性阶梯状条带,证明有水稻干尖线虫。荧光染料直观目测检测方法:在LAMP扩增产物中加入4 μL荧光染料,可观察到绿色荧光,证明有水稻干尖线虫。
1.2.4 水稻干尖线虫LAMP特异性、稳定性和灵敏性检测
用香蕉穿孔线虫、松材线虫、潜根线虫、南方根结线虫和滑刃属线虫作为对照测试水稻干尖线虫LAMP引物的特异性;用26个水稻干尖种群作为水稻干尖线虫LAMP特异引物的稳定性测试对象;用电泳法及荧光染料法检测反应结果;将单条线虫的DNA梯度浓度稀释液进行LAMP扩增,分别按1×100、1×101、1×102、1×103、1×104、1×105梯度进行稀释,检测反应灵敏度。每个处理进行3次重复。
1.2.5 混合样品中水稻干尖线虫的LAMP检测
混合样品检测包括水稻干尖线虫与植物组织混合样品DNA的LAMP检测以及水稻干尖线虫和对照线虫混合样品DNA的LAMP检测。水稻干尖线虫与植物组织混合样品检测:用软体动物组织DNA提取试剂盒(Hipure Mollusc DNA Mini Kit)和植物DNA提取试剂盒(HP Plant DNA Kit )方法提取水稻干尖线虫与植物组织混合样品DNA并进行LAMP扩增反应。混合样品处理为30条水稻干尖线虫和20 mg水稻叶片组织混合的DNA,阴性对照处理为不包含水稻干尖线虫的水稻叶片组织DNA,设置空白对照处理,每个处理重复3次。
水稻干尖线虫和对照线虫混合样品DNA的LAMP检测包括以下处理:(1)空白对照;(2)菊花叶枯线虫、松材线虫、水稻潜根线虫、南方根结线虫、香蕉穿孔线虫和滑刃属线虫的混合样品DNA;(3)水稻干尖线虫、菊花叶枯线虫和松材线虫的混合样品DNA;(4)水稻干尖线虫、水稻潜根线虫和南方根结线虫的混合样品DNA;(5)水稻干尖线虫、香蕉穿孔线虫和滑刃属线虫未定种的混合样品DNA;(6)水稻干尖线虫、菊花叶枯线虫、松材线虫和水稻潜根线虫的混合样品DNA;(7)水稻干尖线虫、南方根结线虫、香蕉穿孔线虫和滑刃属线虫未定种的混合样品DNA;(8)水稻干尖线虫、松材线虫、水稻潜根线虫、南方根结线虫和香蕉穿孔线虫的混合样品DNA。每个处理中的每种线虫均为单条线虫,每个处理进行3次重复。
2 结果与分析
2.1 水稻干尖线虫LAMP引物设计及检测
用水稻干尖线虫的18S核糖体RNA基因的PCR引物对水稻干尖线虫DNA进行扩增,将扩增产物进行连接测序后得到1080 bp的片段,经过序列比对后,证明其和水稻干尖线虫的18S核糖体RNA基因序列一致。基于该序列,通过LAMP引物在线设计网站设计一组水稻干尖线虫LAMP引物,该组引物包括外引物对F3(5’-CGGTATTTTGC GCGTTTTCG-3’)和B3(5’-TCGCTACGGTCCTCG AATT-3’);内引物对FIP(5’-TTCAGTCGTAAGAC CCGCCTTGGTCGGTGATGCGCAGGAT-3’) 和BIP(5’-CAAGGTTGCGG CCGAGTTTTATTGCGC AGCGATACGAATGC-3’);环引物对LF(5’-T GAA ACTTGCCGAATTCACGA-3’)和LB(5’-GGTT TTG TCGGCTGAAACAATG-3’)。用设计的引物序列对供试线虫DNA进行LAMP扩增,扩增产物经电泳检测结果(图1)显示,水稻干尖线虫2个种群的DNA样品出现了明显的梯状条带,而菊花叶枯线虫的DNA样品和空白对照皆未出现条带。因此,确认所设计的引物可以作为水稻干尖线虫的LAMP引物。
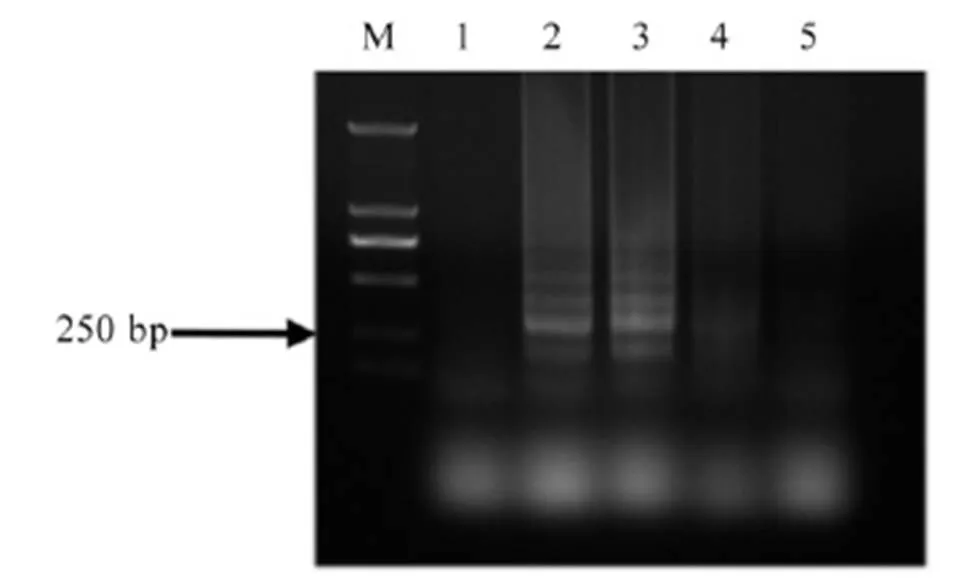
M-标记 DL2000;1-空白对照;2-水稻干尖线虫JZ种群;3-水稻干尖线虫HN-2种群;4和5-菊花叶枯线虫种群。
Fig. 1. Electrophoresis detection results of amplified products ofwith LAMP specific primers.
2.2 水稻干尖线虫LAMP引物特异性和稳定性检测
以水稻干尖线虫作为测试靶标线虫,以香蕉穿孔线虫、松材线虫、水稻潜根线虫、南方根结线虫和滑刃属未定种线虫作为对照线虫,测试水稻干尖线虫LAMP引物的特异性。所有供试线虫的DNA用水稻干尖线虫LAMP引物扩增后的产物分别经电泳法和荧光染料法检测,结果显示(图2),只有水稻干尖线虫的DNA样品出现特异条带(图2-A),且加入荧光染料后颜色变为绿色荧光(图2-B),6种对照线虫DNA样品未出现特异条带,加入荧光染料后也未变色。因此,设计的水稻干尖线虫LAMP引物具有很好的特异性。
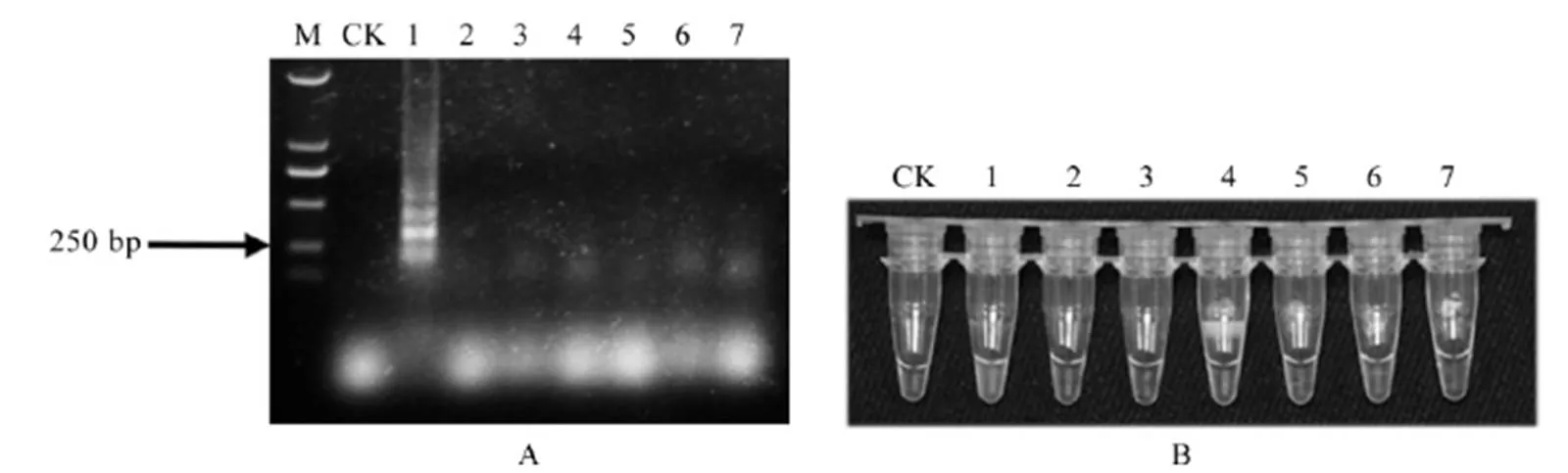
A-LAMP扩增产物电泳检测结果;B-LAMP扩增产物荧光染料反应结果;M-标记 DL2000;CK-空白对照;1-水稻干尖线虫;2-松材线虫;3-水稻潜根线虫;4-南方根结线虫;5-香蕉穿孔线虫;6-滑刃属线虫未定种1;7-滑刃属线虫未定种2。
Fig. 2. Specificity detection results of amplified products ofwith LAMP primers.
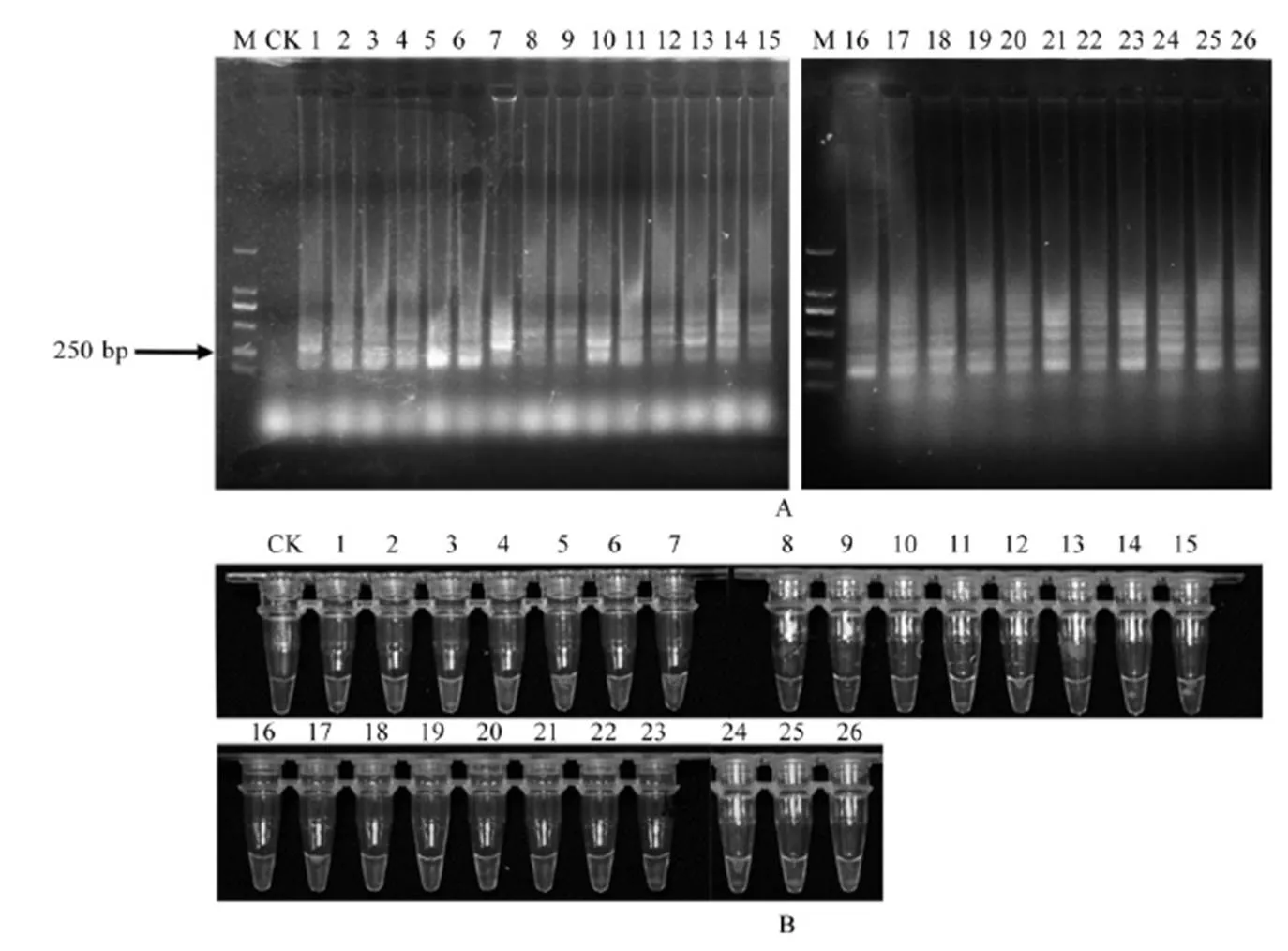
A-LAMP扩增产物电泳检测结果;B-LAMP扩增产物荧光染料反应结果;M-标记 DL2000;CK-空白对照;1~26分别为水稻干尖线虫HM5种群、G27种群、X8种群、YQ1种群、N54种群、N71种群、N80种群、N47种群、YQ3种群、N28种群、G7种群、A-1种群、N65种群、S-2种群、X10种群、GB种群、Hq-2种群、HB种群、JZ种群、J12种群、Xi种群、HN-2种群、HC6种群、N51种群、S24种群、N10种群。
Fig. 3. Stability detection results of amplified products ofwith LAMP primers.
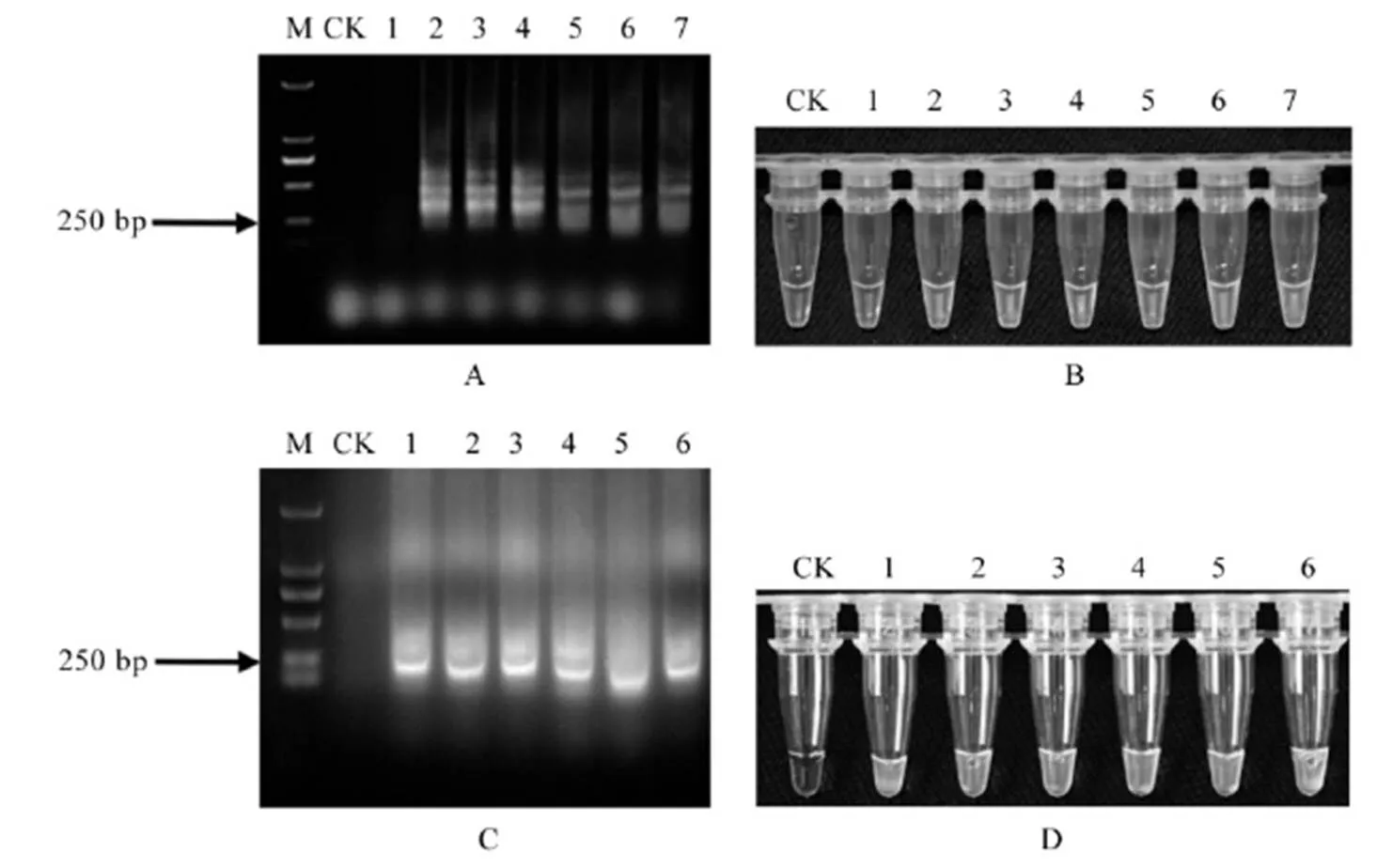
A和C-LAMP扩增产物电泳检测结果;B和D-LAMP扩增产物荧光染料反应结果;M-标记 DL2000;CK-空白对照;A和B: 1-菊花叶枯线虫;2~4-水稻干尖线虫单条雄虫;5~7-水稻干尖线虫单条雌虫;C和D: 1~3-水稻干尖线虫单个卵;4~6-水稻干尖线虫单条幼虫。
Fig. 4. Detection results ofat different development stages with LAMP primers.
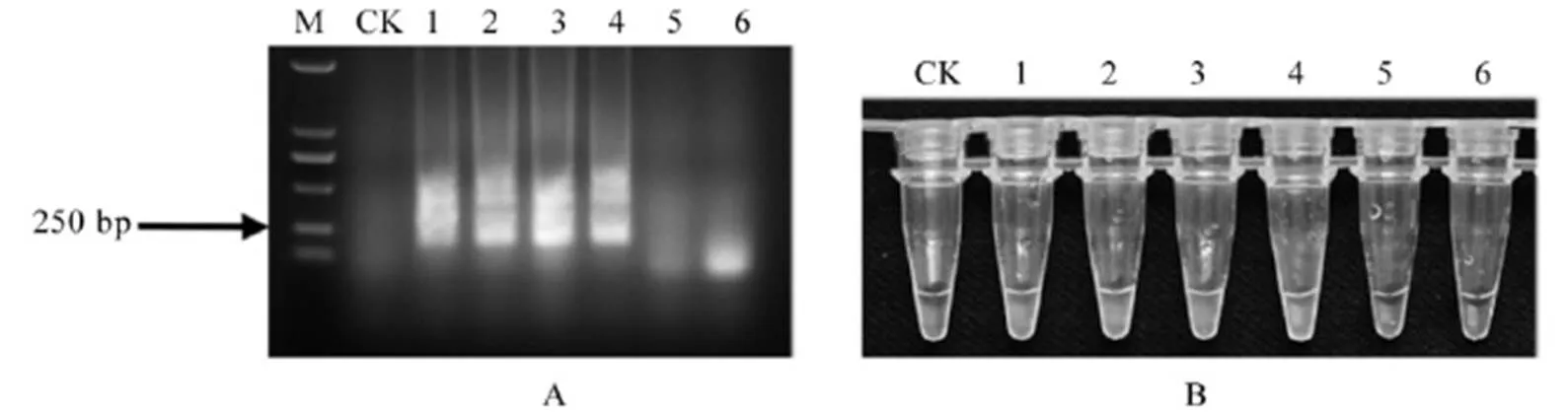
A-LAMP扩增产物电泳检测结果;B-LAMP扩增产物荧光染料反应结果;M-标记 DL2000;CK-空白对照;1-水稻干尖线虫未稀释单条虫DNA;2~6-10-1倍、10-2倍、10-3倍、10-4倍和10-5倍单条虫DNA。
Fig. 5. Sensitivity detection results ofwith LAMP primers.
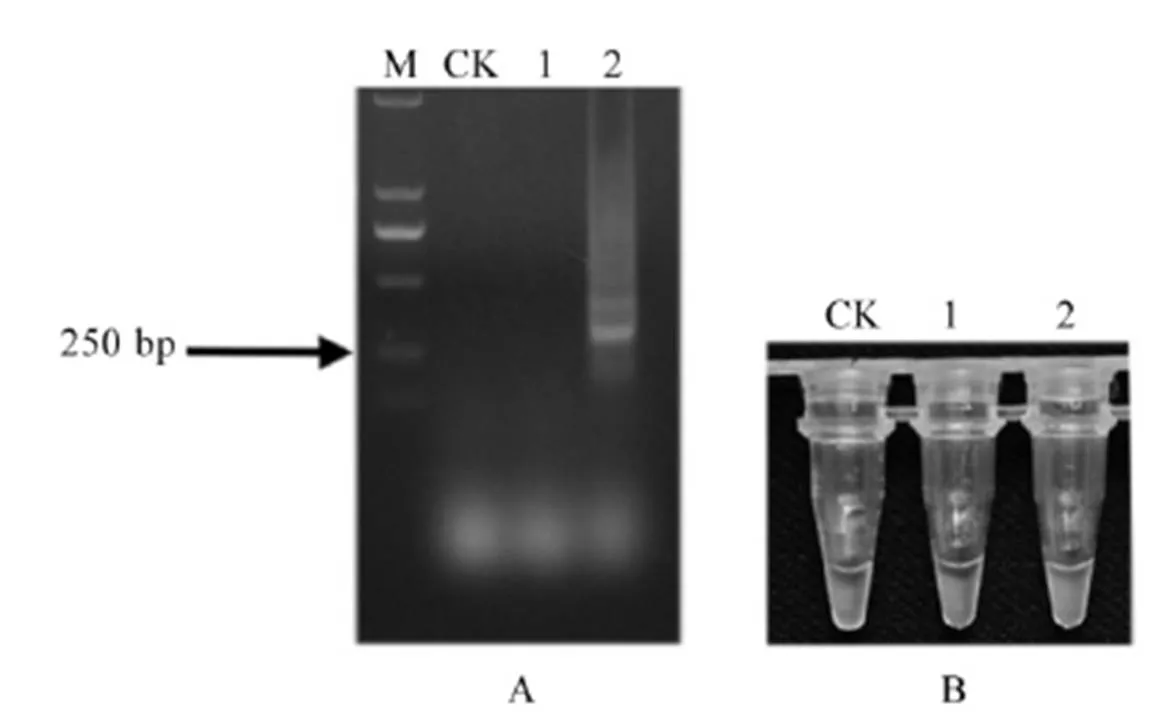
A-LAMP扩增产物电泳检测结果;B-LAMP扩增产物荧光染料反应结果;M-标记 DL2000;CK-空白对照;1-不含水稻干尖线虫的水稻叶组织;2-水稻干尖线虫和水稻叶组织混合样品。
Fig. 6. Detection results of mixed sample of rice leaf tissue andwith LAMP primers.
用26个水稻干尖线虫种群进行水稻干尖线虫LAMP特异引物稳定性测试。所有线虫样品的DNA进行LAMP扩增后的产物分别经电泳法和荧光染料法检测,均出现了阶梯状条带(图3-A)和绿色荧光(图3-B),在种内表现出了很好的稳定性。
采用水稻干尖线虫LAMP引物对水稻干尖线虫单条(个)雌虫、雄虫、幼虫和卵的DNA样品进行LAMP扩增后的产物分别经电泳法和荧光染料法检测(图4),均分别出现梯状电泳条带(图4-A、4-C)和绿色荧光(图4-B、4-D),空白和阴性对照均未出现特异条带和绿色荧光。因此,设计的水稻干尖线虫LAMP引物和反应体系可以用来检测这水稻干尖线虫不同发育时期的单条线虫或单个卵。
2.3 水稻干尖线虫LAMP引物灵敏度检测
将水稻干尖线虫单条虫的DNA浓度梯度稀释液进行LAMP扩增,扩增后的产物分别进行电泳和加入荧光染料。结果表明(图5),水稻干尖线虫的单条虫DNA模版稀释1×103倍后仍然可以扩增出清晰的电泳条带(图5-A),加入荧光染料后则显现绿 色荧光(图5-B)。因此,建立的水稻干尖线虫LAMP方法的检测灵敏度为10-3条线虫DNA。
2.4 植物组织和多种线虫混合样品和的水稻干尖线虫LAMP检测
水稻干尖线虫与水稻叶片组织混合样品的DNA以及水稻干尖线虫与其他7种植物线虫混合样品的DNA分别进行LAMP扩增,产物分别进行电泳和加入荧光染料,结果表明(图6和7),含有水稻叶组织的样品和多种线虫混合样品均出现明显的特异条带(图6-A和7-A),扩增产物的颜色变为绿色荧光(图6-B和7-B)。因此,建立的水稻干尖线虫LAMP检测方法可以直接检测鉴定水稻叶组织样品和多种线虫混合样品中的水稻干尖线虫。
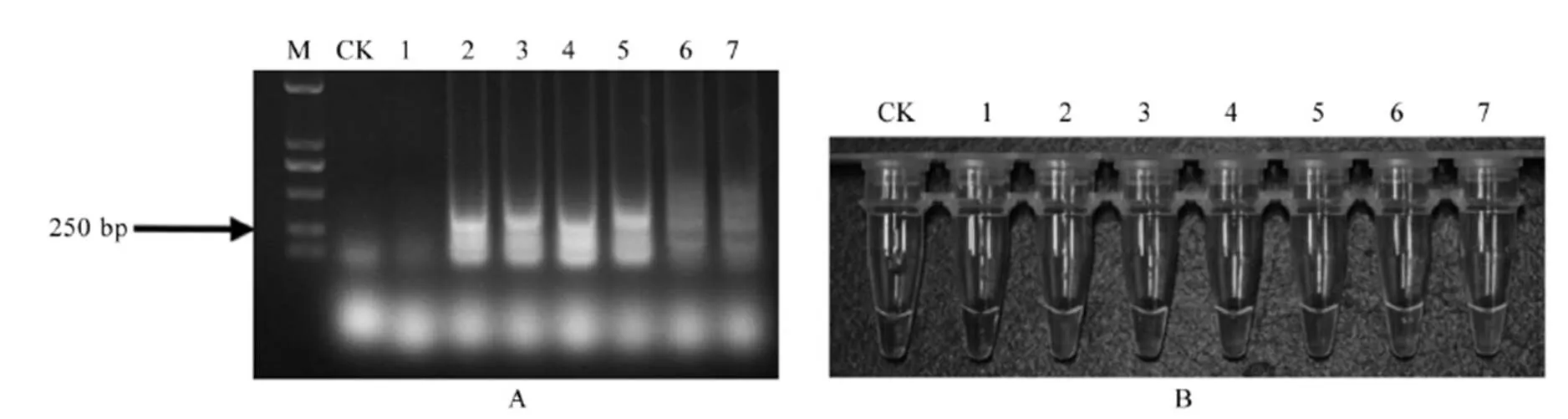
A-LAMP扩增产物电泳检测结果;B-LAMP扩增产物荧光染料反应结果;M-标记 DL2000;CK-空白对照;1-菊花叶枯线虫、松材线虫、水稻潜根线虫、南方根结线虫、香蕉穿孔线虫和滑刃属线虫未定种的混合样品;2-水稻干尖线虫、菊花叶枯线虫和松材线虫的混合样品;3-水稻干尖线虫、水稻潜根线虫和南方根结线虫的混合样品;4-水稻干尖线虫、香蕉穿孔线虫和滑刃属线虫未定种的混合样品;5-水稻干尖线虫、菊花叶枯线虫、松材线虫和水稻潜根线虫的混合样品;6-水稻干尖线虫、南方根结线虫、香蕉穿孔线虫和滑刃属线虫未定种的混合样品;7-水稻干尖线虫、松材线虫、水稻潜根线虫、南方根结线虫和香蕉穿孔线虫的混合样品。
Fig. 7. Detection results of mixed sample of control plant parasitic nematodes tissue andwith LAMP primers.
3 讨论
线虫的18S核糖体RNA是比较保守的一段序列,在种间具有较好的区分度。因此,本研究根据水稻干尖线虫的18S核糖体RNA基因设计了特异LAMP引物。用该引物对水稻干尖线虫以及形态和生物学特性相对近似的2个目6个属7种其他植物线虫进行了检测,只有水稻干尖线虫DNA样品的检测结果显示阳性;用该引物对来自不同地区或寄主植物的26个水稻干尖线虫群体进行LAMP检测,所有种群的检测结果都出现了阳性。因此设计的水稻干尖线虫LAMP引物具有非常好的特异性和稳定性。由于本研究设计的水稻干尖线虫LAMP引物中的1对外引物和1对内引物对水稻干尖线虫18S核糖体RNA序列中的6个不同区域进行识别扩增,若6个区域中的任何区域与引物不匹配都不能进行核酸扩增,因此,相对于PCR引物只对靶序列的2个不同区域进行识别扩增而言,水稻干尖线虫LAMP检测的特异性大大提高,假阳性的概率则随之大大降低,因此检测的准确性提高。
本研究建立的水稻干尖线虫LAMP检测方法分别对水稻干尖线虫的单条雄虫、单条雌虫、单条幼虫和单个卵进行了检测,结果均为阳性。所用检测时间仅需1h,并且检测灵敏度达到1/1000单条虫DNA。而传统的形态学检测鉴定需要几天时间,并且需要多条雌虫[12];已报道的水稻干尖线虫PCR检测方法则需要数小时,并且只检测了一条线虫DNA[13]。因此,本研究的检测方法速度更快、灵敏度更高。本研究建立的水稻干尖线虫LAMP检测方法还可以检测混有不同种类的线虫样品中和植物组织样品中的水稻干尖线虫,省去了传统形态学鉴定和已有PCR检测方法所要求的样品分离步骤,从而节省了大量时间和工作量。本研究建立的LAMP结果荧光染料检测方法,只需恒温水浴锅或有稳定热源的设备就能进行,用肉眼观察颜色变化就可判定结果,省去了昂贵的仪器设备和繁琐的操作过程。因此本研究的检测效率大大提高,操作简单、易行。
本研究建立的水稻干尖线虫LAMP检测方法,实用性强,应用性广,可以广泛应用于口岸和调运检疫以及田间监测中对水稻干尖线虫的检测,为水稻干尖线虫的进出境检疫和调运检疫以及田间病害早期诊断和监测提供了准确、快速和易行的方法,对提高水稻干尖线虫的检出率和防控效果具有重要意义。
[1] Lilley C J, Kyndt T, Gheysen G. Nematode resistant GM crops in industrialised and developing countries//Jones J T, Gheysen G, Fenoll C. Genomics and Molecular Genetics of Plant–Nematode Interactions. Heidelberg: Springer, 2011: 517-541.
[2] 刘维红. 水稻干尖线虫在“小穗头”上的危害及人工接种测定病害发展动态. 南京:南京农业大学, 2007.
Liu W H. The damage ofon the small grains and erect panicles dynamic development on rice plant by artificial inoculations. Nanjing: Nanjing Agricultural University, 2007. (in Chinese with English abstract)
[3] EPPO. Distribion Maps of Quarantine Pests for Europe:. CAB International, 2012, Map 157
[4] 王子明, 周风明, 吕玉亮, 吕宏飞, 卢小莉, 许明宝, 陈志谊, 刘永峰, 徐旸. 江苏省水稻小穗头现象发生原因与防治对策研究. 江苏农业科学, 2003(5): 1-6.
Wang Z M, Zhou F M, Lv Y L, Lv H F, Lu X L, Xu M B, Chen Z Y, Liu Y F, Xu Y. Study on occurrence reason and control countermeasure of small grains and erect panicles of rice plant in Jiangsu., 2003(5): 1-6. (in Chinese)
[5] 王子明, 周风明, 吕宏飞, 吕玉亮, 卢小莉, 陈志谊, 刘永峰, 魏巍. 江苏省水稻小穗头现象的发生与防治措施研究. 江苏农业科学, 2004(3): 34-38.
Wang Z M, Zhou F M, Lv H F, Lv Y L, Lu X L, Chen Z Y, Liu Y F, Wei W. Study on the occurrence and control measures of small grains and erect panicles of rice plant in Jiangsu., 2004(3): 34-38. (in Chinese)
[6] 刘维志. 水稻干尖线虫病. 新学报, 1999, 10: 25-26.
Liu W Z. The disease caused by., 1999, 10: 25-26. (in Chinese)
[7] 裘童兴, 严明富, 陆强. 水稻干尖线虫病发生规律及防治初探. 浙江农业科学, 1991(6): 290-292.
Qiu T X, Yan M F, Lu Q. Preliminary study on occurrence and control of disease caused by., 1991(6): 290-292. (in Chinese)
[8] 林茂松, 丁晓帆, 王子明, 周风明, 林娜. 水稻小穗头上的线虫形态特征鉴定. 中国水稻科学, 2005, 19(4): 361-365.
Lin M S, Ding X F, Wang Z M, Zhou F M, Lin N. Description offrom abnormal rice with small grains and erect panicles in China., 2005, 19(4): 361-365. (in Chinese with English abstract)
[9] 刘丹, 冯齐山, 冯景科. 水稻干尖线虫发生危害及防治技术. 垦殖与稻作, 2006(增): 50
Liu D, Feng Q S, Feng J K. Occurrence and control of disease caused by., 2006(Suppl): 50. (in Chinese)
[10] 范立志, 侍瑞高, 谢小军, 牛有成. 水稻小粒翘穗病原及控制技术研究. 植物保护, 2007, 33(2): 94-97.
Fan L Z, Shi R G, Xie X J, Niu Y C. Studies on the pathogen of small grains and erect ears of rice and its control measures., 2007, 33(2): 94-97. (in Chinese with English abstract)
[11] 中华人民共和国出入境检验检疫行业标准. 菊花滑刃线虫检疫鉴定方法. 北京:中国标准出版社. 2010.
People's Republic of China entry exit inspection and quarantine industry standard. Quarantine identification of chrysanthemum leaf nematode,(schwartz) steiner & buhrer. Beijing: Standards Press of China. 2010. (in Chinese and English)
[12] Rybarczyk-Mydlowska K, Mooyman P, van Megen H, van den Elsen S, Vervoort M, Veenhuizen P, van Doorn J, Dees R, Karssen G, Bakker J, Helder J. Small subunit ribosomal DNA-based phylogenetic analysis of foliar nematodes (spp.) and their quantitative detection in complex DNA backgrounds., 2012, 102(12): 1153-1160.
[13] 崔汝强, 葛建军, 胡学难, 赵立荣, 钟国强, 冯黎霞. 水稻干尖线虫快速分子检测技术研究. 植物检疫, 2010, 24(1): 10-12.
Cui R Q, Ge J J, Hu X N, Zhao L R, Zhong G Q, Feng L X. A rapid method to detectby PCR., 2010, 24(1): 10-12. (in Chinese with English abstract)
[14] Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N,Hase T. Loop-mediated isothermal amplification of DNA., 2000, 28(12): 63.
[15] Imai M, Ninomiya A, Minekawa H,NotomiT, IshizakiT, TashiroM, Odagiri T. Development of H5-RT LAMP (loop-mediated isothermal amplification) system for rapid diagnosis of H5 avian influenza virus infection., 2006, 24: 6679-6682.
[16] 李启明, 马学军, 周蕊, 彭夫望, 高寒春, 匡治州, 侯云德. 环介导逆转录等温扩增技术(RT-LAMP)在丙型肝炎病毒基因检测中的应用. 病毒学报, 2006, 22(5): 334-338.
Li Q M, Ma X J, Zhou R, Peng F W, Gao H C, Kuang Z Z, Hou Y D. Detection of HCV gene by reverse transcription loop-mediated isothermal amplification method., 2006, 22(5): 334-338. (in Chinese with English abstract)
[17] 戴婷婷, 陆辰晨, 沈浩, 王源超,郑小波.基于环介导等温扩增技术检测橡树疫霉菌. 南京农业大学学报, 2013, 36(3): 23-28.
Dai T T, Lu C C, Shen H, Wang Y C, Zheng X B. Rapid diagnostic methods forusing LAMP., 2013, 36(3): 23-28. (in Chinese with English abstract)
[18] 孔德英, 孙涛, 李应国, 滕少娜, 陆丽华, 邓朝晖.柑桔黄龙病 LAMP 快速检测方法的建立. 中国南方果树, 2013, 42(1): 8-11.
Kong D Y, Sun T, Li Y G,Teng S N,Lu L H,Deng Z H. Development amplification and evaluation method for the of a loop mediated isothermal rapid detection of Huanglongbing., 2013, 42(1): 8-11. (in Chinese with English abstract)
[19] 刘威. 现场传染病诊断关键技术的研究及应用. 北京:中国人民解放军军事医学科学院, 2014.
Liu W. Research on key technologies of on-site diagnosis of infectious diseases and its application. Beijing: Military Medical Science Academy of the PLA Institute, 2014. (in Chinese with English abstract)
[20] Kuboki N, Inoue N, Igarashi I,di Cello F , Grab D J , Suzuki H , Sugimoto C , Igarashi I, Kuboki N , Inoue N, Sakurai T, di Cello F, Grab D J , Suzuki H , Sugimoto C , Igarashi I. Loop-mediated isothermal amplification for detection of., 2003, 41(12): 5517-5524.
[21] Seki M, Yamashita Y, Torigoe H, Tsuda H, Sato S, MaenoM. Loop-mediated isothermal amplification method targeting thegene for detection of., 2005, 43(4): 1581-1586.
[22] Taisei K, Takuya A, Yuka O, Karim N, KanzakiN. A rapid and precise diagnostic method for detecting the pinewood nematodeby loop-mediated isothermal amplification., 2009, 99(12): 1365-1369.
[23] Leal I, Allen E, Anema J, Kageyama S, Numazaki K, Ichimura H. Development of a reverse transcription loop mediated isothermal amplification (RTLAMP) method to detect living pinewood nematode,, in wood. Pine Wilt Disease Conference, 2013.
[24] 何旭锋, 彭焕, 丁中, 贺文婷, 黄文坤, 彭德良. 植物罹病组织中象耳豆根结线虫的LAMP快速检测方法. 中国农业科学, 2013, 46(3): 534-544.
He X F, Peng H, Ding Z, He W T, Huang W K, Peng DL. Loop-mediated isothermal amplification assay for rapid diagnosis ofdirectly from infected plants., 2013, 46(3): 534-544. (in Chinese with English abstract)
[25] 彭德良, 徐小琴, 彭焕, 亓晓莉,黄文坤,贺文婷,姜道宏. 一种禾谷孢囊线虫LAMP快速检测方法及应用. 2013100203834, 2013-04-17.
Peng D L, Xu X Q, Peng H, Qi X L, Huang W K, He W T, Jiang D H. Loop-mediated isothermal amplification assay for rapid diagnosis of: China, 2013100203834, 2013-04-17. (in Chinese)
[26] 熊玉芬, 王旭, 葛建军, 吴品珊, 朱水芳, 李芳荣, 赵立荣, 王宏毅. 环介导等温扩增特异检测香蕉穿孔线虫. 植物检疫, 2014, 28(2): 48-51.
Xiong Y F, Wang X, Ge J J, Wu P S, Zhu S F, Li F R, Zhao L R, Wang H Y. Loop-mediated isothermal amplification for detecting of Burrowing nematode ()., 2014, 28(2): 48-51. (in Chinese with English abstract)
[27] 朱琳峰. 应用LAMP检测北方根结线虫和转CP4-EPSPS基因抗草甘膦大豆. 北京:中国农业科学院, 2014.
Zhu L F. Detection ofhapla and glyphosate-resistant soybean by LAMP. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese with English abstract)
[28] 魏洪岩, 王暄, 李红梅, 孙文荣,顾建锋. 采用环介导等温扩增法(LAMP)快速检测苹果根结线虫. 植物保护学报, 2016, 43(2): 260-266.
Wei H Y, Wang X, Li H M, Sun W R, Gu J F. Loop-mediated isothermal amplification assay for rapid diagnosis of., 2016, 43(2): 260-266. (in Chinese with English abstract)
[29] 张跃伟, 李旭妮, 郭盼盼, 付萍, 李佳禾, 黄书林, 蒋菲, 吴文学. 荧光显色在环介导等温扩增 (LAMP) 检测猪繁殖与呼吸综合征病毒的应用. 农业生物技术学报, 2010, 18(3): 508-513.
Zhang Y W, Li X N, Guo P P, Fu P Li J H, Huang S L, Jiang F, Wu W X. Fluorescent reagent in detection of porcine reproductive and respiratory syndrome virus by loop-mediated isothermal amplification (LAMP)., 2010, 18(3): 508-513. (in Chinese with English abstract)
[30] 陈淳, 谢辉, 蔚应俊, 韩玉春, 秦丹, 黄春晓, 唐炯. 香蕉穿孔线虫培养技术及其种群繁殖力研究. 华南农业大学学报, 2006, 26(1): 61-64.
Chen C, Xie H, Wei Y J, Han Y C, Q in D , Huang C X, Tang J. Studies on cultural technique and reproduction fitness of., 2006, 26(1): 61-64. (in Chinese with English abstract)
[31] Reise R W, Huettel R N , Sayre R M. Carrot callus tissue for culture of endoparasitic nematodes., 1987, 19(3): 387-389.
[32] 裴艳艳, 程曦, 徐春玲, 杨再福, 谢辉. 中国水稻干尖线虫部分群体对水稻的致病力测定. 中国水稻科学, 2012, 26(2): 218-226.
Pei Y Y, Cheng X, Xu C L, Yang Z F, Xie H. Virulence of part populations ofon rice in China., 2012, 26(2): 218-226. (in Chinese with English abstract)
[33] 彭晓放, 陈德强, 王东伟, 王珂,吴文佳,徐春玲,谢辉. 菊花滑刃线虫的培养条件和繁殖特性. 华中农业大学学报, 2015, 34(5): 48-51.
Peng X F, Chen D Q, Wang D W, Wang K, Wu W J, Xu C L, Xie H. Culture conditions and reproductive characteristics ofon callus., 2015, 34(5): 48-51. (in Chinese with English abstract)
[34] 王江岭, 张建成, 顾建锋. 单条线虫 DNA 提取方法. 植物检疫, 2011, 25(2): 32-35.
Wang J L, Zhang J C, Gu J F. Method of extract DNA from a single nematode., 2011, 25(2): 32-35. (in Chinese with English abstract)
Loop-mediated Isothermal Amplification Assay for Rapid Diagnosis of
BAI Zongshi1, QIN Meng2,ZHAO Lirong3, HAN Yuchun4, WANG Dongwei1, XU Chunling1, XIE Hui1, *
(Laboratory of Plant Nematology and Research Center of Nematodes of Plant Quarantine,,,,;National Agro-Technical Extension and Service Centre,,;,,,;HainanEntry-Exit Inspection and Quarantine Bureau,,;Corresponding author,:..)
【Objective】This study was performed to provide a new method for the rapid detection and early diagnosis of. 【Method】The loop-mediated isothermal amplification (LAMP) specific primers ofwere designed based on the nematode18S ribosomal RNA gene, including two external primer, two inner primer and two loop primer. The DNA sample was amplified by LAMP primers using isothermal amplification. The amplified products were detected by electrophoresis and fluorescent dye. It proved that there wasin the test sample if there was clear DNA ladder in the electrophoresis results or it showed green fluorescence in the fluorescent dye results. 【Result】The results showed that LAMP primers could detect and identify single egg, juvenile, female and male of, and could also directly detectfrom multiple nematode species samples and plant tissue samples, the sensitivity of LAMP assay was 1/1000 of single nematode DNA. 【Conclusion】This diagnosis method has the advantages of accuracy, sensitivity, stability and intuitive results, and is also simple and more practical.
; LAMP; rapid diagnosis; sensitivity
10.16819/j.1001-7216.2017.7001
S435.112+.9
A
1001-7216(2017)04-0432-09
2017-01-04
国家自然科学基金资助项目(31371920)。
修改稿收到日期:2017-03-29
