腹腔注射氢气与富氢生理盐水对新生大鼠高氧肺损伤的作用研究
2017-10-13孙学军刘成军
吴 丹,姚 兰,于 攀,孙学军,方 芳,许 峰,刘成军
(1.重庆医科大学附属儿童医院PICU,重庆 400014;2.重庆医科大学附属儿童医院呼吸二病房/儿童发育疾病研究教育部重点实验室,重庆 400014;3.南京大学医学院金陵医院烧伤整形科,南京 210002;4.第二军医大学海军医学系潜水医学部,上海 200433)
论著·基础研究doi:10.3969/j.issn.1671-8348.2017.25.004
腹腔注射氢气与富氢生理盐水对新生大鼠高氧肺损伤的作用研究
吴 丹1,姚 兰2△,于 攀3,孙学军4,方 芳1,许 峰1,刘成军1
(1.重庆医科大学附属儿童医院PICU,重庆 400014;2.重庆医科大学附属儿童医院呼吸二病房/儿童发育疾病研究教育部重点实验室,重庆 400014;3.南京大学医学院金陵医院烧伤整形科,南京 210002;4.第二军医大学海军医学系潜水医学部,上海 200433)
目的对比分析腹腔注射氢气(H2)和富氢生理盐水对高氧致新生大鼠肺损伤的作用。方法将SD新生大鼠分为6组(每组10只),A组(空气组)、B组(空气+富氢生理盐水组)、C组(空气+H2组)、D组(高氧组)、E组(高氧+富氢生理盐水组)、F组(高氧+H2组)。A、B、C组置于空气中,D、E、F组置于95% O2中,B、E组每日腹腔注射富氢生理盐水2次(10 mL/kg),C、F组每日腹腔注射H22次(10 mL/kg),A、D组每日腹腔注射普通生理盐水2次(10 mL/kg)。于实验第15天收集肺组织和血清标本,苏木精-伊红(HE) 染色后光镜下观察肺组织病理改变和辐射状肺泡计数(RAC),碱水解法检测肺组织羟脯氨酸(HYP)、血清丙二醛(MDA)、超氧化物歧化酶(SOD)水平,免疫组织化学SP法检测肌成纤维细胞表型标志α-平滑肌肌动蛋白(α-SMA)表达。结果与A组相比,D组RAC、血清SOD活力明显降低,HYP、MDA水平及α-SMA表达均明显增加,H2干预可显著缓解高氧所致上述变化,腹腔注射H2较腹腔注射富氢生理盐水效果更佳。结论H2可一定程度减轻高氧导致的肺氧化损伤、发育受阻及纤维化指标,腹腔注射H2较腹腔注射高氢生理盐水效果更佳。
氢;肺纤维化;高氧肺损伤;肺发育
氧疗是重要的临床治疗手段,但持续高浓度的用氧会导致肺损伤,以前期炎性反应及后期肺纤维化为主要表现,在新生儿特别是早产儿还可影响肺发育,导致支气管肺发育不良(bronchopulmonary dysplasia,BPD)的发生,严重影响患儿健康。已有大量研究报道了氢气(H2)作为抗氧化剂,在氧化应激相关的多种疾病中发挥保护作用[1]。也有研究报道小剂量H2可减轻高氧导致的成年鼠肺损伤[2],在脂多糖(lipopolysaccaride,LPS)诱导的新生鼠BPD模型中也观察到了H2的保护效应[3]。H2较高的生物安全性及良好的生物膜通透性、组织相容性等优点决定其可能成为BPD防治的新选择。本文以高氧诱导的BPD模型为研究对象,观察H2对高氧导致的新生鼠肺损伤的干预作用,并对比分析腹腔注射富氢生理盐水及直接注射H2的效应差异,为BPD的防治寻求新方法,为H2在BPD的应用提供一定的理论基础。
1 材料与方法
1.1实验动物 SPF级SD临产孕鼠,购自第三军医大学大坪医院实验动物中心。
1.2试剂 富氢生理盐水、H2(重庆朝阳气体公司);丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒(南京凯基生物技术有限公司);SP和DAB显色试剂盒、羟脯氨酸(HYP)检测试剂盒。
1.3方法
1.3.1富氢生理盐水的制备 按照第二军医大学孙学军等[2]的方法制作:即在0.4 Mpa压力下加压暴露6 h,将纯H2充分溶解于生理盐水中,制作过程无菌操作,生理盐水中溶解的H2浓度达到0.6 mmol/L。
1.3.2实验分组 待SD临产孕鼠自然分娩,将新生大鼠分为6组(每组10只),A组(空气组)、B组(空气+富氢生理盐水组)、C组(空气+H2组)、D组(高氧组)、E组(高氧+富氢生理盐水组)和F组(高氧+H2组)。D、E、F组大鼠均置于氧气(O2)体积分数为95%的动物氧舱中。H2干预:富氢生理盐水组大鼠腹腔注射富氢生理盐水10 mL/kg,每天2次;H2组大鼠予腹腔注射H2气体10 mL/kg,每天2次。A、D组大鼠则腹腔注射等量生理盐水。室温维持在24~25 ℃,自由进食和水,每日9:00开箱,称体质量,进行清扫,对换高氧组与空气组母鼠防止其氧中毒,开箱时间不超过1 h。
1.3.3肺组织和血清标本的收集 于实验第15天,每组各取6只大鼠肺组织和血清标本用于检测,腹腔注射10%水合氯醛(10 μL/g)麻醉后,右肺组织取出置入液氮中速冻后,于-80 ℃保存,用于后续分子生物学实验,左肺用4%多聚甲醛固定,4 ℃过夜,次日制成5 μm石蜡组织切片;采用心脏取血法取血后将血液缓慢注入消毒后的1.5 mL EP管离心,取上层血清分装,-20 ℃保存。
1.3.4肺组织苏木精-伊红(HE)染色 将制成的石蜡组织切片进行HE染色,光镜下观察肺组织病理学改变的同时随机取5个不重叠的视野(200×)进行辐射状肺泡计数(RAC),RAC的测定参照文献[3],计数从呼吸性细支气管中心至最近纤维隔或胸膜的垂线上的肺泡数。
1.3.5MDA和SOD的检测 黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基(O2-),后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色。按照试剂盒说明书进行操作,酶标仪检测550、532 nm处吸光度值,根据公式分别计算SOD活力和MDA水平。
1.3.6HYP水平 实验步骤按说明书进行,根据HYP在氧化剂作用下产生的氧化产物与二甲基苯甲醛作用呈现紫红色,酶标仪测定550 nm处吸光度值,根据公式计算HYP水平。
1.3.7α-SMA表达 采用免疫组织化学SP法,DAB显色,利用抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色,对目的蛋白进行定性、定位研究。使用Image-Pro Plus 6.0专业图像分析软件系统采集图像,将肺组织各切片随机取染色区域6个高倍视野(×400),测量并记录每个视野阳性染色的平均积分吸光度(IA)。
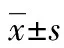
2 结 果
2.1肺组织病理学改变 HE染色显示A、B、C组新生鼠肺泡多且小,肺泡间隔均一,排列规整。而D组肺泡融合,肺泡间隔显著增厚,肺泡数量较A、B、C组明显减少,大小不等,纤维细胞增生显著。高氧加富氢生理盐水和H2干预后上述病理变化均有所减轻,见图1。

A:A组;B:D组;C:E组;D:F组
图1大鼠肺组织典型病理学改变(HE×100)
2.2RAC值 A、B、C组RAC值无明显差异,D组RAC值较A组显著降低,E、F组RAC值较D组有所增高,但仍低于A组,差异有统计学意义,E、F组间RAC值无明显差异,见图2。
#:P<0.05,与A组比较;&:P<0.05,与D组比较
图2各组大鼠RAC比较
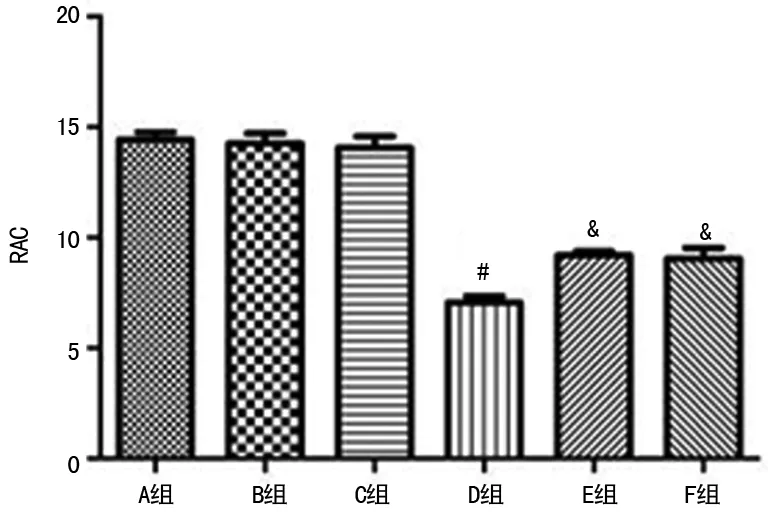
2.3血清MDA水平和SOD活力 A、B、C组大鼠血清MDA水平、SOD活力无显著差异,D组血清MDA水平较A组明显增高、SOD活力较A组明显降低,E、F组血清中MDA水平较D组均明显降低、SOD活力较高D组明显增加,差异有统计学意义(P<0.05)。F组较E组MDA水平略低,差异有统计学意义(P<0.05),F组SOD活力较E组略高,但差异无统计学意义(P>0.05),见图3。
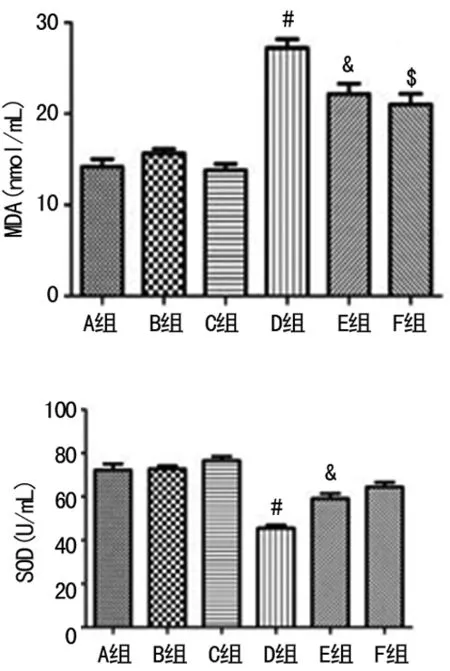
#:P<0.05,与A组比较;&:P<0.05,与D组比较;$:P<0.05,与E组比较
图3高氧及氢气干预对大鼠血清MDA水平和SOD活力的影响
2.4肺组织α-SMA表达 A、B、C组肺组织除大血管和气道平滑肌有α-SMA表达外,肺细支气管、肺泡表面和肺泡间隔均有少量α-SMA表达。D组较A组α-SMA表达明显增多,在肺泡表面和肺泡间隔尤为明显,E、F组α-SMA表达较D组明显减少,E、F组间比较无明显差异,见图4。
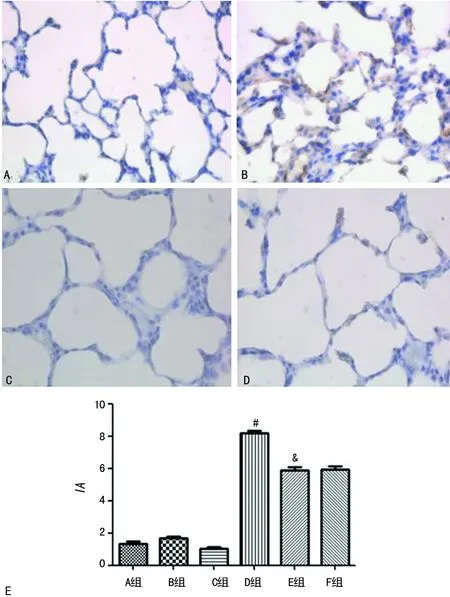
A:A组;B:B组;C:E组;D:F组;#:P<0.05,与A组比较;&:P<0.05,与D组比较
图4免疫组织化学法检测各组大鼠肺组织α-SMA蛋白表达
2.5肺组织HYP水平 A、B、C组肺组织HYP水平无显著差异。D组较A组肺组织HYP水平明显升高(0.659±0.036vs.0.441±0.023)mg/g肺湿重,E、F组HYP水平较D组明显降低,差异有统计学意义(P<0.05),F组较E组效果更好(0.509±0.038vs.0.563±0.021)mg/g肺湿重,差异有统计学意义,见图5。
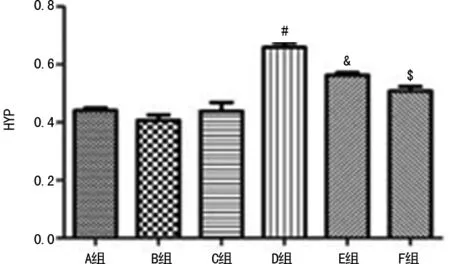
#:P<0.05,与A组比较;&:P<0.05,与D组比较;$:P<0.05,与E组比较
图5各组大鼠肺组织HYP水平
3 讨 论
BPD是多因素导致的复杂疾病,氧疗是治疗新生儿缺氧的常用手段,但持续高浓度氧疗会导致肺损伤、肺发育受阻,是诱导BPD发生的主要原因之一。近年来新生儿医学和围生医学的发展,使极低出生体质量儿存活率增加,BPD的发生率随之增加,而对此目前仍无有效治疗手段,干细胞治疗现也仍处于实验阶段[4]。近年来H2在多器官多系统的多种损伤模型中均观察到了强大的保护效应[11-14]。Muramatsu等[15]发现H2可通过减少炎症因子及毒性活性氧(ROS)的释放减少新生大鼠BPD的发生,但其具体机制尚不完全清楚,抗氧化作用仍被认为是其主要机制之一[5],而氧化应激与高氧诱导BPD关系密切,H2可能为BPD的防治带来新突破,因此H2在高氧致BPD中的作用值得进一步研究。
本研究结果显示高氧组MDA水平明显增高、SOD活力明显降低,氧化损伤明显,抗氧化能力降低,肺组织α-SMA表达和HYP水平明显增多,肺纤维化明显。H2干预后,高氧所导致的上述变化均有明显改善,H2在高氧所导致的肺组织氧化损伤、肺纤维化过程中均发挥了保护效应。结果与其他研究较为一致[6]。同时,研究结果也显示H2能明显减轻长时间使用高浓度氧导致的肺氧化损伤,改善肺发育受阻和肺纤维化,这对于改善BPD远期预后有重要意义。
H2摄入途径多样,有直接吸入H2气体、饮用富氢水、注射富氢生理盐水、氢水浴等,而H2在各研究中的用量大相径庭。既往研究发现只要给予小剂量H2即可达到治疗效果,增加H2用量能否取得更好效果?Ohsawa等[7]研究发现吸入2%和4%H2在大鼠脑缺血再灌注损伤时大脑梗死面积无显著差异。有研究对比分析腹腔注射生理盐水和H2对大鼠或兔H2代谢的影响,发现等量腹腔注射H2也能快速提高机体H2浓度,并较腹腔注射富氢生理盐水维持更长时间的H2高水平状态[8-9]。且有研究发现腹腔注射H2作为有效治疗手段对心脏骤停兔的脑发挥保护效应[10]。为保证实验安全性及H2用量的准确性,本研究采用腹腔注射富氢生理盐水的方式,为进一步验证H2的量效关系,本研究还采用了腹腔注射等体积H2,并对两种方式进行了对比分析。结果显示两种方式均可明显改善高氧所致新生大鼠肺损伤,而腹腔注射H2较腹腔注射富氢生理盐水更为显著地降低了MDA和HYP水平,提示其保护效应可能存在一定的量效关系,但需进一步研究。
综上所述,H2对高氧致肺损伤过程中肺组织的氧化应激损伤、肺发育受阻及肺纤维化等过程均发挥了保护效应,腹腔注射等体积H2的H2摄入量远大于腹腔注射富氢生理盐水,在部分检测指标中观察到了更好的保护作用,提示其保护效应可能存在一定的量效关系。H2可能成为防治BPD的有效手段之一,而目前H2的研究多为动物实验,其临床效应有待进一步验证,其用量、方式及具体作用机制有待更深入的研究。
[1]Shen M,Zhang H,Yu C,et al.A review of experimental studies of hydrogen as a new therapeutic agent in emergency and critical care medicine[J].Med Gas Res,2014,4(1):17.
[2]Sun Q,Cai J,Liu S,et al.Hydrogen-rich saline provides protection against hyperoxic lung injury[J].J Surg Res,2011,165(1):43-49.
[3]胡良冈,钱燕,龚永生,等.SPF级新生大鼠高氧肺损伤模型的建立[J].中国实验动物学报,2008,16(6):441-444.
[4]Mobius MA,Thebaud B.Cell therapy for bronchopulmonary dyspsia:promises and perils[J].Paediatr Respir Rev,2016,20(1):18.
[5]Iida AI,Nosaka N,Yumoto T,et al.The clinical application of hydrogen as a medical treatment[J].Acta Med Okayama,2016,70(5):331-337.
[6]孟超,周华成.氢气对肺损伤保护作用的研究进展[J].临床肺科杂志,2014,19(10):1896-1904.
[7]Ohsawa I,Ishikawa M,Takahashi K,et al.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J].Nat Med,2007,13(6):688-694.
[8]林涛,黄国庆,文明祥,等.腹腔注射氢气与腹腔注射氢水对大鼠氢气代谢的影响[J].广西医学,2012,34(11):1488-1491.
[9]黄国,詹蔚,熊艳,等.不同给氢方式对兔代谢的影响[J].中国组织工程研究,2012,16(11):2023-2027.
[10]Huang G,Zhou J,Zhan W,et al.The neuroprotetive effects of intraperitoneal injection of hydrogen in rabbits with cardiac arrest[J].Resuscitation,2013,84(5):690-695.
[11]王大为,刘琦,陈兴,等.富氢生理盐水对烟雾吸入所致大鼠急性肺损伤的保护作用[J].山东医药,2014,54(2):20-23.
[12]李葛威,吴成如,方健,等.富氢生理盐水对兔脊髓损伤神经细胞凋亡及凋亡相关蛋白表达的影响[J].颈腰痛杂志,2015,36(3):197-204.
[13]赵婷婷,耿立成.富氢生理盐水对大鼠视网膜缺血再灌注损伤神经保护作用的研究[J].海峡药学,2016,28(1):25-27.
[14]Liu NH,Zhang Y,He J,et al.Hydrogen sulfide protects H9c2 cardiac cell against doxorubicin?induced cytotoxicity through the PI3K/Akt/FoxO3a pathway[J].Cell Physiol Biochem,2013,32(6):1668-1680.
[15]Muramatsu Y,Ito M,Oshima T,et al.Hydrogen-rich water ameliorates bronchopulmonary dysplasia (BPD) in newborn rats[J].Pediatr Pulmonol,2016,51(9):928-935.
Effectofintraperitonealinjectionofhydrogenandhydrogen-richsalineinneonatalratswithhyperoxia-inducedlunginjury*
WuDan1,YaoLan2△,YuPan3,SunXuejun4,FangFang1,XuFeng1,LiuChengjun1
(1.PediatricIntensiveCareUnit,AffiliatedChildren′sHospitalofChongqingMedicalUniversity,Chongqing400014,China;2.SecondDepartmentofRespiration,AffiliatedChildren′sHospitalofChongqingMedicalUniversity/MinistryofEducationKeyLaboratoryofChildDevelopmentandDisorders,Chongqing400014,China;3.DepartmentofBurnandPlasticSurgery,JinlingHospital,SchoolofMedicine,NanjingUniversity,Nanjing,Jiangsu210002,China;4.DepartmentofDivingMedicine,FacultyofNavalMedicine,SecondMilitaryMedicalUniversity,Shanghai200433,China)
ObjectiveTo observe and comparatively analysize the effect of intraperitoneal injection of hydrogen and hydrogen-rich saline in neonatal rats with hyperoxia-induced lung injury.MethodsSprague-Dawley(SD) newborn rats were randomly divided into six groups(n=10).air group(A),air+ hydrogen-rich saline group(B),air+hydrogen group(C),hyperoxia group(D),hyperoxia+hydrogen-rich saline group (E) and hyperoxia+hydrogen group(F).The group A,B and C were exposed to air and group D,E and F were exposed to 95% oxygen.The group B and E were intraperitoneally injected with hydrogen-rich saline (10 mL/kg,twice daily),while the groups C and F with hydrogen (10 mL/kg,twice daily).The group A and D were injected with normal saline(10 mL/kg,twice daily).Lung tissue and serum samples were collected on 15 d of experiment.The pathological changes of lung tissue and radiate alveoli count (RAC) were observed by HE staining.The content of HYP in lung tissue was detected by the alkaline hydrolysis method,serum SOD and MDA levels were measured.The expression of α-SMA in lung tissue was detected by immunohistochemistry SP method.ResultsCompared with the A group,RAC and SOD activities in the D group were significantly decreased,while the HYP and MDA levels and α-SMA expression were significantly increased.Hydrogen intervention could significantly alleviate these changes caused by hyperoxia.while intraperitoneal injection of hydrogen got better effect than intraperitoneal injection of hydrogen-rich saline.ConclusionHydrogen can extenuate the indexes of hyperoxia-induced lung oxidative damage,impairment development and fibrosis to a certain extent.Intraperitoneal injection of hydrogen has slightly better effect than hydrogen-rich saline.
hydrogen;pulmonary fibrosis;hyperoxia-induced lung injury;pulmonary development
R729
A
1671-8348(2017)25-3466-04
2017-01-20
2017-06-08)
重庆市科委基金资助项目(cstc2013jcyjA10031)。
吴丹(1991-),硕士,主要从事高氧肺损伤方面的研究。
△通信作者,E-mail:yaolankaoyan2008@163.com。
