胶质母细胞瘤放疗结合替莫唑胺治疗对比单独放疗的Meta分析
2017-10-13宋向奇张卫红付爱军李建民
李 梅,陈 通△,宋向奇,张卫红,付爱军,朱 军,李建民
(1.华北理工大学附属医院神经外科,河北唐山 063000;2.河北省肃宁县人民医院神经外科 061000;3.华北理工大学附属医院护理部,河北唐山 063000)
2016年度重庆市出版专项资金资助项目
循证医学doi:10.3969/j.issn.1671-8348.2017.25.029
胶质母细胞瘤放疗结合替莫唑胺治疗对比单独放疗的Meta分析
李 梅1,陈 通1△,宋向奇2,张卫红3,付爱军1,朱 军1,李建民1
(1.华北理工大学附属医院神经外科,河北唐山 063000;2.河北省肃宁县人民医院神经外科 061000;3.华北理工大学附属医院护理部,河北唐山 063000)
目的评价胶质母细胞瘤患者放疗结合替莫唑胺治疗方案的有效性和安全性。方法按Cochrane 系统评价方法,分别检索Pubmed、Cochrane library、Medline、OVID数据库,对纳入的文献进行质量评估,提取数据后进行Meta分析。结果纳入的研究中替莫唑胺组对比单独放疗组汇总显示:12个月总生存率[RR1.22,95%CI(1.01,1.47),P=0.04]、24个月总生存率[RR2.65,95%CI(1.86,3.78),P<0.01],差异均有统计学意义。12个月无进展生存率[RR2.59,95%CI(1.53~4.40),P=0.000 4]、24个月无进展生存率[RR6.77,95%CI(2.82~16.26),P<0.01],差异也有统计学意义。血液毒性反应:替莫唑胺组中同步治疗期对比放疗期 [RR3.21,95%CI(1.89,5.46),P<0.01];替莫唑胺组中辅助治疗期对比放疗组[RR6.11,95%CI(3.70,10.09),P<0.01];替莫唑胺组中同步治疗期对比辅助治疗期[RR0.48,95%CI(0.36,0.65),P<0.01],差异均有统计学意义;非血液毒性反应事件[RR1.11,95%CI(0.72,1.70),P=0.64],差异无统计学意义。结论放疗结合同步和随后辅助替莫唑胺治疗提高了胶质母细胞瘤患者的总生存期和无进展生存期,较高血液毒性反应发生率与替莫唑胺治疗药物相关。
放射疗法;药物疗法;胶质母细胞瘤
胶质母细胞瘤是成人最常见的原发中枢神经系统恶性肿瘤,占成人恶性脑肿瘤60%以上[1];其预后差,平均总生存期仅12~18个月,即使患者具有年龄较小、积极手术切除、放疗和化疗等有利条件,大多数依旧在2年内死亡[2-3]。近年来,替莫唑胺作为一种口服烷化剂类抗肿瘤药物,通过直接杀死肿瘤细胞来抑制肿瘤生长,口服治疗后有几乎完整的生物利用度;易通过血脑屏障,在脑脊液中达到很高的药物浓度,不良反应发生率低[4-6]。2005年Stupp等[7]进行了一个较大的随机试验(EORTC/NCIC)证实,术后放疗结合同步和随后辅助替莫唑胺治疗对比术后单独放疗均延长了无进展生存期和总生存期。随后,美国食品药物管理局(FDA)批准在手术后放疗的新诊断胶质母细胞瘤标准治疗方案中加入替莫唑胺治疗形成新的标准方案。同年,Athanassiou等[6]进行的一个较小的随机试验得出结论与Stupp相似,在该试验中同步治疗期的方案与其相同,但在辅助治疗期有些差异,该方案为每2星期连续5 d替莫唑胺治疗代替每4星期连续5 d的方案。在此基础上,本研究收集了相关外文随机或非随机试验(截止检索日期为2016年5月31日),旨在评估胶质母细胞瘤患者术后替莫唑胺同步放疗结合随后辅助治疗对比术后单独放疗的安全性及有效性。
1 资料与方法
1.1纳入及排除标准 纳入标准:(1)研究对象年龄小于70岁,经组织病理学证实的新诊断的胶质母细胞瘤患者;(2)研究类型为前瞻性、回顾性、随机、非随机研究;(3)干预措施为试验组标准放疗(每星期连续放疗5 d,每天2 Gy,共6个星期,总剂量为60 Gy)结合同步替莫唑胺(75 mg/m2)治疗,随后辅助替莫唑胺治疗(150~200 mg/m2,每28天连续治疗5 d,28 d为1个周期,总共6个周期),对照组单独标准放疗(与治疗组相同);(4)全面检索所有外文文献,不进行语言限定。排除标准:有严重血液、肝、肾功能障碍等系统性疾病;伴随其他部位原发或转移肿瘤;颅内脓肿史;哺乳或怀孕妇女;之前接受其他方式化疗、放疗或免疫治疗;对替莫唑胺治疗过敏;单臂和动物模型试验。
1.2结局测量指标 主要指标为总生存期(overall survival,OS)。次要指标为无进展生存期(progression free survival,PFS)和不良反应事件(血液或非血液毒性反应)。
1.3检索策略 分别对Pubmed、Cochrane library、Medline、OVID各数据库进行检索,检索日期为建库到2016年5月31日;检索式为:(glioma OR glioblastoma)AND temozolomide AND (radiotherapy OR radiation therapy)AND (random OR randomized controlled trial OR nonrandom OR nonrandomized controlled trial),人工检索相关参考文献、杂志期刊、会议论文,检索WHO国际临床注册网站,查询正在进行的研究和已完成但尚未发表的临床研究。
1.4资料筛选与质量评估 两名评价者均接受专业培训,按照试验设计标准,独立地筛选文献检索结果并阅读全文,采用Cochrane质量评估方法和(或)NOS分别对纳入研究的随机试验和非随机试验进行评估,评估过程中为避免纳入研究选择偏倚的出现,对选择文献有任何不一致意见均经两人讨论后解决或者与第三方协商解决。
1.5统计学处理 采用RevMan5.3统计软件进行Meta分析,生存资料采用风险比(hazard ratio,HR)和95%可信区间(confidence interval,CI)进行OS和PFS分析,以P<0.05为差异有统计学意义。如果原始文献中没有给出或无法从原作者处获得HR值和95%CI数值,可以采用相对危险度(relative risk,RR)及其95%CI代替。纳入研究的异质性检验使用χ2和I2统计量,当P<0.1、I2>20%时,认为结果有显著异质性,采用随机效应模型;反之采用固定效应模型。
2 结 果
2.1文献检索流程 见图1。
2.2纳入研究的质量评价 共纳入4篇文献,其中2篇为非随机试验,2篇为随机试验,根据研究设定对不同试验类型采用不同的评估方式(表1、2),研究中对原始文献有任何问题,通过电话或者邮件咨询原作者解决。
2.3Meta分析结果
2.3.1OS Meta分析显示(图2、3),根据研究类型分为2个亚组,12个月总生存率分析中随机试验组(P=0.47,I2=0%)和非随机试验组(P=0.15,I2=51%)均无统计学异质性,采用随机试验模型。随机试验组[RR1.18,95%CI(1.03,1.35),P=0.02],非随机试验组[RR1.51,95%CI(0.83,2.74),P=0.18];汇总:4个研究间无统计学异质性(P=0.43,I2=0%),差异有统计学意义[RR1.22,95%CI(1.01,1.47),P=0.04]。24个月总生存率分析:2个亚组均无统计学异质性,采用固定效应模型。随机试验组[RR2.57,95%CI(1.76,3.75),P<0.01],非随机试验组[RR3.22,95%CI(1.12,9.27),P=0.03];汇总:4个研究间无统计学异质性(P=0.69),差异有统计学意义[RR2.65,95%CI(1.86,3.78),P<0.01]。
2.3.2PFS Meta分析显示(图4、5)纳入的4个研究中只有3个研究获得无进展生存率,12个月无进展生存率分析:非随机试验亚组无统计学异质性(P=0.11,I2=61%),采用随机效应模型。随机试验组[RR2.95,95%CI(1.95,4.46),P<0.01],非随机试验组[RR2.30,95%CI(0.72,7.40),P=0.16];汇总:3个研究间无统计学异质性(P=0.70),差异有统计学意义[RR2.59,95%CI(1.53,4.40),P=0.000 4]。24个月无进展生存率分析:2个亚组无异质性,采用固定效应模型。随机试验组[RR7.72,95%CI(2.76,21.60),P<0.01],非随机试验组[RR4.49,95%CI(0.82,24.63),P=0.08];汇总:3个研究间无统计学异质性(P=0.59),差异有统计学意义[RR6.77,95%CI(2.82,16.26),P<0.01]。此外,Szczepanek等[9]报道了放疗组和替莫唑胺治疗组无进展生存期分别为5.0个月和7.5个月,揭示了替莫唑胺组比单独放疗组无进展生存期提高了2.5个月。

图1 文献检索流程

纳入研究随机隐藏分组盲法资料选择性报告其他Stupp等2005[7]是不清楚不清楚完整无不清楚Szczepanek等2013[9]是不清楚不清楚完整无不清楚
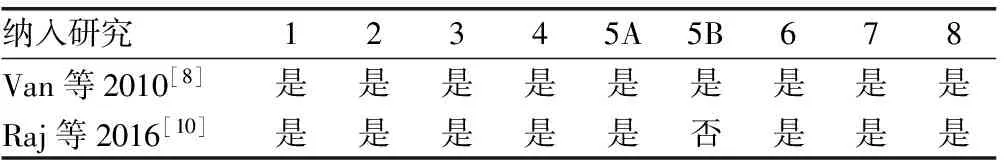
表2 非随机试验质量评估
1:独立的确定研究病例;2:病例人口学代表性;3:医院对照;4:无胶质瘤病史;5A:研究中年龄的控制;5B:其他研究因素的控制;6:结果评价的质量;7:足够的随访时间;8:整个试验的完整性
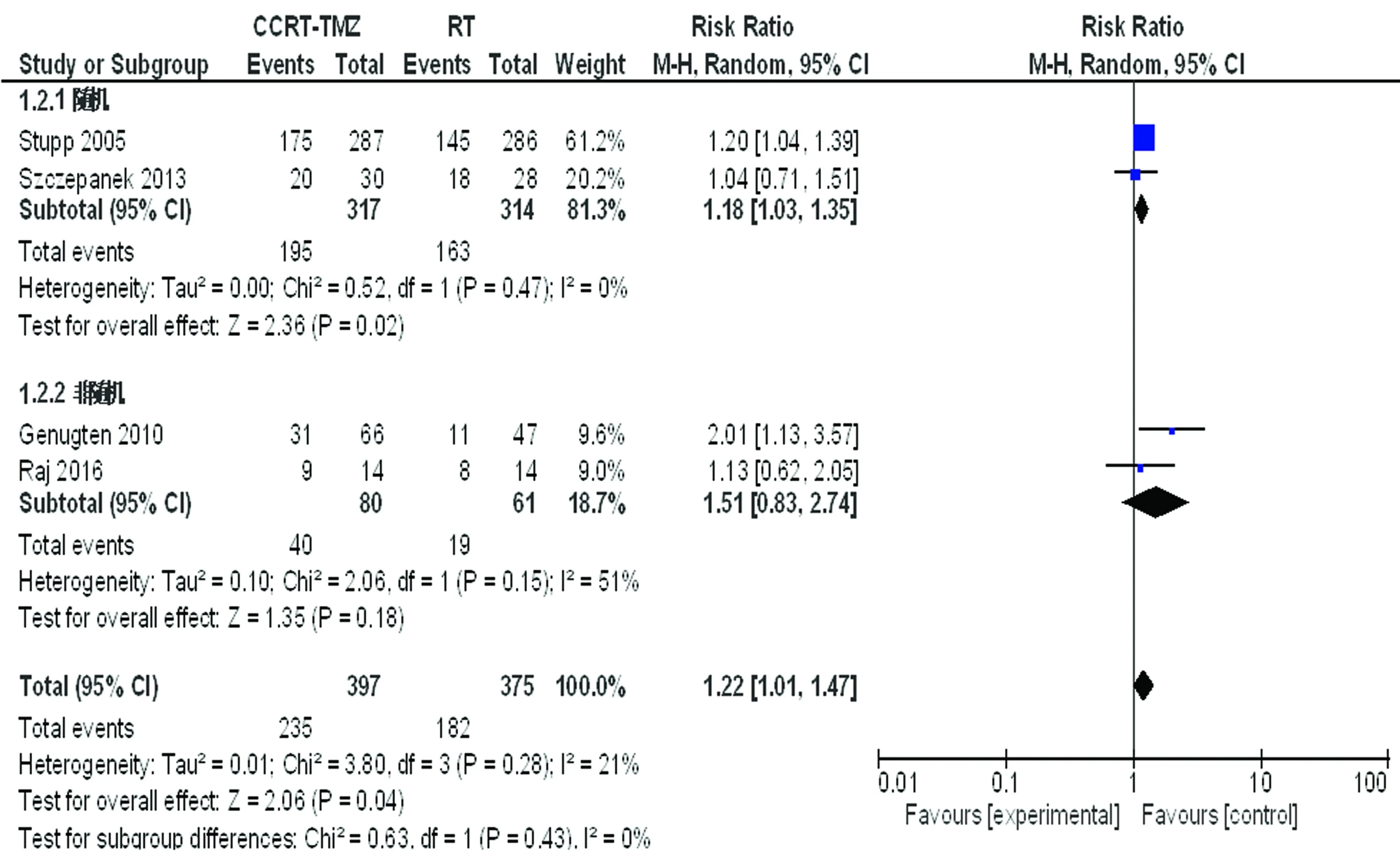
图2 12个月总生存率

图3 24个月总生存率
2.3.3不良反应事件 纳入的4个研究,2个非随机试验仅报道了替莫唑胺组不良反应事件发生率高于放疗组,然而并没有获得详细的数据记录。2个随机试验根据替莫唑胺治疗的不同时期之间与放疗组血液毒性反应发生率进行亚组分析。3个亚组分析均无异质性(P>0.1),采用固定效应模型;结果显示分别为替莫唑胺组中同步治疗期对比放疗组 [RR3.21,95%CI(1.89,5.46),P<0.01];替莫唑胺组中辅助治疗期对比放疗组[RR6.11,95%CI(3.70,10.09),P<0.01];替莫唑胺组中同步治疗期对比辅助治疗期[RR0.48,95%CI(0.36,0.65),P<0.01],差异均有统计学意义。2个随机试验中替莫唑胺组对比放疗组非血液毒性反应事件无异质性(P=0.21,I2=36%),采用随机效应模型;差异有统计学意义[RR1.11,95%CI(0.72,1.70),P=0.64]。
2.4敏感性分析 对以上Meta分析均进行敏感性分析,结果均未发生逆转,说明本研究结果可靠。

图4 12个月无进展生存率

图5 24个月无进展生存率
3 讨 论
胶质母细胞的治疗依旧是一个极具挑战的问题。早期进行的一个开放性二期试验纳入64例新诊断胶质母细胞瘤患者探索放疗结合同步替莫唑胺治疗和随后辅助6个周期替莫唑胺治疗的安全性和可耐受性,揭示该方案在胶质母细胞瘤患者中是安全的。随后大量研究探索该方案对比单独放疗的疗效。
本研究收集了4个相关研究进行Meta分析,结果揭示替莫唑胺同步放疗结合随后辅助替莫唑胺治疗对比单独放疗显著提高了胶质母细胞瘤患者的总生存率和无进展生存率。纳入的试验中所有患者均给予预防肺孢子虫肺炎和止吐剂治疗,两治疗组非血液毒性反应发生率比较差异无统计学意义(P=0.64),常见的反应为疲劳、无力、恶心、感染等;然而在替莫唑胺组同步治疗期和辅助治疗期分别对比单独放疗组血液毒性反应发生率显著提高,同时在替莫唑胺组辅助期相对于同步期血液毒性反应的发生率增加了48%,揭示血液毒性反应的发生率增加可能与替莫唑胺治疗相关,但在纳入的研究中所有不良反应经过治疗均可逆转,因不良反应事件发生终止治疗的患者所占比例也极少。
O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)是一种细胞DNA修复蛋白酶在O6鸟嘌呤位置快速逆转烷基化,因此可以中和烷化剂的细胞毒性作用[11-12]。Hegi等[13]进行的一个前瞻性临床试验证实了MGMT甲基化状态在烷化剂治疗的胶质母细胞瘤患者中是一个独立的预测因子。随后Stupp等[14]进行试验的5年分析中也揭示了MGMT启动子甲基化是最强的生存期预测因子,可以从替莫唑胺治疗中获益。然而,来自日本单中心试验的结果揭示了胶质母细胞瘤患者可以从Stupp方案中获益但MGMT的表达与延长生存期没有显著关系[15]。除此之外,在EORTC/NCIC试验的5年分析中依旧考虑了手术切除方式、年龄、递归分区分级(RPA)在替莫唑胺治疗中的获益,揭示部分或完全手术切除比仅单纯活检患者从替莫唑胺治疗中获益显著,年龄大于或等于50岁比小于50岁的患者降低了替莫唑胺治疗的疗效,同样RPAⅤ/Ⅳ级对比RPAⅢ级也降低了替莫唑胺治疗的疗效,提出这些因素的存在可能对胶质母细胞瘤患者的预后存在一定的影响。然而本文纳入的772例患者大部分有较好的基线状态(包括年龄,手术切除方式,卡氏评分等),在原始文献中根据这些可能的预后影响因素没有给予详细的数据分组分析,因此本研究也没有在该方面进行详细的亚组分析。
综上所述,本研究进一步证实了在胶质母细胞瘤患者中替莫唑胺同步放疗结合随后辅助替莫唑胺治疗具有有效性和安全性;该方案提高了这类患者的OS和PFS,其中血液毒性反应发生率的增高和替莫唑胺治疗药物相关。然而,在当前的分析中依旧存在许多缺陷:(1)当前试验纳入的均为英文文献,所有纳入研究试验地点均在国外,较局限,基于我国的基本现状、经济理念,在国内推广可能存在一定的困难;(2)在当前的分析中手术后开始治疗的时间存在一定的差异,这些差异存在对患者预后的影响尚未可知;而且本研究没有考虑先前试验提出的预后因素的影响;(3)当前研究中仅叙述了替莫唑胺治疗有利于胶质母细胞瘤患者,然而并没有区分其有效性来源于同步治疗期、辅助治疗期或者二者均存在。因此,在未来需要根据患者年龄、手术切除方式、递归分区分级、MGMT启动子甲基化状态等进行大量的研究进一步证实该类因素在胶质母细胞瘤患者中对替莫唑胺制剂治疗的影响,同时需要考虑替莫唑胺治疗中同步治疗期和辅助治疗期存在的具体意义,用于指导个体化治疗,期望患者从替莫唑胺治疗中获得最大的疗效。
[1]Rock K,McArdle O,Forde P,et al.A clinical review of treatment outcomes in glioblastoma multiforme-the validation in a non-trial population of the results of a randomised phase Ⅲ clinical trial:has a more radical approach improved survival?[J].Br J Radiol,2012,85(1017):729-733.
[2]Mineo JF,Bordron A,Baroncini M,et al.Prognosis factors of survival time in patients with glioblastoma multiforme:a multivariate analysis of 340 patients[J].Acta Neurochir (Wien),2007,149(3):245-253.
[3]Ashby LS,Ryken TC.Management of malignant glioma:steady progress with multimodal approaches[J].Neurosurg Focus,2006,20(4):E3.
[4]Cohen MH,Johnson JR,Pazdur R.Food and drug administration drug approval summary:temozolomide plus radiation therapy for the treatment of newly diagnosed glioblastoma multiforme[J].Clin Cancer Res,2005,11(19 Pt 1):6767-6771.
[5]Chakravarti A,Erkkinen MG,Nestler U,et al.Temozolomide-mediated radiation enhancement in glioblastoma:a report on underlying mechanisms[J].Clin Cancer Res,2006,12(15):4738-4746.
[6]Athanassiou H,Synodinou M,Maragoudakis E,et al.Randomized phase Ⅱ study of temozolomide and radiotherapy compared with radiotherapy alone in newly diagnosed glioblastoma multiforme[J].J Clin Oncol,2005,23(10):2372-2377.
[7]Stupp R,Mason WP,Van Den Bent MJ,et al.European organisation for research and treatment of cancer brain tumor and radiotherapy groups;National cancer institute of Canada clinical trials group[J].N Engl J Med,2005,352(10):987-996.
[8]Van GJ,Leffers P,Baumert BG,et al.Effectiveness of temozolomide for primary glioblastoma multiforme in routine clinical practice[J].J Neurooncol,2010,96(2):249-257.
[9]Szczepanek D,Marchel A,Krupa M,et al.Efficacy of concomitant and adjuvant temozolomide in glioblastoma treatment:a multicentre randomized study[J].Neurol Neurochir Pol,2013,47(2):101-108.
[10]Raj S,Pandit PN,Kishor K.A retrospective comparative study of concomitant chemoradiotherapy followed by adjuvant temozolomide versus radiotherapy alone in newly diagnosed glioblastoma multiforme-an experience at radium institute,patna medical college and hospital[J].Gulf J Oncolog,2016,1(20):6-11.
[11]Stupp R,Dietrich PY,Ostermann KS,et al.Promising survival for patients with newly diagnosed glioblastoma multiforme treated with concomitant radiation plus temozolomide followed by adjuvant temozolomide[J].J Clin Oncol,2002,20(5):1375-1382.
[12]Hegi ME,Liu LL,Herman JG,et al.Correlation of O-6-methylguanine methyltransferase (MGMT) promoter methylation with clinical outcomes in glioblastoma and clinical strategies to modulate MGMT activity[J].J Clin Oncol,2008,26(25):4189-4199.
[13]Hegi ME,Diserens AC,Godard S,et al.Clinical trial substantiates the predictive value of O-6-methylguanine-DNA methyltransferase promoter methylation in glioblastoma patients treated with temozolomide[J].Clin Cancer Res,2004,10(6):1871-1874.
[14]Stupp R,Hegi ME,Mason WP,et al.Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J].Lancet Oncol,2009,10(5):459-466.
[15]Oike T,Suzuki Y,Sugawara K,et al.Radiotherapy plus concomitant adjuvant temozolomide for glioblastoma:Japanese mono-institutional results[J].PLoS One,2013,8(11):e78943.
Metaanalysisoncomparisonbetweenradiotherapycombinedwithtemozolomideandsingleradiotherapyinglioblastoma
LiMei1,ChenTong1△,SongXiangqi2,ZhangWeihong3,FuAijun1,ZhuJun1,LiJianmin1
(1.DepartmentofNeurosurgery,AffiliatedHospital,HuabeiUniversityofScienceandEngineering063000,China;2.SuningCountyPeople′sHospital,Hebei061000,China;3.DepartmentofNursing,AffiliatedHospital,HuabeiUniversityofScienceandEngineering,Tangshan,Hebei063000,China)
ObjectiveTo evaluate the efficacy and safety of radiotherapy combined with concurrent and then adjuvant temozolomide in the patient with glioblastoma.MethodsThe databases of PubMed,Cochrane library,Medline and OVID were retrieved according to the Cochrane systematical assessment method.The included literatures were performed the quality evaluation and the meta analysis was performed after extracting the data.ResultsThe summary of comparison between temozolomide group and radiotherapy group in the included studies showed that the 12-month overall survival rate[RR1.22,95%CI(1.01,1.47),P=0.04]and 24-month overall survival rate[RR2.65,95%CI(1.53,4.40),P<0.01]had statistically significant differences;the 12-month pregrossion free survival rate[RR2.59,95%CI(1.53,4.40),P=0.000 4] and 24-month pregrossion free survival rate[RR6.77,95%CI(2.82,16.26),P<0.01]also showed statistically significant difference.The results of adverse reaction events revealed that the hematological toxic reactions in the temozolomide group had statistical difference between the concurrent therapy period and radiotherapy period [RR3.21,95%CI(1.89,5.46),P<0.01];which in the temozolomide group had statistical difference between the concurrent period and adjuvant period [RR0.48,95%CI(0.36,0.65),P<0.01);but the non-hematological toxic reaction had no statistical difference[RR1.11,95%CI(0.72,1.70),P=0.64].ConclusionRadiotherapy combined with concurrent and then adjuvant temozolomide therapy improves the overall and progression free survival period in the patient with glioblastoma,the higher occurrence rate of hematologic toxic reactions is correlated with temozolomide treatment drugs.
radiotherapy;drug therapy;glioblastoma
R739.4
A
1671-8348(2017)25-3542-05
2016-12-06
2017-06-21)
李梅(1988-),硕士,主要从事胶质瘤方面的研究。
△通信作者,E-mail:ct.1973@163.com。
