离子液体选择性萃取分离磷脂酰丝氨酸和磷脂酰胆碱
2017-10-13师维李煜惠锁显杨启炜杨亦文邢华斌
师维,李煜惠,锁显,杨启炜,杨亦文,邢华斌
离子液体选择性萃取分离磷脂酰丝氨酸和磷脂酰胆碱
师维,李煜惠,锁显,杨启炜,杨亦文,邢华斌
(浙江大学化学工程与生物工程学院,生物质化工教育部重点实验室,浙江杭州 310029)
同系物分离是高纯度药物单体和化学品制备中的重要环节,磷脂酰丝氨酸是一类重要的药物和功能添加剂,其制备过程中的关键技术是磷脂酰丝氨酸与其他磷脂同系物的分离,但同系物之间结构相似、分离难度大。报道了以离子液体为介质选择性萃取分离磷脂酰丝氨酸和磷脂酰胆碱的方法,系统研究了离子液体结构和浓度、萃取温度对分离性能的影响。研究表明,离子液体的阴离子结构显著影响同系物的分离选择性,且离子液体与极性稀释剂之间存在协同萃取效应,离子液体的摩尔浓度仅为5%时,1-乙基-3-甲基咪唑溴/甲醇-正己烷两相体系中的磷脂酰丝氨酸和磷脂酰胆碱的选择性高达29.48。采用量子化计算初步研究了萃取机理,结果表明离子液体与磷脂之间形成了多重氢键和静电相互作用,从而促进了磷脂同系物之间的选择性分离。
离子液体;分离;萃取;磷脂酰丝氨酸;磷脂酰胆碱
引 言
动植物组织内存在一系列结构相似的天然活性同系物,而不同结构的同系物之间的生理活性常存在很大差异,某些单体具有独特的生理活性,因此同系物间的分离十分必要。磷脂是一类具有多重生理功能的天然活性物质,广泛存在于生物体细胞组织中,主要由磷脂酰胆碱(phosphatidylcholine,PC)和磷脂酰丝氨酸(phosphatidylserine,PS)等一系列磷脂同系物单体组成。这些磷脂同系物在生理功能和活性上存在一定差异,其中,PS因对大脑有特殊的生理活性而受到人们的广泛关注,并被广泛应用于医药和食品行业中[1]。有临床研究表明,PS对修复脑细胞、改善记忆力、缓解精神压力、防治老年痴呆以及治疗抑郁症等方面有显著疗效[2-5],这使得高纯度PS的市场需求越来越大。现有制备PS的方法主要是提取分离法和酶转化法,而通过上述两种方法只能制备出低纯度的PS,其产品中还会含有以PC为主的多种磷脂组分杂质,这些磷脂同系物因结构和性质相似,导致磷脂单体分离困难。因此,PS和其他磷脂同系物的选择性分离,尤其是PS和PC的选择性分离成为高纯PS制备过程中的关键。
目前,PS和其他磷脂同系物的分离技术有柱色谱分离法、离心分离法、膜分离法以及超临界流体萃取法等。柱色谱分离法在磷脂同系物分离中较为常见[6-7],例如,Hanahan等[7]用中性氧化铝作为吸附剂,以氯仿-甲醇(体积比为1:1)混合溶剂为洗脱剂,对低纯度PS的混合磷脂进行分离,可将PC和中性脂质混合物洗脱出,之后再经薄层色谱分离,最终可得到纯度达90%以上PS产品。柱色谱分离法虽然可获得较高的产品纯度,但存在样品处理量有限、溶剂消耗量大、能耗高等问题。离心分离法主要是依据各磷脂单体在不同溶剂中的溶解性差异,选择合适的溶剂对磷脂同系物进行离心分离。龚雁[8]将低纯度PS的混合磷脂溶解于正己烷-异丙醇(体积比为1:1)混合溶剂中,充分振荡后高速离心,离心后的沉淀固体即为PS产品,其纯度达90%以上。离心法操作简单,但其产品收率过低、处理量小,因而不适于高纯PS的大规模生产。膜分离法对PS进行分离纯化的原理是根据PS与其他磷脂单体的分子大小及分子量差异,选择合适的半透膜,使得各磷脂单体通过膜的难易程度不同,从而将PS从混合磷脂中分离出来[9]。膜分离法因膜再生困难、重复性能差等问题推广受限。超临界CO2萃取法虽在磷脂的分离中有应用[10],但是由于该法对各磷脂单体的选择性较差,目前还不能用于高纯PS的分离制备。综上,亟需研发既经济又高效的PS与其他磷脂同系物的分离方法。
离子液体是一类完全由离子组成的化合物,具有蒸气压低、热稳定性高、溶解能力好和液程宽等优良特性。此外,离子液体结构和性质具有可设计性,且内聚能高易与其他溶剂形成液-液两相体系,因而适合作萃取剂用于萃取分离过程[11-14]。近年来,以离子液体为介质的液-液萃取技术被广泛应用于结构相似物质的分离过程中,并在天然活性物质[15-16]、有机化合物[17-18]以及低碳烃[19]等分离纯化领域表现出良好的应用前景。特别是在天然活性同系物的分离中,离子液体已被用于生育酚[15-16,20]、多不饱和脂肪酸酯[21]、甾醇和生物碱[22-23]等相似结构的天然活性物质的分离,但离子液体在PS分离制备中的应用研究尚未见报道。因此,本工作研究了离子液体在PS和PC萃取分离过程中的应用,考察了离子液体结构、离子液体浓度以及萃取温度对分离性能的影响。此外,本工作还通过量子化学计算对萃取机理进行初步研究。
1 实验材料和方法
1.1 实验材料与仪器
1.1.1 实验材料 1-乙基-3-甲基咪唑溴盐([EMIm]Br,99%)、1-乙基-3-甲基咪唑四氟硼酸盐([EMIm]BF4,99%)、四乙基溴化铵([N2222]Br,99%)、1-乙基-3-甲基咪唑三氟甲烷磺酸盐([EMIm]CF3SO3,99%)、1-乙基-3-甲基咪唑高氯酸盐([EMIm]ClO4,99%)、-乙基吡啶溴盐([EPy]Br,99%)、1-丁基-3-甲基咪唑溴盐([BMIm]Br,99%)、1-乙基-3-甲基咪唑氯盐([EMIm]Cl,99%)、1-己基-3-甲基咪唑溴盐([HMIm]Br,99%)、1-辛基-3-甲基咪唑溴盐([OMIm]Br,99%),购自中国科学院兰州化学物理研究所绿色化学与催化中心;溴化胆碱([Ch]Br,98%),购自梯希爱(上海)化成工业发展有限公司;正己烷(分析纯)、甲醇(分析纯),购自国药集团化学试剂有限公司;磷脂酰丝氨酸(PS,97%),购自Sigma公司;磷脂酰胆碱(PC,98%),购自德国Lipoid公司;粉末磷脂原料购于陕西帕尼尔生物科技有限公司。以上各离子液体结构如图1所示。
1.1.2 实验仪器 高效液相色谱仪(包括1525二元高压梯度泵,717 plus自动进样器,2420蒸发光散射检测器),Waters公司;恒温振荡器(ZQZY-70B),上海知楚仪器有限公司。
1.2 实验方法
1.2.1 萃取实验
(1)预平衡实验。将离子液体与甲醇按一定比例混合配制成复合萃取剂,取适量与一定量的正己烷加入50 ml具塞锥形瓶中,然后置于ZQZY-70B恒温振荡器中,在一定温度下以215 r·min−1的速度振荡2 h,之后在相同温度下静置至两相完全分层;取出彻底分离后的上下两相放于锥形瓶中待用。
(2)萃取实验。用平衡后的正己烷,将粉末磷脂原料溶解配制成3 mg·ml−1的原料液。取5 ml原料液与相同体积平衡后的复合萃取剂加入25 ml的具塞锥形瓶中,将此锥形瓶置于恒温振荡器中,在预平衡实验温度下,以215 r·min−1的速度振荡2 h,然后在相同温度下静置至两相完全分层;以注射器分别对上相、原料液取样,然后进行高效液相色谱(HPLC)分析。
1.2.2 色谱分析方法 色谱柱为硅胶柱(Waters Sunfire Prep Silica,5.0 μm,4.6 mm × 250 mm);柱温30℃;蒸发光散射检测器增益为100,气压为50 psi(pounds per square inch,1 psi=6.895 kPa),漂移管温度为60℃;流动相为氯仿、甲醇、水和氨水的混合溶剂(75/24/0.5/0.5,体积比),流速为1 ml·min−1;进样量为10 μl。
分配系数A,以及溶质A对溶质B的选择性A/B的计算公式如下

(2)
式中,oA和eA分别表示溶质A在原料液中的浓度和萃取平衡后上相中的浓度,mg·ml−1。
1.3 量子化学计算
通过Gaussian 09量子化学计算软件,在HF/6-31G(d)水平下进行优化构型计算。在对离子液体-磷脂复合物构型进行优化之前,首先要对离子液体进行结构优化。由于离子液体是由阳离子和阴离子组成的化合物,所以对离子液体进行结构优化时,要考虑阴、阳离子的空间相对位置。在设定离子液体的最初构型时,将阴离子放于阳离子四周的多个区域,并通过Gaussian 09软件对各初始构型进行优化计算。之后,对优化后的构型进行频率计算,得出离子液体的稳定构型。比较各稳定构型的生成热,其中,最低能量构型即为离子液体的最优构型[24-25]。得到离子液体的最优构型后,将其放于磷脂周围多个区域进行优化,进而得出离子液体-磷脂复合物的最低能量构型。
2 实验结果与讨论
2.1 离子液体结构对萃取分离效果的影响
磷脂分子在结构上含有非极性和极性部分(图2),非极性部分由两条饱和和不饱和脂肪酸链(R1、R2)组成;极性部分由磷酸根和其他取代基团构成。磷脂同系物的结构差异主要在于极性部分的取代基团,当取代基团为丝氨酸时即为PS,当取代基团为胆碱时即为PC。虽然PS和PC结构相似,但二者的理化性质仍会受不同取代基团的影响[26],在极性和氢键酸碱性方面存在微小差异,因此有望利用离子液体较强的氢键碱性和氢键作用能力[27-28],实现选择性分离。
纯离子液体由于在常温下黏度高且极性大,不适合作为萃取剂用于脂溶性物质的萃取分离。因此,在离子液体液-液萃取体系中,可选用合适的有机溶剂作为离子液体的稀释剂,组成离子液体-有机溶剂复合萃取剂。根据PS和PC在有机溶剂中的溶解度差异,并结合有机溶剂对离子液体的溶解性,选取对磷脂有良好溶解性的正己烷为非极性相,离子液体-甲醇混合溶液为极性相,构建了离子液体/甲醇-正己烷液-液两相萃取体系。离子液体的结构是影响萃取分离性能的关键因素,所以从离子液体的阴离子、阳离子侧链长度及阳离子母核结构3个方面,考察在离子液体/甲醇-正己烷体系中离子液体结构改变对萃取性能的影响。
2.1.1 阴离子对萃取分离的影响 根据PC和PS的结构特点可知,PC的取代基团中含有带正电的季铵结构,而PS的取代基团则为整体显电中性的氨基酸结构。由此,考虑到离子液体中带负电的阴离子其电负性较大,因而具有供电子形成氢键的能力,而阴离子供电基团可与磷脂中的带电基团发生不同强度的相互作用,这将有望作为高选择性分离磷脂同系物的关键。而阴离子结构的不同,会使离子液体的供电子能力存在差异,并呈现为氢键碱性强度的差别[27]。因此,固定[EMIm]+为阳离子,选取一系列阴离子具有不同氢键碱性的离子液体,在相同的实验条件下,考察阴离子结构对萃取分离效果的影响,PC的分配系数及选择性系数如图3所示。
图3中的实验结果表明,离子液体的阴离子结构对萃取效果有较大影响,随阴离子氢键碱性的增强,PC的分配系数(PC)出现先增大后减小的趋势,PC对PS的选择性(PC/PS)大体呈上升趋势,综合考虑PC和PC/PS后发现,Br−为阴离子的离子液体/甲醇复合萃取剂表现出优良的萃取性能。据文献[29-30]报道,本研究所选用的离子液体阴离子的氢键碱性强弱顺序为Cl−> Br−> CF3SO3−> ClO4−> BF4−。在分配系数方面,当阴离子由BF4−变为CF3SO3−时,阴离子氢键碱性增加,PC由8.96提高到了12.77;当阴离子氢键碱性进一步增加,由CF3SO3−变为Br−时,PC有所下降,减小为11.79;阴离子变更为氢键碱性更强的Cl−时,PC的减小更为明显,仅有8.86。这表明选择氢键碱性适中的离子液体,可使PC在萃取体系中获得较高的分配系数。在选择性方面,阴离子按照氢键碱性增强的顺序变更,由氢键碱性较弱的BF4−变为氢键碱性较强的Br−时,PC/PS由8.37升高至29.48,最大值是最小值的3.5倍。然而再提高氢键碱性,将阴离子变更为Cl−,PC/PS显出下降趋势,降至20.60,但仍明显优于BF4−等氢键碱性较弱的阴离子的选择性(8.86)。这表明选用阴离子氢键碱性较强的离子液体,有利于PS和PC的选择性分离。
综合离子液体阴离子结构变化对PC和PC/PS的影响,可以发现以CF3SO3−、Br−为阴离子的离子液体/甲醇复合萃取剂均表现出优良的萃取性能。在Br−为阴离子的离子液体/甲醇-正己烷体系中,PC为11.79,PC/PS为29.48;当离子液体阴离子为CF3SO3−时,体系的PC和PC/PS分别为12.77和20.27,与[EMIm]Br体系相比,虽然PC的分配系数略有提高,但选择性能却明显不如后者。由此可见,Br−为阴离子的离子液体/甲醇复合萃取剂体现出更佳的萃取性能。此外,在纯甲醇为萃取剂的甲醇-正己烷两相体系中,PC和PC/PS分别为7.48和17.08,这表明当萃取体系中加入少量[EMIm]Br后,可使PC和PC/PS分别提高57.6%和72.6%,说明离子液体的加入有效提高了萃取性能。综上所述,当固定阳离子为[EMIm]+,改变离子液体的阴离子,考察阴离子结构变化对PS和PC萃取分离效果影响时发现,萃取效果受阴离子结构影响较大,阴离子氢键碱性适中的离子液体萃取性能优异。实验结果表明阴离子为Br−的离子液体与甲醇混合形成的复合萃取剂,萃取分离效果最佳。
2.1.2 阳离子侧链长度对萃取分离的影响 选用[EMIm]Br、[BMIm]Br、[HMIm]Br和[OMIm]Br 4种离子液体,在相同实验条件下,考察离子液体阳离子侧链长度对PS和PC萃取分离效果的影响,实验结构如图4所示。从实验结果可以看出,PC随离子液体阳离子侧链长度的增加而增大。例如,当阳离子侧链长度由C2(乙基)延长到C8(辛基)时,PC的分配系数由11.79提高至37.11,同时PS的分配系数也由0.40提高到了1.62。由于离子液体阳离子侧链长度的改变,会对其亲脂性产生影响,碳链越长,则离子液体的亲脂性越强。而磷脂结构中有两条C18长链,具有很强的亲脂性,因此离子液体烷基侧链的延长使离子液体与磷脂分子间的亲和力显著提高,使得磷脂更容易进入离子液体相,分配系数提高。与分配系数的改变相反,随着离子液体侧链长度的增加,PC对PS的选择性呈下降趋势。例如,随阳离子侧链长度由C2(乙基)延长到C8(辛基),PC/PS由29.48下降至22.72。这说明延长离子液体阳离子的侧链长度,虽然可以增加离子液体与磷脂间的亲和力,但却降低了离子液体对磷脂同系物间的选择性。
2.1.3 阳离子母核结构对萃取分离的影响 在相同的实验条件下,以Br−为阴离子固定不变,改变阳离子的母核结构,考察阳离子的母核结构对萃取效果的影响,结果见表1。实验表明,阳离子的母核结构对萃取效果的影响不大。例如,当阴离子为Br−,阳离子分别为[Ch]+、[EPy]+、[N2222]+、[EMIm]+时,PC的分配系数在10.29~11.79之间,差异较小。当阳离子为[Ch]+时,PC对PS的选择性相对低一些(23.39),其他3种阳离子体系中PC对PS的选择性均将近30。因此,阳离子母核结构的变化,对PS和PC的分配系数以及选择性的没有产生较大影响。
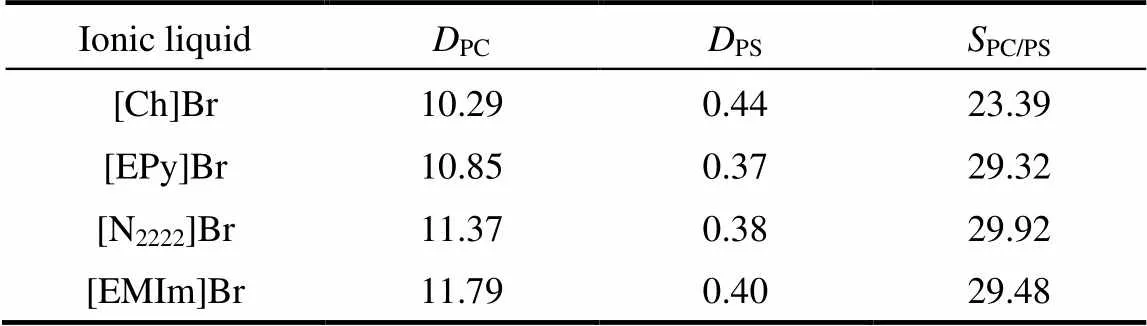
表1 离子液体阳离子母核结构对PC分配系数及PC对PS选择性的影响
Note: The initial concentration of phospholipids in the hexane phase was 3 mg·ml−1. The volume ratio of feed and extraction solvent was 1:1. The extraction temperature was 25℃. The mole fraction of IL in mixed extractant (IL+methanol) was 5%.
2.2 离子液体的浓度对萃取分离的影响
以[EMIm]Br与甲醇混合物为萃取剂,在相同的萃取实验条件下,改变萃取剂中[EMIm]Br的含量,考察离子液体的浓度变化对萃取分离效果的影响,结果如图5所示。从图中可以清晰看出,离子液体浓度的变化对PC的分配系数和PC对PS的选择性影响显著。PC随着离子液体浓度的增加,呈现先增大后减小的趋势。当离子液体在复合萃取剂中的摩尔浓度为0.05时,PC达到最大值,为11.79。与PC的变化趋势不同,PS随着离子液体浓度的增加呈缓慢下降趋势。由此可见,离子液体浓度过高时,PC的分配系数显著下降,PS的分配系数缓慢下降,这是因为离子液体是强极性物质,离子液体浓度高时极性较强,降低了油溶性的PC和PS在萃取体系极性相中的溶解度,导致分配系数下降,不利于PC的萃取。综合PC和PS随离子液体浓度增加的变化规律可知,在[EMIm]Br的摩尔浓度为5%时,PC/PS达到最大值29.48。像这样被萃取物质的分配系数随着复合萃取剂中离子液体浓度的升高出现最大值的现象,在其他以离子液体/有机溶剂为复合萃取剂的萃取分离过程中也有体现[31-32],该现象可认为是复合萃取剂中离子液体与有机溶剂协同作用的结果。离子液体浓度对萃取分离效果影响的研究表明,在离子液体/甲醇组成的复合萃取剂中,少量离子液体的加入,使得复合萃取剂与PC间的相互作用增强,可显著提高磷脂同系物的分离效率,这对工业化上提高萃取效率具有一定指导意义。
2.3 萃取温度对萃取分离的影响
以[EMIm]Br/甲醇-正己烷两相体系为例,在相同的实验条件下,考察萃取温度对萃取分离效果的影响,实验结果如图6所示。当萃取温度由25℃升高至45℃,PC的分配系数逐渐下降,由11.79下降至8.00;而PS的分配系数则基本不变,维持在0.45左右。这可能是因为在较高温度下,磷脂与复合萃取剂间较难形成稳定的氢键(详见2.4节),从而导致两者之间的相互作用力减弱,磷脂分配系数下降。此外,温度升高会增加离子液体/甲醇-正己烷两相体系的互溶度,使萃取效果变差。因此,在有离子液体参与的磷脂萃取分离过程,适宜在常温下进行。
2.4 萃取机理探究
为了探究离子液体的萃取机理,以[EMIm]Br和磷脂的作用为例,通过Gaussian 09量子化学计算软件,得出其在HF/6-31G(d)水平优化后的最优构型。根据Zhang等[33]报道,磷脂与离子液体作用时,主要是磷酸基团与离子液体发生作用。因此,分别对PC、PS简化后的磷脂末端磷酸基团与离子液体形成的复合结构进行构型优化,得到两者的最低能量构型,并计算该复合物的相互作用能。计算表明,PC与[EMIm]Br之间相互作用能为−129.45 kJ·mol−1,其作用强度显著大于PS与[EMIm]Br之间相互作用能(−91.70 kJ·mol−1),说明离子液体可选择性地萃取PC,实现PC与PS之间的分离。与常规天然活性物质与离子液体的作用能相比(−40~−70 kJ·mol−1)[34],PC、PS与[EMIm]Br的作用能相对较大。这可能是由于磷脂为两性离子化合物,其分子结构中含有带正电荷和负电荷的基团,这些带电基团与离子液体的阴、阳离子间会产生较强的静电吸引作用(详见下文分析),从而表现出较大的相互作用能。
进一步分析了PC、PS和离子液体的相互作用位点和作用方式。如图7所示,离子液体主要作用于PC与PS的两性离子部分。离子液体的阴离子Br−位于咪唑环和磷脂中带正电的N原子之间。由于离子液体阳离子的正电性分布于整个咪唑环上,所以,探究Br−到离子液体阳离子的距离时,选定Br−到咪唑环上离Br−最近的N原子和C原子的距离为考察目标。结果显示,在PC-[EMIm]Br体系中,Br−到PC季铵中N原子[图7(a):Br49-N19]的距离为0.396 nm,Br−到[EMIm]Br中N原子和C原子的距离分别为0.391 nm[图7(a):Br49-N36]和0.358 nm[图7(a):Br49-C33];在PS-[EMIm]Br 体系中,Br−到PS氨基中N原子[图7(a):Br37-N38]的距离为0.348 nm,Br−到[EMIm]Br中N原子和C原子的距离分别为0.378 nm[图7(a):Br49-N21]和0.344 nm[图7(a):Br49-C18]。综上,Br−到磷脂中的N原子的距离与Br−到咪唑环中N原子和C原子的距离非常接近,表明PC、PS与[EMIm]Br的阴离子之间均有较强的静电作用。
此外,量子化计算结果显示[EMIm]Br中咪唑环上的H原子以及烷基侧链上的H原子与磷脂的P=O之间有不同强度的氢键作用,且离子液体阴离子Br−与磷脂末端取代基团之间同样存在不同强度的相互作用力,这也为离子液体能够选择性分离PC提供了理论支持。如图7(a)所示,[EMIm]Br中咪唑环上的H原子以及烷基侧链上的H原子与PC的PO双键形成了多重氢键。例如PC中的两个PO双键与[EMIm]Br中咪唑环上H34以及烷基侧链上的H43、H46的距离分别为0.207 nm[图7(a):C32-H34···O23]、0.250 nm[图7(a):C42-H43···O23]和0.269 nm[图7(a):C45-H46···O22](H和O的范德华半径总和为0.272 nm)。其中,咪唑环上H34到PC中PO双键的距离较小(C32-H34···O23的距离为0.207 nm),说明两者存在较强的相互作用,这是因为在[EMIm]Br的咪唑环上,位于两个N原子之间的C原子[图7(a):C32],其电子云密度相对较低,导致H34显现出较强的酸性[35-36],吸引PC中的PO基团。如图7(b)所示,PS的PO双键也能与[EMIm]Br中咪唑环上的H原子以及烷基侧链上的H原子形成氢键,距离分别为0.196 nm[图7(b):C20-H24···O9]和0.252 nm[图7(b):C26-H27···O8]。虽然PC中PO双键到咪唑环上H34的距离(0.207 nm)比PS中PO双键到咪唑环上H24的距离(0.196 nm)长一些,但是咪唑环烷基侧链上的H43到PC的PO双键的距离(0.250 nm)却短于咪唑环烷基侧链上的H27到PS的PO双键的距离(0.252 nm),而且[EMIm]Br与PC之间形成了三重氢键,与PS之间仅形成双重氢键,这表明PC与[EMIm]Br之间的氢键作用更强。再从[EMIm]Br中阴离子Br−与PS、PC的末尾取代基团之间的相互作用分析,如图7(a)所示,PC末端季铵结构中的多个H原子与[EMIm]Br中阴离子Br−有很强的作用,比如PC末端N取代烷基上的H2、H11、H7到[EMIm]Br中阴离子Br−的距离分别为0.271 nm[图7(a):C1-H2···Br49]、0.274 nm[图7(a):C8-H11···Br49]和0.275 nm[图7(a):C4-H7···Br49]。Br的原子半径比O原子大,且电负性比O原子小,但上述H原子到Br原子的距离与H和O的范德华半径总和(0.272 nm)相当,这表明PC末端季铵结构与[EMIm]Br中阴离子Br−之间存在非常强的相互作用;而PS末端氨基结构中的仅有一个H原子与[EMIm]Br中阴离子Br−有较强作用,即PS末端氨基上的H39与[EMIm]Br中阴离子Br−之间的距离为0.246 nm[图7(b):N38-H39···Br37]。这进一步说明,PC与[EMIm]Br之间的相互作用要强于PS。[EMIm]Br可选择性地识别PC分子,实现PC和PS的分离。
3 结 论
报道了以离子液体为介质选择性萃取分离磷脂同系物PS和PC的方法。研究结果表明,离子液体可选择性萃取分离PC和PS,其中离子液体的阴离子结构显著影响分离性能,具备适宜氢键碱性的Br−为阴离子的离子液体不仅具有较高的分配系数,同时表现出出色的PC和PS分离选择性;延长阳离子结构可显著提高PC的分配系数。研究表明,离子液体与稀释剂之间存在协同萃取的现象,当离子液体[EMIm]Br在复合萃取剂中的摩尔浓度为5%时,[EMIm]Br/甲醇-正己烷两相体系中的PC和PC/PS达到最大值,分别为11.79和29.48。量子化学计算结果表明,离子液体与磷脂之间形成了多重氢键和静电相互作用,PC与[EMIm]Br之间的相互作用强于PS,从而促进了PC与PS间的选择性分离。本研究不仅为磷脂同系物的分离提供必要的理论依据,也为其他结构相似天然产物的分离提供了参考。
References
[1] LEIROS I, MCSWEENEY S, HOUGH E. The reaction mechanism of phospholipase D fromsp. strain PMF snapshots along the reaction pathway reveal a pentacoordinate reaction intermediate and an unexpected final product[J]. Mol. Biol., 2004, 339(4): 805-820.
[2] JORISSE B L. Safety of soy-derived phosphatidyl-serine in elderly people[J]. Nutreurosci, 2002, 5(5): 337-343.
[3] HELLHAMMER J. Effects of soy lecithin phosphatidic acid phosphatidylserine complex (PAS) on the endocrine and psychological responses tomental stress[J]. Stress, 2004, 7(2): 119-126.
[4] DELWAIDE P J. Double-blind randomized controlled study of phosphatidylserine in senile demented patients[J]. Acta Neurologica Scandinavica, 1986, 73(2): 136-140.
[5] BRAMBILLA F, MAGGIONI M. Blood levels of cytokines in elderly patients with major depressive disorder[J]. Acta Psychiatrica Scandinavica, 1998, 97(4): 309-313.
[6] 司朝勇, 吴素芳, 许海丹, 等. 含水量对氧化铝柱色谱法同时分离纯化卵磷脂和脑磷脂的影响[J]. 化工学报, 2005, 56(4): 689-693. SI C Y, WU S F, XU H D,. Effects of water content on simultaneous purification of PC and PE by alumina column chromatography[J]. Journal of Chemical Industry and Engineering (China), 2005, 56(4): 689-693.
[7] HANAHAN D J, CHACKOFF I L. Analysis of phospholipase D[J]. Biol. Chem., 1974: 169-199.
[8] 龚雁. 磷脂化合物的分离制备和测定方法研究[D]. 北京: 北京化工大学, 2006. GONG Y. Studies on phospholipids preparation and analysis[D]. Beijing: Beijing University of Chemical Technology, 2006.
[9] 夏玉宇. 化学实验室手册[M]. 北京: 化学工业出版社, 2004: 507-510. XIA Y Y. Handbook of Chemistry Lab[M]. Beijing: Chemical Industry Press, 2004: 507-510.
[10] 曹栋, 裘爱泳, 王兴国. 超临界流体分离大豆磷脂酰胆碱[J]. 中国油脂, 2002, 27(3): 72-74. CAO D, QIU A Y, WANG X G. Separation of soybean phosphatidylcholine by supercritical carbon dioxide/ethanol[J]. China Oils and Fats, 2002, 27(3): 72-74.
[11] 金文彬, 邢华斌, 任其龙, 等. 离子液体在结构相似物分离中的进展[J]. 中国科学: 化学, 2016, 46: 1251-1263. JIN W B, XING H B, REN Q L,. Separation of structurally-related compounds with ionic liquids[J]. Sci. Sin. Chim., 2016, 46(12): 1251-1263.
[12] 曹领帝, 曾少娟, 张锁江, 等. 离子液体吸收分离硫化氢进展[J]. 化工学报, 2015, 66(S1): 1-9. CAO L D, ZENG S J, ZHANG S J,. Progress on hydrogen sulfide removal using ionic liquids[J]. CIESC Journal, 2015, 66(S1): 1-9.
[13] ROUT A, WELLENS S, BINNEMANS K. Separation of rare earths and nickel by solvent extraction with two mutually immiscible ionic liquids[J]. RSC Adv, 2014, 4(11): 5753-5758.
[14] MEINDERSMA G W, HAAN A B. Coneeptual process design for aromatic/aliphatic separation with ionic 1iquids[J]. Chemical Engineering Research and Design, 2008, 86(7): 745-752.
[15] YANG Q W, XING H B, YANG Y W,. Selective separation of tocopherol homologues by liquid-liquid extraction using ionic liquids[J]. Ind. Eng. Chem. Res., 2009, 48(13): 6417-6422.
[16] JIN W B, YANG Q W, HUANG B B,. Enhanced solubilization and extraction of hydrophobic bioactive compounds using water/ionic liquid mixtures[J]. Green Chemistry, 2016, 18(12): 3549-3557.
[17] MATSUMOTO M, INOMOTO Y, KONDO K. Selective separation of aromatic hydrocarbons through supported liquid membranes based on ionic liquids[J]. Journal of Membrane Science, 2005, 246(1): 77-81.
[18] LARRIBA M, NAVARRO P, GARCIA J,. Liquid-liquid extraction of toluene from heptane using[EMIM][DCA], [BMIM][DCA], and [EMIM][TCM] ionic liquids[J]. Industrial and Engineering Chemistry Research, 2013, 52(7): 2714-2720.
[19] ZHAO X, YANG Q W, XU D,. Design and screening of ionic liquids for C2H2/C2H4separation by COSMO-RS and experiments[J]. AIChE Journal, 2015, 61(6): 2016-2027.
[20] LIU X X, YANG Q W, BAO Z B,. Nonaqueous lyotropic ionic liquid crystals: preparation, characterization, and application in extraction[J]. Chemistry—A European Journal, 2015, 21(25): 9150-9156.
[21] LI M, PHAM P J, PITTMAN C U,. SBA-15-supported ionic liquid compounds containing silver salts: novel mesoporous 7t-complexing sorbents for separating polyunsaturated fatty acid methyl esters[J]. Microporous and Mesoporous Materials, 2009, 117(1): 436-443.
[22] JIN W B, YANG Q W, ZHANG Z G,Self-assembly induced solubilization of drug-like molecules in nanostructured ionic liquids[J]. Chemical Communications, 2015, 51(67): 13170-13173.
[23] CAO Y F, XING H B, YANG Q W,. High performance separation of sparingly aqua-/lipo-soluble bioactive compounds with an ionic liquid-based biphasic system[J]. Green Chemistry, 2012, 14(9): 2617-2625.
[24] BINI R, BORTOLINI O, CHIAPPE C,. Development of cation/anion “interaction” scales for ionic liquids through ESI-MS measurements[J]. The Journal of Physical Chemistry B, 2007, 111(3): 598-604.
[25] SHIROTA H, CASTNER E W. Why are viscosities lower for ionic liquids with− CH2Si (CH3)3vs− CH2C (CH3)3substitutions on the imidazolium cations?[J]. The Journal of Physical Chemistry B, 2005, 109(46): 21576-21585.
[26] 贺杠. 磷脂酶D催化合成磷脂酰丝氨酸(PS)的色谱分离研究[D]. 西安: 西北大学, 2011. HE G. The chromatographic separation study of phosphatidylserine enzymatic synthetised by phospholipase D[D]. Xi’an: Northwest University, 2011.
[27] XU D, YANG Q W, SU B G,. Enhancing the basicity of ionic liquids by tuning the cation-anion interaction strength andthe anion-tethered strategy[J]. The Journal of Physical Chemistry B, 2014, 118(4): 1071-1079.
[28] DONG K, ZHANG S J. Hydrogen bonds: a structural insight into ionic liquids[J]. Chemistry—A European Journal, 2012, 18(10): 2748-2761.
[29] CAMMARATA L, KAZARIAN S G, SALTER P A,. Molecular states of water in room temperature ionic liquids[J]. Physical Chemistry Chemical Physics, 2001, 3(23): 5192-5200.
[30] CLAUDIO A F M, SWIFT L, HALLETT J P,. Extended scale for the hydrogen-bond basicity of ionic liquids[J]. Physical Chemistry Chemical Physics, 2014, 16(14): 6593-6601.
[31] YANG Q W, XING H B, SU B G,. Improved separation efficiency using ionic liquid-cosolvent mixturesas the extractant in liquid-liquid extraction: a multipleadjustment andsynergistic effect[J]. Chemical Engineering Journal, 2012, 181: 334-342.
[32] NI X L, XING H B, YANG Q W,. Selective liquid-liquid extraction of natural phenolic compounds using amino acid ionic liquids: a case of-tocopherol and methyl linoleate separation[J]. Ind. Eng. Chem. Res., 2012, 51(18): 6480-6488.
[33] ZHANG J Z, YU K, YANG Q W,Selective separation of zwitterionic phospholipidhomologues with functional ionic liquids asextractants[J]. RSCAdv, 2015, 5(95): 77581-77588.
[34] YANG Q W, XING H B, SU B G,. The essential role of hydrogen-bonding interaction in the extractive separation of phenolic compounds by ionic liquid[J]. AIChE Journal, 2013, 59(5): 1657-1667.
[35] 孙奇, 管生洲, 王晓武, 等. 咪唑及其衍生物N-1H保护基的研究进展[J/OL].[2010-03-10]. http: //jonline.nwu.edu.cn/wenzhang/ 210008.pdf. SUN Q, GUAN S Z, WANG X W,. General trends in N-1H protection of imidazole and its derivatives[J/OL].[2010-03-10]. http: //jonline. nwu. edu. cn/wenzhang/210008. pdf.
[36] SHIRLEY D A, ALLEY P W. The metalation of 1-methyl-, 1-benzyl- and 1-phenylimidazole with-butyllithium[J]. Journal of the American Chemical Society, 1957, 79(18): 4922-4927.
Selective separation of phosphatidylserine and phosphatidylcholine with ionic liquids as extractants
SHI Wei, LI Yuhui, SUO Xian, YANG Qiwei, YANG Yiwen, XING Huabin
(Key Laboratory of Biomass Chemical Engineering of the Ministry of Education,College of Chemical and Biological Engineering,Zhejiang University,Hangzhou 310029,Zhejiang,China)
Homologues separation is a key process in the production of high-purity drugs and chemicals. High-purity phosphatidylserine (PS) is widely used as drugs and functional additives; however PS often appears in a mixture withstructurally similar homologues and the selective separation of phospholipid homologues remains challenging. Here, a novel extraction method was developed to separate PS and phosphatidylcholine (PC) with ionic liquids (ILs) as extractants. The effects of structure and concentration of ILs and temperature on extraction performance were investigated. The results showed that the structure of the IL’s anion had a significant impact on the separation selectivity, and an obvious synergistic extraction effect between IL and polar diluent was observed. In 1-ethyl-3-methylimidazolium bromide([EMIm]Br)-methanol-hexane biphasic systems, the selectivity of PC to PS (PC/PS) reached up to 29.48, when the mole fraction of IL was only 5%. Additionally,calculations were used to explore the extraction mechanism, and the results indicated that the multiple hydrogen-bonding and electrostatic interactions were formed between phospholipids and ILs, which is probably beneficial for the selective separation of phospholipid homologues.
ionic liquids; separation; extraction; phosphatidylserine; phosphatidylcholine
10.11949/j.issn.0438-1157.20170319
TQ 041+.8
A
0438—1157(2017)09—3442—09
2017-03-29收到初稿,2017-05-28收到修改稿。
邢华斌。
师维(1991—),女,硕士研究生。
国家自然科学基金项目(21476192);国家万人计划-青年拔尖人才。
2017-03-29.
XING Huabin, xinghb@zju.edu.cn
supported by the National Natural Science Foundation of China (21476192) and the National Program for Support of Top-notch Young Professionals (H. X.).
