大黄素甲醚8-O-β-吡喃葡萄糖苷对皮肤黑色素瘤A375细胞凋亡的影响及机制研究
2017-10-13李晖李文静马荣曹建华韩志武青岛大学药学院药理学系山东青岛6601青岛市第三人民医院药学部山东青岛66040青岛大学附属医院药学部山东青岛66003
李晖,李文静,马荣,曹建华,韩志武(1.青岛大学药学院药理学系,山东青岛6601;.青岛市第三人民医院药学部,山东青岛 66040;3.青岛大学附属医院药学部,山东青岛 66003)
大黄素甲醚8-O-β-吡喃葡萄糖苷对皮肤黑色素瘤A375细胞凋亡的影响及机制研究
李晖1,2*,李文静2,马荣2,曹建华2,韩志武3#(1.青岛大学药学院药理学系,山东青岛266021;2.青岛市第三人民医院药学部,山东青岛 266040;3.青岛大学附属医院药学部,山东青岛 266003)
目的:研究天然产物大黄素甲醚8-O-β-吡喃葡萄糖苷(PG)对皮肤黑色素瘤A375细胞凋亡的影响及机制。方法:以0、10、20、50 μg/mL的PG作用于A375细胞24、48、72 h后,采用CCK-8法测定细胞的存活率;以0(对照)、20、50 μg/mL的PG作用于A375细胞48 h后,通过流式细胞仪以膜联蛋白Ⅴ/碘化丙啶(PI)双染法检测细胞凋亡率;免疫印迹法检测半胱氨酸天冬氨酸蛋白酶3(Caspase-3)和多腺苷二磷酸核糖聚合酶(PARP)的蛋白表达以及细胞色素C在线粒体内外的蛋白表达;以0(对照)、5、10 μmol/L的PG作用于A375细胞48 h后,采用酶底物法测定细胞中Caspase-8、Caspase-9的活性。结果:PG能有效降低A375细胞的存活率;与对照比较,20、50 μg/mL的PG作用后细胞凋亡率明显升高(P<0.01),细胞中Caspase-3、PARP及细胞基质中细胞色素C的蛋白表达均明显增强(P<0.05或P<0.01),线粒体中细胞色素C蛋白表达明显减弱(P<0.05或P<0.01);5、10 μmol/L的PG作用后细胞中Caspase-9活性明显增强(P<0.05或P<0.01),Caspase-8活性无明显变化。结论:PG能抑制A375细胞活性、促进细胞凋亡;其是通过破坏线粒体膜电位、促进细胞色素C外流来发挥促凋亡作用的。
大黄素甲醚8-O-β-吡喃葡萄糖苷;皮肤黑色素瘤A375细胞;细胞凋亡;线粒体途径
黑色素瘤一般指恶性黑色素瘤,来源于黑素细胞,多由黑素细胞所形成的痣或黑素斑发生恶变而来。近30年来,黑色素瘤的患病率和致死率正以每年4.1%的速度呈现显著上升趋势,已成为近年来所有恶性肿瘤中发病率增长最快的恶性肿瘤[1-3]。黑色素瘤极易转移致死,属于最难有效治疗的肿瘤之一。鉴于已转移的晚期黑色素瘤致死率极高,且其治疗方案相对有限,因此寻找安全有效的新型治疗手段抑制黑色素瘤是治疗关键。中药抗肿瘤有着悠久的历史和丰富的临床经验,具有药理活性显著、毒副作用小、不良反应轻微等特点。现代药化药理分析发现,羊蹄根中主要含有大黄素、大黄素甲醚、大黄酚等蒽醌类成分[4-5],具有抗菌、抗炎、抗肿瘤及止血等生物活性,据此推测,羊蹄根中的抗肿瘤有效成分对黑色素瘤也可能具有抑制作用。而羊蹄根中主要抗肿瘤成分大黄素甲醚8-O-β-吡喃葡萄糖苷(PG),是近年来研究的热点,受到广泛的关注[6-9]。本研究拟以羊蹄根中有效抗肿瘤成分PG作用于黑色素瘤细胞,观察PG对黑色素瘤细胞凋亡的影响,以期为黑色素瘤的临床治疗提供更多的新思路和新方法。
1 材料
1.1 仪器
Allegra X-22型高速低温离心机(美国Beckman Coulter公司);UV-4802型紫外分光光度计(上海旦鼎国际贸易有限公司);Mini-PRTEANⅡ型垂直电泳仪(美国Bio-Rad公司);Tecan Safire 2型多功能酶标仪(瑞士Tecan公司);DYY-Ⅲ8型电泳仪(北京六一仪器厂);FACS Vantage型流式细胞仪(美国BD公司);Leica DMI 4000 B型荧光倒置显微镜(德国Leica公司);凝胶成像系统(法国Vilber Lourmat公司)。
1.2 药品与试剂
PG(批号:140701,纯度:≥98%)和二甲基亚砜(DMSO)均购自美国Sigma公司;小鼠抗半胱氨酸天冬氨酸蛋白酶3(Caspase-3)、多腺苷二磷酸核糖聚合酶(PARP)、细胞色素C单克隆抗体和10~170 kD彩色预染蛋白质分子量标准(Marker)、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(中国碧云天生物科技有限公司);大鼠抗β-肌动蛋白(β-actin)单克隆抗体(北京康为世纪生物科技有限公司);辣根过氧化物酶(HRP)标记羊抗小鼠免疫球蛋白G(IgG)(美国Cell Signaling Technology公司);Ac-IETD-AFC(Caspase-8荧光底物)、Ac-LEHDAFC(Caspase-9荧光底物)(天津百萤生物科技有限公司);RIPI细胞裂解液(北京索莱宝科技有限公司);细胞膜联蛋白Ⅴ(AnnexinⅤ)-碘化丙啶(PI)凋亡检测试剂盒(中国BioTeke试剂有限公司);胎牛血清(天津灏洋生物制品科技公司);DMEM培养基(美国Invitrogen公司)。
1.3 细胞
人恶性黑色素瘤A375细胞株购自美国ATCC公司,用含10%胎牛血清和1%双抗的DMEM培养基在37℃、5%CO2、饱和湿度的细胞培养箱中培养。
2 方法
2.1 PG对A375细胞活性的影响
将A375细胞以5×105mL-1接种于96孔板中,于培养箱中培养至对数生长期,以0(对照)、10、20、50 μg/mL的PG(以DMSO配制,下同)孵育细胞,调节细胞密度为1×106mL-1,孵育24、48、72 h。然后向每孔加入10 μL CCK-8溶液,再将96孔板放入细胞培养箱孵育3 h,用酶标仪检测450 nm波长处的光密度(OD),计算细胞存活率,试验重复3次。细胞存活率(%)=(加药孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)×100%。
2.2 PG对A375细胞凋亡的影响
将细胞以5×105mL-1接种于6孔板中,于培养箱中培养至对数生长期,用0(对照)、20、50 μg/mL的PG孵育细胞48 h,调节细胞密度为1×106mL-1,加入5 μL AnnexinⅤ-异硫氰酸荧光素(FITC)的结合缓冲液,37℃温育30 min。然后在4℃下PI染色15 min,用流式细胞仪检测细胞凋亡情况,试验重复3次。在FACS管上样检测荧光强度,设激发波长488 nm、发射波长635 nm、变异系数(CV值)<2%、前向角散射光(FSC)/侧向角散射光(SSC)设门。收集门内10 000个细胞,用Modfit LT 3.2软件分析凋亡率,以AnnexinⅤ-/PI-为活细胞、AnnexinⅤ+/PI-为凋亡早期细胞、AnnexinⅤ+/PI+为凋亡晚期细胞(死亡细胞)。
2.3 PG对A375细胞中Caspase-3、PARP及细胞色素C蛋白表达的影响
按“2.2”项下方法培养和孵育A375细胞48 h后收集细胞,用RIPA裂解液裂解细胞,收集裂解上清,采用BCA法测定蛋白浓度后,加入5×上样缓冲液(Loading buffer)煮沸后按Western blot法检测细胞中Caspase-3、PARP、细胞色素C(线粒体中和细胞基质中)及内参(β-actin)蛋白表达水平,试验重复3次。蛋白表达以目的蛋白/内参蛋白进行评价。将提取的蛋白样品混匀后上样于十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,同时以Marker作为分子量标记,75 V恒压30~45 min,待样品进入分离胶后调电压至120 V。待目的蛋白分离后,进行转膜,250 mA恒流,湿转法转印1 h,以使目的蛋白转印到PVDF膜上。转印结束后,PVDF膜用5%脱脂牛奶室温摇床封闭1 h,之后用5%脱脂牛奶配制的一抗(β-actin按1∶3 000配制,Caspase-3、PARP、细胞色素C按1∶1 000配制)室温摇床孵育4 h。1×TBST缓冲液洗膜,后加入1×TBST缓冲液配制的二抗(HRP标记兔抗小鼠IgG按1∶3 000配制)孵育1 h,1×TBST缓冲液洗膜。在暗室内进行显影,采用凝胶分析软件Image J进行灰度分析。
2.4 PG对A375细胞中Caspase-8和Caspase-9活性的影响
按“2.2”项下方法培养A375细胞至对数生长期,用0(对照)、5、10 μmol/L的PG孵育A375细胞48 h,调节细胞密度为1×106mL-1。将每个浓度的蛋白均分为二份,分别加入Ac-IETD-AFC、Ac-LEHD-AFC,混匀后在37℃孵育2 h。通过酶标仪于发射波长505 nm、激发波长400 nm处检测荧光强度,试验重复3次。
2.5 统计学方法
采用Graph-pad Prism 5.01软件处理数据,计量资料以±s表示,采用t检验进行组间比较。P<0.05表示差异有统计学意义。
3 结果
3.1 PG能够抑制A375细胞活性
在PG孵育24 h后,仅50 μg/mL的PG能够明显降低A375细胞的细胞存活率(P<0.05);孵育48、72 h后,20、50 μg/mL的PG均能够明显降低A375细胞的细胞存活率(P<0.05),综合考察可优先选择短时间48 h进行后续研究。此结果提示,PG能够抑制A375细胞活性,具有抗A375细胞潜质。PG对A375细胞存活率的影响见图1。
3.2 PG能够促进A375细胞凋亡
与对照比较,20、50 μg/mL的PG孵育后A375细胞凋亡率明显增加(P<0.01),且随着PG剂量增加细胞凋亡率增加越明显。PG作用后A375细胞的流式图见图2,测定结果见图3。
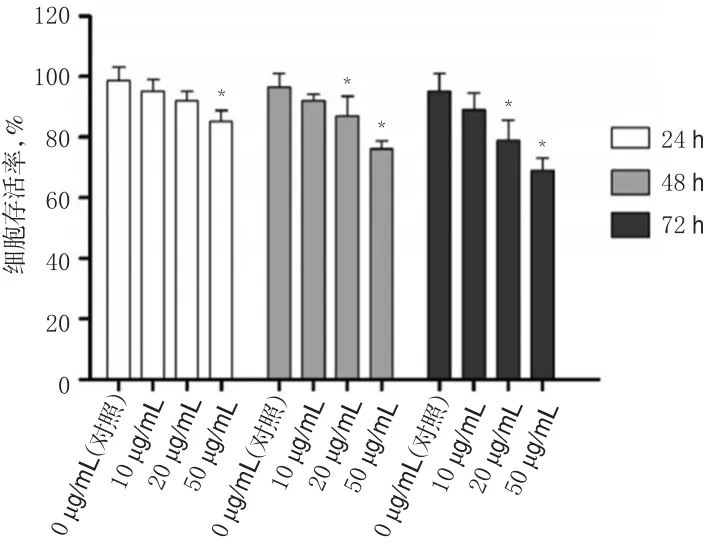
图1 PG对A375细胞存活率的影响Fig 1 Effect of PG on survival rate ofA375 cells
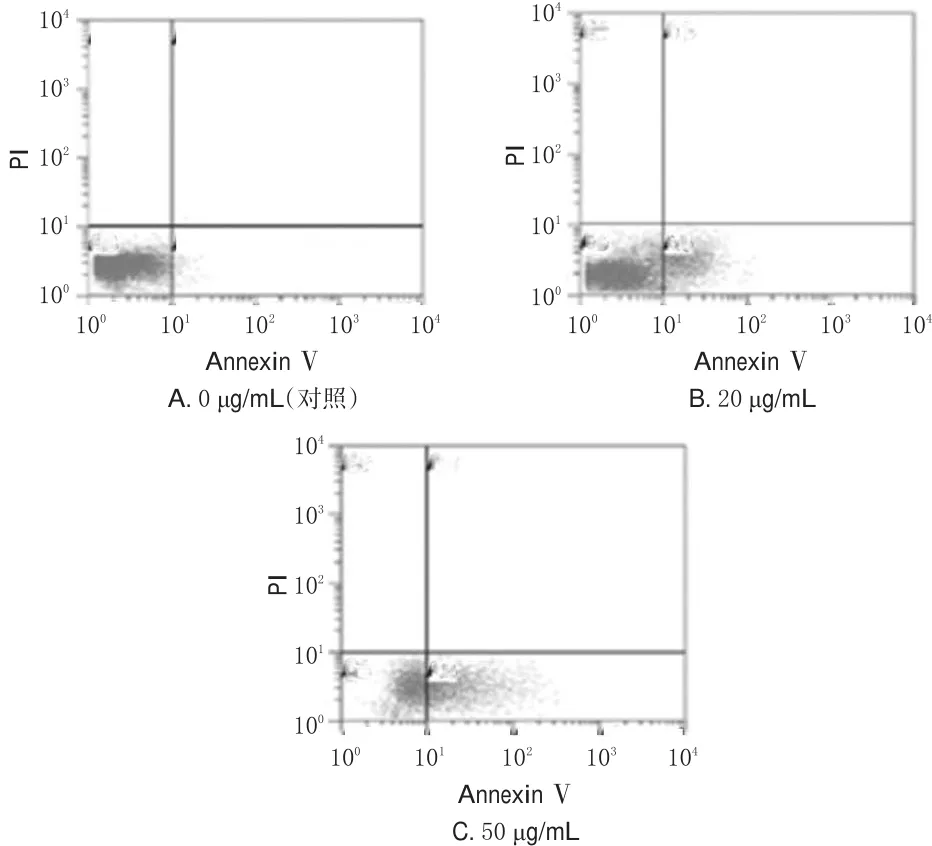
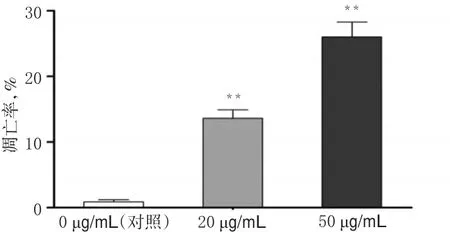
图3 PG对A375细胞凋亡率的影响Fig 3 Effect of PG on apoptosis rate ofA375 cells
3.3 PG能够促进A375细胞中Caspase-3、PARP蛋白表达
与对照比较,20、50 μg/mL的PG孵育后A375细胞中Caspase-3、PARP蛋白表达均明显增强(P<0.01),且随着PG浓度增加增强越明显。PG作用后A375细胞中Caspase-3、PARP表达的电泳图见图4,测定结果见图5。
3.4 PG通过线粒体途径启动凋亡
与对照比较,5、10 μmol/L的PG作用后A375细胞中Caspase-8活性无明显变化,而Caspase-9活性随着PG浓度的增加不断增强(P<0.05或P<0.01)。PG对A375细胞中Caspase-8、Caspase-9活性的影响见图6。
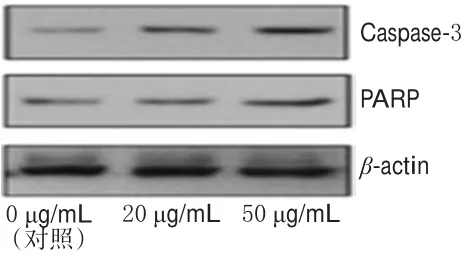
图4 PG作用后A375细胞中Caspase-3、PARP蛋白表达的电泳图Fig 4 Electrophoresis chart of the protein expressions of Caspase-3,PARP in A375 cells after treated by PG
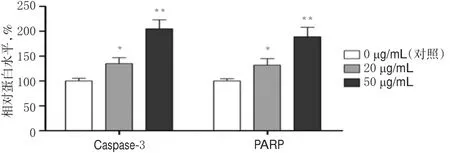
图5 PG对A375细胞中Caspase-3、PARP蛋白表达的影响Fig 5 Effects of PG on the protein expressions of Caspase-3,PARPinA375 cells
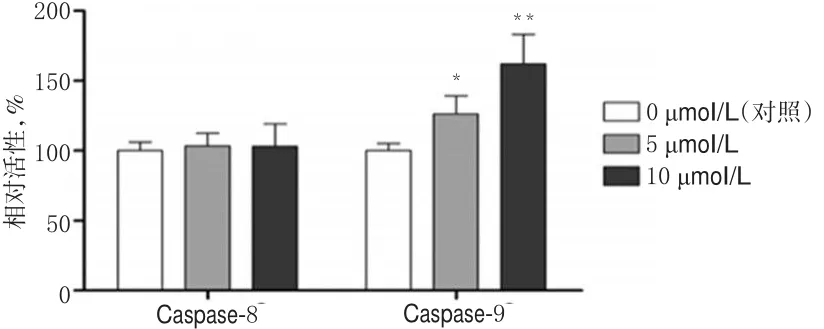
图6 PG对A375细胞中Caspase-8、Caspase-9活性的影响Fig 6 Effects of PG on the activities of Caspase-8,Caspase-9 inA375 cells
3.5 PG通过降低线粒体中细胞色素C蛋白表达增强细胞基质中细胞色素C蛋白表达
与对照比较,20、50 μg/mL的PG作用后,A375细胞线粒体中细胞色素C蛋白表达明显降低(P<0.05或P<0.01),且随着PG浓度的增加降低越明显;A375细胞基质中细胞色素C蛋白表达明显增强(P<0.05或P<0.01),且随着PG浓度的增加增强越明显。PG作用后A375细胞中细胞色素C蛋白表达的电泳图见图7,测定结果见图8。
4 讨论
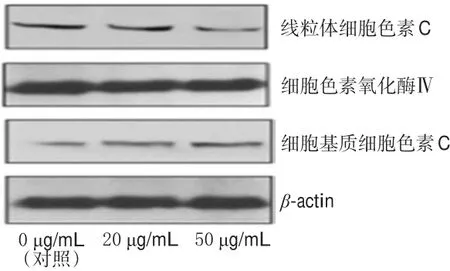
图7 PG作用后A375细胞中细胞色素C蛋白表达的电泳图Fig 7 Electrophoresis chart of the protein expression of cytochrome C in A375 cells after treated by PG
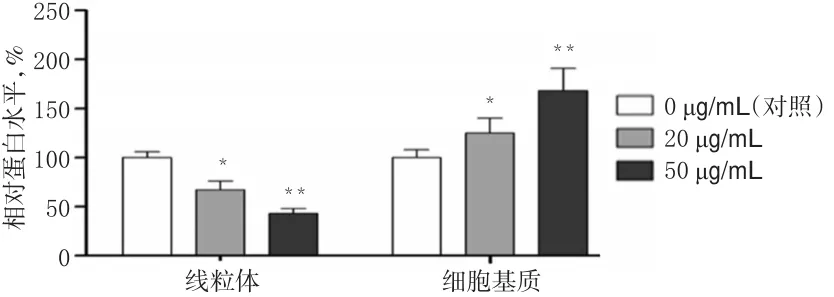
图8 PG对A375细胞中细胞色素C蛋白表达的影响Fig 8 Effect of PG on the protein expression of cytochrome C inA375 cells
PG是传统中药羊蹄根中的主要活性成分,也存在于大黄、何首乌、虎杖等中药中,是自然界中天然存在的蒽醌类化合物。自20世纪初,PG被提取、纯化并确认结构之后,诸多学者致力于其药理学功效的深入研究,近年来越来越多的研究结果见于报道,尤其PG抗肿瘤作用的研究成为关注的焦点[10-11]。研究报道提示,PG具有广谱抗肿瘤作用,对肺癌、口腔上皮癌、骨肉瘤、乳腺癌等多种肿瘤均具有凋亡诱导和转移侵袭抑制等作用,其抗肿瘤作用一部分是通过线粒体途径促凋亡实现的[12-13]。
针对黑色素瘤,截至目前,尚无PG抗黑色素瘤的相关报道。笔者推测PG可以应用到黑色素瘤的预防与治疗中,因此本研究以PG处理黑色素瘤A375细胞,检测PG对A375细胞增殖、凋亡的作用。结果显示,PG能够抑制A375细胞活性,促进细胞凋亡,促进细胞中Caspase-3和PARP的蛋白表达。
笔者对PG促凋亡作用机制进行了研究。通常细胞凋亡会通过线粒体途径、死亡受体途径两种主要方式,线粒体途径凋亡以线粒体膜电位受损、Caspase-9激活为特征,而死亡受体途径以死亡信号复合物(DISC)形成、Caspase-8激活为特征,二者均最终激活Caspase-3,启动凋亡不可逆转模式。本研究结果提示,PG的促凋亡作用可能是通过线粒体途径实现的,与死亡受体途径无关。
细胞色素C为生物氧化过程中的电子传递体,在线粒体上与其他氧化酶排列成呼吸链,参与细胞呼吸过程。通常情况下,细胞色素C主要存在于线粒体中,不能进入细胞基质;而在线粒体膜电位损伤后,由于膜通透性增加,细胞色素C进入细胞基质。因此,笔者以Western blot法对细胞基质和线粒体中细胞色素C的蛋白表达进行了检测。结果显示,细胞基质中细胞色素C蛋白表达增加,表明PG破坏了A375细胞中的线粒体膜电位,使线粒体膜通透性增加,细胞色素C进入细胞基质,加剧了细胞凋亡。
综上所述,PG能抑制A375细胞活性、促进细胞凋亡,其是通过破坏线粒体膜电位、促进细胞色素C外流来发挥促凋亡作用的。
[1] 张国强,张朝利,丁政云,等.恶性黑色素瘤治疗的新进展[J].中国老年学杂志,2015,11(35):6281-6284.
[2] Hübner J,Waldmann A,Geller AC,et al.Interval cancers after skin cancer screening:incidence,tumour characteristics and risk factors for cutaneous melanoma[J].Br J Cancer,2017,116(2):253-259.
[3] Green B,Elhamshary A,Gomez R,et al.An update on the current management of head and neck mucosal melanoma[J].J Oral Pathol Med,2017,46(7):475-479.
[4] 何盛江,聂阳,陈刚,等.HPLC法同时测定不同产地羊蹄药材中大黄素、大黄酚、大黄素甲醚的含量[J].中国药房,2016,27(33):4719-4721.
[5] 邓立华,刘丹,雷钧涛,等.羊蹄根有效部位的初步分离[J].吉林医药学院学报,2009,30(4):197-199.
[6] 尚小雅,刘威,赵聪伟,等.羊蹄甲属植物化学成分和药理活性的研究进展[J].中国中药杂志,2008,33(6):709-717.
[7] 吴琪,黄璐,茹梦,等.羊蹄化学成分及其抗肿瘤活性研究[J].药学与临床研究,2013,21(3):227-229.
[8] Li YP,Takamiyagi A,Ramzi ST,et al.Inhibitory effect of rumex japonicus houtt on the porphyrin photooxidative reaction[J].J Dermatol,2000,27(12):761-768.
[9] Alzoreky N,Nakahara K.Antioxidant activity of some edible yemeni plants evaluated by ferrylmyoglobin/abts·+assay[J].Food Sci Technol Res,2001,7(2):141-144.
[10] Xie QC,Yang YP.Anti-proliferative of physcion 8-O-βglucopyranoside isolated from Rumex japonicus Houtt.on A549 cell lines via inducing apoptosis and cell cycle arrest[J].BMC Complement Altern Med,2014,14(1):1-10.
[11] Ding Z,Xu F,Tang J,et al.Physcion 8-O-β-glucopyranosidepreventshypoxia-induced epithelial-mesenchymal transition in colorectal cancer HCT116 cells by modulating EMMPRIN[J].Neoplasma,2016,63(3):351-361.
[12] Liu M,Xiong S,Tan F,et al.Physcion 8-O-β-glucopyranoside induces mitochondria-dependent apoptosis of human oral squamous cell carcinoma cells via suppressing survivin expression[J].Acta Pharmacol Sin,2016,37(5):687-697.
[13] Chen X,Guo H,Li F,et al.Physcion 8-O-β-glucopyranoside suppresses the metastasis of breast cancer in vitro and in vivo by modulating DNMT1[J].Pharmacol Rep,2016,69(1):36-44.
(编辑:邹丽娟)
Study on the Effect and Mechanism of Physcion 8-O-β-glucopyranoside on the Apoptosis of Skin Melanoma A375 Cells
LI Hui1,2,LI Wenjing2,MA Rong2,CAO Jianhua2,HAN Zhiwu3(1.Dept.of Pharmacology,School of Pharmacy,Qingdao University,Shandong Qingdao 266021,China;2.Dept.Pharmacy,Qingdao Third People’s Hospital,Shandong Qingdao 266040,China;3.Dept.of Pharmacy,the Affiliated Hospital of Qingdao University,Shandong Qingdao 266003,China)
OBJECTIVE:To study the effect and mechanism of physcion 8-O-β-glucopyranoside(PG)on the apoptosis of skin melanoma A375 cells.METHODS:After A375 cells were treated by PG with 0,10,20,50 μg/mL for 24,48,72 h,CCK-8 method was adopted to determine the survival rate of cells.After A375 cells were treated by PG with 0(control),20,50 μg/mL for 48 h,flow cytometry was used to detect the apoptosis rate of cells with membrane protein Ⅴ/propidium iodide(PI)double staining.Immunoblotting was used to detect the protein expressions of Caspase-3 and polyadenyl adenine diphosphate ribose polymerase(PARP)and protein expressions of cytochrome C inside and outside mitochondria.After A375 cells were treated by PG with 0(control),5,10 μmol/L for 48 h,enzyme substrate method was used to determine the activities of Caspase-8 and Caspase-9.RESULTS:PG can effectively decrease the survival rate of A375 cells.Compared with control,apoptosis rate of cells was obviously increased after treated by PG with 20,50 μg/mL(P<0.01);protein expressions of Caspase-3,PARP in cells and cytochrome C in cell matrix were obviously enhanced(P<0.05 or P<0.01);and protein expression of cytochrome C in mitochondria was obviously weakened(P<0.05 or P<0.01).Caspase-9 activity in cells was obviously enhanced after treated by PG with 5,10 μmol/L(P<0.05 or P<0.01);and Caspase-8 activity had no obvious changes.CONCLUSIONS:PG can inhibit activity of A375 cells and promote its apoptosis,and its pro-apoptotic effects is achieved by destructing mitochondrial membrane potential and promoting cytochrome C outflow.
Physcion 8-O-β-glucopyranoside;Skin melanoma A375 cells;Cell apoptosis;Mitochondrial pathway
R965
A
1001-0408(2017)28-3941-05
2017-04-17
2017-08-16)
*主管药师,硕士。研究方向:临床药学。电话:0532-89076099。E-mail:lihui821127@163.com
#通信作者:主任药师,硕士。研究方向:临床药学、药事管理。电话:0532-82911848。E-mail:zhiwu1218@126.com
DOI 10.6039/j.issn.1001-0408.2017.28.15
