氢溴酸樟柳碱对急性脑缺血再灌注损伤模型大鼠脑组织细胞凋亡及ERK1/2磷酸化水平的影响Δ
2017-10-13陈丹丹谢晓芳万峰刘莟赵石陈秋伶陈延清彭成成都中医药大学药学院成都637雅安职业技术学院药学检验系四川雅安625000中药资源系统研究与开发利用省部共建国家重点实验室培育基地成都637成都第一制药有限公司成都6003
陈丹丹,谢晓芳,万峰,刘莟,赵石,陈秋伶,陈延清,彭成#(.成都中医药大学药学院,成都637;2.雅安职业技术学院药学检验系,四川雅安 625000;3.中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都 637;.成都第一制药有限公司,成都 6003)
氢溴酸樟柳碱对急性脑缺血再灌注损伤模型大鼠脑组织细胞凋亡及ERK1/2磷酸化水平的影响Δ
陈丹丹1,2*,谢晓芳1,3,万峰4,刘莟1,赵石1,陈秋伶1,陈延清4,彭成1,3#(1.成都中医药大学药学院,成都611137;2.雅安职业技术学院药学检验系,四川雅安 625000;3.中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都 611137;4.成都第一制药有限公司,成都 610031)
目的:研究氢溴酸樟柳碱对急性脑缺血再灌注损伤模型大鼠脑组织细胞凋亡及细胞外信号调节蛋白激酶1/2(ERK1/2)磷酸化(p-ERK1/2)水平的影响。方法:将大鼠随机分为假手术组、模型组、阳性对照组(尼莫地平1.0 mg/kg)和氢溴酸樟柳碱高、中、低、极低剂量组(1.2、0.6、0.3、0.15 mg/kg),每组8只,采用线栓法建立大鼠急性脑缺血再灌注损伤模型。分别于脑缺血2 h和再灌注6 h时对各组大鼠尾iv给药1次,再灌注22 h后检测各组大鼠脑组织三磷酸腺苷(ATP)酶活性、Ca2+含量、细胞凋亡情况、脑组织中p-ERK1/2蛋白表达和p-ERK1/2/总ERK1/2(t-ERK1/2)比例。结果:与假手术组比较,模型组大鼠脑组织ATP酶活性明显降低、Ca2+含量明显增加、凋亡细胞密度明显增加,以上差异均有统计学意义(P<0.01)。与模型组比较,各给药组大鼠脑组织凋亡细胞密度均明显减小,阳性对照组和氢溴酸樟柳碱高、低剂量组大鼠脑组织Ca2+含量均明显降低,氢溴酸樟柳碱高、低、极低剂量组大鼠脑组织中p-ERK1/2/t-ERK1/2比例均明显增加,以上差异均有统计学意义(P<0.05或P<0.01);其余差异均无统计学意义(P>0.05)。结论:氢溴酸樟柳碱能抑制急性脑缺血再灌注损伤模型大鼠脑组织细胞凋亡,其作用机制可能与激活ERK1/2信号通路和调节ATP酶活性,进而降低脑组织Ca2+含量有关。
氢溴酸樟柳碱;急性脑缺血再灌注;大鼠;细胞凋亡;细胞外信号调节蛋白激酶1/2
缺血性脑卒中占脑卒中发生率的80%以上,是脑卒中死亡的主要原因[1-2]。因其发病机制复杂,目前临床上仍缺乏有效的防治措施。病理生理学研究发现,缺血性脑卒中造成患者脑组织损伤的机制主要为脑缺血再灌注损伤(CI/R)。因此需要积极研究对CI/R有确切治疗作用的药物,明确其作用机制。已有研究表明,樟柳碱能降低急性CI/R模型大鼠脑内异常升高的钙离子(Ca2+)含量和伊文思蓝含量,减少脑组织水肿[3]。但对其作用机制缺乏进一步的后续研究,阻碍了该品种的开发和推广应用。
本研究拟采用线栓法建立大鼠急性CI/R模型,尾iv给予氢溴酸樟柳碱进行干预,从脑组织中三磷酸腺苷(Triphosadenine,ATP)酶活性、Ca2+含量、神经细胞凋亡情况及细胞外信号调节蛋白激酶1/2磷酸化(p-ERK1/2)水平等方面进一步研究氢溴酸樟柳碱对CI/R大鼠的保护作用及机制,为该药的开发及临床应用提供依据。
1 材料
1.1 仪器
Enspire多标记微孔板检测仪(珀金埃尔默新加坡有限公司);TDZ4A-WS台式低速离心机(湖南湘仪实验室仪器开发有限公司);BA200Digital数码三目摄像显微镜(厦门麦克奥迪实业集团有限公司)。
1.2 药品与试剂
氢溴酸樟柳碱原料药(成都第一药业有限公司,批号:140903,纯度:99%);尼莫地平注射液(拜耳医药保健有限公司广州分公司,批号:BXGVZ71,规格:50 mL∶10 mg);ATP酶测试盒(包括Na+-K+-ATPase、Ca2+-Mg2+-ATPase、Ca2+-ATPase)、Ca2+含量测试盒、蛋白定量测试盒(南京建成生物工程研究所,批号:20160402、20160405、20160407);原位末端标记法(TUNEL)细胞凋亡检测试剂盒(瑞士罗氏公司,批号:10279600);兔源p-ERK1/2、总ERK1/2(t-ERK1/2)抗体(英国Abcam公司,批号:GR210921-2、GR197011-16);兔源甘油醛-3-磷酸脱氢酶(GAPDH)抗体(武汉博士德生物工程有限公司,批号:14MA18);辣根过氧化物酶(HRP)标记山羊抗兔免疫球蛋白G(IgG)(北京中杉金桥生物技术有限公司,批号:109525)。1.3 动物
SD大鼠,SPF级,♂,体质量为280~320 g,购自四川省中医药科学院实验动物中心,生产许可证号:SCXK(川)2013-19。本研究严格按照《实验动物护理和使用指南》进行操作,实验过程符合实验动物伦理相关要求。
2 方法
2.1 急性CI/R模型的建立
[4]方法并加以改良:术前大鼠禁食12 h,自由饮水,ip给予10%水合氯醛300 mg/kg麻醉后,分离颈总动脉(CCA),结扎CCA近心端,分离颈外动脉(ECA)和颈内动脉(ICA),结扎ECA、CCA处切口,在近心端距分叉处4 mm切口插入直径为0.285 mm、头端打磨光滑的鱼线,使其垂直进入ICA,插入长度约为20 mm,以完全阻断大脑中动脉(MCA)的供血。缺血2 h时轻柔回抽鱼线约10 mm,再灌注22 h。假手术组大鼠除不插入鱼线外,其余操作同模型组。
2.2 分组与给药
按照Longa EZ等[4]建立的五分制评分标准于缺血2 h后对大鼠进行评分:0分为无明显神经损伤症状;1分为不能完全伸展对侧前爪;2分为向对侧转圈;3分为向对侧倾倒;4分为不能自发行走、意识丧失。选取评分为1~3分的大鼠进入后续实验,随机将其分为模型组、阳性对照组(尼莫地平1.0 mg/kg)和氢溴酸樟柳碱高、中、低、极低剂量组(1.2、0.6、0.3、0.15 mg/kg),每组8只;另设8只大鼠为假手术组。尼莫地平和氢溴酸樟柳碱的给药剂量是在文献[3,5]的基础上结合药物的临床给药剂量设计而成;氢溴酸樟柳碱原料药使用前用超纯水充分溶解并过0.22 μm微孔滤膜后备用。分别于大鼠脑缺血2 h和再灌注6 h时尾iv给予各组大鼠相应药物1次,共计给药2次;模型组和假手术组大鼠尾iv给予超纯水。
2.3 脑组织中ATP酶活性、Ca2+含量的测定
各组大鼠再灌注22 h后,麻醉,断头处死,取缺血侧视交叉前冠状切片脑组织约100 mg,按1∶9(m/V)加入冰冷生理盐水,制成10%的脑组织匀浆,3 000 r/min(离心半径为15 cm)离心15 min,取上清液,按测试盒说明书操作测定ATP酶活性和Ca2+含量。
2.4 脑组织细胞凋亡的测定
各组大鼠断头处死后,迅速选取缺血侧视交叉附近约1 mm厚度的冠状切片脑组织,10%甲醛溶液固定。每组随机选取4只采用TUNEL法检测细胞凋亡情况,每张切片选取3个典型区域采用BA200Digital数码三目摄像显微镜于400倍镜下进行图像采集,计数凋亡细胞,取3个视野的平均值作为该样本的凋亡细胞密度。
2.5 免疫组化法检测大鼠脑组织中p-ERK1/2蛋白表达
每组随机选取6只大鼠,取固定的脑组织脱水、包埋、切片,经二甲苯脱蜡、梯度乙醇脱水,在3%甲醇双氧水中室温下放置10 min,磷酸盐缓冲液(PBS)漂洗,滴加山羊血清封闭液,室温放置20 min,加入一抗兔源p-ERK1/2抗体,4℃下过夜;PBS漂洗,滴加HRP标记山羊抗兔IgG,37℃下放置30 min;PBS漂洗,二氨基联苯胺(DAB)显色,蒸馏水洗涤,苏木素轻度复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。阳性细胞呈棕黄色。于大鼠脑组织阳性细胞分布区随机选择3个不重复的200倍视野,采用Image Pro Plus 6.0成像分析系统分析计算其灰度值,每一样本取3个视野计算平均值。其灰度值与p-ERK1/2蛋白表达呈正相关。
2.6 Western blot法检测脑组织中p-ERK1/2/t-ERK1/2比例
每组随机选取3只大鼠,取缺血侧半暗带附近固定解剖部位脑组织约50 mg,按1∶10(m/V)加入蛋白裂解液,提取脑组织蛋白,测定蛋白含量并定量。行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后电转至聚偏二氟乙烯(PVDF)膜上,脱脂奶粉封闭2 h,孵育后加入兔源p-ERK1/2、t-ERK1/2、GAPDH抗体,4℃封闭过夜,TBST缓冲液洗膜;然后将PVDF膜放入HRP标记山羊抗兔IgG中,37℃孵育1 h;TBST缓冲液洗膜,加入增强化学发光(ECL)显影液,通过化学发光成像系统对蛋白条带成像。应用Image-lab图像处理软件,以目标蛋白与内参GAPDH灰度值的比值评定目标蛋白的表达水平,并计算p-ERK1/2/t-ERK1/2比例。
2.7 统计学方法
采用SPSS 17.0软件进行统计分析,正态计量指标采用±s表示,多组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 脑组织中ATP酶活性和Ca2+含量变化
与假手术组比较,模型组大鼠脑组织中3种ATP酶活性均降低、Ca2+含量增加(P<0.01)。与模型组比较,氢溴酸樟柳碱各剂量组大鼠均能在一定程度上提高3种ATP酶活性,但差异均无统计学意义(P>0.05);氢溴酸樟柳碱高、低剂量组和阳性对照组大鼠脑组织中Ca2+含量均明显降低(P<0.05或P<0.01)。各组大鼠脑组织中ATP酶活性和Ca2+含量的测定结果见表1。
表1 各组大鼠脑组织中ATP酶活性和Ca2+含量的测定结果(±s,n=8)Tab 1 Determination results of ATP enzyme activity and Ca2+content in brain tissue of rats in each group(±s,n=8)
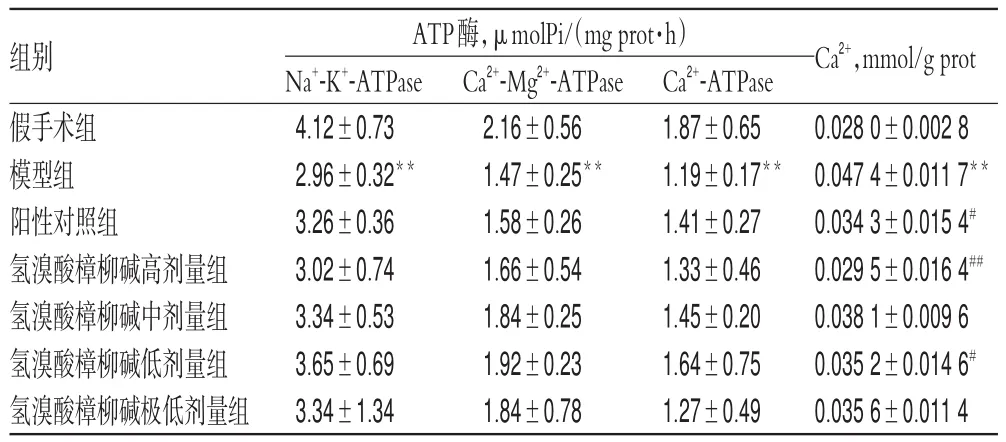
表1 各组大鼠脑组织中ATP酶活性和Ca2+含量的测定结果(±s,n=8)Tab 1 Determination results of ATP enzyme activity and Ca2+content in brain tissue of rats in each group(±s,n=8)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.sham operation group,**P<0.01;vs.model group,#P<0.05,##P<0.01
Ca2+,mmol/g prot 0.028 0±0.002 8 0.047 4±0.011 7**0.034 3±0.015 4#0.029 5±0.016 4##0.038 1±0.009 6 0.035 2±0.014 6#0.035 6±0.011 4组别假手术组模型组阳性对照组氢溴酸樟柳碱高剂量组氢溴酸樟柳碱中剂量组氢溴酸樟柳碱低剂量组氢溴酸樟柳碱极低剂量组ATP酶,μmolPi/(mg prot·h)Na+-K+-ATPase 4.12±0.73 2.96±0.32**3.26±0.36 3.02±0.74 3.34±0.53 3.65±0.69 3.34±1.34 Ca2+-Mg2+-ATPase 2.16±0.56 1.47±0.25**1.58±0.26 1.66±0.54 1.84±0.25 1.92±0.23 1.84±0.78 Ca2+-ATPase 1.87±0.65 1.19±0.17**1.41±0.27 1.33±0.46 1.45±0.20 1.64±0.75 1.27±0.49
3.2 脑组织细胞凋亡情况
与假手术组比较,模型组大鼠脑组织凋亡细胞密度明显增加(P<0.01)。与模型组比较,氢溴酸樟柳碱各剂量组和阳性对照组大鼠脑组织凋亡细胞密度明显减小(P<0.05或P<0.01)。各组大鼠脑组织细胞凋亡的显微镜图见图1,凋亡细胞密度测定结果见表2。
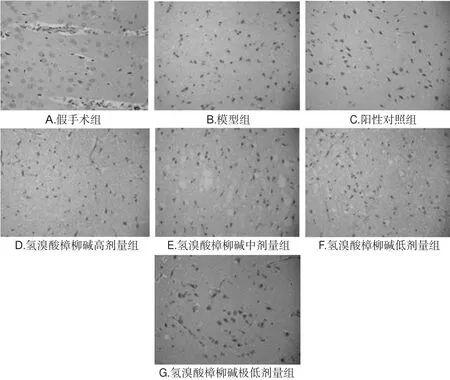
图1 各组大鼠脑组织细胞凋亡的显微镜图(×400)Fig 1 Microscope figure of cell apoptosis in brain tissue of rats in each group(×400)
表2 各组大鼠脑组织凋亡细胞密度、p-ERK1/2表达及p-ERK1/2/t-ERK1/2水平的测定结果(±s)Tab 2 Determination results of density of cell apoptosis,p-ERK1/2 expression,p-ERK1/2/t-ERK1/2 level in brain tissue of rats in each group(±s)
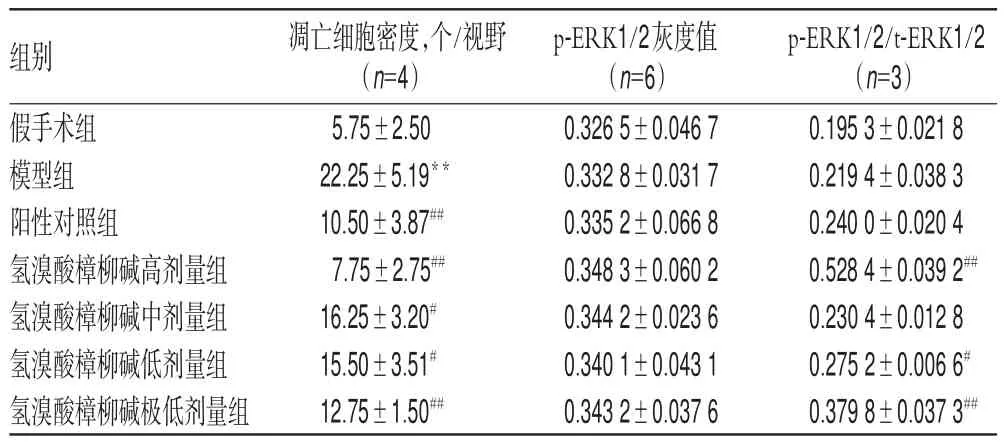
表2 各组大鼠脑组织凋亡细胞密度、p-ERK1/2表达及p-ERK1/2/t-ERK1/2水平的测定结果(±s)Tab 2 Determination results of density of cell apoptosis,p-ERK1/2 expression,p-ERK1/2/t-ERK1/2 level in brain tissue of rats in each group(±s)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.sham operation group,**P<0.01;vs.model group,#P<0.05,##P<0.01
p-ERK1/2/t-ERK1/2(n=3)0.195 3±0.021 8 0.219 4±0.038 3 0.240 0±0.020 4 0.528 4±0.039 2##0.230 4±0.012 8 0.275 2±0.006 6#0.379 8±0.037 3##组别假手术组模型组阳性对照组氢溴酸樟柳碱高剂量组氢溴酸樟柳碱中剂量组氢溴酸樟柳碱低剂量组氢溴酸樟柳碱极低剂量组凋亡细胞密度,个/视野(n=4)5.75±2.50 22.25±5.19**10.50±3.87##7.75±2.75##16.25±3.20#15.50±3.51#12.75±1.50##p-ERK1/2灰度值(n=6)0.326 5±0.046 7 0.332 8±0.031 7 0.335 2±0.066 8 0.348 3±0.060 2 0.344 2±0.023 6 0.340 1±0.043 1 0.343 2±0.037 6
3.3 脑组织中p-ERK1/2蛋白表达变化
与假手术组比较,模型组大鼠脑组织中p-ERK1/2表达轻微增强(P>0.05)。与模型组比较,氢溴酸樟柳碱各剂量组和阳性对照组大鼠脑组织中p-ERK1/2表达均轻微增强(P>0.05)。各组大鼠脑组织中p-ERK1/2灰度值的测定结果见表2。
3.4 脑组织中p-ERK1/2/t-ERK1/2比例变化
与假手术组比较,模型组大鼠脑组织中p-ERK1/2/t-ERK1/2比例轻微增加(P>0.05)。与模型组比较,氢溴酸樟柳碱高、低、极低剂量组大鼠脑组织中p-ERK1/2/t-ERK1/2比例均明显增加(P<0.05或P<0.01),其余差异均无统计学意义(P>0.05)。各组大鼠脑组织中p-ERK1/2、t-ERK1/2蛋白表达的电泳图见图2,p-ERK1/2/t-ERK1/2比例的测定结果见表2。
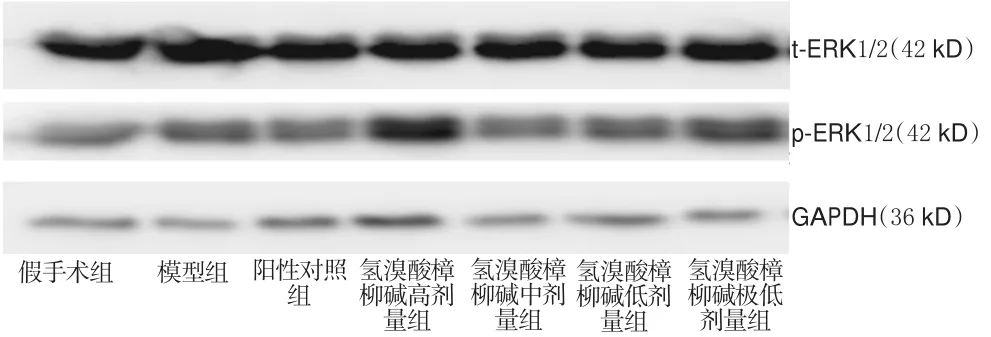
图2 各组大鼠脑组织p-ERK1/2、t-ERK1/2蛋白表达的电泳图Fig 2 Electrophoresis chart of p-ERK1/2 protein expression,t-ERK1/2 protein expression in brain tissue of rats in each group
4 讨论
Ca2+超载是CI/R重要的发病机制。脑缺血时细胞膜去极化引起Ca2+内流,加之膜磷脂降解及其产物均可引起ATP酶活性降低,进而可能影响细胞内Na+和Ca2+的聚积、K+的流失,从而加速细胞的损伤,故提高ATP酶的活性可能有助于脑保护[6]。本研究中,各剂量氢溴酸樟柳碱均表现出一定的提高脑组织ATP酶活性的作用,但差异无统计学意义(P>0.05);氢溴酸樟柳碱在1.2、0.3 mg/kg剂量时能显著降低脑组织Ca2+含量(P<0.05或P<0.01),表明其对抗CI/R的机制可能与提高脑组织ATP酶活性和降低脑组织Ca2+含量有关。
细胞的凋亡和坏死所导致的神经细胞死亡几乎是所有神经退化性疾病的显著特征。缺血神经元凋亡具有延迟性,且呈可逆过程,这就为脑缺血的治疗提供了时间[7]。尽管目前关于ERK信号通路在CI/R中的作用存在争议,但一般认为ERK是生存通路,其在神经元的增殖分化以及抑制神经元凋亡中起着重要作用[8]。本研究中各剂量氢溴酸樟柳碱均可显著减少CI/R模型大鼠脑组织凋亡细胞密度(P<0.05或P<0.01),除0.6 mg/kg剂量外均能显著提高脑组织p-ERK1/2/t-ERK1/2水平(P<0.05或P<0.01),提示氢溴酸樟柳碱能对抗脑组织细胞凋亡,ERK1/2信号通路的激活可能是其作用的分子机制之一。
同时有研究提示,ERK激活后可降低N-甲基-D-天冬氨酸(NMDA)受体活性,抑制Ca2+内流,发挥神经元保护作用[9]。本研究中氢溴酸樟柳碱高、低剂量组p-ERK1/2/t-ERK1/2显著升高,而脑组织Ca2+含量显著降低(P<0.05或P<0.01),该结果与文献[9]报道吻合。
综上,氢溴酸樟柳碱能抑制急性CI/R模型大鼠脑组织细胞凋亡,其作用机制可能与激活ERK1/2信号通路和调节ATP酶活性,进而降低脑组织Ca2+含量有关。
本研究中,不同剂量氢溴酸樟柳碱对各指标的影响存在差异,指标变化与给药剂量变化趋势不完全一致。结合本模型和药物本身的特点分析其原因可能有以下几方面:(1)脑缺血是一个复杂的快速级联反应的病理过程,涉及Ca2+超载、细胞凋亡、氧化应激、氮化应激、能量代谢障碍、炎性细胞浸润等诸多环节[10]。本研究是在不确定氢溴酸樟柳碱作用靶点和剂量的情况下从Ca2+超载和细胞凋亡方面进行了初步探讨,可能无法很好体现其量效相关性。(2)氢溴酸樟柳碱属于莨菪烷类生物碱,目前的研究报道显示,莨菪烷类生物碱尚可通过调节神经递质、保护线粒体、调节血管与血流等诸多方面对抗CI/R,由此笔者推测氢溴酸樟柳碱对本实验模型的作用靶点可能也不是单一的而是多机制的。但其在不同的机制方面的药效剂量存在差异,而对模型的治疗结果是这多种机制综合作用的结果,从而导致本研究结果的量效正相关不典型。再则,樟柳碱对学习记忆能力也呈现双向调节作用,即在大于2.5 mg/kg时会损伤记忆,但在0.5 mg/kg以下则能促进学习记忆,表明樟柳碱的量效关系可能非传统的量效正相关。但上述猜测还有待进一步研究以证实。
参考文献
[1] Yitshak Sade M,Novack V,Ifergane G,et al.Air pollution and ischemic stroke among young adults[J].Stroke,2015,46(12):3348-3353.
[2] Dong JY,Iso H,Kitamura A,et al.Multivitamin use and risk of stroke mortality:the Japan collaborative cohort study[J].Stroke,2015,46(5):1167-1172.
[3] Xu W,Deng YF.Effect of anisodine on acute forebrain ischemia-reperfusion damage in rats[J].Acta Pharmacologica Sinica,1996,17(2):161-163.
[4] Longa EZ,WeinsteinPR,Carlson S,et al.Reversible middle cerbral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5] 苏建华,陈玉芳,丁新生,等.甲钴胺对脑缺血再灌注损伤大鼠细胞凋亡及细胞色素C表达的影响[J].中华老年心脑血管病杂志,2015,17(11):1193-1196.
[6] Yu DJ,Gao HY.Effect of propofol on mitochondrial ATP content and ATPase activity in hippocampus of rats withcerebral ischemia-reperfusion injury[J].Saudi J Biol Sci,2017,24(2):246-250.
[7] Pei B,Yang M,Qi X,et al.Quercetin ameliorates ischemia/reperfusion-induced cognitive deficits by inhibitingASK1/JNK3/caspase-3 by enhancing the Akt signaling pathway[J].Biochem Biophys Res Commun,2016,478(1):199-205.
[8] 赵丽薇,聂莹雪.丁基苯酞对沙土鼠脑缺血再灌注损伤后p-ERK表达的影响[J].重庆医学,2013,42(12):1377-1379.
[9] Li Z,Fang F,Wang Y,et al.Resveratrol protects CA1 neurons against focal cerebral ischemic reperfusion-induced damage via the ERK-CREB signaling pathway in rats[J].Pharmacol Biochem Behav,2016,doi:10.1016/j.pbb.2016.04.007.
[10] 李冬梅,徐丽,张红果,等.芍药苷对脑缺血再灌注模型沙土鼠脑组织炎症反应因子的影响[J].中国药房,2015,26(1):56-58.
Effects of Anisodine Hydrobromide on Cell Apoptosis and ERK1/2 Phosphorylation Level in Brain Tissue of Model Rats with Acute Cerebral Ischemia-reperfusion Injury
CHEN Dandan1,2,XIE Xiaofang1,3,WAN Feng4,LIU Han1,ZHAO Shi1,CHEN Qiuling1,CHEN Yanqing4,PENG Cheng1,3(1.College of Pharmacy,Chengdu University of TCM,Chengdu 611137,China;2.Dept.of Pharmacy and Examination,Ya’an Polytechnical College,Sichuan Ya’an 625000,China;3.State Key Laboratory Breeding Base of Systematic Research,Development and Utilization of Chinese Medicine Resources Co-founded by Sichuan Province and Ministry of Education,Chengdu 611137,China;4.Chengdu No.1 Pharmaceutical Co.,Ltd.,Chengdu 610031,China)
OBJECTIVE:To study the effects of anisodine hydrobromide on cell apoptosis and extracellular signal-regulated protein kinase 1/2(ERK1/2)phosphorylation(p-ERK1/2)level in brain tissue of model rats with acute cerebral ischemia-reperfusion injury.METHODS:Rats were randomly divided into sham operation group,model group,positive control group(nimodipine 1.0 mg/kg),anisodine hydrobromide high-dose,medium-dose,low-dose,extreme low-dose groups(1.2,0.6,0.3,0.15 mg/kg),8 in each group.Suture method was used to establish the rat models with acute cerebral ischemia-reperfusion injury.Rats were intravenously injected once in tail at 2nd of ischemia and 6th of reperfusion.Then adenosine triphosphate(ATP)enzyme activity,Ca2+content,cell apoptosis in brain tissue,p-ERK1/2 protein expression in brain tissue,and p-ERK1/2/total ERK1/2(t-ERK1/2)proportion in brain tissue of rats were detected after 22 h of reperfusion.RESULTS:Compared with sham operation group,ATP enzyme activity in brain tissue of rats in model group was obviously decreased,Ca2+content was obviously increased,density of cell apoptosis in brain tissue was obviously increased,with statistical significances(P<0.01).Compared with model group,density of cell apoptosis in brain tissue was obviously decreased in each administration group;Ca2+contents in brain tissue of rats in positive control group,anisodine hydrobromide high-dose,low-dose groups were obviously decreased;and p-ERK1/2/t-ERK1/2 proportion in brain tissue of rats in anisodine hydrobromide high-dose,low-dose,extreme low-dose groups were obviously increased,with statistical significances(P<0.05 or P<0.01);the other differences were not statistically significant(P>0.05).CONCLUSIONS:Anisodine hydrobromide can inhibit the cell apoptosis in brain tissue of model rats with acute cerebral ischemia-reperfusion injury,and the mechanism may be related with activating ERK1/2 signal pathway and regulating ATP enzyme activity to decrease the Ca2+content in the brain tissue.
Anisodine hydrobromide;Acute cerebral ischemia-reperfusion; Rats; Cellapoptosis; Extracellularsignal-regulated protein kinase 1/2
R965
A
1001-0408(2017)28-3907-04
2016-12-01
2017-04-24)
(编辑:邹丽娟)
国家基础科学人才培养基金资助项目(No.J1310034);四川省科技支撑计划项目(No.16ZC1731)
*讲师,博士。研究方向:疾病动物模型与中药复方药理。电话:028-61800231。E-mail:chendandan619@126.com
#通信作者:研究员,博士。研究方向:疾病动物模型与中药复方药理。电话:028-61800231。E-mail:pengchengchengdu@126.com
DOI 10.6039/j.issn.1001-0408.2017.28.06
