驱虫斑鸠菊中紫铆素对人永生化角质形成细胞株HaCaT增殖及细胞分泌因子的影响Δ
2017-10-13王志杰高莉霍仕霞谭雪罗静莺闫明石河子大学药学院新疆石河子83003新疆维吾尔自治区维吾尔医药研究所新疆维吾尔医方剂学实验室乌鲁木齐830049
王志杰,高莉,霍仕霞,谭雪,罗静莺,闫明#(1.石河子大学药学院,新疆石河子83003;.新疆维吾尔自治区维吾尔医药研究所/新疆维吾尔医方剂学实验室,乌鲁木齐 830049)
驱虫斑鸠菊中紫铆素对人永生化角质形成细胞株HaCaT增殖及细胞分泌因子的影响Δ
王志杰1*,高莉2,霍仕霞2,谭雪2,罗静莺2,闫明2#(1.石河子大学药学院,新疆石河子832003;2.新疆维吾尔自治区维吾尔医药研究所/新疆维吾尔医方剂学实验室,乌鲁木齐 830049)
目的:研究驱虫斑鸠菊(VW)中紫铆素对人永生化角质形成细胞株HaCaT的增殖及细胞分泌因子的影响,初步探讨VW中紫铆素治疗白癜风的机制。方法:采用MTT法测定0(空白对照)、0.1、0.5、1.0、5.0、10.0 μg/mL紫铆素作用于HaCaT细胞48 h后的细胞存活率;采用酶联免疫吸附法测定0.5、1.0、5.0 μg/mL紫铆素作用于HaCaT细胞48 h后培养液中细胞分泌因子内皮素1(ET-1)、ET-3、黑素细胞刺激素(MSH)、干细胞因子(SCF)、碱性纤维细胞生长因子(bFGF)的含量。结果:与空白对照比较,0.1~5.0 μg/mL紫铆素作用48 h后细胞存活率均有不同程度升高,而10.0 μg/mL紫铆素作用后细胞存活率降低;0.5、1.0、5.0 μg/mL紫铆素作用48 h后培养液中ET-1、SCF、bFGF含量均显著增加(P<0.01),1.0、5.0 μg/mL紫铆素作用48 h后培养液中ET-3、MSH含量显著增加(P<0.01)。结论:紫铆素可促进HaCaT细胞的增殖,其作用机制可能与促进细胞分泌因子ET-1、ET-3、MSH、SCF、bFGF的分泌有关。
驱虫斑鸠菊;紫铆素;人永生化角质形成细胞株HaCaT细胞;增殖;细胞因子
驱虫斑鸠菊[Vernonia anthelmintica(L.)Willd]为菊科(Compositae)斑鸠菊属一年生草本植物[1],可用于治疗痰饮浮肿、湿痹疼痛、肠内寄生虫、白癜风等[2]。白癜风白斑的形成主要有两种机制:一种是黑素合成能力下降或因传输障碍使其不能传输到周围角质细胞;另一种是黑素细胞部分或全部缺失[3]。临床研究结果表明,驱虫斑鸠菊注射液、复方驱虫斑鸠菊搽剂均对白癜风有较好的疗效[4-5],但具体的药效成分及作用机制不明。有研究验证实,驱虫斑鸠菊中紫铆素可以使黑素细胞增殖并促进黑素合成,具有抗白癜风的作用[6-7]。角质形成细胞和黑素细胞是人表皮中两种重要的组成细胞,其在结构和功能上有密切的联系[8]。角质形成细胞可通过分泌一些生长因子或者细胞基质成分,直接或间接地对黑素细胞的增殖、黑素合成和转运等活动进行调节[9]。本研究拟考察驱虫斑鸠菊中紫铆素对人永生化角质形成细胞株HaCaT的增殖以及细胞分泌因子的影响,初步探讨驱虫斑鸠菊中紫铆素治疗白癜风的药理作用机制。
1 材料
1.1 仪器
Bm-37xay倒置显微镜(上海光学仪器六厂);1510全波长酶标仪(美国赛默飞世尔科技公司);SQP电子分析天平(德国赛多利斯公司)。
1.2 药品与试剂
紫铆素(新疆维吾尔自治区维吾尔医药研究所自制[7],批号:20151208,纯度:≥98%);DMEM干粉培养基(美国Gibco公司);胎牛血清(美国HycLone公司);黑素细胞刺激素(MSH)、干细胞因子(SCF)、碱性纤维细胞生长因子(bFGF)、内皮素1(ET-1)、ET-3酶联免疫吸附(ELISA)试剂盒(武汉基因美生物科技有限公司,批号:GR201609-1);MTT(美国Amresco公司);二甲基亚砜(DMSO,天津市光复化工研究所);其余试剂均为分析纯。
1.3 细胞
人永生化角质形成细胞株HaCaT购自中国典型培养物保藏中心(武汉大学细胞库)。
2 方法
2.1 细胞培养
复苏HaCaT细胞后,加入含有10%胎牛血清的DMEM完全培养液在37℃、5%CO2孵箱内培养,待细胞贴壁后更换新鲜的完全培养液,继续培养、传代。选择对数生长期的细胞进行试验。
2.2 MTT法测定细胞增殖活性
取对数生长期的细胞,用1.0 mL 0.25%胰酶消化制成细胞悬液,调整细胞密度为5×104mL-1,接种于96孔细胞培养板中,每孔接种100 μL。将细胞置于37℃、5%CO2孵箱内培养过夜。然后弃培养基,依次加入终质量浓度分别为0.1、0.5、1.0、5.0、10.0 μg/mL的紫铆素含药培养液,200 μL/孔,每个质量浓度设8个复孔;同时设置空白对照,每孔加入等体积的DEME完全培养液。继续培养48 h,于结束前4 h,每孔加入20 μL 5 g/L的MTT溶液,弃上清液,加入DMSO 200 μL/孔,振荡10 min,使结晶完全溶解。采用酶标仪于490 nm波长处测定各孔光密度(OD)值,计算细胞存活率,细胞存活率(%)=加药孔OD值/空白对照孔OD值×100%。
2.3 ELISA法检测细胞分泌因子水平
取对数生长期细胞,用适量的0.25%胰酶消化,调整细胞密度为5×104mL-1,接种于24孔细胞培养板中,500 μL/孔。将细胞置于37℃、5%CO2孵箱中培养过夜,然后依次加入终质量浓度分别为0.5、1.0、5.0 μg/mL的紫铆素含药培养液,500 μL/孔,每个质量浓度设8个复孔;同时设置空白对照,每孔加入等体积的DEME完全培养液。继续培养48 h后,将培养板每孔中的培养液分别移至EP管中,采用ELISA法检测培养液上清液中细胞分泌因子ET-1、ET-3、MSH、SCF、bFGF的含量,具体操作严格按照相应试剂盒说明书进行。
2.4 统计学方法
3 结果
3.1 紫铆素对HaCaT细胞增殖活性的影响结果
与空白对照比较,0.1 μg/mL紫铆素对细胞增殖的影响不明显;10.0 μg/mL紫铆素对细胞增殖有抑制作用;0.5、1.0、5.0 μg/mL紫铆素对细胞增殖有明显的促进作用,可明显升高细胞存活率,OD值明显增加(P<0.05),结果见表1。
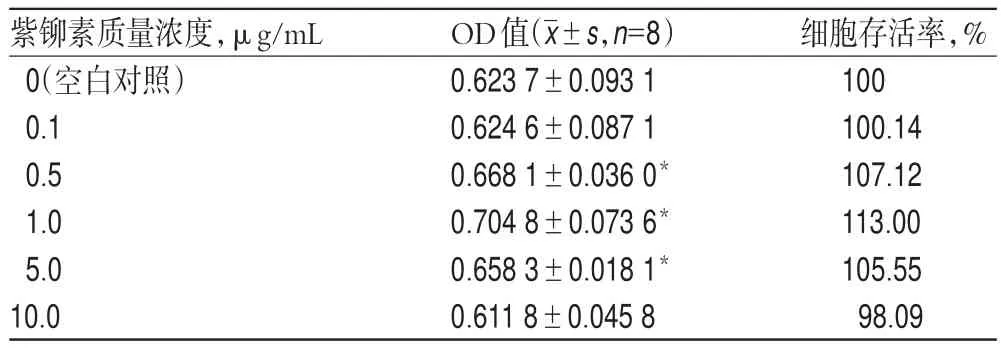
表1 不同质量浓度紫铆素对细胞存活率的影响Tab 1 Effect of different mass concentration butin on survival rate of cells
3.2 紫铆素对HaCaT细胞ET-1、ET-3分泌的影响结果
与空白对照比较,0.5、1.0、5.0 μg/mL 的紫铆素与细胞共孵育48 h后,培养液中ET-1含量显著增加(P<0.01);1.0、5.0 μg/mL紫铆素与细胞共孵育48 h后,细胞培养液中ET-3含量显著增加(P<0.01),结果见表2。
表2 不同质量浓度紫铆素对细胞培养液中ET-1、ET-3含量的影响(±s,n=8,pg/mL)Tab 2 Effects of different mass concentration butin on the contents of ET-1,ET-3 in cell culture medium(±s,n=8,pg/mL)

表2 不同质量浓度紫铆素对细胞培养液中ET-1、ET-3含量的影响(±s,n=8,pg/mL)Tab 2 Effects of different mass concentration butin on the contents of ET-1,ET-3 in cell culture medium(±s,n=8,pg/mL)
注:与空白对照比较,**P<0.01Note:vs.blank control,**P<0.01
紫铆素质量浓度,μg/mL 0(空白对照)0.5 1.0 5.0 ET-3 8.93±1.34 11.16±1.93 18.46±2.36**28.16±1.01**ET-1 67.62±19.03 104.09±15.80**131.63±32.03**217.72±29.21**
3.3 紫铆素对HaCaT细胞分泌SCF、bFGF、MSH的影响结果
与空白对照比较,紫铆素作用48 h后细胞培养液中细胞分泌因子SCF、bFGF、MSH的含量均有所增加;其中0.5、1.0、5.0 μg/mL紫铆素孔细胞培养液中 SCF、bFGF含量差异有统计学意义(P<0.01),1.0、5.0 μg/mL 紫铆素孔细胞培养液中MSH的含量差异有统计学意义(P<0.01),结果见表3。
表3 不同质量浓度紫铆素对细胞培养液中SCF、bFGF、MSH含量的影响(±s,n=8,pg/mL)Tab 3 Effects of different mass concentration butin on the contents of SCF,bFGF,MSH in culture medium(±s,n=8,pg/mL)

表3 不同质量浓度紫铆素对细胞培养液中SCF、bFGF、MSH含量的影响(±s,n=8,pg/mL)Tab 3 Effects of different mass concentration butin on the contents of SCF,bFGF,MSH in culture medium(±s,n=8,pg/mL)
注:与空白对照比较,**P<0.01Note:vs.blank control,**P<0.01
紫铆素质量浓度,μg/mL 0(空白对照)0.5 1.0 5.0 MSH 690.47±65.35 693.44±60.49 959.74±66.98**788.48±66.28**SCF 50.30±8.64 70.56±11.26**76.12±7.16**107.16±11.42**bFGF 88.47±14.35 141.90±19.31**186.05±18.21**126.28±18.93**
4 讨论
由于本研究是初步探讨紫铆素对人角质形成永生化细胞增殖的影响,从角质细胞可通过自分泌和旁分泌多种细胞分泌因子而影响黑素细胞的增殖及黑素合成的角度展开研究,目的是考察紫铆素是否能够通过促进角质细胞增殖及细胞分泌因子而激活黑素细胞,并不是进行药物药效的研究。故在本研究中没有进行量效关系的考察,给药浓度是按照倍数来设计,即以0.5 μg/mL为基数,给药浓度分别是0.5 μg/mL的2、5、10倍。白癜风是一种常见的由黑素细胞被选择性破坏而引起的皮肤色素脱失性疾病,受到内外因素的影响。黑素细胞在生长、分化、增殖、迁移、凋亡等过程中某一个或者几个环节出现异常,将导致黑素形成和沉着异常,发生色素障碍性疾病。虽然白癜风病因尚不明确,但有组织病理学表明,白癜风皮损处缺乏黑素细胞[10]。
ET-1、ET-3是角质形成细胞分泌的重要细胞因子之一,在白癜风发病中起重要作用,皮肤内的ET-1、ET-3升高会促使黑素细胞的游离及分裂增殖,从而促使白斑区的恢复。MSH可促进黑素细胞增殖、产生黑素小体以及通过小眼畸形相关转录因子调节黑素细胞分化,引起皮肤色素沉着。SCF对小眼畸形相关转录因子MITF具有重要的调控作用,而黑素合成酶和黑素合成受黑素细胞特异性MITF基因的调控[11]。皮肤内的SCF上调会使SCF信号传导途径达到正常发挥作用的水平,使黑素细胞的生物学功能趋于正常,从而使白斑区复色[12]。bFGF作为一种具有多种生物效应的细胞生长因子,其可以促进黑素细胞的生长以及调整黑素的量,恢复皮损区的黑素细胞,使皮肤恢复正常的外观和功能,从而达到治疗白癜风的目的[13]。本研究结果显示,紫铆素能够促进HaCaT细胞的增殖及细胞分泌因子ET-1、ET-3、MSH、SCF、bFGF的分泌。
综上所述,紫铆素抗白癜风的作用机制可能与其促进HaCaT细胞增殖以及细胞分泌因子ET-1、ET-3、SCF、bFGF、MSH的分泌,从而促进黑素细胞色素合成有关,但其更多的作用机制有待进一步研究。
[1] 刘铜华.维药驱虫斑鸠菊治疗白癜风的研究与应用[J].国外医学中医中药分册,2004,26(2):103-104.
[2] 范广建,张坚,孙力,等.HPLC法测定驱虫斑鸠菊中紫铆素的含量[J].中国药房,2009,20(30):2366-2367.
[3] ke Poole IC,Van den Wijngaard RM,Westerhof W,et al.Presence or absence of melanocytes in vitiligo lesions:all immunohistochemical investigation[J].J Invest Dermatol,1993,100(6):816-822.
[4] 徐媛媛,唐定书,王慧娟.驱虫斑鸠菊注射液治疗白癜风56例[J].中外医疗,2009,28(8):82.
[5] 陈剑虹,樊宇,张宾,等.复方驱虫斑鸠菊丸联合窄谱UVB治疗白癜风疗效观察[J].内蒙古中医药,2016,35(10):8.
[6] 尚靖.紫铆素及其衍生物在制备具有抑制免疫系统作用药物的用途:中国,200810172195[P].2009-10-21.
[7] 赵萍萍,霍仕霞,彭晓明,等.驱虫斑鸠菊中紫铆素、紫铆花素的分离及其对人A375黑素瘤细胞黑素合成作用的影响[J].中国药学杂志,2013,44(20):1724-1727.
[8] 祃丽娟.热处理对黑素细胞和HaCaT细胞α-MSH分泌变化的研究[D].西安:第四军医大学,2013.
[9] 李海东,王鹰.正常人角质形成细胞和黑素细胞体外共培养体系的建立[J].重庆医学,2012,41(8):769-771、724、833.
[10] 郑莉娟,黄庆华,吕迎霞,等.白癜风发病机制与细胞因子的关系[J].医药论坛杂志,2017,38(2):176-178.
[11] 王鹰,李海东,廖军.过氧化氢对表皮黑素细胞和角质形成细胞SCF/Kit/MITF表达的影响[J].临床皮肤科杂志,2012,41(2):86-88.
[12] 张峻岭,索丹凤.他克莫司对角质形成细胞SCF mRNA及黑素细胞c-kit mRNA表达的影响[C]//全国中西医结合皮肤性病学术会议论文汇编.昆明:中国中西医结合学会皮肤性病专业委员会,2011:1-11.
[13] 陈小佳,谢秋玲,张玲,等.bFGF与黑色素关系的研究进展[J].中国生物工程杂志,2003,23(7):20-23.
Effects of Butin in Vernohia anthelmintica on Proliferation of Human Immortal Keratinocyte Cell Strain HaCaT and Cell Secretory Factors
WANG Zhijie1,GAO Li2,HUO Shixia2,TAN Xue2,LUO Jingying2,YAN Ming2(1.College of Pharmacy,Shihezi University,Xinjiang Shihezi 832003,China;2.Xinjiang Institute of Traditional Uighur Medicine/Xinjiang Laboratory of Uighur Medical Prescription,Urmuqi 830049,China)
OBJECTIVE:To study the effects of butin in Vernohia anthelmintica(VW)on proliferation of human immortal keratinocyte cell strain HaCaT and cell secretory factors,and explore the mechanism of butin in VW in the treatment of vitiligo.METHODS:MTT method was used to determine the survival rate of HaCaT cells cultured by 0(blank control),0.1,0.5,1.0,5.0,10.0 μg/mL of butin for 48 h.Enzyme-linked immunosorbent assay was used to determine the contents of cell secretory factors as endothelin 1(ET-1),ET-3,melanocyte stimulating hormone(MSH),stem cell factor(SCF),basic fibroblast growth factor(bFGF)in culture medium after HaCaT cells were cultured by 0.5,1.0,5.0 μg/mL of butin for 48 h.RESULTS:Compared with blank control,cell survival rate was increased to varying degrees after cultured by 0.1-5.0 μg/mL of butin for 48 h,while decreased after cultured by 10.0 μg/mL of butin.Contents of ET-1,SCF,bFGF in culture medium were significantly increased after cultured by 0.5,1.0,5.0 μg/mL of butin for 48 h(P<0.01);and contents of ET-3,MSH in culture medium were significantly increased after cultured by 1.0,5.0 μg/mL of butin for 48 h(P<0.01).CONCLUSIONS:Butin can promote the proliferation of HaCaT cells,the mechanism may be associated with promoting the secretion of cell secretory factors of ET-1,ET-3,MSH,SCF,bFGF.
Vernohia anthelmintica;Butin;Human immortal keratinocyte cell strain HaCaT;Proliferation;Cell factors
R751.05
A
1001-0408(2017)28-3904-03
2017-03-17
2017-07-19)
(编辑:林 静)
国家自然科学基金资助项目(No.81260689)
*硕士研究生。研究方向:药物分析、新药研发。E-mail:1542658051@qq.com
#通信作者:研究员,硕士。研究方向:药物分析、新药研发。E-mail:yanming21cn@sohu.cn.com
DOI 10.6039/j.issn.1001-0408.2017.28.05
