磷脂酶D的制备及催化磷脂酰胆碱合成磷脂酰丝氨酸
2017-10-12钱娟,庞洋,王昕
钱 娟,庞 洋,王 昕
(南京工业大学 生物与制药工程学院,南京 211816)
油脂化学
磷脂酶D的制备及催化磷脂酰胆碱合成磷脂酰丝氨酸
钱 娟,庞 洋,王 昕
(南京工业大学 生物与制药工程学院,南京 211816)
选用穗色链霉菌(Streptomycesracemochromogenes)作为磷脂酶 D 的生产菌株进行了酶的制备及条件优化,并在两相体系中进行了酶催化磷脂酰胆碱合成磷脂酰丝氨酸的研究。结果表明,最适的产酶条件为葡萄糖 10 g/L、酵母粉5 g/L、鱼粉蛋白胨 5 g/L、司班-60 10 g/L、氯化钙 3 g/L,接种量 1%、培养基初始 pH 7.0、培养温度 30.℃,在最适产酶条件下酶活达到2 967 U/L,是优化前 的2.12 倍;最适的催化工艺条件为有机相二氯甲烷、反应温度35.℃、pH 5.5、酶用量1.15 U/mL、钙离子浓度10 mmol/L,在该催化工艺条件下反应10 h后磷脂酰胆碱的生成率达94%。
穗色链霉菌;磷脂酶D;磷脂酰丝氨酸;两相催化
Abstract:Streptomycesracemochromogeneswas used as the producing strain to prepare phospholipase D and the preparation conditions were optimized.The synthesis of phosphatidylserine from phosphatidylcholine catalyzed by phospholipase D in biphasic catalysis system was studied.The results showed that the optimal conditions for enzyme production were obtained as follows:glucose 10 g/L,yeast extract 5 g/L,fishmeal peptone 5 g/L,Span-60 10 g/L,calcium chlodride 3 g/L,inoculation amount 1%,initial pH of medium 7.0 and cultural temperature 30.℃.Under these conditions,the enzyme activity reached 2 967 U/L,which was 2.12 times of that before optimization.The optimal catalytic process conditions were obtained as follows:dichloromethane as organic phase,reaction temperature 35.℃,pH 5.5,enzyme dosage 1.15 U/mL,Ca2+concentration 10 mmol/L.Under these conditions,the yield of phosphatidylcholine reached 94%.
Keywords:Streptomycesracemochromogenes; phospholipase D; phosphatidylserine; biphasic catalysis
磷脂酰丝氨酸(PS)是一种磷脂,具有很好的健脑功效[1]。近年来研究发现来源于链霉菌的磷脂酶D(PLD)表现出较好的水解和转磷酯化活性[2],基于PLD所具有的转酰基反应能力,以大豆卵磷脂或蛋黄卵磷脂(主要成分为磷脂酰胆碱,PC)和L-丝氨酸为底物,以酶法合成磷脂酰丝氨酸(PS)的方法已经被广泛研究。由于底物磷脂酰胆碱为脂溶性物质,L-丝氨酸为水溶性物质,因此在催化反应中一般采用双向体系来进行。
Juneja等[3]研究表明在乙酸乙酯和醋酸盐缓冲液双向体系中,PLD催化合成PS的产率可达98%。Birichevskaya等[4]在双向体系中PS产率达到81%。Sakai等[5]使用均质体系催化合成PS,优化后PS的生成率达到46.7%。胡飞[6]使用均相体系,在溶剂体系(2-甲基四氢呋喃/γ-戊内酯)中,经过条件优化后,PS产率达到81%。朱南南[7]利用两相反应体系,有机溶剂为乙醚,PS收率达58.4%。韩海霞[8]利用链霉菌CA-1为生产菌株制备PLD,以乙醚-醋酸盐缓冲液为双向体系,PS生成率达到67.8%。
本文利用穗色链霉菌制备PLD,通过优化酶制备和转磷酯化反应体系条件,从蛋黄磷脂出发富集磷脂酰丝氨酸[9],提高了稀有磷脂的产率,为进一步扩大培养及工业化生产打下一定的基础。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株及试剂
穗色链霉菌(Streptomycesracemochromogenes)4.331,购自中国普通微生物菌种保藏管理中心(CCGMC)。蛋黄磷脂(含75%磷脂酰胆碱),购自北京美亚斯磷脂技术有限公司;L-丝氨酸,购自阿拉丁试剂;其他化学试剂均为分析纯。
1.1.2 培养基
斜面培养基:葡萄糖5 g/L,蛋白胨5 g/L,酵母粉5 g/L,K2HPO42 g/L,MgSO4·7H2O 0.5 g/L,琼脂25 g/L,pH自然。
种子及发酵培养基:葡萄糖5 g/L,蛋白胨5 g/L,酵母粉5 g/L,K2HPO42 g/L,MgSO4·7H2O 0.5 g/L,pH自然。
1.2 实验方法
1.2.1 摇瓶培养
将经斜面培养基活化的穗色链霉菌孢子刮于0.9%的无菌生理盐水中,制成孢子悬浮液,吸取1 mL 孢子悬浮液于50 mL种子培养基中,200 r/min、30.℃条件下恒温振荡培养24 h。将种子液以1%的接种量接于50 mL发酵培养基中,在200 r/min、30.℃条件下培养48 h后,离心弃细胞,取发酵液上清测定PLD的酶活为1 400 U/L。以初始培养基为对照,每组3组平行,规定对照条件下的酶活为100%,对产酶条件进行优化。
1.2.2 初始催化体系
在2 mL水相为0.2 mol/L的乙酸-乙酸钠缓冲液(pH为5.5)中,加入0.575 U/mL酶液,L-丝氨酸同时溶解于醋酸盐缓冲液中,磷脂酰胆碱溶解于2 mL二氯甲烷中,磷脂酰胆碱与L-丝氨酸的摩尔比1∶20,反应温度30.℃。在初始催化体系的基础上,优化催化工艺。
1.2.3 酶活的测定
在初始催化体系条件下测定PLD的酶活。
1.2.4 磷脂酰胆碱和磷脂酰丝氨酸的测定
采用Agilent 1260高效液相色谱仪测定磷脂酰胆碱和磷脂酰丝氨酸。色谱条件:色谱柱为ZORBAX RX-SIL Columns(4.6 mm×250 mm);以甲醇-水-冰醋酸-三乙胺(体积比85∶15∶0.45∶0.05)为流动相A,以正己烷-异丙醇-流动相A(体积比20∶48∶32)为流动相B,按表1进行梯度洗脱;柱温为39.℃,用蒸发光散射检测器检测(参考条件:漂移管温度65.℃,载气流量2.0 mL/min)

表1 HPLC梯度洗脱
1.2.5 PS转化率和PS生成率的计算
PS转化率=PS产量/PC消耗量×100%
PS生成率=PS产量/PC初始添加量×100%
2 结果与讨论
2.1 穗色链霉菌发酵条件的优化
2.1.1 不同碳源对产酶的影响
碳源是构成细胞成分的重要因素,是细胞内贮藏物质和代谢产物的骨架,也是微生物生长的主要能量来源[10]。分别以5 g/L葡萄糖、果糖、蔗糖、甘油、可溶性淀粉作为培养基中碳源,研究不同碳源对产酶的影响,得出产酶情况如图1所示。

注:A.葡萄糖;B.果糖;C.蔗糖;D.甘油;E.可溶性淀粉。
由图1可知,葡萄糖作为碳源时,酶活最大,可能是由于葡萄糖为单糖,发酵时菌丝易于吸收分解,促进菌体快速生长,使产酶量增加,酶活较大;可溶性淀粉次之,甘油和果糖作为碳源时,则不利于产酶。根据酶活大小,选择葡萄糖作为最佳碳源。
以优化出的葡萄糖作为碳源,其他培养基成份不变,以空白作对照,考察不同的葡萄糖质量浓度对产酶的影响,结果如图2所示。
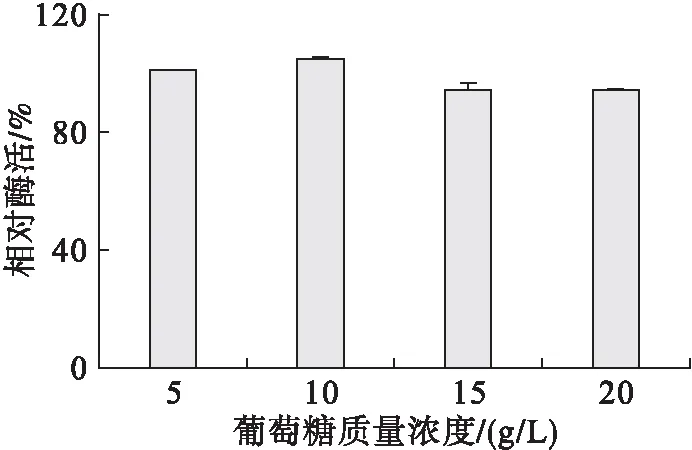
图2 葡萄糖质量浓度对产酶的影响
由图2可知,葡萄糖质量浓度从5 g/L逐渐增加至10 g/L时,发酵液中的酶活随葡萄糖质量浓度的升高呈上升趋势,葡萄糖质量浓度再增大,酶活下降。因此,葡萄糖最适质量浓度为10 g/L。
2.1.2 不同氮源对产酶的影响
氮源供应微生物生长所需,也是细胞合成含氮化合物的主要来源,实验室常用的有机氮源有蛋白胨、牛肉膏、酵母粉等,无机氮源主要包括铵盐、硝酸盐等[11-13]。研究了不同氮源对产酶的影响,氮源质量浓度均为10 g/L,复合氮源均分,总质量浓度也为10 g/L,结果如图3所示。

注:A.蛋白胨+酵母粉;B.蛋白胨+酵母粉+(NH4)2SO4;C.酵母粉;D.蛋白胨;E.聚蛋白胨;F.鱼粉蛋白胨;G.牛肉膏;H.玉米浆;I.(NH4)2SO4;J.鱼粉蛋白胨+酵母粉。
图3不同氮源对产酶的影响
由图3可知,当氮源为有机氮源时,酶活较高;而添加无机氮源时,对培养基pH影响较大,继而影响酶活。培养基中添加鱼粉蛋白胨和酵母粉的复合氮源时,酶活最高,达到了对照组的2倍。可能是复合氮源中氨基酸、生长因子等成分配比更适合菌丝生长,产酶量大,发酵液中酶活大,因此选择鱼粉蛋白胨5 g/L、酵母粉5 g/L作为最佳氮源。
2.1.3 表面活性剂对产酶的影响
表面活性剂可作用于菌体细胞膜,改善细胞膜的通透性,加速胞外酶的释放。PLD是一种胞外酶,在培养基中添加适当的表面活性剂理论上可以促进酶的释放[14]。考察了实验室常用的几种表面活性剂对酶活的影响,每种表面活性剂均添加10 g/L,结果如图4所示。

注:A.对照;B.司班-60;C.SDS;D.吐温20;E.吐温60;F.吐温80;G.TritonX-100。
图4表面活性剂对产酶的影响
由图4可知,司班-60,吐温80,吐温60等非离子型表面活性剂可以一定程度促进PLD的释放。而吐温20对细胞的产酶没有明显的提高作用,TritonX-100和SDS的加入不利于菌体生长和酶的生产。因此,在培养基中添加10 g/L司班-60以提高酶的释放。
2.1.4 钙离子对产酶的影响
微生物生长繁殖和产生代谢产物的过程中,需要某些微量元素作为其生理活性物质的组成物质或调节物,离子可能会对编码蛋白酶的基因转录产生影响,也会影响胞外酶的酶活[8]。其中,已经有文献报道钙离子能促进链霉菌的产酶,但是机理尚不明确。可能是因为钙离子是某些酶的辅因子,能影响酶的活性和稳定性,有助于链霉菌孢子的形成[15]。为研究钙离子对实验菌株产酶影响,向培养基中加入不同质量浓度氯化钙,以不加氯化钙的培养基为对照,结果如图5所示。

图5 钙离子对产酶的影响
由图5可知,氯化钙为3 g/L时,酶活达到最大值,是对照组的1.69倍,当氯化钙质量浓度大于3 g/L 时,酶活开始下降。因此在一定范围内,钙离子对实验菌株产酶有促进作用,可能是钙离子参与PLD的合成,改变酶蛋白的折叠结构或调节细胞膜流动性,促进PLD分泌到细胞外,使产酶量增加。
2.1.5 培养基初始pH和培养温度对产酶的影响
pH可以影响菌体生长,对酶的活性产生重要的影响继而改变生物的代谢途径。研究了不同培养基初始pH对产酶的影响,结果如图6所示。不同培养温度对产酶的影响,结果如图7所示。

图6 培养基初始pH对产酶的影响

图7 培养温度对产酶的影响
由图6可知,当pH从4.0到7.0时,酶活逐渐升高,pH再增大时,酶活开始下降;pH为4.0时,抑制菌体生长,菌体浓度很低,产酶少,大于4.0时,菌体浓度和酶活逐渐增大,推测酸性条件抑制酶的活性,中性偏碱性条件下,酶活也呈下降趋势,因此选择最佳培养基初始pH 7.0。
由图7可知,培养温度在20~30.℃之间,酶活上升,培养温度继续升高时,酶活开始下降,说明高温影响菌体的产酶。根据酶活大小,选择最佳培养温度为30.℃。
经过优化,最终得到的穗色链霉菌产PLD的最适发酵条件为葡萄糖10 g/L、酵母粉5 g/L,鱼粉蛋白胨5 g/L、司班-60 10 g/L、氯化钙3 g/L,培养基初始pH 7.0、培养温度30.℃。在最适发酵条件下,酶活达到2 967 U/L,是优化前的2.12倍。
2.2 PLD催化磷脂酰胆碱合成磷脂酰丝氨酸工艺条件的优化
2.2.1 有机溶剂的选择
磷脂酰胆碱溶解在有机相中,适宜的有机溶剂可以增大底物的溶解度,提高传质速率,且能够对酶的天然构象产生正影响[16]。因此,考察了反应4 h后几种常见的有机溶剂对PLD催化生产PS的影响,结果如表2所示。
由表2可知,二氯甲烷和醋酸丁酯为有机相时,转化率相对较高,甲苯为有机相时,转化率最小,而在乙酸乙酯中则没有检测到产物的生成,可能是溶剂的极性影响介质的介电常数,介电常数影响酶的催化能力,导致酶活力的差异。综上,选择二氯甲烷和醋酸丁酯作为进一步研究对象,考察PLD对这两种有机溶剂的耐受性。

表2 有机溶剂对PLD催化生产PS的影响
以不经过任何处理的酶液作为阳性对照;以在室温摇床上进行200 r/min振荡处理4、8、12、24 h的酶液作为阴性对照,目的是排除温度对酶活的影响;以分别与两种有机溶剂按体积比1∶1混合,在室温摇床上200 r/min振荡处理4、8、12、24 h的酶液作为实验组。取3组酶液进行催化反应,反应时间4 h,结果如图8、图9所示。
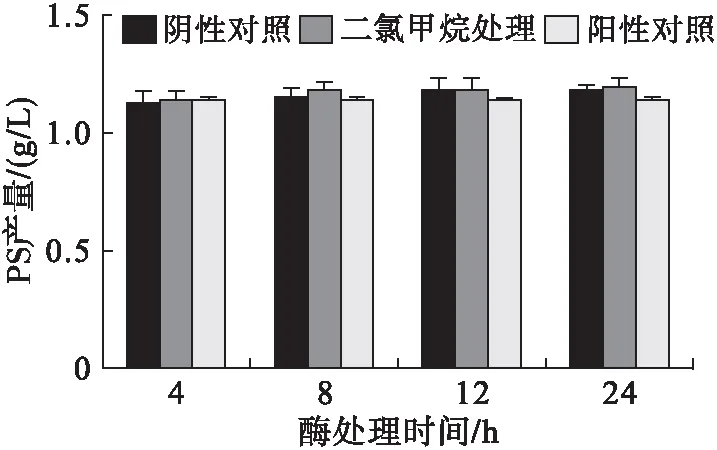
图8 PLD对二氯甲烷耐受性

图9 PLD对醋酸丁酯耐受性
由图8和图9可知,室温情况下,酶的活性基本不受影响,二氯甲烷对酶的活性也基本没有影响,而经过醋酸丁酯处理的酶液用于反应则对酶活有明显的抑制作用,且在醋酸丁酯中处理时间越长,对酶活的抑制作用越明显,因此推测在含有醋酸丁酯的生物催化体系中,溶剂的性质影响了酶的活性,这可能是醋酸丁酯降低了酶分子的柔性,继而影响了酶的催化活性。综上,选择二氯甲烷作为双向体系的有机溶剂。
2.2.2 酶用量的选择
采用双相反应体系,有限的界面面积限制了酶的用量,一定范围内增大酶用量会提高产品的产率,但是过量的酶会造成酶量饱和,因此考察体系最大酶用量。反应10 h后酶用量对PLD催化生产PS的影响如表3所示。
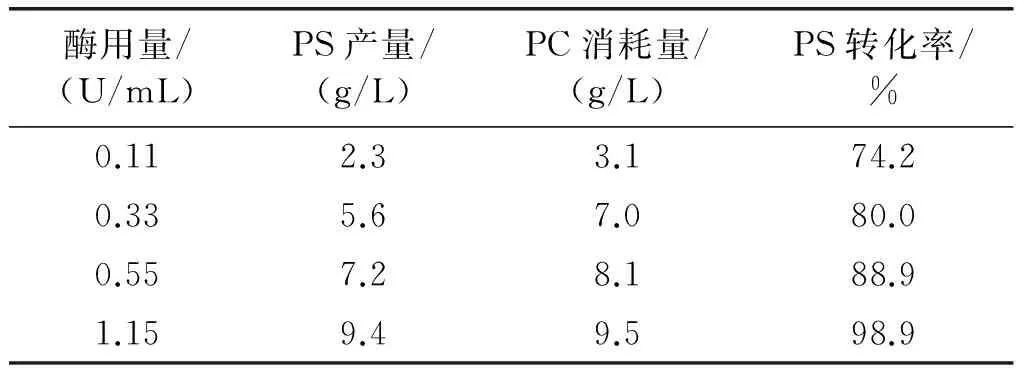
表3 酶用量对PLD催化生产PS的影响
由表3可知,PS转化率随酶用量增加而增大,当酶用量为1.15 U/mL,几乎达到饱和,即为最适酶用量。
2.2.3 金属离子的选择
在反应体系中添加合适的金属离子,可能会影响酶的蛋白质结构,进而对酶活产生积极的影响。有文章报道钙离子能增大PLD的催化转酯活性,如Simkhada等[17]报道的产自菌株Streptomycesolivochromogenes的PLD528及Mander等[18]报道产自Streptomycestendae的PLDSt都受钙离子影响。为探讨金属离子对酶活的影响机制,研究了几种常见的金属离子对酶活的影响。金属离子浓度均为10 mmol/L,以不加金属离子的为对照。反应4 h后金属离子对PLD催化生产PS的影响如图10所示。
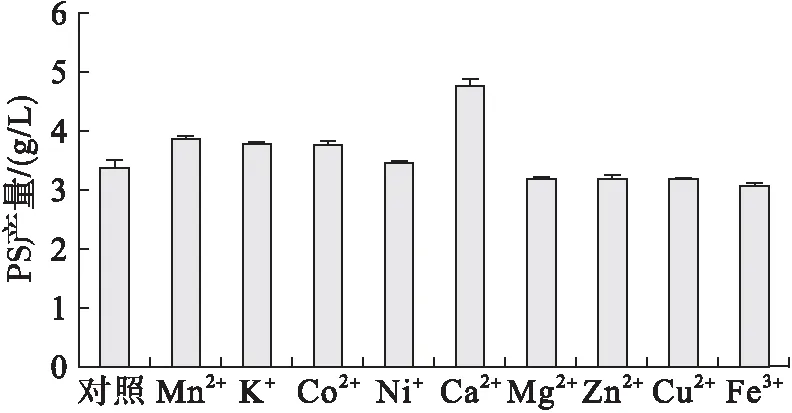
图10 金属离子对PLD催化生产PS的影响
由图10可知,钙离子对PLD对酶的促进作用最大,加入钙离子后,PS产量是对照组的1.4倍;锰、钾、钴离子对酶的转酯活性有一定积极影响,镍离子对酶活影响不大,镁、锌、铜、铁离子对转酯活性有抑制作用,但抑制效果均不明显,可能是金属离子影响酶的二级结构,影响酶的稳定性,不利于酶与底物结合。
2.2.4 反应pH和反应温度的选择
每一种酶都有它的最适pH,pH偏低或偏高都会使酶活性部位的基团离子化发生变化而降低酶的活力,考察反应10 h后pH对PLD催化生产PS的影响,结果如图11所示。反应温度的变化使底物磷脂在两相体系中分配系数产生变化,继而改变底物在两相中的分布状态,反应温度的变化也会影响酶蛋白的结构,过高的反应温度会改变活性部位的结构,导致催化活性的降低,甚至使酶失活,考察反应10 h后反应温度对PLD催化生产PS的影响,结果如图12所示。

图11 pH对PLD催化生产PS的影响
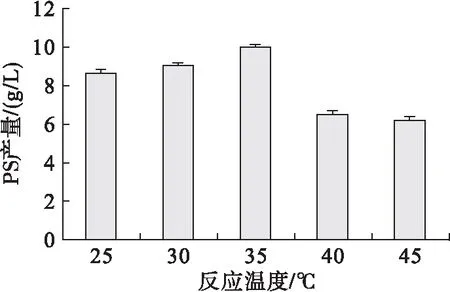
图12 反应温度对PLD催化生产PS的影响
由图11可知,PS产量随pH的增加而先升高后降低,在pH为5.5时达到最大值,因此可以确定PLD催化生产PS的最佳pH为5.5。
由图12可知,PS产量随反应温度的升高而先升高后降低,35.℃时酶的催化活性最高,因此选择35.℃作为最适反应温度。
经过对反应体系的优化,得出的催化最适温度和pH分别为35.℃和5.5;使用有机相为二氯甲烷;最适酶用量为1.15 U/mL,钙离子浓度为10 mmol/L。在最适催化工艺条件下,10 h后PS生成率可达到94%。
3 结 论
通过对产酶条件的优化和催化工艺条件的优化,得到最适产酶条件为葡萄糖10 g/L、酵母粉5 g/L、鱼粉蛋白胨5 g/L、司班-60 10 g/L、氯化钙3 g/L,接种量1%、培养基初始pH 7.0、培养温度30.℃。在最适产酶条件下,酶活达到2 967 U/L,是优化前的2.12倍。最适催化工艺条件为使用二氯甲烷作为有机相、酶用量1.15 U/mL、钙离子浓度10 mmol/L、反应温度35.℃和pH 5.5。在最适催化工艺条件下,反应10 h后PS生成率达94%。实验极大地提高了PS的生成率,为进一步扩大培养及工业化生产提供了可能。
[1] KIDD P M.Attention deficit/hyperactivity disorder (ADHD) in children:rationale for its integrative management[J].Altern Med Rev,2000,5(5):402-428.
[2] SONG J K,HAN J J,RHEE J S.Phospholipases:occurrence and production in microorganisms,assay for high throughput screening,and gene discovery from natural and man-made diversity[J].J Am Oil Chem Soc,2005,82(10):691-705.
[3] JUNEJA L R,KAZUOKA T,GOTO N,et al.Conversion of phosphatidylcholine to phosphatidyserine by various phosphalipases D in the presence ofL- orD-serine[J].Biochim Biophys Acta,1989,1003(3):277-283.
[4] BIRICHEVSKAYA L L,KISEL M A.Use of phosphalipases D fromStreptomycesnetropsisfor the biocatalytic synthesis of phosphatidyserine[J].Vestsi Nats Akad Navuk Belarusi,Ser Navuk,2008(3):86-90.
[5] SAKAI M,EBINA R,YAMATOYA H,et al.Method for producing phosphalipid:US20050170476A1[P].2005-02-24.
[6] 胡飞.磷脂酶 D 制备及其催化合成磷脂酰丝氨酸研究[D].合肥:合肥工业大学,2013.
[7] 朱南南.磷脂酶D催化磷脂酰基转移合成磷脂酰丝氨酸反应的研究[D].西安:西北工业大学,2005.
[8] 韩海霞.磷脂酶D的制备及其在磷脂酰丝氨酸合成中的应用[D].江苏 无锡:江南大学,2014.
[9] HATANAKA T,NEGISHI T,KUBOTA-AKIZAWA M,et al.Study on thermostability of phospholipase D fromStrep-tomycessp.[J].Biochim Biophys Acta,2002,1598(2):156-164.
[10] 许建和.生物催化工程[M].上海:华东理工大学出版社,2008:69-72.
[11] 曹军卫,马辉文.微生物工程[M].北京:科学工业出版社,2002:80-121.
[12] 肖冬光.微生物工程原理[M].北京:中国轻工业出版社,2004:37-40,61-71,200-207.
[13] 程殿林.微生物工程技术原理[M].北京:化学工业出版社,2007:18-21,58-61,92,114-121.
[14] 郭浩.磷脂酶D高产菌株的选育及发酵条件优化 [D].西安:西北大学,2007.
[15] SHINONAGA M A,KAWAMURA Y,SHIMBO K,et al.Continuous production of phospholipase D byStreptomyceslydicusD-121 immobilized with corss-linked chitosan beads[J].J Ferment Bioeng,1996,81(4):310-314.
[16] 王兴国,裘爱泳,陶文沂,等.磷脂酶 D 催化反应中的有机溶剂效应[J].无锡轻工大学学报,1995,3(4):212-220.
[17] SIMKHADA J R,LEE H J,JANG S Y,et al.A novel alkalo- and thermostable phospholipase D fromStreptomycesolivochromogen[J].Biotechnol Lett,2009,31(3):429-435.
[18] MANDER P,SIMKHADA J R,CHO S S,et al.A novel Ca2+-dependent phospholipase D fromStreptomycestendae,possessing only hydrolytic activity[J].Arch Pharm Res,2009,32:1461-1467.
PreparationofphospholipaseDandcatalyticsynthesisofphosphatidylserinefromphosphatidylcholine
QIAN Juan,PANG Yang,WANG Xin
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211816,China)
TQ033;TS202.3
A
1003-7969(2017)09-0066-06
2016-11-24;
2017-05-05
钱 娟(1991),女,硕士研究生,研究方向为微生物酶催化(E-mail)18260037163@163.com。
王 昕,讲师,博士(E-mail)xinwang1988@njtech.edu。
