不同地区青檀根际土壤肥力和真菌多样性及其相关性分析
2017-10-12常强强范佳佳刘慧君李晓红张小平
常强强, 范佳佳, 刘慧君, 李晓红, 张小平
(安徽师范大学生命科学学院, 安徽 芜湖 241000)
不同地区青檀根际土壤肥力和真菌多样性及其相关性分析
常强强, 范佳佳, 刘慧君, 李晓红, 张小平①
(安徽师范大学生命科学学院, 安徽 芜湖 241000)
为了探明不同地区青檀(PteroceltistatarinowiiMaxim.)根际土壤真菌多样性及其与土壤肥力的关系,对国内7省(广西、安徽、河南、陕西、四川、山东和辽宁)1市(北京)8个样地野生青檀根际土壤的肥力指标(包括pH值、速效磷含量和速效钾含量)进行比较,并采用Illumina MiSeq高通量测序技术对其根际土壤的真菌多样性进行了分析;在此基础上,对土壤真菌多样性指数与土壤肥力指标的相关性以及土壤真菌科水平相对丰度前20位的操作分类单元(OTUs)与土壤肥力指标的相关性进行分析。结果表明:供试8个样地青檀根际土壤的pH值为pH 6.06~pH 7.61,速效磷含量为0.49~3.27 μg·g-1,速效钾含量为150.24~636.89 μg·g-1。基于土壤真菌DNA测序结果,以有效序列相似度97%为阈值获得7 143个OTUs,鉴定出6门32纲106目254科,其中,包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota)3个优势门以及Incertae sedis(GenBank数据库中存在,但未准确分类的科)、被孢霉科(Mortierellaceae)、发菌科(Trichocomaceae)、丛赤壳科(Nectriaceae)和Archaeorhizomycetaceae 5个共有优势科;不同样地的土壤真菌多样性差异明显,Chao1指数、Shannon-Wiener指数和Simpson指数分别为1 041.37~1 793.19、5.39~6.14和0.007~0.020,盖度为98.90%~99.84%。相关性分析结果表明:土壤真菌Chao1指数与土壤速效钾含量呈显著(P<0.05)负相关,其余土壤真菌多样性指数与土壤肥力指标的相关性均不显著;在相对丰度前20位的OTUs中,55%OTUs与土壤pH值呈负相关,并且,多数OTUs与土壤的速效磷含量和速效钾含量呈正相关,其中,OTU0(被孢霉科)与土壤pH值呈显著负相关,OTU1(丛赤壳科)和OTU4(伞型束梗孔菌科)(Agaricostilbaceae)与土壤速效钾含量呈显著正相关。研究结果显示:野生青檀根际土壤呈弱酸性至弱碱性,并具有富钾少磷的特点;青檀根际土壤真菌多样性与土壤肥力有一定相关性,并且,被孢霉科、丛赤壳科和伞型束梗孔菌科与土壤肥力有显著相关性。
青檀; 土壤肥力; 土壤真菌多样性; Illumina MiSeq高通量测序技术; 操作分类单元(OTUs); 相关性分析
Abstract: To verify fungal diversity and its relationship with soil fertility of rhizophere soil ofPteroceltistatarinowiiMaxim. in different regions, fertility indexes (including pH value, available phosphorus and available potassium contents) of rhizosphere soil of wildP.tatarinowiiin eight plots of seven provinces(Guangxi, Anhui, He’nan, Shaanxi, Sichuan, Shandong, and Liaoning) and one city(Beijing) in China were compared, and fungal diversity of its rhizosphere soil was analyzed by Illumina MiSeq high-throughput sequencing technology. On this basis, the correlation between soil fungal diversity indexes and soil fertility indexes and that between the top 20 operational taxonomic units (OTUs) with relative abundance of soil fungi at family level and soil fertility indexes were analyzed. The results show that pH value of rhizosphere soil ofP.tatarinowiiin eight plots tested is pH 6.06-pH 7.61, available phosphorus content is 0.49-3.27 μg·g-1, and available potassium content is 150.24-636.89 μg·g-1. Based on sequencing result of soil fungal DNA, 7 143 OTUs are obtained by taking effective sequence similarity of 97% as threshold, and 6 phyla, 32 classes, 106 orders, 254 families are identified, in which, there are three dominant phyla including Ascomycota, Basidiomycota, and Zygomycota, and five common dominant families including Incertae sedis (the family exists in GenBank data base, but is inexactly classifed), Mortierellaceae, Trichocomaceae, Nectriaceae, and Archaeorhizomycetaceae. The difference in soil fungal diversity among different plots is obvious, and Chao1 index, Shannon-Wiener index, and Simpson index are 1 041.37-1 793.19, 5.39-6.14, and 0.007-0.020, respectively, coverage is 98.90%-99.84%. The correlation analysis results show that there is a significantly (P<0.05) negative correlation between Chao1 index of soil fungi and soil available potassium content, and correlations between other soil fungal diversity indexes and soil fertility indexes are not significant. In the top 20 OTUs with relative abundance, 55% OTUs have a negative correlation with soil pH value, and most OTUs have a positive correlation with soil available phosphorus and available potassium contents. In which, OTU0 (Mortierellaceae) has a significantly negative correlation with soil pH value, and OTU1 (Nectriaceae) and OTU4 (Agaricostilbaceae) have significantly positive correlations with soil available potassium content. It is suggested that rhizosphere soil of wildP.tatarinowiiis weakly acidic to weakly alkaline with characteristics of rich potassium and less phosphorus. There are some correlations between fungal diversity of rhizosphere soil ofP.tatarinowiiand soil fertility, in addition, Mortierellaceae, Nectriaceae, and Agaricostilbaceae have significant correlations with soil fertility.
Keywords:PteroceltistatarinowiiMaxim.; soil fertility; soil fungal diversity; Illumina MiSeq high-throughput sequencing technology; operational taxonomic units (OTUs); correlation analysis
青檀(PteroceltistatarinowiiMaxim.)为榆科(Ulmaceae)青檀属(PteroceltisMaxim.)的惟一种,属阔叶乔木,是中国特有种植物[1],栽培历史悠久,已经成为安徽省具有地域特色的经营树种[2-3],可作为造纸原料、饲料、药用植物、景观植物和生态防护植物等。青檀为宣纸的主要原材料,其树皮的纤维素和木质素含量直接影响宣纸质量。相关研究表明:青檀树皮的纤维素和木质素含量受土壤肥力影响明显,其中,土壤的速效磷含量与青檀树皮的纤维素含量呈正相关;并且,土壤的速效钾含量与青檀树皮的纤维长度呈显著正相关[4]。随着人们对宣纸需求量的不断增大,人工种植青檀的规模逐渐扩大,对青檀的相关研究也日渐深入,目前有关青檀的研究主要集中在解剖学、生理学、生态学、育苗及栽培技术、檀皮质量和遗传变异等方面[5-11],但关于青檀与微生物尤其是土壤真菌的相关研究报道却较少[12-13],不利于优质檀皮的规模化生产。
相关研究表明:植物根际土壤真菌与土壤的肥力状况以及植物的生长发育和物质代谢均密切相关。郭顺星等[14]的研究结果表明,真菌可以促进兰科(Orchidaceae)植物种子萌发;欧静等[15]的研究结果表明,接种杜鹃花类菌根真菌(ericoid mycorrhizal fungi)后2年生桃叶杜鹃(RhododendronannaeFranch.)无菌苗叶片的光合性能和叶绿素荧光参数均较对照(不接种杜鹃花类菌根真菌)显著提高,幼苗干质量也较对照显著提高;周浓等[16]的研究结果表明,随着种植年限增大,根际土壤的真菌数量逐渐增加,而滇重楼〔Parispolyphyllavar.yunnanensis(Franch.) Hand.-Mazz.〕的甾体皂苷含量却逐渐减少;孙金华等[17]认为,部分丛枝菌根真菌(arbuscular mycorrhizal fungi)能够诱导某些植物体内高亲和力磷转运蛋白基因的表达,从而促进生长在贫瘠土壤中的植物对磷的吸收;丛枝菌根真菌能够通过调节芦笋(AsparagusofficinalisLinn.)体内钠、钾等离子的吸收和分布来缓解盐胁迫对植株的伤害[18]。由此可见,明确土壤真菌多样性与土壤肥力的关系对于人工种植植物具有重要意义。
鉴于此,作者以国内7省1市8个样地野生青檀的根际土壤为研究对象,对土壤肥力状况进行了比较,并采用Illumina MiSeq高通量测序技术对土壤真菌多样性进行了分析;在此基础上,对土壤真菌多样性指数与土壤肥力指标的相关性以及土壤真菌科水平相对丰度前20位的操作分类单元(operational taxonomic units,OTUs)与土壤肥力指标的相关性进行了分析,以期明确青檀根际土壤的真菌多样性及其与土壤肥力的关系,为探究根际土壤真菌与檀皮质量的关系提供参考。
1 样地概况和研究方法
1.1 样地概况
根据中国数字植物标本馆(CVH)中的信息,选择国内7省1市8个样地野生青檀的根际土壤作为研究对象,包括广西桂林龙岩村(东经110°17′43″、北纬25°03′36″)、安徽宣城小岭村(东经118°18′36″、北纬30°40′48″)、河南信阳鸡公山(东经114°03′30″、北纬31°49′17″)、陕西汉中一里沟村(东经106°07′12″、北纬33°13′12″)、四川广元鼓城村(东经106°52′12″、北纬32°42′36″)、山东济南灵岩寺(东经116°58′28″、北纬36°21′43″)、辽宁大连蛇岛(东经120°58′48″、北纬38°57′23″)和北京滴水岩(东经115°53′24″、北纬39°52′48″)。其中,广西桂林龙岩村和安徽宣城小岭村样地属亚热带季风气候,热量充足,降水丰富,气温年较差较小;陕西汉中一里沟村和四川广元鼓城村样地位于北亚热带北缘,属山地暖温带湿润季风气候,四季分明,年温差较大;北京滴水岩样地属北温带季风气候,夏季高温多雨,冬季寒冷干燥,气候特征变化明显;河南信阳鸡公山和山东济南灵岩寺样地属暖温带季风气候,四季分明,雨热同期,天气非周期性变化明显;辽宁大连蛇岛样地位于渤海中,与大陆隔绝,具有典型的海洋性气候特点,四季分明,变化平缓,夏无酷暑,冬无奇寒。
1.2 研究方法
1.2.1 根际土壤采集 于2016年8月至10月在供试8个样地内分别选择5株胸径15~20 cm的野生青檀植株,去除土壤表层的腐殖质,确定母株根系,在距地表5~10 cm的根系周围采集土样。每个样地每株采集2份土样,每份约300 g,装入无菌密封袋中,迅速置于冰盒或液氮罐中保存,并带回实验室。
取每个单株的一份土样,分别编号后,置于45 ℃鼓风干燥箱中烘干至恒质量,碾碎后过200目筛,用于土壤肥力检测。取每个单株的另一份土样,去除根系等杂物后,将同一样地的5份土样充分混匀并编号,置于-80 ℃冰箱中保存,用于土壤真菌检测。
1.2.2 土壤肥力检测 使用SJ-4A型pH计(上海闵胜科技有限公司)测定土壤的pH值;采用碳酸氢钠法[19]42-44测定土壤的速效磷含量;采用乙酸铵-火焰光度计法[19]49-50测定土壤的速效钾含量。每个土样各指标均重复测定3次。
1.2.3 土壤真菌检测 使用土壤细菌基因组DNA提取试剂盒(离心柱型)〔(天根生化科技(北京)有限公司〕,按照使用说明书的操作流程分别提取供试8个样地土壤真菌的总DNA;采用真菌ITS1-ITS2区通用引物ITS1F和ITS2〔生工生物工程(上海)股份有限公司〕进行扩增反应,其中,引物ITS1F的序列为5′-CTTGGTCATTTAGAGGAAGTAA-3′,引物ITS2的序列为5′-GCTGCGTTCTTCATCGATGC-3′。扩增体系总体积30 μL,包括2×MasterMix〔宝生物工程(大连)有限公司〕15 μL,10 mmol·L-1引物ITS1F和ITS2各1 μL,模板DNA 10~20 ng,ddH2O补足至30 μL。使用晶格T960 PCR仪(杭州晶格科学仪器有限公司)进行扩增反应,扩增程序为:94 ℃预变性3 min;94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s,共30个循环;72 ℃延伸5 min。扩增产物交由生工生物工程(上海)股份有限公司,采用Illumina MiSeq高通量测序技术进行测序。
1.3 数据处理和统计分析
测序后,对序列进行修剪、去除嵌合体序列及非特异性扩增序列等过滤处理,得到有效序列;以有效序列相似度97%为阈值划分OTUs;使用BLASTx程序将每个OTU包含的有效序列与GenBank数据库(http:∥ncbi.nlm.nih.gov)中的已知序列进行比对,根据相似度97%确定每个OTU代表性序列的真菌属(种)名;根据每个OTU包含的有效序列数量进行相对丰度排名。根据OTUs和每个OTU包含的有效序列数量计算土壤真菌的Chao1指数[20]、Shannon-Wiener指数[21]、Simpson指数[22]和盖度[23]。
采用EXCEL 2007软件对土壤肥力和土壤真菌DNA测序结果进行数据处理,并计算土壤真菌科水平的相对丰度;采用R语言对8个样地土壤真菌科水平的分类结果进行制图;采用SPSS 19.0统计分析软件对土壤肥力进行差异显著性分析(Duncan’s新复极差法),对土壤真菌多样性指数与土壤肥力指标进行Pearson相关性分析,并对土壤真菌科水平相对丰度前20位的OTUs与土壤肥力指标进行Pearson相关性分析。
2 结果和分析
2.1 不同样地青檀根际土壤肥力比较
供试8个样地青檀根际土壤肥力的比较结果见表1。由表1可以看出:8个样地的土壤pH值为pH 6.06~pH 7.61,呈弱酸性至弱碱性,各样地间的土壤pH值差异较大。其中,山东济南灵岩寺(P5)和广西桂林龙岩村(P2)样地的土壤pH值显著(P<0.05)高于其余样地,但2个样地间的土壤pH值差异不显著;河南信阳鸡公山(P4)和辽宁大连蛇岛(P8)样地的土壤pH值显著低于其余样地,但2个样地间的土壤pH值差异不显著。P2样地的土壤速效磷含量最高(3.27 μg·g-1),P8和四川广元鼓城村(P3)的土壤速效磷含量较高,且3个样地的土壤速效磷含量显著高于其余样地,但3个样地间的土壤速效磷含量差异不显著;P5样地的土壤速效磷含量也较高,与其余样地的土壤速效磷含量差异显著;安徽宣城小岭村(P1)和北京滴水岩(P7)样地的土壤速效磷含量较低(分别为0.49和0.69 μg·g-1),显著低于其余样地。P7样地的土壤速效钾含量最高(636.89 μg·g-1),显著高于其余样地;P1样地的土壤速效钾含量最低(150.24 μg·g-1),显著低于其余样地;P2、P5、陕西汉中一里沟村(P6)和P8样地间的土壤速效钾含量差异不显著。

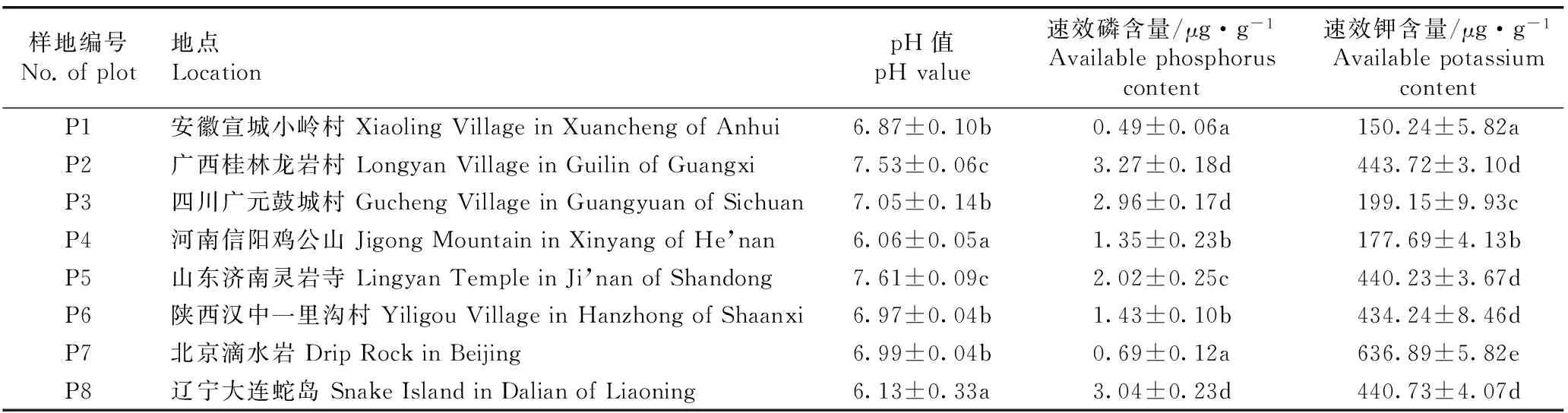
样地编号No.ofplot地点LocationpH值pHvalue速效磷含量/μg·g-1Availablephosphoruscontent速效钾含量/μg·g-1AvailablepotassiumcontentP1安徽宣城小岭村XiaolingVillageinXuanchengofAnhui6.87±0.10b0.49±0.06a150.24±5.82aP2广西桂林龙岩村LongyanVillageinGuilinofGuangxi7.53±0.06c3.27±0.18d443.72±3.10dP3四川广元鼓城村GuchengVillageinGuangyuanofSichuan7.05±0.14b2.96±0.17d199.15±9.93cP4河南信阳鸡公山JigongMountaininXinyangofHe’nan6.06±0.05a1.35±0.23b177.69±4.13bP5山东济南灵岩寺LingyanTempleinJi’nanofShandong7.61±0.09c2.02±0.25c440.23±3.67dP6陕西汉中一里沟村YiligouVillageinHanzhongofShaanxi6.97±0.04b1.43±0.10b434.24±8.46dP7北京滴水岩DripRockinBeijing6.99±0.04b0.69±0.12a636.89±5.82eP8辽宁大连蛇岛SnakeIslandinDalianofLiaoning6.13±0.33a3.04±0.23d440.73±4.07d
1)同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant difference (P<0.05).
2.2 不同样地青檀根际土壤真菌多样性分析
分析结果表明:从青檀根际土壤真菌DNA中共获得有效序列197 112条,以有效序列相似度97%为阈值获得7 143个OTUs,包含代表性序列193 799条,共鉴定出6门32纲106目254科。其中,门水平的代表性序列有149 974条,占总数的77.39%;纲水平的代表性序列有148 660条,占总数的76.71%;目水平的代表性序列有128 467条,占总数的66.29%;科水平的代表性序列有113 888条,占总数的58.77%。在门水平上,子囊菌门(Ascomycota)、接合菌门(Zygomycota)和担子菌门(Basidiomycota)所占比例分别为62.75%、11.88%和6.51%;在目水平上,肉座菌目(Hypocreales)、被孢霉目(Mortierellales)、伞菌目(Agaricales)、粪壳菌目(Sordariales)、曲霉目(Aspergillales)和散囊菌目(Eurotiales)所占比例分别为11.36%、9.04%、6.95%、6.76%、6.08%和5.13%,其余目所占比例均低于5.00%。
供试8个样地青檀根际土壤真菌DNA的测序及多样性分析结果(表2)表明:各样地土壤真菌的有效序列数量和优质序列数量分别为18 824~28 680和18 442~28 298,且其中7个样地土壤真菌的有效序列数量和优质序列数量超过20 000;各样地土壤真菌的OTU数量为1 031~1 772。广西桂林龙岩村(P2)样地土壤真菌的Chao1指数最小(1 041.37),而河南信阳鸡公山(P4)样地土壤真菌的Chao1指数最大(1 793.19);辽宁大连蛇岛(P8)样地土壤真菌的Shannon-Wiener指数最小(5.39),而P4样地土壤真菌的Shannon-Wiener指数最大(6.14);各样地土壤真菌的Simpson指数均较小,为0.007~0.020,其中,山东济南灵岩寺(P5)和北京滴水岩(P7)样地土壤真菌的Simpson指数最小,而P8样地土壤真菌的Simpson指数最大;各样地土壤真菌的盖度均在99.00%左右,其中,6个样地土壤真菌的盖度超过99.00%。
供试8个样地青檀根际土壤真菌科水平的分类结果见图1。由图1可见:在已经鉴定出的真菌〔不包括GenBank数据库中不存在的科(unclassfied)和相对丰度排名前50位之外的科(other)〕中,安徽宣城小岭村(P1)样地土壤真菌有11个优势科(相对丰度大于1%),其中Archaeorhizomycetaceae的相对丰度最高(8.96%);P2样地土壤真菌有8个优势科,其中发菌科(Trichocomaceae)的相对丰度最高(10.37%);四川广元鼓城村(P3)样地土壤真菌有13个优势科,其中被孢霉科(Mortierellaceae)的相对丰度最高(12.63%);P4样地土壤真菌有12个优势科,其中被孢霉科的相对丰度最高(10.93%);P5样地土壤真菌有10个优势科,其中Incertae sedis(GenBank数据库中存在,但未准确分类的科)的相对丰度最高(6.99%);陕西汉中一里沟村(P6)样地土壤真菌有11个优势科,其中被孢霉科的相对丰度最高(7.55%);P7样地土壤真菌有9个优势科,其中Incertae sedis的相对丰度最高(8.95%);P8样地土壤真菌有8个优势科,其中丛赤壳科(Nectriaceae)的相对丰度最高(12.41%)。
表2供试8个样地青檀根际土壤真菌的DNA测序及多样性分析结果
Table2AnalysisresultsofDNAsequencinganddiversityoffungiinrhizospheresoilofPteroceltistatarinowiiMaxim.ineightplotstested
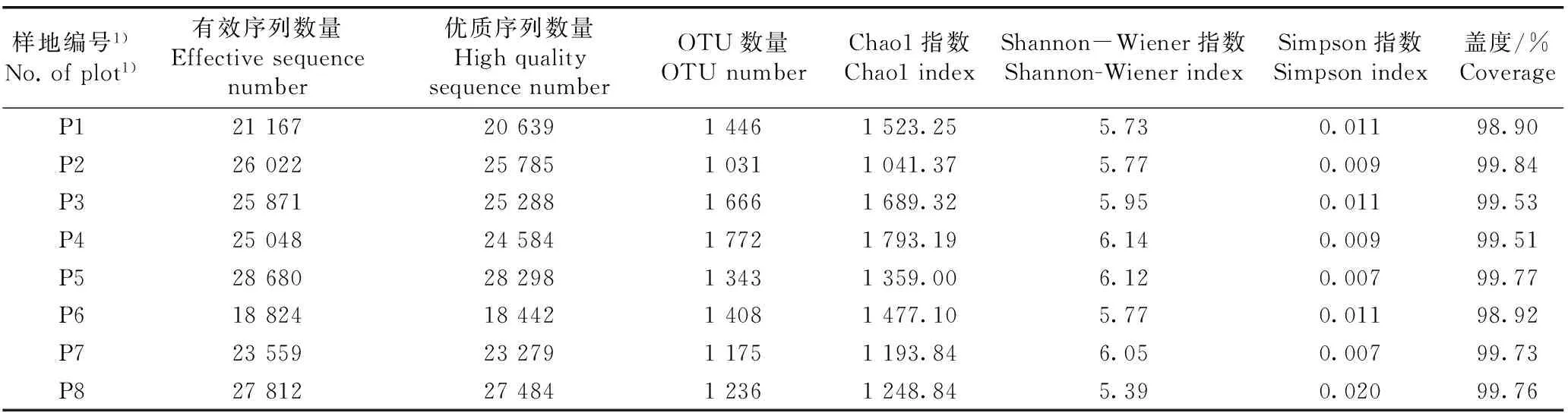
样地编号1)No.ofplot1)有效序列数量Effectivesequencenumber优质序列数量HighqualitysequencenumberOTU数量OTUnumberChao1指数Chao1indexShannon-Wiener指数Shannon-WienerindexSimpson指数Simpsonindex盖度/%CoverageP1211672063914461523.255.730.01198.90P2260222578510311041.375.770.00999.84P3258712528816661689.325.950.01199.53P4250482458417721793.196.140.00999.51P5286802829813431359.006.120.00799.77P6188241844214081477.105.770.01198.92P7235592327911751193.846.050.00799.73P8278122748412361248.845.390.02099.76
1)P1: 安徽宣城小岭村 Xiaoling Village in Xuancheng of Anhui; P2: 广西桂林龙岩村 Longyan Village in Guilin of Guangxi; P3: 四川广元鼓城村 Gucheng Village in Guangyuan of Sichuan; P4: 河南信阳鸡公山 Jigong Mountain in Xinyang of He’nan; P5: 山东济南灵岩寺 Lingyan Temple in Ji’nan of Shandong; P6: 陕西汉中一里沟村 Yiligou Village in Hanzhong of Shaanxi; P7: 北京滴水岩 Drip Rock in Beijing; P8: 辽宁大连蛇岛 Snake Island in Dalian of Liaoning.
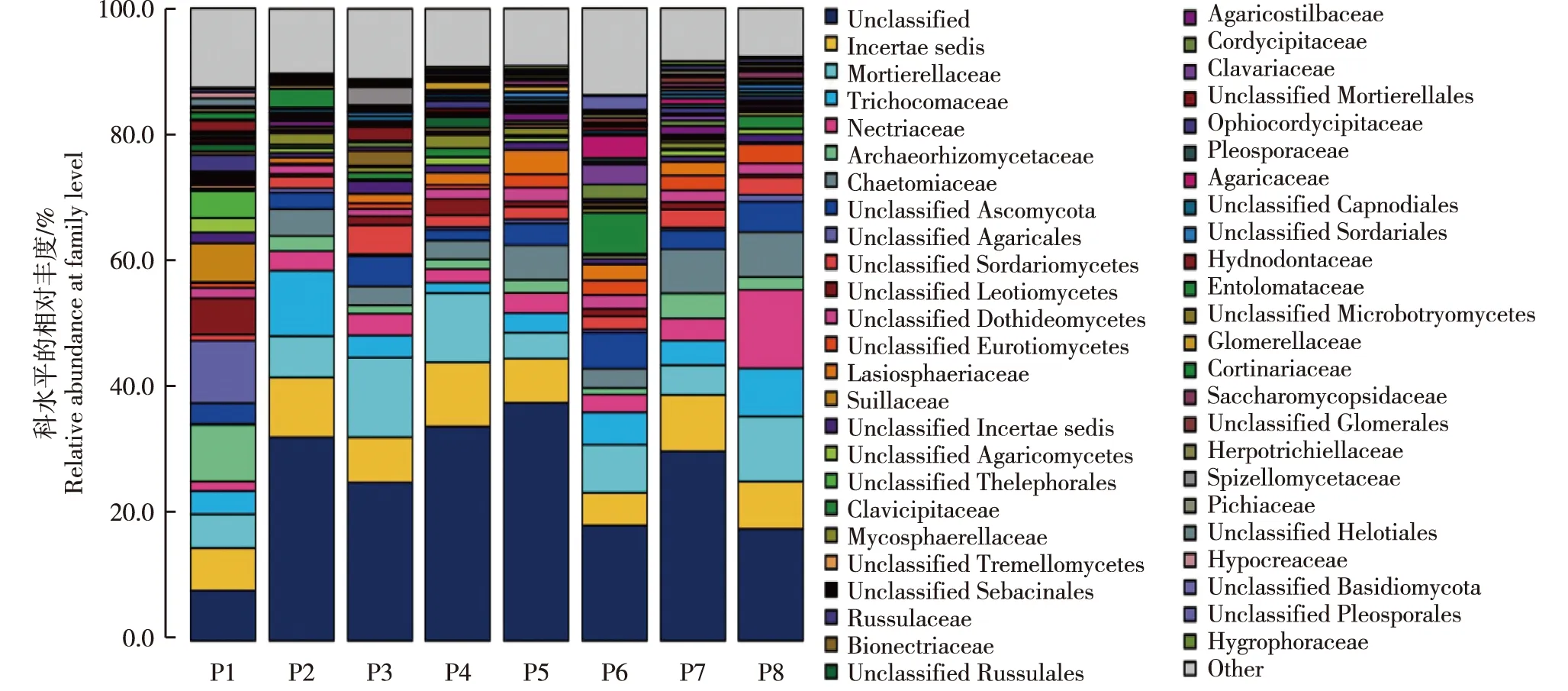
P1: 安徽宣城小岭村 Xiaoling Village in Xuancheng of Anhui; P2: 广西桂林龙岩村 Longyan Village in Guilin of Guangxi; P3: 四川广元鼓城村 Gucheng Village in Guangyuan of Sichuan; P4: 河南信阳鸡公山 Jigong Mountain in Xinyang of He’nan; P5: 山东济南灵岩寺 Lingyan Temple in Ji’nan of Shandong; P6: 陕西汉中一里沟村 Yiligou Village in Hanzhong of Shaanxi; P7: 北京滴水岩 Drip Rock in Beijing; P8: 辽宁大连蛇岛 Snake Island in Dalian of Liaoning.图1 供试8个样地青檀根际土壤真菌科水平的分类结果Fig. 1 Classification result of fungi at family level in rhizosphere soil of Pteroceltis tatarinowii Maxim. in eight plots tested
由图1还可见:供试8个样地土壤真菌有5个共有优势科,即Incertae sedis、被孢霉科、发菌科、丛赤壳科和Archaeorhizomycetaceae,其中,Incertae sedis为最优势科,在P1、P2、P3、P4、P5、P6、P7和P8样地土壤中的相对丰度分别为6.76%、9.48%、7.17%、10.20%、6.99%、5.20%、8.95%和7.52%。
2.3青檀根际土壤真菌多样性与土壤肥力的相关性分析
采用SPSS 19.0统计分析软件对青檀根际土壤的pH值、速效磷含量和速效钾含量以及根际土壤真菌的Chao1指数、Shannon-Wiener指数和Simpson指数6个指标间的相关性进行分析。结果表明:Chao1指数与土壤的pH值、速效磷含量和速效钾含量均呈负相关,相关系数分别为-0.440、-0.278和-0.793,其中,Chao1指数与土壤速效钾含量的相关性达到显著水平(P<0.05);Shannon-Wiener指数与土壤pH值呈正相关(相关系数为0.284),与土壤的速效磷含量和速效钾含量均呈负相关(相关系数分别为-0.360和-0.057);Simpson指数与土壤的pH值和速效钾含量均呈负相关(相关系数分别为-0.593和-0.099),与土壤的速效磷含量呈正相关(相关系数为0.412)。
为了明确青檀根际土壤真菌与土壤肥力的关系,对根际土壤真菌科水平相对丰度前20位的OTUs与土壤的pH值、速效磷含量和速效钾含量的相关性进行分析,结果见表3。由表3可见:11个OTUs与土壤pH值呈负相关,9个OTUs与土壤pH值呈正相关。其中,OTU4、OTU10、OTU25和OTU73与土壤pH值的相关系数较大且为正值;OTU0、OTU2、OTU22和OTU72与土壤pH值的相关系数也较大,但均为负值,且OTU0与土壤pH值的相关性达到显著水平。多数OTUs与土壤的速效磷含量和速效钾含量呈正相关。其中,OTU3、OTU5和OTU38与土壤速效磷含量的相关系数较大且为正值,OTU7和OTU24与土壤速效磷含量的相关系数也较大且为负值,并且,各OTUs与土壤速效磷含量的相关性均不显著;OTU1、OTU3、OTU4、OTU25、OTU73和OTU75与土壤速效钾含量的相关系数较大且为正值,OTU7和OTU24与土壤速效钾含量的相关系数也较大且为负值,并且,OTU1和OTU4与土壤速效钾含量的相关性达到显著水平。
根据土壤真菌DNA的测序结果,相对丰度前20位的OTUs中,OTU1、OTU2、OTU3、OTU5、OTU10、OTU12、OTU22、OTU23、OTU25、OTU38、OTU73、OTU74和OTU75属于子囊菌门,OTU4、OTU7、OTU24和OTU72属于担子菌门,OTU0、OTU8和OTU90属于接合菌门。结合表3结果,在与土壤pH值相关性较大的OTUs中,1个OTU属于接合菌门,2个OTUs属于担子菌门,5个OTUs属于子囊菌门;在与土壤速效磷含量相关性较大的OTUs中,2个OTUs属于担子菌门,3个OTUs属于子囊菌门;在与土壤速效钾含量相关性较大的OTUs中,5个OTUs属于子囊菌门,3个OTUs属于担子菌门。在与土壤肥力显著相关的OTUs中,OTU0属于被孢霉科,OTU1属于丛赤壳科,OTU4属于伞型束梗孔菌科(Agaricostilbaceae)。
表3青檀根际土壤真菌科水平相对丰度前20位的OTUs与土壤肥力的相关性分析1)
Table3Correlationanalysisbetweenthetop20OTUswithrelativeabundanceatfamilyleveloffungiinrhizospheresoilofPteroceltistatarinowiiMaxim.andsoilfertility1)

OTU相关系数 CorrelationcoefficientpH值pHvalue速效磷含量Availablephosphoruscontent速效钾含量AvailablepotassiumcontentOTU0-0.749*0.460-0.169OTU1-0.0360.1810.798*OTU2-0.5590.4180.175OTU30.0570.5000.667OTU40.5920.1740.741*OTU50.4530.5030.190OTU7-0.025-0.529-0.516OTU80.2150.468-0.245OTU100.561-0.1260.413OTU12-0.2270.0460.246OTU22-0.5430.4460.155OTU23-0.3130.4960.206OTU24-0.013-0.528-0.507OTU250.6870.0660.644OTU380.1650.6040.317OTU72-0.601-0.207-0.443OTU730.5900.2080.643OTU74-0.3830.2570.381OTU75-0.1940.3570.510OTU900.1440.4030.014
1)*:P<0.05.
3 讨论和结论
青檀喜生于石灰岩山地,喜钙,多生于山麓、林缘、沟谷、河滩、溪旁及峭壁石隙等处,成小片纯林或与其他树种混生[1]。本研究中,供试8个样地多位于山脚或半山腰,青檀的根际土壤呈弱酸性至弱碱性(pH 6.06~pH 7.61),土壤的速效磷含量均较低(0.49~3.27 μg·g-1),速效钾含量(150.24~636.89 μg·g-1)却较高,与青檀的生长习性及李光友等[6]的研究结果相吻合。刘慧君等[4]的研究结果表明:土壤速效钾含量与青檀的纤维长度呈正相关,并且钾元素能够促进青檀韧皮部的生长发育,据此认为,供试8个样地土壤的速效钾含量偏高利于青檀的生长发育。依据“全国第二次土壤普查养分分级标准”,供试8个样地青檀根际土壤的速效磷含量均处于5级(3~5 μg·g-1)和6级(低于3 μg·g-1)水平,速效钾含量均处于1级(高于200 μg·g-1)和2级(150~200 μg·g-1)水平,表明青檀根际土壤呈富钾少磷的状态。
土壤真菌种类繁多、功能多样,对植物生长影响较大,主要包括以下3个方面:1)通过分解作用调节土壤肥力,间接影响植物生长;2)通过与植物共生或寄生直接影响植物生长;3)以病害方式直接影响植物生长。不同植物种类根际土壤的真菌组成有一定差异。红松(PinuskoraiensisSieb. et Zucc.)的根际土壤真菌以半知菌门(Deuteromycota)、接合菌门和子囊菌门为主[24],而青檀的根际土壤真菌则以子囊菌门、担子菌门和接合菌门为主,这可能是不同植物与根际土壤真菌通过互生和化感作用等方式相互选择的结果[25-26],也可能与植物生长地土壤肥力状况差异较大有关。
在生态学研究中,Chao1指数常用来估计物种总数;Shannon-Wiener指数可用来估算微生物多样性,其数值越大,说明微生物的多样性越高;Simpson指数用于分析微生物群落的优势度,其数值越大,说明微生物的优势越明显;盖度反映了研究结果能否代表样本的真实情况,其数值越高越能全面反映样本的真实情况。本研究中,供试8个样地青檀根际土壤真菌的盖度均在99.00%左右,其中6个样地土壤真菌的盖度超过99.00%,说明本研究结果可以代表8个样地青檀根际土壤真菌的真实情况。北京滴水岩样地青檀根际土壤真菌的Chao1指数和Simpson指数较小(分别为1 193.84和0.007),但Shannon-Wiener指数较大(6.05),说明该样地青檀根际土壤真菌多样性较高,但种类不丰富,优势度不明显,分布较均匀。河南信阳鸡公山样地青檀根际土壤的Chao1指数和Shannon-Wiener指数最大(分别为1 793.19和6.14),但Simpson指数较低(0.009),说明该样地青檀根际土壤真菌种类丰富,多样性较高,但优势度不明显,分布较均匀。辽宁大连蛇岛样地青檀根际土壤真菌的Chao1指数较小(1 248.84),Shannon-Wiener指数最小(5.39),但Simpson指数最大(0.020),说明该样地青檀根际土壤真菌种类不丰富,多样性最低,但优势度明显,可见,该样地土壤真菌群落分布单一,优势种群较为突出。
Zak等[27]的研究结果表明:土壤微生物是生态系统的重要组成部分,其对土壤有机物的降解、土壤肥力的形成均有极其重要的作用;并且,土壤的理化性质也能够影响土壤真菌的种类、分布和数量[28]。本研究中,青檀根际土壤真菌的Chao1指数与土壤速效钾含量呈显著负相关,说明土壤真菌种类数量与土壤速效钾含量关系密切。在相对丰度前20位的OTUs中,55%OTUs与青檀根际土壤的pH值呈负相关,并且,多数OTUs与土壤的速效磷含量和速效钾含量呈正相关,结合OTUs的分类鉴定结果,子囊菌门与青檀根际土壤肥力的相关性最高,且与土壤肥力显著相关的真菌科有被孢霉科、丛赤壳科、伞型束梗孔菌科;担子菌门与青檀根际土壤肥的相关性居中;接合菌门与青檀根际土壤肥力的相关性最低。
柴新义等[13]的研究结果表明:青檀内生真菌与附生真菌间存在密切的演化关系,并且,青檀与其内生真菌关系紧密。本研究中,供试8个样地青檀根际土壤真菌有5个共有优势科,然而,这些科与青檀内生真菌有较大差异,推测这可能是因为多数内生真菌与青檀存在寄生或共生关系,而根际土壤真菌的主要生境是土壤,并不完全依赖青檀植株。
总体看来,青檀根际土壤呈弱酸性至弱碱性,并具有富钾少磷的特点。青檀根际土壤真菌的优势门包括子囊菌门、担子菌门和接合菌门;各样地根际土壤真菌的多样性差异明显,但存在5个共有优势科,分别为Incertae sedis、被孢霉科、发菌科、丛赤壳科和Archaeorhizomycetaceae。青檀根际土壤真菌多样性与土壤肥力有一定相关性,但仅土壤真菌的Chao1指数与土壤速效钾含量呈显著负相关。被孢霉科真菌与青檀根际土壤的pH值呈显著负相关;丛赤壳科和伞型束梗孔菌科真菌与青檀根际土壤的速效钾含量呈显著正相关。
[1] 中国科学院中国植物志编辑委员会. 中国植物志: 第二十二卷[M]. 北京: 科学出版社, 1998: 334-413.
[2] 高 慧, 徐 斌, 邵卓平. 青檀树皮的化学组成与细胞壁结构[J]. 经济林研究, 2007, 25(4): 28-33.
[3] 包善寿. 泾县青檀特色产业发展的思路与对策[J]. 现代农业科技, 2015(18): 328, 332.
[4] 刘慧君, 张 莉, 王 芳, 等. 11个种群青檀檀皮差异及其与环境因子的关系[J]. 南京林业大学学报(自然科学版), 2015, 39(3): 78-84.
[5] 方升佐, 朱 梅, 唐罗忠, 等. 不同种源青檀种子的营养成分及种子活力的差异[J]. 植物资源与环境, 1998, 7(2): 16-21.
[6] 李光友, 方升佐, 吕家驹, 等. 立地条件对青檀人工林生物生产力及檀皮产量的影响[J]. 南京林业大学学报(自然科学版), 2001, 25(4): 49-53.
[7] 洑香香, 方升佐, 杜 艳. 青檀种子休眠机理及发芽条件的探讨[J]. 植物资源与环境学报, 2002, 11(1): 9-13.
[8] 张 莉, 张小平, 陆 畅, 等. 安徽琅琊山青檀种群空间格局[J]. 林业科学, 2012, 48(2): 9-15.
[9] 张丽娜, 王桔红, 陈 文, 等. 红毛草不同程度入侵区土壤微生物群落结构和部分理化指标的比较及其相关性分析[J]. 植物资源与环境学报, 2016, 25(2): 33-40.
[10] 朱翠翠, 张 林, 孙忠奎, 等. 中国中北部青檀的AFLP分析[J]. 农学学报, 2016, 6(5): 60-64.
[11] 张 林, 朱翠翠, 王 峰, 等. 青檀诱变育种与种质创新[J]. 天津农业科学, 2016, 22(8): 134-137.
[12] 柴新义, 柴钢青, 向玉勇, 等. 青檀叶片内生和附生真菌组成及生态分布[J]. 生态学报, 2016, 36(16): 5163-5172.
[13] 柴新义, 钟媛媛. 青檀果内生真菌菌群的组成及多样性[J]. 应用生态学报, 2017, 28(2): 636-642.
[14] 郭顺星, 徐锦堂. 真菌在兰科植物种子萌发生长中的作用及相互关系[J]. 植物学通报, 1990, 7(1): 13-17.
[15] 欧 静, 何跃军, 刘仁阳, 等. 杜鹃花类菌根真菌对桃叶杜鹃幼苗光合性能及叶绿素荧光参数的影响[J]. 微生物学通报, 2013, 40(8): 1423-1436.
[16] 周 浓, 戚文华, 肖国生, 等. 滇重楼根际微生物分布与甾体皂苷含量的相关性[J]. 中国中药杂志, 2015, 40(6): 1055-1060.
[17] 孙金华, 毕银丽, 裘 浪, 等. 土壤中丛枝菌根真菌对宿主植物磷吸收作用机制综述[J]. 土壤通报, 2016, 47(2): 499-504.
[18] 曹岩坡, 代 鹏, 戴素英, 等. 丛枝菌根真菌(AMF)对盐胁迫下芦笋幼苗生长及体内Na+、K+、Ca2+、Mg2+含量和分布的影响[J]. 生态学杂志, 2015, 34(6): 1699-1704.
[19] 王友保. 土壤污染与生态修复实验指导[M]. 芜湖: 安徽师范大学出版社, 2015.
[20] CHAO A. Nonparametricestimation of the number of classes in a population[J]. Scandinavian Journal of Statistics, 1984, 11: 265-270.
[21] LI X G, DING C F, ZHANG T L, et al. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing[J]. Soil Biology and Biochemistry, 2014, 72: 11-18.
[22] MAGURRAN A E. Ecological Diversity and Its Measurement[M]. Princeton: Princeton University Press, 1988.
[23] GOOD I J. The population frequencies of species and the estimation of population parameters[J]. Biometrika, 1953, 40: 237-264.
[24] 晁开瑞, 任洪婷, 朱丹璐, 等. 西伯利亚红松林下凋落物及土壤真菌组成研究[J]. 西部林业科学, 2016, 45(3): 69-74.
[25] WANG K, HERRERAESTRELLA A, MONTAGU M V, et al. Transformation of Plants and Soil Microorganisms[M]. Cambridge: Cambridge University Press, 1995: 32-41.
[26] ROVIRA A D. Interactions between plant roots and soil microorganisms[J]. Annual Review of Microbiology, 1965, 19: 241-266.
[27] ZAK D R, HOLMES W E, WHITE D C, et al. Plant diversity, soil microbial communities, and ecosystem function: are there any links?[J]. Ecology, 2003, 84: 2042-2050.
[28] 尚 蓓. 松山林区木腐菌与两类主要林型土壤真菌的研究[D]. 北京: 北京林业大学林学院, 2008.
(责任编辑: 佟金凤)
FertilityandfungaldiversityofrhizospheresoilofPteroceltistatarinowiiindifferentregionsandtheircorrelationanalysis
CHANG Qiangqiang, FAN Jiajia, LIU Huijun, LI Xiaohong, ZHANG Xiaoping①
(College of Life Sciences, Anhui Normal University, Wuhu 241000, China),J.PlantResour. &Environ., 2017,26(3): 27-34
Q949.32; S154.3; S158.2
A
1674-7895(2017)03-0027-08
10.3969/j.issn.1674-7895.2017.03.04
2017-04-14
国家自然科学基金资助项目(41401062); 中国科学院南京地质古生物研究所国家重点开放实验室开放基金项目(143115)
常强强(1990—),男,安徽阜阳人,硕士研究生,主要从事植物资源保护与利用方面的研究。
①通信作者E-mail: pinghengxu@sina.com
