响应面优化微波固相合成花生肽亚铁金属配位螯合工艺
2017-10-11李玉珍肖怀秋姜明姣谢佳琦赵谋明
李玉珍,肖怀秋,,姜明姣,谢佳琦,周 全,赵谋明
(1.湖南化工职业技术学院 制药与生物工程学院,湖南 株洲 412000;2.华南理工大学 轻工与食品学院,广州 510640;3.湖南中威制药有限公司,湖南 株洲 412000)
油料蛋白
响应面优化微波固相合成花生肽亚铁金属配位螯合工艺
李玉珍1,肖怀秋1,2,姜明姣3,谢佳琦1,周 全1,赵谋明2
(1.湖南化工职业技术学院 制药与生物工程学院,湖南 株洲 412000;2.华南理工大学 轻工与食品学院,广州 510640;3.湖南中威制药有限公司,湖南 株洲 412000)
以花生肽(相对分子质量<3.0 kD)为原料,以硫酸亚铁(FeSO4·7H2O)为金属螯合剂,利用微波固相合成技术在单因素试验基础上,采取中心复合响应面法对花生肽亚铁配位螯合工艺进行了优化,建立了花生肽亚铁配位螯合工艺的二阶多项式非线性回归方程和数值模型,分析了微波辐射时间、花生肽亚铁配体比和引发剂用量对花生肽亚铁配位螯合的影响。结果表明,最佳花生肽亚铁配位螯合工艺为:微波辐射时间153 s,花生肽亚铁配体比5∶1,引发剂(H2O)用量3%,微波辐射功率608 W,反应物粒径120目,2.5%白炭黑(占花生肽质量)为脱酸剂,0.3%异抗坏血酸钠(占硫酸亚铁质量)为亚铁保护剂。在最佳条件下螯合率为(90.68±1.31)%,与模型预测值92.71%基本吻合。研究表明,以微波固相合成技术进行花生肽亚铁固相催化制备肽金属配位螯合营养强化剂可行。
花生肽亚铁配位螯合;微波固相催化;响应面优化
Abstract:To promote the coordination chelation of peanut peptide and ferrous,peanut peptide (relative molecular weight less than 3.0 kD) and ferrous sulfate (FeSO4·7H2O) were used as reactant and mental chelator,respectively.A central composite design response surface methodology (CCD-RSM) was utilized to optimize peanut peptide-ferrous coordination chelation process using microwave solid-phase synthesis technology based on single factor experiment.The influences of microwave radiation time,peanut peptide-ferrous ratio and initiator dosage on peanut peptide-ferrous coordination chelation were investigated,and a second-order polynomial nonlinear regression equation and mathematical model were established.The results showed that the optimal peanut peptide-ferrous coordination chelation process conditions were obtained as follows: microwave radiation time 153 s,peanut peptide-ferrous ratio 5∶1,initiator dosage 3%,microwave radiation power 608 W,reactant particle size 120 meshes,using 2.5% of carbon-white as deacidification agent (based on the mass of peanut peptide) and 0.3% of sodium isoascorbate as ferrous protective agent (based on the mass of ferrous sulfate).Under these conditions,the chelating rate was (90.68±1.31)%,and was consistent with the predictive value (92.71%).The research indicated that microwave solid-phase synthesis technology was an efficient and promising means for the solid-phase catalytic preparation of metal nutrition supplement from peanut peptide and ferrous.
Keywords:peanut peptide-ferrous coordination chelation; microwave solid-phase catalysis; response surface methodology optimization
铁元素是机体蛋白质和酶生物合成、生物氧化及能量代谢和生理免疫等重要的微量元素,严重缺铁会导致缺铁性贫血(IDA)、细胞色素和含铁酶活性降低、供氧不足、电子传递和能量代谢过程紊乱、机体免疫功能下降和生长发育迟缓等生理疾病[1-3]。目前,临床上常以无机铁盐(如硫酸亚铁)作为缺铁性贫血的药物,但存在稳定性差、胃肠刺激大、易受到肠内容物干扰、生物利用率低和存在一定毒副作用等不足[3]。在多肽一级结构中存在多个易与金属配位螯合的位点,如羧基氧原子、咪唑基氮原子以及巯基硫原子等,多肽结构中的N-端氨基、C-端羧基,分子结构中的羰基和亚氨基、以及氨基酸侧链的某些基团均可提供金属配位点,配位螯合后能有效影响多肽二级结构并调控其生物学活性[4]。金属螯合肽可利用小肽配位体转运系统进行转运,具有转运耗能低、转运速度快和不易被饱和等优点,有利于促进金属元素吸收利用,金属螯合肽能抑制小肠刷状缘细胞中肽酶活性,有助于完整多肽作为金属元素配体通过小肽转运系统进入肠黏膜细胞,提高金属螯合肽的稳定性,并能减少金属元素间的拮抗作用[4]。当前,亚铁蛋白多肽载体研究主要集中在猪血多肽、乌鸡肽、酪蛋白磷酸肽、米蛋白肽、鱼类蛋白肽等方面,以冷榨花生饼蛋白肽与亚铁螯合鲜有报道。
本试验以酶解冷榨花生饼蛋白制备得到的花生肽(相对分子质量<3.0 kD)为原料,以硫酸亚铁(FeSO4·7H2O)为金属螯合剂,利用微波固相合成技术,在单因素试验基础上,采取中心复合响应面优化技术对花生肽亚铁配位螯合工艺进行优化分析,以期为花生肽亚铁金属营养强化剂的制备提供理论和技术支持。
1 材料与方法
1.1 试验材料
花生肽(相对分子质量<3.0 kD,自制[5]),其他试剂均为分析纯。
LABCONCO冷冻干燥仪(美国Labconco公司),HERMLE Z323K冷冻离心机(德国Hermle公司),海尔MZC-2070M1家用机械式微波炉,DK-98-11A型电热恒温水浴箱,可见分光光度计。
1.2 试验方法
1.2.1 花生肽亚铁配位螯合工艺
准确称取适当粒径的花生肽粉末,依据花生肽亚铁配体比加入硫酸亚铁,加入0.3%亚铁保护剂(占硫酸亚铁质量,下同)、一定量的白炭黑(占花生肽质量,下同)及适量引发剂(H2O),在一定微波功率下辐射一定时间,反应完成后进行粉碎,用去离子水溶解并过滤,取上清液,无水乙醇醇沉并离心收集滤渣,干燥备用。
1.2.2 微波辐射功率的确定
将1 000 mL初温为20.℃的蒸馏水装入烧杯中,微波辐射120 s,并记录水温温差(ΔT)。微波辐射功率P=1 000 g×4.2 J/(g·.℃)×ΔT/120 s。
1.2.3 水解度的测定
采取pH-stat法[6]测定水解度。
1.2.4 花生肽亚铁配位螯合率计算
铁含量采取邻菲罗琳510 nm比色法[7-8]测定。亚铁螯合率=M1/M0×100%,式中:M1为螯合物中铁质量,mg;M0为加入反应体系的铁质量,mg。
2 结果与分析
2.1 亚铁源与亚铁保护剂的选择
微波固相反应体系中,不同酸根亚铁盐氧化速度不同,醋酸亚铁几秒钟内就完全被氧化成醋酸铁,氧化速度最快,氯化亚铁氧化速度次之,硫酸亚铁相对稳定。虽然醋酸亚铁微波固相催化副产物为挥发性弱酸,对微波固相催化有利,但价格相对昂贵;氯化亚铁作为金属配位铁源时,反应副产物是挥发性强酸,微波辐射条件下易引起物料焦黏。本研究选取硫酸亚铁作为花生肽亚铁配位螯合剂。考虑到微波固相配位螯合过程中Fe2+易氧化成Fe3+,在微波辐射功率608 W、反应物粒径80目、微波辐射时间120 s、花生肽亚铁配体比2∶1和4%引发剂的条件下,于反应体系中添加0.3%异抗坏血酸钠(SIA)、烟酰胺(NA)、茶多酚(TPP)、L-抗坏血酸棕榈酸酯(LAP)等单一或复配亚铁保护剂,研究其对亚铁氧化保护的影响,结果见图1。
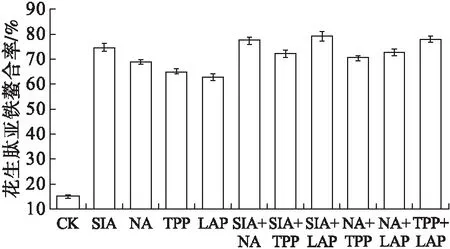
图1 亚铁保护剂对螯合率的影响
由图1可以看出,微波固相配位螯合过程中,添加的单一亚铁保护剂,以异抗坏血酸钠(SIA)效果最好;在亚铁保护复配方剂中,以SIA+NA、SIA+LAP和TPP+LAP对亚铁氧化保护较好,特别是SIA+LAP保护效果最好,但相比单一保护剂SIA来说,差异不显著。在后续试验中选择异抗坏血酸钠作为亚铁保护剂。
2.2 脱酸剂对配位螯合的影响
以盐酸盐或硫酸盐作为金属配位供体,在微波辐射过程中产生的酸根离子电荷、电子云密度及空间位阻效应会影响多肽金属配位螯合[9],常以碱中和去除,但由于化学脱酸剂均呈碱性,易加速Fe2+氧化。本试验选用白炭黑作为脱酸剂进行物理脱酸。白炭黑吸附能力强,不溶于水,不影响产物分离精制,不与花生肽和亚铁发生反应,对金属配位螯合物稳定性没有影响,且为低微波损耗物质,不易形成微波“过热点”[10]。在微波辐射功率608 W、反应物粒径80目、微波辐射时间120 s、花生肽亚铁配体比2∶1、4%引发剂和0.3%异抗坏血酸钠的条件下,研究白炭黑用量对花生肽亚铁配位螯合的影响,结果如图2所示。

图2 白炭黑用量对螯合率的影响
由图2可以看出,在微波固相催化体系中加入0.5%~2.5%白炭黑作为脱酸剂能提高花生肽亚铁配位螯合率,主要由于白炭黑能很好地分散硫酸并起到“吸附、扩散、稀释”硫酸作用,避免“焦化”现象产生。因此,添加2.5%白炭黑脱酸效果最好。
2.3 微波辐射功率的测定
理论上,通过测定波导电压、谐振腔电压及电流值,能相对准确反映出微波辐射功率[11]。但由于家用微波炉为多模微波腔体,微波场分布有较大不确定性,辐射功率无法准确测定。试验通过对已知质量的冷水进行微波辐射,测量水温变化间接计算微波辐射功率,结果得到微波炉加热档次由低至高的辐射功率为86 W(低火)、248 W(中低火)、426 W(中火)、527 W(中高火)、608 W(高火),其中高火档功率损失相对较少,微波场平均密度也最大[12]。
2.4 花生肽亚铁微波固相催化配位螯合工艺单因素试验
2.4.1 微波辐射功率对配位螯合的影响
在花生肽亚铁配体比2∶1、反应物粒径80目、4%引发剂、0.3%异抗坏血酸钠、2.5%白炭黑条件下,分别用86、248、426、527、608 W微波辐射120 s,考察微波辐射功率对花生肽亚铁配位螯合的影响,结果如图3所示。
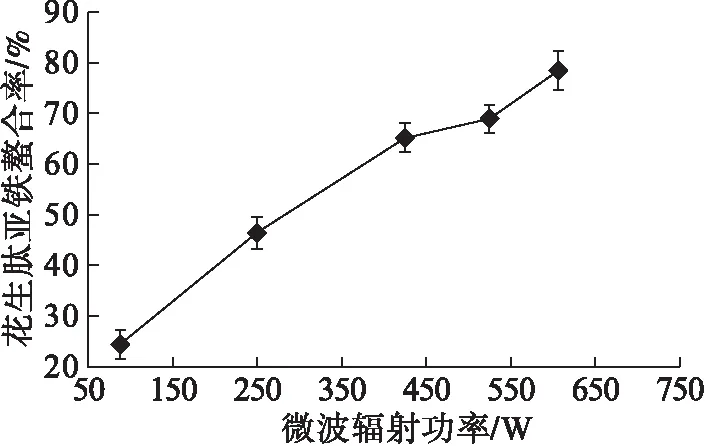
图3 微波辐射功率对螯合率的影响
由图3可以看出,随着微波辐射功率的增加,花生肽亚铁螯合率呈递增趋势,在微波辐射功率为608 W(高火档)时配位螯合效果最好。因此,微波辐射功率选择高火档(608 W)进行微波固相催化。
2.4.2 微波辐射时间对配位螯合的影响
在花生肽亚铁配体比2∶1、反应物粒径80目、4%引发剂、0.3%异抗坏血酸钠和2.5%白炭黑条件下,608 W微波辐射30~270 s,考察微波辐射时间对花生肽亚铁配位螯合的影响,结果如图4所示。

图4 微波辐射时间对螯合率的影响
由图4可以看出,在一定范围内,随着微波辐射时间的延长,花生肽亚铁配位螯合率呈递增态势,微波辐射时间为150 s时螯合率达到最大。继续延长微波辐射时间,螯合率反而下降。这是由于微波辐射时间过长,样品中积聚的能量无法及时释放,造成反应物内部温度过高,形成微波“过热点”,导致已配位螯合的花生肽亚铁螯合物发生解离[10]。因此,选择微波辐射时间为150 s。
2.4.3 花生肽亚铁配体比对配位螯合的影响
配体比过小,不能形成稳定的环状螯合物结构,且结构不稳定,而配体比过大,则易造成浪费。精确控制配体比可很好实现多肽金属配位螯合。在反应物粒径80目、4%引发剂、0.3%异抗坏血酸钠、2.5%白炭黑、608 W微波辐射150 s条件下,考察配体比对花生肽亚铁配位螯合的影响,结果如图5所示。
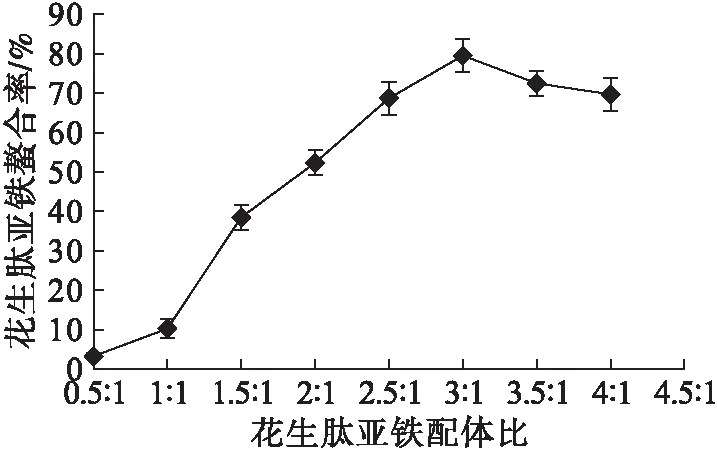
图5 花生肽亚铁配体比对螯合率的影响
由图5可以看出,花生肽亚铁配体比为3∶1时,花生肽亚铁配位螯合率最高,继续增加配体比,螯合率不再增加。可能是由于随着配体比的增加,花生肽中金属螯合位点逐步趋于饱和,螯合率不再继续增加。因此,选择花生肽亚铁配体比为3∶1。
2.4.4 反应物粒径对配位螯合的影响
微波固相反应中,固相反应物的接触程度、反应物表面晶核形成速度和反应产物表面晶核更新速度是决定反应的3个主要因素[9]。在花生肽亚铁配体比3∶1、4%引发剂、0.3%异抗坏血酸钠、2.5%白炭黑、608 W微波辐射150 s条件下,考察反应物粒径对花生肽亚铁配位螯合的影响,结果如图6所示。

图6 反应物粒径对螯合率的影响
由图6可以看出,反应物粒径减少有利于微波固相合成,当反应物粒径为120目时,花生肽亚铁配位螯合率达到较高,粒径继续减少至140目时,螯合率增幅不明显。因此,反应物粒径选择120目。
2.4.5 引发剂用量对配位螯合的影响
一般物质对微波吸收的能力主要取决于介电常数(ε)和介质损耗角正切(tanδ)两个重要参数。引发剂用量只影响反应初速度,不影响反应平衡点。水、乙醇、乙酸、甲醇等极性溶剂均可作为引发剂,最常用引发剂是水[13]。微波固相合成反应中加入微量引发剂不仅能加快反应速度,还能减轻产物焦糊和分解等现象,并提高螯合率[13-14]。在花生肽亚铁配体比3∶1、反应物粒径120目、0.3%异抗坏血酸钠和2.5%白炭黑、608 W微波辐射150 s条件下,以水作为引发剂,考察引发剂用量对花生肽亚铁配位螯合的影响,结果如图7所示。

图7 引发剂用量对螯合率的影响
由图7可以看出,随着引发剂用量增加,花生肽亚铁螯合率呈先增加后降低趋势,当引发剂用量为5%时,花生肽亚铁配位螯合率达到最大。因此,选择引发剂用量为5%。
2.5 花生肽亚铁微波固相催化配位螯合工艺响应面优化试验
2.5.1 响应面试验设计及结果
固定异抗坏血酸钠用量0.3%、白炭黑用量 2.5%、微波辐射功率608 W、反应物粒径120目,采用中心复合响应面优化设计分析微波辐射时间(X1)、花生肽亚铁配体比(X2)和引发剂用量(X3)对花生肽亚铁配位螯合率(Y)的影响。因素水平见表1,响应面试验设计及结果见表2。
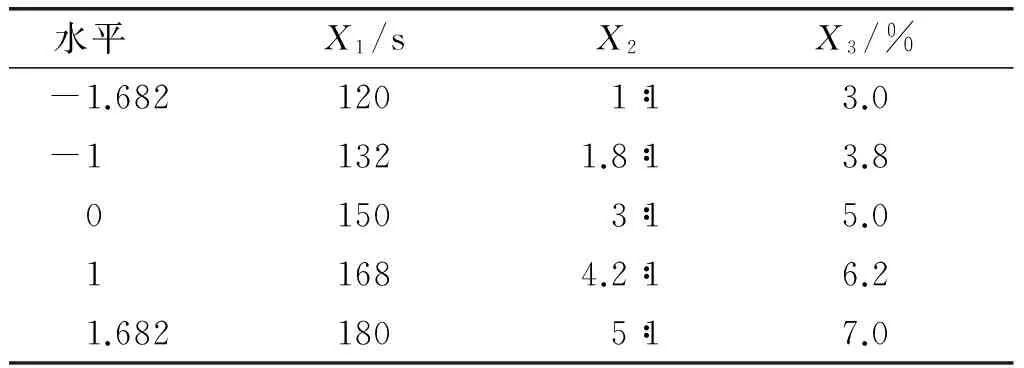
表1 因素水平

表2 响应面试验设计及结果
2.5.2 模型序贯分析与数值模型构建
对响应面模型进行序贯分析(SA),结果如表3所示。

表3 中心复合响应面模型构建序贯分析
由表3可以看出,一阶线性模型不显著(P=0.659 9>0.05),失拟项极显著(P=0.002 5<0.01)。失拟项显著表示应用该模型进行数值预测出现误差的可能性较高,需要更高阶模型进行数值的模拟;二因素交互关系模型不显著,失拟项极显著(P=0.002 2<0.01),也不适宜用于数值预测;二阶模型极显著(P<0.01),失拟项不显著(P=0.140 9>0.05),表明该二阶模型可很好地进行数值预测;三阶模型不显著(P=0.789 5>0.05),失拟项显著(P=0.047 1<0.05),不宜用于数值分析。因此,选择二阶模型进行数值拟合分析是最合适的。

2.5.3 方差分析
对所构建的二阶模型进行方差分析,结果如表4所示。
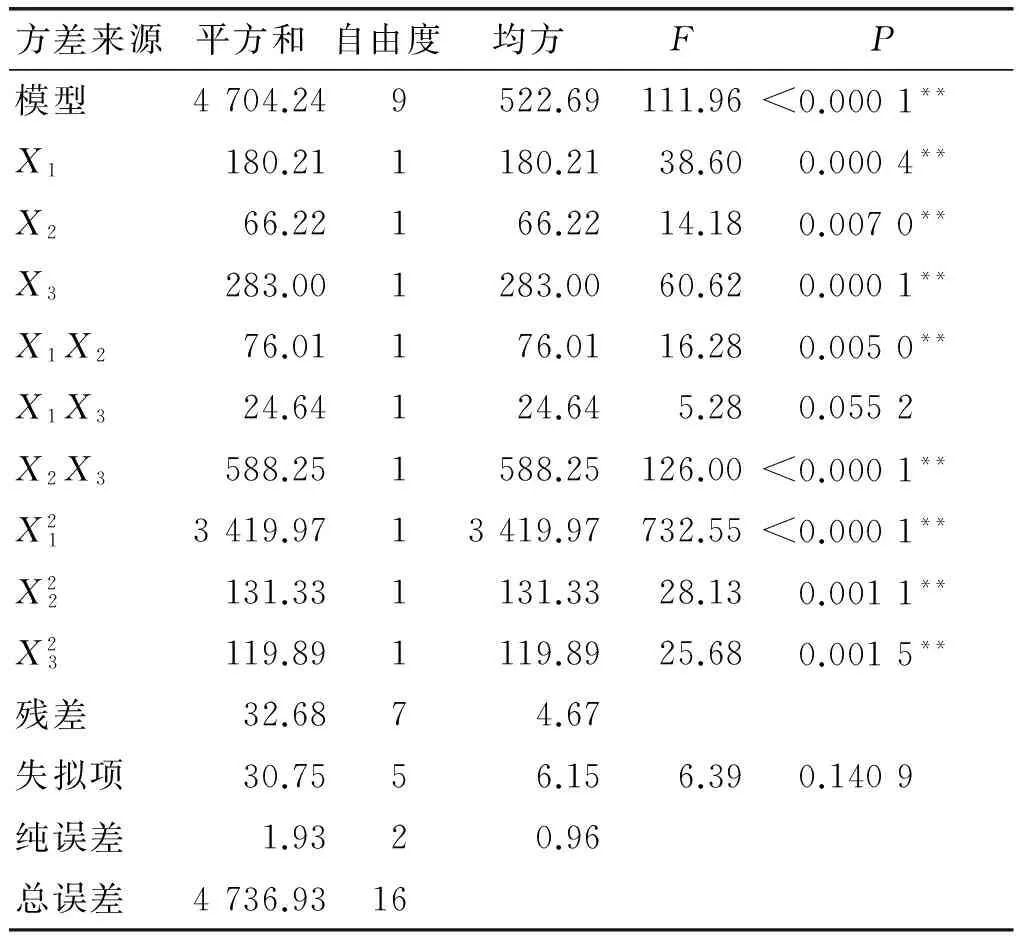
表4 二阶回归模型方差分析
从表4可以看出,模型影响极显著(P<0.01),模型确定系数为0.984 2,说明能解释总变异的98.42%,仅有1.58%变异无法用该模型进行解释。变异系数(CV)是衡量模型精密度和稳健性的重要评价指标,越小越好。模型CV为3.14%,说明模型出现变异的可能性较少;模型信噪比(SNR)为33.414,SNR>4表明构建模型是可靠的[15];失拟项不显著(P=0.140 9>0.05),表明应用该模型进行数值估测不会失真。模型一次项和二次项影响均极显著(P<0.01),交互作用项X1X2、X2X3影响极显著(P<0.01),而X1X3影响不显著(P>0.05)。
2.5.4 模型最优解与验证试验
对回归模型解逆矩阵可求出方程最优解:X1=0.14,X2=1.0和X3=-1,对应的实际水平为微波辐射时间153 s,花生肽亚铁配体比5∶1,引发剂(H2O)用量3%,其他条件为微波辐射功率608 W,反应物粒径120目,2.5%白炭黑为脱酸剂,0.3%异抗坏血酸钠(SIA)为亚铁保护剂。在优化条件下进行重复试验,螯合率为(90.68±1.31)%(n=3),与模型预测值92.71%基本吻合,偏差为-2.19%。
固相反应属非均相反应,固相条件下其原子或离子扩散比气相、液相要慢得多,需在高温条件下才能进行,微波加热能加快反应的进程。石蔼如等[16]发现,在微波效应存在条件下,处于微波场中物质内部的电磁场分布对离子扩散和固相反应过程有影响,认为微波加热能产生离子扩散增强效应,使反应物离子通过涨落获得大于势垒的能量穿过产物层,并进行浓度差扩散,在扩散过程中与生成物层的空位形成相关对,在交变微波电磁作用下,相关对不断改变取向,进一步产生浓度梯度,从而推动离子的扩散。当微波场处于合适位置时,反应体系熵最低,增强了分子碰撞概率,反应物中部分分子吸收微波辐射提供的能量被激活,提高了反应效率[17]。
3 结 论
本试验以花生肽(相对分子质量<3.0 kD)为原料,以硫酸亚铁(FeSO4·7H2O)为金属螯合剂,在微波固相催化作用下进行了花生肽亚铁的配位螯合,在单因素试验基础之上,利用中心复合响应面优化设计对花生肽亚铁金属配位螯合过程进行了优化分析,并获得了优化的配位螯合工艺参数,即微波辐射时间153 s,花生肽亚铁配体比5∶1,引发剂(H2O)用量3%,微波辐射功率608 W,反应物粒径120目,2.5%白炭黑作为脱酸剂(占花生肽质量),0.3%异抗坏血酸钠作为亚铁保护剂(占硫酸亚铁质量)。在最优条件下螯合率为(90.68±1.31)%,与模型预测值92.71%接近。研究表明,微波固相合成技术能有效地促进花生肽亚铁的配位螯合。
[1] GERA T,SACHDEV H P.Effect of iron supplementation on incidence of infectious illness in children: systematic review[J].BMJ,2002,325:1142-1152.
[2] HERMOSO M,VUCIC V,VOLLHARDT C,et al.The effect of iron on cognitive development and function in infants,children and adolescents: a systematic review[J].Annals Nutr Metab,2011,59(2/3/4):154-165.
[3] FAIRWEATHERTAIT S J,TEUCHER B.Iron and calcium bioavailability of fortified foods and dietary supplements[J].Nutr Rev,2002,60(11): 360-367.
[4] 方细娟,曾庆祝,战宇,等.多肽-金属元素配合物的研究进展及发展前景[J].食品工业科技,2012,33(4):413- 416.
[5] 肖怀秋,李玉珍,林亲录,等.响应面优化冷榨花生粕酶法制备多肽工艺的研究[J].中国粮油学报,2013,28(9): 50-55.
[6] DONG X H,ZHAO M M,SHI J,et al.Effects of combined high-pressure homogenization and enzymatic treatment on extraction yield,hydrolysis and function properties of peanut proteins[J].Innov Food Sci Emerg Technol,2011,12(4): 478-483.
[7] 张宇昊,王强.Alcalase酶水解花生蛋白制备花生短肽的研究[J].农业工程学报,2007,23(4): 258-263.
[8] 黄薇,邓尚贵,唐艳,等.鳕鱼皮复合肽的制备工艺研究[J].浙江海洋学院学报(自然科学版),2011,30(5): 401-404.
[9] DIRSCHERL G,KÖNIG B.The use of solid-phase synthesis techniques for the preparation of peptide-metal complex conjugates[J].Eur J Organ Chem,2008,2008(4): 597-634.
[10] 李亮,施用晖,乐国伟.微波固相合成蛋氨酸亚铁的工艺研究[J].中国粮油学报,2004,19(3): 74-77.
[11] LOBEAV M A,BOGDANOV S A,RADISHEV D B,et al.Method of power density determination in microwave discharge,sustained in hydrogen-methane gas mixture[J].Diam Relat Mater,2016,66:177-182.
[12] KAPPE C O.High-speed combinatorial synthesis utilizing microwave irradiation[J].Chem Inform,2002,51(6): 314-320.
[13] 李玉珍,肖怀秋.微波固相合成技术及其在多肽(氨基酸)金属螯合物合成中的应用[J].现代食品科技,2017,33(2): 262-269.
[14] 孙姣,胡浩斌,毕阳.响应面法优化亚麻胶微波-超声波辅助提取工艺[J].中国油脂,2015,40(6):86-89.
[15] 肖怀秋,李玉珍,林亲录,等.Box-Behnken响应面优化冷榨花生粕酶解制备花生肽工艺[J].中国粮油学报,2014,29(10):106-111.
[16] 石蔼如,贾云发.微波固相反应的扩散增强机理[J].青岛大学学报(自然科学版),1998(1): 64-67.
[17] 李彩云,康健,刘晓娜,等.微波超声辅助优化葵花籽粕绿原酸的提取工艺[J].中国油脂,2016,41(2):88-91.
Optimizationofmicrowavesolid-phasesynthesisofpeanutpeptide-ferrousmetalcoordinationchelatingtechnologybyresponsesurfacemethodology
LI Yuzhen1,XIAO Huaiqiu1,2,JIANG Mingjiao3,XIE Jiaqi1,ZHOU Quan1,ZHAO Mouming2
(1.School of Pharmaceutical and Bioengineering,Hunan Vocational Technical College of Chemical and Industrial Technology,Zhuzhou 412000,Hunan,China; 2.College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China; 3.Hunan Zonwe Pharmaceutical Co.,Ltd.,Zhuzhou 412000,Hunan,China)
TQ936.2;TQ464.7
A
1003-7969(2017)09-0038-06
2016-12-30;
2017-05-23
湖南省教育厅科研项目(16C0550);湖南省高校科研项目(12C1049);湖南化工职业技术学院科研项目(HNHY2015002)
李玉珍(1981),女,讲师,硕士,主要从事蛋白质生物化学方面的教学与研究工作(E-mail)yuzhenli@163.com。
肖怀秋,副教授(E-mail)xiaohuaiqiu@163.com。
