银屑病关节炎患者血清tP1NP、β-CTX、OC、25-(OH)VD3水平变化及意义
2017-10-10王丽芳董鹏刘伟宋慧
王丽芳,董鹏,刘伟,宋慧
(北京积水潭医院,北京100035)
银屑病关节炎患者血清tP1NP、β-CTX、OC、25-(OH)VD3水平变化及意义
王丽芳,董鹏,刘伟,宋慧
(北京积水潭医院,北京100035)
目的探讨银屑病关节炎(PsA)患者血清总Ⅰ型前胶原氨基端延长肽(tP1NP)、Ⅰ型胶原羧基端肽β特殊序列(β-CTX)、N-端骨钙素(OC)、25-羟维生素D3[25-(OH)VD3)]水平变化及其临床意义。方法选择51例PsA患者作为观察组,其中骨质破坏19例、无骨质破坏32例,28例健康体检者作为对照组。采用电化学发光法检测两组血清骨标记物tP1NP、β-CTX、OC及25-(OH)VD3,并分析血清骨标记物水平与PsA患者病情相关指标(年龄、病程、血沉及血清CRP)的关系。结果观察组血清tP1NP、β-CTX、OC水平均高于对照组(P<0.05或<0.01),两组血清25-(OH)VD3水平比较差异无统计学意义(P>0.05)。观察组有骨质破坏者血清tP1NP、OC水平均高于无骨质破坏者(P均<0.01),有、无骨质破坏者血清β-CTX、25-(OH)VD3水平比较差异均无统计学意义(P均>0.05)。血清tP1NP、β-CTX、OC、25-(OH)VD3水平与PsA患者年龄、病程、血沉及血清CRP水平均无关(P均>0.05)。观察组有骨质破坏者血清tP1NP水平与血沉呈正相关(r=0.557,P<0.05),血清β-CTX、OC、25-(OH)VD3水平与患者病情相关指标均无关(P均>0.05)。结论PsA患者血清tP1NP、β-CTX、OC水平均升高;血清tP1NP水平有助于判断PsA患者骨质破坏及病情活动程度。
银屑病;关节炎;总Ⅰ型前胶原氨基端延长肽;Ⅰ型胶原羧基端肽β特殊序列;N-端骨钙素
银屑病关节炎(PsA)属于血清阴性脊柱关节炎[1],发病隐匿,有显著的骨质破坏倾向[2],约2/3的患者疾病早期即发生骨质破坏[3],最终可导致关节残毁。依据受累关节的不同,PsA患者可分为5个亚型,即远端指(趾)间关节炎型(仅远端指间关节及近端指间关节受累)、残毁性关节炎型、对称性多关节炎型、非对称性寡关节炎型、脊柱关节炎型[4]。血清骨标记物主要包括25-羟维生素D3[25-(OH)VD3]、骨形成标志物总Ⅰ型前胶原氨基端延长肽(tP1NP)和N-端骨钙素(OC),以及骨吸收特异性标志物Ⅰ型胶原羧基端肽β特殊序列(β-CTX)等。本研究探讨tP1NP、β-CTX、OC、25-(OH)VD3在PsA患者血清中的变化及其在PsA诊断、骨质破坏预测等方面的作用。
1 资料与方法
1.1 临床资料 选择2010年1月~2016年11月北京积水潭医院收治的PsA患者51例(观察组),男35例、女16例,年龄(45.29±13.83)岁,病程0.5个月~40年;银屑病家族史11例;临床分型:远端指(趾)间关节炎型1例,残毁性关节炎型7例,对称性多关节炎型14例,非对称性寡关节炎型16例,脊柱关节炎型13例;血沉(ESR)为2~120 mm/h,CRP为2.02~178 mg/dL;X线片和CT检查显示骨质破坏19例。研究对象均符合2006年修订的银屑病关节炎分类诊断标准中的PsA诊断标准,即炎性关节病(关节、脊柱、肌腱)伴有以下3项或3项以上表现者:①目前患有银屑病、既往有银屑病史或有银屑病家族史;②有典型的银屑病指甲改变,包括甲剥离、顶针样改变、过度角化等表现;③类风湿因子阴性;④指趾炎表现或指趾炎病史;⑤影像学显示关节周围新骨形成,手足X线片可见关节间隙附近有模糊骨化(而非骨赘形成)。排除标准:①孕妇、哺乳期妇女及有生育计划者;②恶性肿瘤及合并心、肝、肾等重要脏器疾病者;③近1年内行激素治疗者;④急、慢性严重感染者;⑤合并内分泌系统疾病者。选择同期体检健康者28例作为对照组,男15例、女13例,年龄(46.15±13.79)岁。两组性别构成比及年龄具有可比性。本研究通过医院伦理委员会审核,患者及其家属均知情同意。
1.2 血清骨标记物检测 所有受试者过夜禁食10 h以上,清晨经肘静脉采血2 mL,采用日立PAM离心机室温条件下4 000 r/min离心10 min,分离血清,采用电化学发光法检测血清tP1NP、β-CTX、OC、25-(OH)VD3。采用直线相关分析法分析血清骨标记物水平与病情相关指标(年龄、病程、ESR及血清CRP水平)的关系。
2 结果
2.1 两组血清骨标记物水平比较 观察组血清tP1NP、β-CTX、OC水平均高于对照组(P<0.05或<0.01),两组血清25-(OH)VD3水平比较差异无统计学意义(P>0.05)。见表1。

表1 两组血清骨标记物水平比较(ng/mL)
注:与对照组比较,*P<0.05,#P<0.01。
2.2 有、无骨质破坏PsA患者血清骨标记物水平比较 有骨质破坏PsA患者血清tP1NP、OC水平均高于无骨质破坏者(P均<0.01),有、无骨质破坏PsA患者血清β-CTX、25-(OH)VD3水平比较P均>0.05。见表2。

表2 有、无骨质破坏PsA患者血清骨标记物水平比较(ng/mL)
注:与无骨质破坏者比较,*P<0.01。
2.3 血清骨标记物水平与病情相关指标的关系 血清tP1NP、β-CTX、OC、25-(OH)VD3水平与PsA患者年龄、病程、ESR、CRP均无关(P均>0.05)。见表3。PsA骨质破坏患者血清tP1NP与ESR呈正相关(r=0.557,P<0.05);与年龄、病程、CRP均无关(P均>0.05);血清β-CTX、OC、25-(OH)VD3与PsA骨质破坏患者年龄、病程、ESR、CRP均无关(P均>0.05)。见表4。
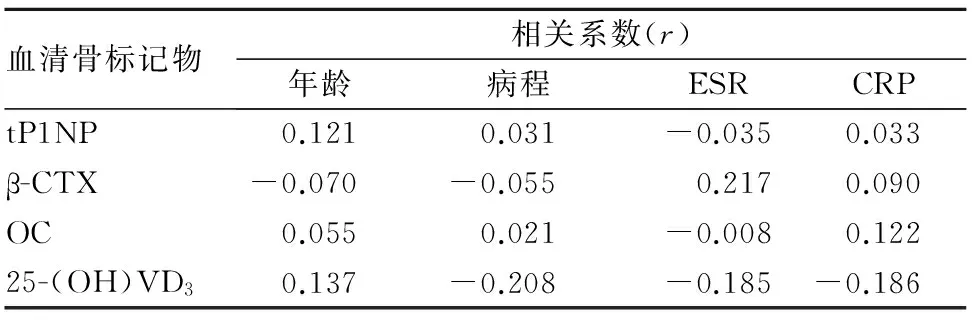
表3 PsA患者血清骨标记物水平与病情相关指标的关系
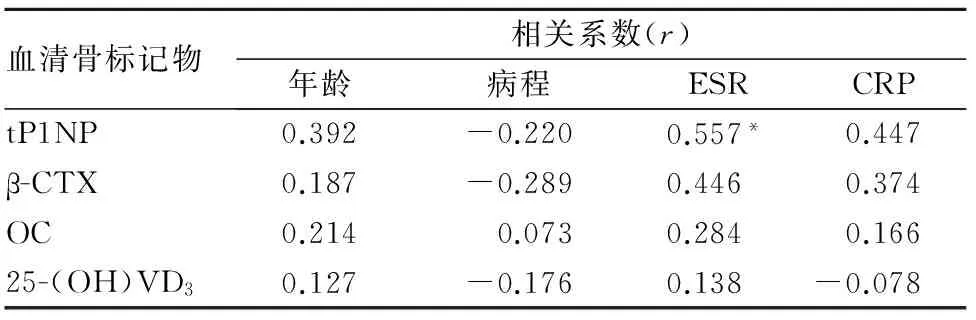
表4 PsA骨质破坏患者血清骨标记物水平与病情相关指标的关系
注:*P<0.05。
3 讨论
骨质丢失和骨质破坏是多种风湿性疾病尤其是炎性关节疾病常见的临床特点之一[5]。研究表明,多种炎症因子均参与骨代谢过程,如活化的IL-17可加速骨溶解进程[6]。TNF-α不仅作用于破骨细胞的各个阶段,影响骨质吸收,还是一种具有较强作用的骨吸收诱导剂,可抑制骨细胞的形成。TNF-α还可增强破骨细胞的吸收功能,促进骨的快速分解[7]。PsA患者的影像学检查可表现为离心性骨质溶解、笔帽征及远端指趾溶解[8],关节周围骨质矿化如骨膜炎和关节强直等,以上均提示PsA患者可能存在骨质破坏和新骨再生现象。
骨基质中90%的有机成分为Ⅰ型胶原,tP1NP是从Ⅰ型前胶原分子的两端分解出来的前胶原肽。当成骨细胞活性增强时,前胶原合成增多,tP1NP在血液中的水平显著增高[9]。因此,tP1NP是重要的骨形成标志物。OC又称为骨谷氨酰基蛋白(BGP),是人体骨组织中含量最多的非胶原蛋白,其主要生理功能是维持正常的骨矿化速率,抑制异常的羟基磷灰石结晶形成,血清OC水平可反映成骨细胞活性以及骨质形成情况[10]。骨形成标记物水平上升代表成骨细胞作用失衡,可表现为异常的新骨再生及骨融合、强直。近来有学者认为,附着点炎是PsA最重要的病理机制[11],主要表现为骨再生[12,13]。本研究发现,观察组血清tP1NP、OC水平均明显高于对照组,且骨质破坏的PsA患者血清tP1NP、OC水平均高于无骨质破坏者,说明PsA患者尤其是已经发生骨质破坏者多伴有明显的异常骨增生,提示血清tP1NP、OC水平检测有助于判断PsA患者骨质破坏和异常骨增生情况。但PsA患者成骨细胞活性增强导致异常骨增生的机制尚不明确,有待进一步研究。
活性维生素D不仅通过调节体内钙磷水平参与成骨及破骨活动,还可通过抑制细胞因子(如IL-1、IL-23、IFN-γ、TNF-α等)表达以及促进活化的T细胞和B细胞产生IL-10等,对骨代谢发挥免疫调节作用[14]。本研究观察组与对照组血清25-(OH)VD3水平比较差异无统计学意义,PsA有、无骨质破坏者血清25-(OH)VD3水平比较差异亦无统计学意义。可能与血清25-(OH)VD3水平受多种因素影响有关,如皮损严重程度、BMI、骨矿物质密度(BMD)等[15]。β-CTX是Ⅰ型胶原蛋白的羧基端降解产物,是骨吸收的特异标记物。当骨吸收增强时,Ⅰ型胶原蛋白降解,形成的C末端肽降解为β-CTX入血[16]。骨吸收标记物水平上升代表破骨细胞骨吸收能力增强,可导致骨量降低或骨质疏松。本研究观察组血清β-CTX水平高于对照组,但有、无骨质破坏的PsA患者血清β-CTX水平比较差异无统计学意义,可能与纳入患者的PsA亚型不同有关。既往研究发现,除脊柱关节炎亚型外,其他亚型的PsA患者并无明显的骨量减低[17]。不同亚型PsA患者的骨代谢情况仍需进一步研究。
目前用于评价PsA患者病情的评分系统较多,如28处关节的疾病活动度评分、银屑病关节炎关节活动指数、银屑病综合活动指数等[18~20],但目前尚无统一的评分标准,且多数评分与患者的主观意识有关。ESR和CRP是临床常用的炎症相关指标,可用于评价PsA的病情活动程度[21,22]。本研究相关性分析结果显示,PsA骨质破坏者血清tP1NP与ESR呈正相关,其他血清骨标志物与病情相关指标均无相关性,说明tP1NP可作为PsA骨质破坏患者病情活动程度的相关指标。
综上所述,PsA患者血清tP1NP、β-CTX、OC水平均升高;血清tP1NP水平有助于判断PsA患者骨质破坏及病情活动程度。
[1] Myers WA, Gottlieb AB, Mease P. Psoriasis and psoriatic arthritis: clinical features and disease mechanisms [J]. Clin Dematol, 2006,24(5):438-447.
[2] Ronti T, Lupattelli G, Mannarino E. The endocrine function of adipose tissue: an update[J]. Clin Endocrinol (Oxf), 2006,64(4):355-365.
[3] Gladman DD, Farewell VT, Nadeau C. Clinical indicators of progression in psoriatic arthritis: multivariate relative risk model[J]. J Rheumatol, 1995,22(4):675-679.
[4] Moll JM, Wright V. Psoriatic arthritis[J]. Semin Arthritis Rheum, 1973(3):55-78.
[5] Schwarz EM, Looney RJ, Drissi MH, et al. Autoimmunity and bone[J]. Ann N Y Acad Sci, 2006,1068(1):275-283.
[6] Lockhart E , Green AM, Flynn JL. IL-17 production is dominated by gammadelta T cells rather than CD4 T cells during Mycobacterium tuberculosis infection[J]. J Immunol, 2006,177(7):4662-4669.
[7] Mantravadi S, Ogdie A, Kraft WK. Tumor necrosis factor inhibitors in psoriatic arthritis[J]. Expert Rev Clin Pharmacol, 2016(22):1-12.
[8] Gladman DD, Antoni C, Mease P, et al. Psoriatic arthritis: epidemiology, clinical features, course and outcome[J]. Ann Rheum Dis, 2005,64(suppl2):l4-l7.
[9] Recker RR, Marin F, Ish-Shalom S, et al. Comparative effects of teriparatide and strontium ranelate on bone biopsies and biochemical markers of bone turnover in postmenopausal women with osteoporosis[J]. J Bone Miner Res, 2009,24(8):1358-1368.
[10] 刘石平,廖二元,伍贤平,等.尿Ⅰ型胶原羧基末端肽和氨基末端肽排泄率与年龄、绝经和绝经后骨丢失的关系[J].中华医学杂志,2006,86(6):371-375.
[11] McGonagle D. Enthesitis: an autoinflammatory lesion linking nail and joint involvement in psoriatic disease[J]. J Eur Acad Dermatol Venereol, 2009,23 (Suppl 1):9-13.
[12] Franck H, Ittel T. Serum osteocalcin levels in patients with psoriatic arthritis: an extended report[J]. Rheumatol Int, 2000,19(5):161-164.
[13] Braun J, Bollow M, Sieper J. Radiologic diagnosis and pathology of the spondyloarthropathies[J]. Rheum Dis Clin North Am, 1998,24(4):697 -735.
[14] Soleymani T, Hung T, Soung J. The role of vitamin D in psoriasis: a review[J]. Int J Dermatol, 2015(54):383-392.
[15] Kincse G, Bhattoa PH, Heredi E, et al. Vitamin D3 levels and bone mineral density in patients with psoriasis and/or psoriatic arthritis[J]. J Dermatol, 2015,42(7):679-684.
[16] Kirylow E, Kaminski G. Place of biochemical markers of bone turnover in guidelines for diagnosis and treatment of osteoporosis[J]. Pol Merkur Lekarski, 2008,25(148):386-389.
[17] Nolla JM, Fiter J, Rozadilla A, et al. Bone mineral density in patients with peripheral psoriatic arthritis [J]. Rev Rhum Engl Ed, 1999,66(10):457-461.
[18] Gladman DD, Mease PJ, Strand V, et al. Consensus on a core set of domains for psoriatic arthritis[J]. J Rheumatol, 2007(34):1167-1170.
[19] Mease PJ. Assessment tools in psoriatic arthritis[J]. J Rheumatol, 2008(35):1426-1430.
[20] Mease PJ, CE Antoni, Gladman DD, et al. Psoriatic arthritis assessment tools in clinical trials[J]. Ann Rheum Dis, 2005,64(Suppl 2):49-54.
[21] Maejima H, Taniguchi T, Watarai A, et al. Analysis of clinical, radiological and laboratory variables in psoriatic arthritis with 25 Japanese patients[J]. J Dermatol, 2010,37(7):647-656.
[22] Gladman DD, Mease PJ, Choy EH, et al. Risk factors for radiographic progression in psoriatic arthritis: subanalysis of the randomized controlled trial ADEPT[J]. Arthritis Res Ther, 2010,12(3):113.
宋慧(E-mail: jst_fsmy@163.com)
10.3969/j.issn.1002-266X.2017.32.020
R593.9
B
1002-266X(2017)32-0065-03
2016-12-08)
