miR-199a-3p在食管鳞癌细胞中的表达及其对细胞增殖和凋亡的影响*
2017-10-10鲁照明刘襄艳张幸丽师莹莹侯桂琴
高 盼,鲁照明,刘襄艳,张幸丽,凡 丞,师莹莹,侯桂琴
郑州大学药学院 郑州 450001
miR-199a-3p在食管鳞癌细胞中的表达及其对细胞增殖和凋亡的影响*
高 盼,鲁照明,刘襄艳,张幸丽,凡 丞,师莹莹,侯桂琴#
郑州大学药学院 郑州 450001
miR-199a-3p;食管鳞癌;细胞增殖;细胞凋亡
目的:探讨miR-199a-3p在食管鳞癌细胞中的表达情况及其对细胞增殖、凋亡的影响。方法采用Real-time PCR法检测miR-199a-3p在5株食管鳞癌细胞TE1、Eca109、EC9706、KYSE450、KYSE790中的表达。用siRNA-MateTM转染试剂将人工合成的miR-199a-3p模拟物 mimics转染Eca109、EC9706细胞后,采用Real-time PCR法检测miR-199a-3p的表达,采用克隆形成实验、CCK-8法及双染法检测细胞克隆形成能力、增殖能力和凋亡率,Western blot检测mTOR、p-p70S6K和Bcl-2蛋白的表达。以未转染细胞为空白对照,以转染mimics阴性对照的细胞为阴性对照。结果miR-199a-3p在5株食管鳞癌细胞中均有表达,表达水平差异无统计学意义(P>0.05)。与空白对照组和阴性对照组细胞相比,转染mimics的Eca109和EC9706细胞中miR-199a-3p相对表达量显著升高(P<0.001),细胞克隆形成能力降低(P<0.001),细胞增殖能力降低(P<0.001),细胞凋亡率增加(P<0.001),mTOR、p-p70S6K及Bcl-2蛋白表达水平降低。结论miR-199a-3p可能是通过调节mTORC1/p70S6K信号通路来抑制食管鳞癌细胞的增殖并促进细胞的凋亡。
食管癌是一种较常见的消化道恶性肿瘤,我国90%以上的食管癌患者其病理学类型为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[1]。微小RNA(microRNA,miRNA)是一种内源性的非蛋白质编码的小分子RNA,可通过与靶基因mRNA的非编码区域(3’-untranslated region,3’UTR)互补匹配,干扰mRNA分子的翻译,从而下调靶基因的表达[2]。miR-199a-3p是miR-199a的一个亚基,能够调控细胞增殖和凋亡。报道[3]证实,miR-199a可通过与MeCP2结合调节mTOR信号通路,影响RTT(Rett Syndrome Phenotypes)疾病的发展过程;通过抑制mTOR和c-Met的表达而提高肝癌细胞对多柔比星的敏感性[4];也可通过靶向mTOR的3’UTR,抑制mTOR的表达,从而抑制子宫内膜癌细胞的增殖[5];还可通过抑制Met和mTOR的表达,抑制乳头状甲状腺癌细胞的增殖和迁移[6]。作者观察了miR-199a-3p对ESCC细胞增殖、凋亡及mTORC1/p70S6K信号通路相关蛋白表达的影响,探讨ESCC发生发展确切的分子机制,为其分子靶向治疗提供理论依据。
1 材料与方法
1.1细胞和主要试剂ESCC细胞TE1、Eca109、EC9706购自上海中科院细胞库,KYSE450和KYSE790由郑州大学第一附属医院李晟磊教授惠赠,其中TE1和EC9706是低分化细胞株,Eca109、KYSE450、KYSE790是高分化细胞株,5株细胞用含有体积分数10%胎牛血清的完全培养基于37 ℃、体积分数5%CO2细胞培养箱中培养。人工合成的miR-199a-3p模拟物 mimics、mimics阴性对照及siRNA-MateTM转染试剂购自上海吉玛制药技术有限公司;miR-199a-3p引物序列由上海吉玛制药技术有限公司设计并合成,U6引物由上海生工生物工程股份有限公司合成;反转录试剂盒和Real-time PCR试剂盒购自宝生物工程(大连)有限公司;GAPDH、mTOR、磷酸化p70S6K(p-p70S6K)、Bcl-2兔抗人多克隆抗体均购自美国CST公司;CCK-8试剂购自郑州德雅科技有限公司;细胞凋亡检测试剂盒购自天津三箭生物技术股份有限公司。
1.2 5株ESCC细胞中miR-199a-3p表达的检测
分别收集对数生长期的5株细胞,提取总RNA并反转录得cDNA,用Real-time PCR法检测miR-199a-3p。miR-199a-3p引物序列为:上游5’-GCCGAA CAGTAGTCTGCACAT-3’,下游5’-TATGGTTTT GACGACTGTGTGAT-3’;U6内参引物序列为:上游5’-CTCGCTTCGGCAGCACA-3’,下游5’-AACGCT TCACGAATTTGCGT-3’;U6反转录引物序列为5’-AACGCTTCACGAATTTGCGT-3’。PCR反应体系20 μL,其中cDNA 2 μL,上、下游引物各0.8 μL,SYBR 10 μL,dH2O 6.4 μL。每个样本设置3个复孔。反应程序:95 ℃30 s;95 ℃5 s,62 ℃30 s,40个循环;95 ℃5 s,60 ℃60 s,95 ℃1 s;50 ℃30 s。记录Ct值,按照2-ΔΔCt计算miR-199a-3p的相对表达量。
1.3转染mimics的Eca109和EC9706细胞增殖、凋亡、miR-199a-3p及mTORC1/p70S6K信号通路相关蛋白表达的检测
1.3.1 转染 将适量Eca109和EC9706细胞接种于6孔板中,过夜培养至细胞融合度达30%~50%。分别取11 μL预先配制好的mimics及阴性对照加入到含有200 μL基础培养基的无RNA酶EP管中,混匀,室温孵育5 min,加入适量siRNA-MateTM,混匀,室温孵育10 min,然后将配制好的转染试剂加入细胞培养孔,使mimics及阴性对照终浓度为100 nmol/L。将6孔板放入培养箱中培养6 h后,更换成完全培养基继续培养。以未转染细胞作空白对照。
1.3.2 miR-199a-3p的检测 更换成完全培养基继续培养48 h后收集各组细胞并提取总RNA,按1.2方法测定miR-199a-3p的相对表达量。
1.3.3 细胞克隆形成实验 转染24 h后,将各组细胞接种于6孔板中,每孔1 000个,每组3个复孔,放入培养箱中培养,每隔3 d换一次培养基,当出现肉眼可见的细胞团时终止培养。弃去原培养基,用PBS洗2~3次,加1 mL甲醇固定30 min,弃去甲醇,再用PBS洗2~3次,加1 mL 10 g/L结晶紫染色30 min,最后用PBS冲洗直至细胞周围无明显紫色为止,室温晾干,拍照,用Image J进行细胞克隆计数。
1.3.4 细胞增殖的检测 采用CCK-8法检测。将适量细胞接种至96孔板中,过夜培养至细胞融合度在30%~50%。第2天进行转染,方法同1.3.1。转染6、24、48、72和96 h后,加入CCK-8继续培养4 h,最后测定450 nm处的吸光度值,表示细胞增殖能力。每组设3个复孔,实验重复3次。
1.3.5 细胞凋亡的检测 转染48 h后收集各组细胞,用预冷PBS洗1~2次,加1 mL 1×Binding Buffer重悬,1 000 r/min离心5 min,弃去上清,用适量1×Binding Buffer重悬,再加5 μL Annexin V-FITC室温孵育10 min,加5 μL PI室温孵育5 min,然后上流式细胞仪检测。整个操作过程应避光。实验重复3次。
1.3.6 mTOR、p-p70S6K和Bcl-2蛋白检测 转染72 h后收集各组细胞,Western blot法检测mTOR、 p-p70S6K和Bcl-2蛋白。蛋白上样量均为20 μg,一抗稀释比例均为11 000,二抗稀释比例均为110 000。电泳条件为80 V 40 min,120 V 1 h。转膜条件为300 mA 2 h。50 g/L脱脂奶粉PBST封闭2 h,4 ℃过夜。次日用PBST洗10 min×3次,室温振摇2 h。然后PBST洗10 min×3次,ECL超敏发光液孵育1 min,曝光。实验重复3次。
1.4统计学处理数据用SPSS 21.0进行统计分析,组间各指标的比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 5株ESCC细胞中miR-199a-3p的表达Real-time PCR实验结果显示,TE1、Eca109、EC9706、KYSE450、KYSE790细胞中miR-199a-3p的相对表达量分别为(1.351±0.549)、(1.362±0.130)、(1.368±0.279)、(1.346±0.181)、(1.352±0.860),5组比较差异无统计学意义(F=0.001,P>0.999),提示miR-199a-3p的表达水平与ESCC细胞分化程度无关。
2.2转染mimics的Eca109和EC9706细胞中miR-199a-3p的表达见表1。转染mimics的Eca109和EC9706细胞中miR-199a-3p相对表达量较阴性对照和空白对照显著升高(P<0.05)。
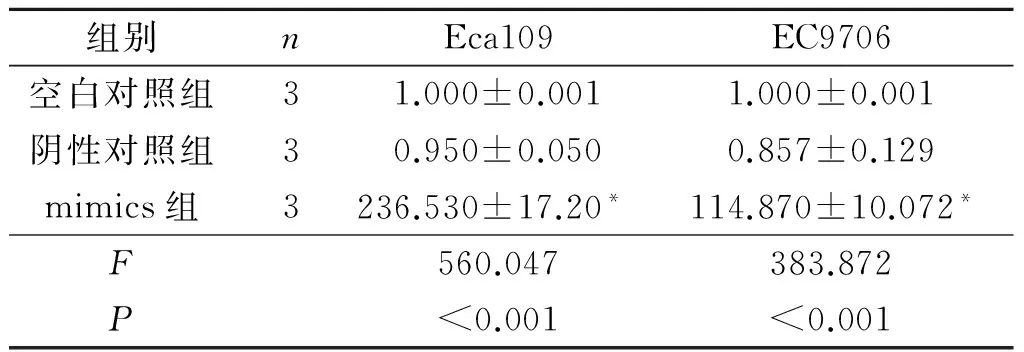
表1 转染mimics的Eca109、EC9706细胞中miR-199a-3p的相对表达量
*:与空白对照组和阴性对照组相比,P<0.05。
2.3转染mimics的Eca109和EC9706细胞的克隆形成能力见图1、表2。转染mimics后Eca109和EC9706细胞克隆形成能力较空白对照和阴性对照降低(P<0.05)。
2.4转染mimics的Eca109和EC9706细胞的凋亡情况见表3。转染mimics的Eca109和EC9706细胞凋亡率较空白对照和阴性对照升高(P<0.05)。
2.5转染mimics的Eca109和EC9706细胞的增殖能力见表4、5。转染mimics的Eca109和EC9706细胞增殖能力较空白对照和阴性对照降低(P<0.05)。
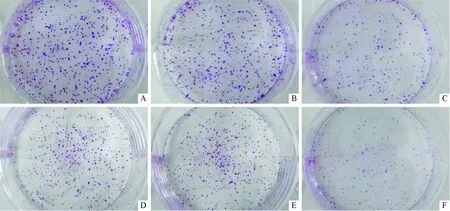
A~C:空白对照组、阴性对照组、mimics组Eca109细胞;D~F:空白对照组、阴性对照组、mimics组EC9706细胞。 图1 细胞克隆实验
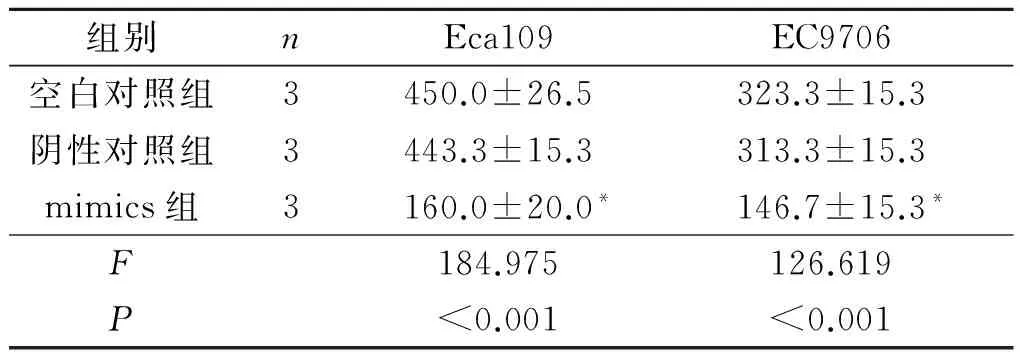
组别nEca109EC9706空白对照组3450.0±26.5323.3±15.3阴性对照组3443.3±15.3313.3±15.3mimics组3160.0±20.0*146.7±15.3*F184.975126.619P<0.001<0.001
*:与空白对照组和阴性对照组相比,P<0.05。
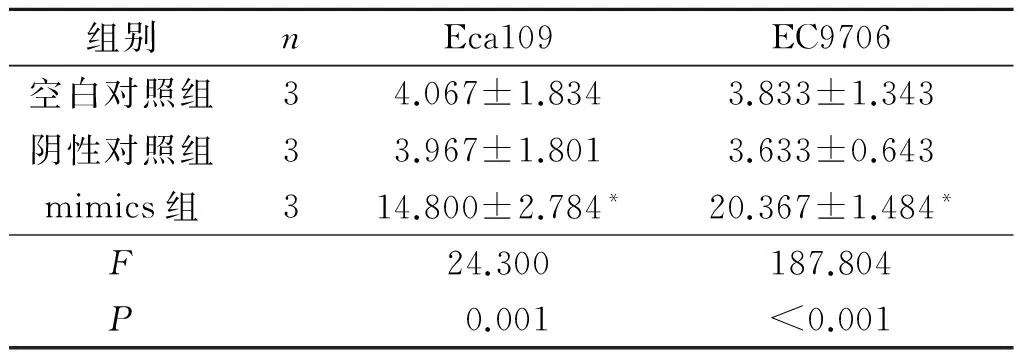
表3 3组细胞凋亡率的比较 %
*:与空白对照组和阴性对照组相比,P<0.05。
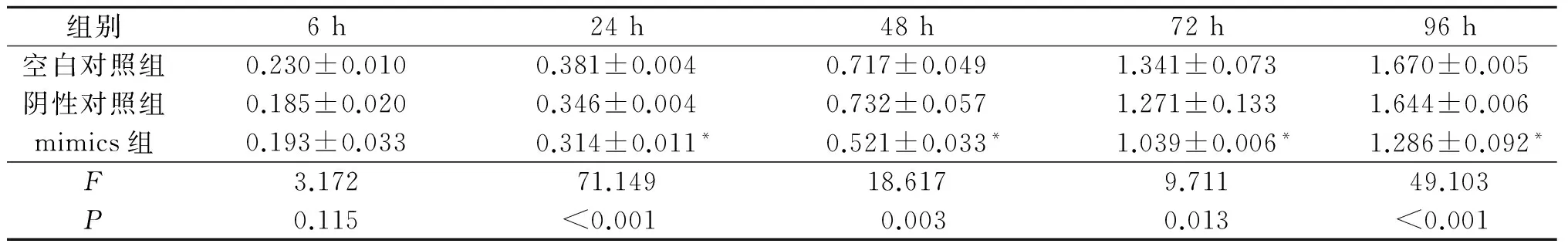
表4 Eca109细胞增殖能力测定结果(n=3)
*:与空白对照组和阴性对照组相比,P<0.05。
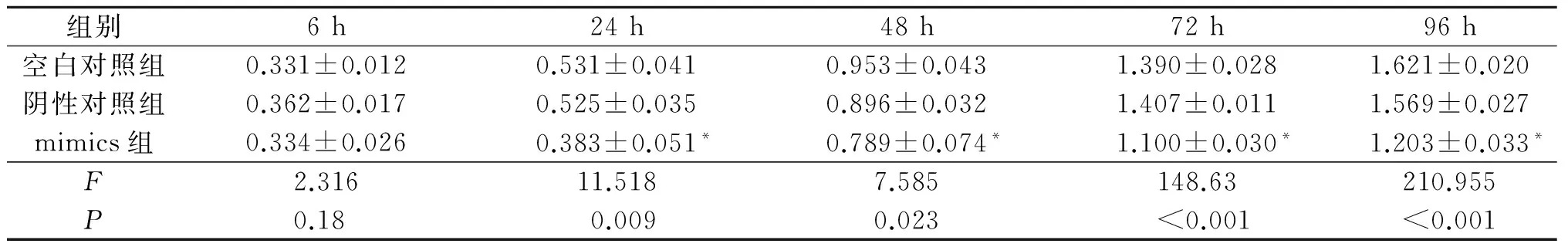
表5 EC9706细胞增殖能力测定结果(n=3)
*:与空白对照组和阴性对照组相比,P<0.05。
2.6转染mimics的Eca109和EC9706细胞mTOR、p-p70S6K及Bcl-2蛋白的表达见图2。转染mimics的Eca109和EC9706细胞中mTOR、p-p70S6K及Bcl-2蛋白表达水平均降低。
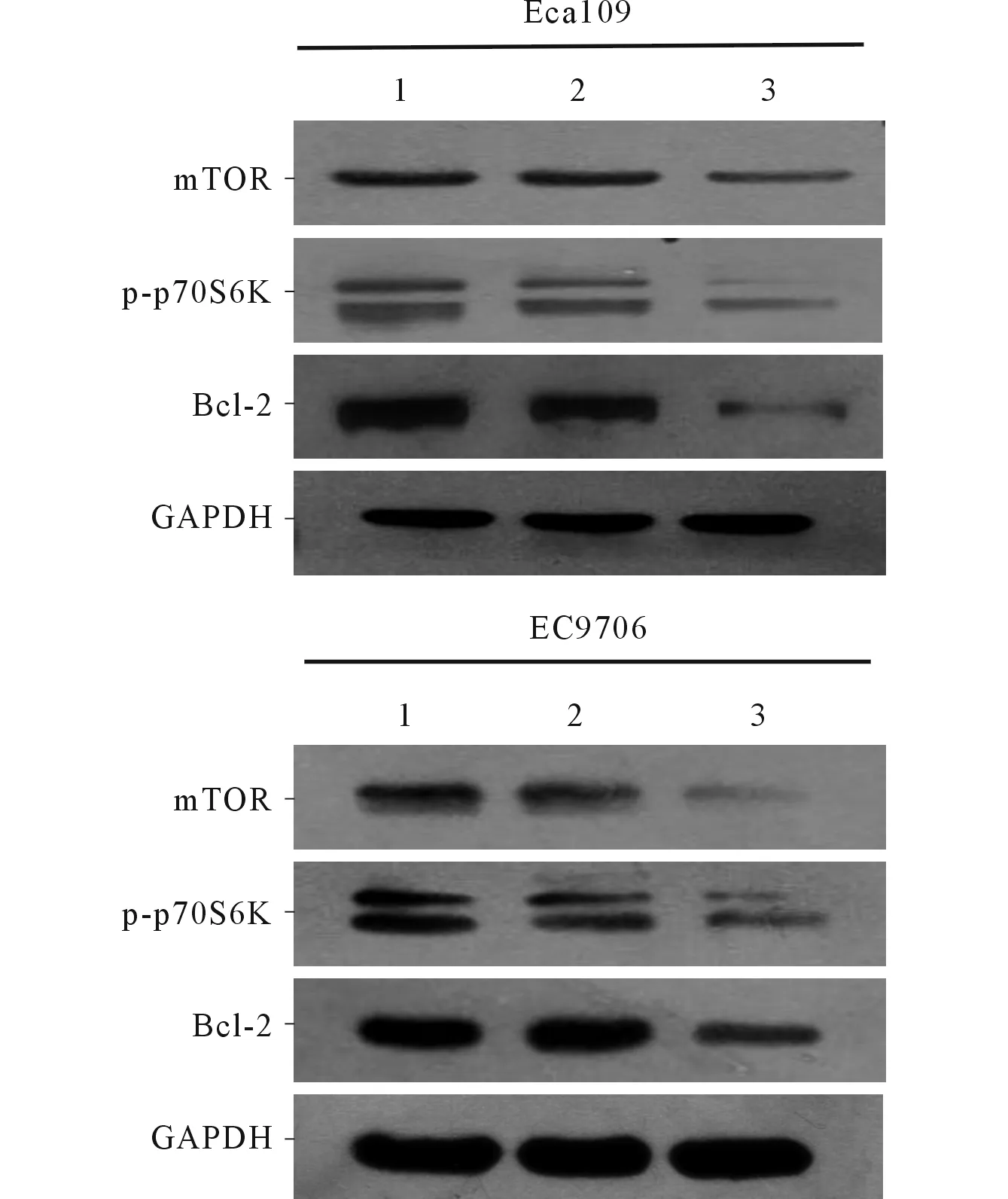
1:空白对照组;2:阴性对照组;3:mimics组。 图2 mTOR、p-p70S6K及Bcl-2蛋白的检测
3 讨论
1993年,Lee等[7]首先在秀丽新小杆线虫(Caenorhabditiselegans)中发现了第一个可时序调控胚胎后期发育的miRNA——lin-4,之后Reinhart等[8]又在同类线虫中发现了第二个异时性开关基因let-7,接着人们相继在细菌、动植物与人体内发现大量miRNA。近年来研究[2-9]发现,miRNA不仅在生物体细胞分化、增殖、代谢以及免疫应答等生命活动中发挥重要作用,而且与肿瘤、心脑血管疾病、代谢性疾病、神经性疾病、内分泌疾病及免疫性疾病等的发生发展密切相关。在肿瘤中,miRNA通常以癌基因或抑癌基因的角色参与肿瘤的发生发展。Huo等[10]研究发现,miR-144a-3p可通过靶向mTOR抑制人唾液腺腺样癌细胞的增殖,促进细胞凋亡;Chen等[11]发现,miR-451在多种结直肠癌组织中高表达,其表达与mTORC1的活性和FSCN1的表达密切相关,miR-451高表达可抑制AMPK的活性,导致mTORC1过度激活和FSCN1高表达,从而使细胞具有较高的迁移和增殖能力,促进结直肠癌的发生发展。Janaki等[12]研究发现,在乳腺癌MDA-MB-231细胞中,miR-15/16可通过抑制p70S6K1的表达抑制细胞增殖并使细胞周期停留在G1阶段。
miR-199a定位在人染色体19q13.2[13]。miR-199a-3p在多种肿瘤组织中异常表达,如卵巢癌、胃癌、肝癌、结直肠癌、胰腺癌、子宫内膜癌、乳头状甲状腺癌、胶质瘤、骨肉瘤等,影响癌症的发生发展[9-16]。Troppan等[14]发现,miR-199a和miR-497可增强弥散型B淋巴细胞瘤对化疗的敏感性,延长患者的生存期;Tian等[15]发现miR-199a-3p和miR-34a可通过影响p53信号通路诱导人骨肉瘤细胞凋亡;Peng等[16]研究发现,miR-199a-3p在胃癌组织中表达下调,上调其表达可抑制胃癌细胞增殖。该研究结果证实,ESCC细胞中也存在miR-199a-3p的表达;上调其表达可明显抑制细胞增殖并能促进细胞凋亡,降低mTORC1/p-p70S6K信号通路相关蛋白以及抗凋亡蛋白Bcl-2的表达水平,说明miR-199a-3p可能是通过调节mTORC1/p-p70S6K信号通路来影响ESCC细胞的增殖和凋亡。
目前有关miR-199a-3p在ESCC中的研究较少,该研究也仅对其进行了体外研究。总之,miR-199a-3p在ESCC的发生发展中具有重要作用,深入探讨miR-199a-3p在ESCC中的作用及相关机制可能为ESCC的临床诊断和分子治疗提供新的靶标和策略。
[1] SIEGEL RL,MILLER KD,JEMAL A.Cancer statistics, 2016[J].CA Cancer J Clin,2016,66(1):7
[2] VAN ROOIJ E.The art of microRNA research[J].Circ Res,2011,108(2):219
[3] TSUJIMURA K,IRIE K,NAKASHIMA H,et al.miR-199a links MeCP2 with mTOR signaling and its dysregulation leads to rett syndrome phenotypes[J].Cell Rep,2015,12(11):1887
[4] FORNARI F,MILAZZO M,CHIECO P,et al.MiR-199a-3p regulates mTOR and c-Met to influence the doxorubicin sensitivity of human hepatocarcinoma cells[J].Cancer Res,2010,70(12):5184
[5] WU D,HUANG HJ,HE CN,et al.MicroRNA-199a-3p regulates endometrial cancer cell proliferation by targeting mammalian target of rapamycin(mTOR)[J].Int J Gynecol Cancer,2013,23(7):1191
[6] MINNA E,ROMEO P,DE CECCO L,et al.miR-199a-3p displays tumor suppressor functions in papillary thyroid carcinoma[J].Oncotarget,2014,5(9):2513
[7] LEE RC,FEINBAUM RL,AMBROS V.TheC.elegansheterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843
[8] REINHART BJ,SLACK FJ,BASSON M,et al.The 21-nucleotide let-7 RNA regulates developmental timing inCaenorhabditiselegans[J].Nature,2000,403(6772):901
[9] DU J,LIU S,HE J,et al.MicroRNA-451 regulates stemness of side population cells via PI3K/Akt/mTOR signaling pathway in multiple myeloma[J].Oncotarget,2015,6(17):14993
[10]HUO F,ZHANG C,HE H,et al.MicroRNA-144-3p inhibits proliferation and induces apoptosis of human salivary adenoid carcinoma cells via targeting of mTOR[J].Biotechnol Lett,2016,38(3):409
[11]CHEN MB,WEI MX,HAN JY,et al.MicroRNA-451 regulates AMPK/mTORC1 signaling and fascin1 expression in HT-29 colorectal cancer[J].Cell Signal,2014,26(1):102
[12]JANAKI RAMAIAH M,LAVANYA A,HONARPISHEH M,et al.MiR-15/16 complex targets p70S6 kinase 1 and controls cell proliferation in MDA-MB-231 breast cancer cells[J].Gene,2014,552(2):255
[13]WANG Z,TING Z,LI Y,et al.microRNA-199a is able to reverse cisplatin resistance in human ovarian cancer cells through the inhibition of mammalian target of rapamycin[J].Oncol Lett,2013,6(3):789
[14]TROPPAN K,WENZL K,PICHLER M,et al.miR-199a and miR-497 are associated with better overall survival due to increased chemosensitivity in diffuse large B-cell lymphoma patients[J].Int J Mol Sci,2015,16(8):18077
[15]TIAN Y,ZHANG YZ,CHEN W.MicroRNA-199a-3p and microRNA-34a regulate apoptosis in human osteosarcoma cells[J].Biosci Rep,2014,34(4):e00132
[16]PENG W,CHEN ZY,WANG L,et al.MicroRNA-199a-3p is downregulated in gastric carcinomas and modulates cell proliferation[J].Genet Mol Res,2013,12(3):3038
(2016-12-03收稿 责任编辑王 曼)
Expression of miR-199a-3p and its effects on cell proliferation and apoptosis in esophageal squamous cell carcinoma cells
GAOPan,LUZhaoming,LIUXiangyan,ZHANGXingli,FANCheng,SHIYingying,HOUGuiqin
SchoolofPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou450001
miR-199a-3p;esophageal squamous cell carcinoma;cell proliferation;cell apoptosis
Aim: To investigate the expression of miR-199a-3p in esophageal squamous cell carcinoma(ESCC) cells and its effects on cell proliferation and apoptosis. Methods: The expression of miR-199a-3p in five ESCC cell lines(TE1, Eca109, EC9706, KYSE450, KYSE790) was detected by Real-time PCR. miR-199a-3p mimics was transfected into Eca109 and EC9706 cells, respectively by siRNA-MateTM, and then the colony capacity, proliferation capacity and apoptosis rate were detected by colony formation assay, CCK-8 assay and Annexin V-FITC and PI staining method, respectively, the expressions of mTOR, p-p70S6K and Bcl-2 protein were detected by Western blot. Cells without transfection were the blank control, and cells transfected with negative mimics were the negative control.Results: miR-199a-3p expressed in five ESCC cell line cells, and the expression level had no significant difference(P>0.05). Compared with negative control and blank control, the expression level of miR-199a-3p in Eca109 and EC9706 cells transfected with miR-199a-3p mimics increased(P<0.001), the colony formation capacity and proliferation capacity decreased(bothP<0.001), the apoptosis rate increased(P<0.001), and the protein expressions of mTOR, p-p70S6K and Bcl-2 decreased. Conclusion: miR-199a-3p might inhibit cell proliferation and promote cell apoptosis in ESCC cells through mTORC1/p70S6K signal pathway.
10.13705/j.issn.1671-6825.2017.05.001
R735.1
*国家自然科学基金项目 30901778;河南省基础与前沿技术研究计划项目 162300410122
#通信作者,女,1977年6月生,博士,副教授,研究方向:肿瘤细胞分子生物学,E-mail:hougq@zzu.edu.cn