DTI评价非压迫性腰椎神经根炎微创治疗价值的实验研究
2017-10-10牛翔科肖建明杨朝炳王宗勇
牛翔科,肖建明,杨朝炳,植 彪,王宗勇,彭 涛
(成都大学附属医院放射科,四川 成都 610081)
DTI评价非压迫性腰椎神经根炎微创治疗价值的实验研究
牛翔科,肖建明,杨朝炳,植 彪,王宗勇,彭 涛
(成都大学附属医院放射科,四川 成都 610081)
目的:探讨非压迫性腰椎神经根炎经CT导向下微创治疗后神经根病理转归及神经根DTI的各向异性分数(FA)值的变化。方法:巴马小型猪9只经CT导向下非压迫性神经根炎造模成功14 d后,根据治疗药物不同随机分为3组。分别于实验猪L2~3、L3~4及L4~5双侧神经根旁注入相应药物进行治疗。每组分别于术后3、7及14 d行DTI扫描,扫描完成后处死实验动物,取相应双侧神经根行免疫组织化学检查。采用单因素方差分析术后3、7、14 d神经根FA值及神经根TNF-α平均光密度值的组间、组内差异;Spearman相关性分析神经根FA值与神经根TNF-α平均光密度值之间的关系。结果:消炎液治疗组神经根FA值及TNF-α平均光密度值治疗后下降趋势最明显;脉络宁治疗组于治疗后14 d神经根FA值及TNF-α平均光密度值与生理盐水组比较差异均有统计学意义(均P<0.05)。神经根FA值与TNF-α平均光密度值之间呈负相关。结论:CT导向下硬膜外注射消炎液可改善实验猪非压迫性神经根炎的炎症程度,且FA值可作为无创性客观评价其病理转归的手段。
腰椎;椎间盘移位;扩散张量成像;神经根病;外科手术,微创性;模型,动物;免疫组织化学
传统观点认为,腰椎神经根性疼痛主要是由于椎间盘突出对神经根造成机械性压迫所致。但目前越来越多的观点支持腰椎神经根性疼痛是由于压迫性(机械性)和非压迫性(化学性)因素共同引起的[1]。DTI的纤维示踪技术已广泛用于神经系统,特别是脑白质[2]。腰椎神经根性疼痛的治疗主要为手术和影像设备导向下的微创治疗。CT引导下微创治疗由于其断层解剖清晰、手术用时短、患者和术者射线暴露少等得到广泛认可。DTI能否客观评估非压迫性腰椎神经根炎微创治疗后病理转归目前鲜有报道。基于此,本研究拟采用非压迫性神经根炎的实验猪模型探讨CT导向下微创治疗的疗效及DTI参数各向异性分数(FA)值能否对其治疗后转归进行评价,为下一步研究奠定基础。
1 材料与方法
1.1 实验动物 健康巴马小型猪9只[成都达硕实验动物有限公司提供,许可证号:SCXK(川)2013-24],均为雌性,体质量15~20 kg。均经MRI扫描排除脊柱先天性畸形、胸腰段脊柱感染性病变、腰椎神经根畸形等。
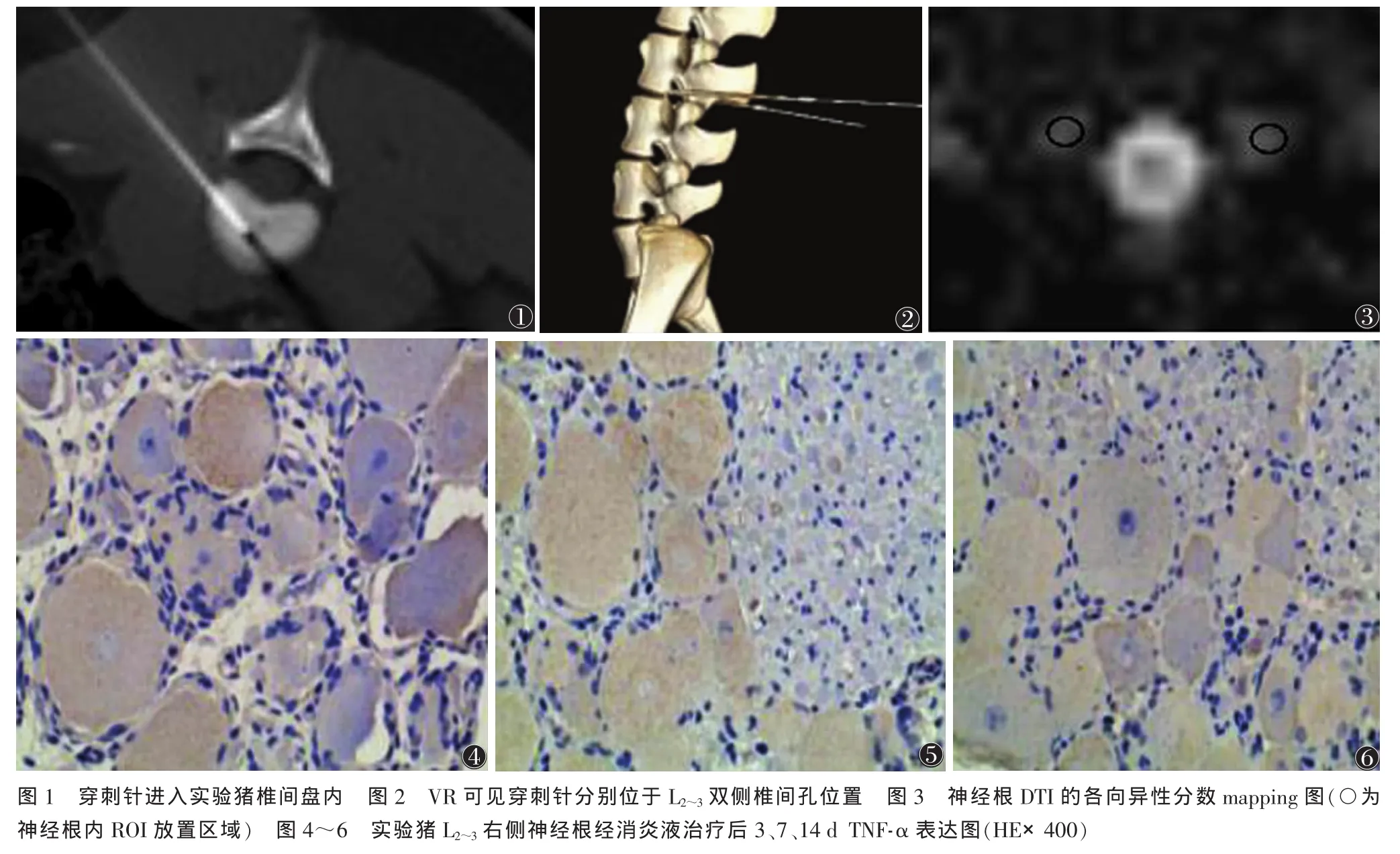
1.2 非压迫性神经根炎造模及治疗 实验动物保持麻醉状态,取俯卧位固定,常规消毒、备皮、铺巾,用17 cm 19 G 巴德针(TruGuide C2020B,Bard,USA)于CT 引导下穿刺 L2~3、L3~4、L4~5椎间盘,经扫描确定进入椎间盘后用电动经皮椎间盘旋切器(Stryker instruments,USA)旋切椎间盘髓核,速度 0.5~1 mm/s,共切吸1.0~2.0 g髓核组织并置于无菌容器中,加入生理盐水充分搅拌,制备成12 mL混悬液备用(图1)。同样 CT 引导下,于 L2~3、L3~4、L4~5双侧椎间孔(硬膜外)注入混悬液2 mL(图2)。造模完成后,将实验猪随机分为3组:A组为消炎液治疗组;B组为脉络宁治疗组;C组为生理盐水组。造模后14 d,按上述方法进行麻醉,CT引导下于实验猪相同节段双侧椎间孔(硬膜外)分别注入10 mL相应药物。消炎液制备方法:曲安奈德(天津金耀药业有限公司)120 mg、维生素B12(国药集团容生制药有限公司)6 mg、利多卡因(上海朝晖药业有限公司)30 mL制成溶液共72 mL。脉络宁采用南京金陵制药公司产品。
1.3 MRI检查方法 实验动物麻醉后,取仰卧位头先进方式固定,采用Siemens Aavnto 1.5 T超导型MRI仪及8通道相控阵脊柱线圈进行扫描。扫描序列及参数:矢状位T2WI SE,层数88,FOV 250 mm×250mm,层厚 1 mm,TR 2 000 ms,TE 117 ms,NEX 2次,相位编码方向H-F,分辨率256×254,并行因子2,翻转角 150°,带宽 399;横轴位 DTI:采用单次激发 SE-EPI,TR 12 000 ms,TE 117 ms,FOV 200 mm×200 mm,分辨率 132×132,NEX 5 次,层厚 3 mm,层数48,无间隔,相位编码方向A-P,并行因子 2,b值取 0、800 s/mm2,带宽 996 Hz。
1.4 MRI图像分析 图像在Siemens后处理工作站,采用neuro 3D软件进行后处理。于DTI横轴位图像神经根走行方向放置ROI测量神经根FA值,并放置对应药物治疗腰椎节段,分别测量双侧神经根椎管内段、椎间孔内、椎间孔外段FA值,取其测量平均值(图3);ROI尽量包括所显示的神经根断面,大小 12~28 mm2。
1.5 免疫组织化学检查 相应观察时间点结束时,将实验动物处死后立即解剖取得多组神经根。免疫组化处理步骤:经载玻片防脱片处理及热修复抗原后,滴加稀释的一抗(1∶200)[TNF-α,兔多克隆抗体,批号:ab6671,英国abcam-艾博抗(上海)贸易有限公司],4 ℃过夜,PBS(pH 7.2~7.4)洗 3 次;滴加生物素化山羊抗鼠/兔IgG二抗[生物素化山羊抗兔IgG(H+L),批号13152A11,北京中山金桥生物有限公司],37 ℃ 30 min,PBS(pH 7.2~7.4)洗 3 次;最后滴加辣根过氧化酶标记链霉素卵蛋白试剂[辣根酶标记链霉素卵蛋白素(HRP/A-V),批号:13152A11,北京中衫金桥生物有限公司]30 min(37 ℃),PBS(pH 7.2~7.4)洗4次;DAB显色后蒸馏水洗涤;苏木素轻度复染,脱水,透明,中性树胶封片。病理图像采集:采用麦克奥迪实业集团有限公司生产的BA200 Digital数码三目显微摄像系统对切片进行图像采集(图4~6)。结果分析:采用Image-Pro Plus 6.0图像分析系统测定所采集全部图像的平均光密度。
1.6 统计学方法 采用SPSS Statstics Ver.21进行数据处理和分析,定量资料以±s表示。采用方差分析比较实验动物神经根于治疗后3、7、14 d FA值及TNF-α平均光密度值的组间与组内差异。运用Spearman秩相关法分析神经根FA值与神经根TNF-α平均光密度值之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 3组神经根TNF-α平均光密度值比较(表1)神经根TNF-α平均光密度值组内比较:A组治疗后7、14 d与3 d比较差异均有统计学意义(均P<0.05);B组及C组治疗后神经根TNF-α平均光密度值不同天数比较,差异均无统计学意义(均P>0.05)。组间比较:治疗后3 d A组、B组分别与C组比较,差异均无统计学意义(均P>0.05);治疗后7 d,A组与C组比较差异有统计学意义(P<0.05),B组与C组比较差异无统计学意义(P>0.05);治疗后 14 d,A组、B组分别与C组比较差异均有统计学意义(均P<0.05)。
表1 3组神经根TNF-α平均光密度值比较(±s)
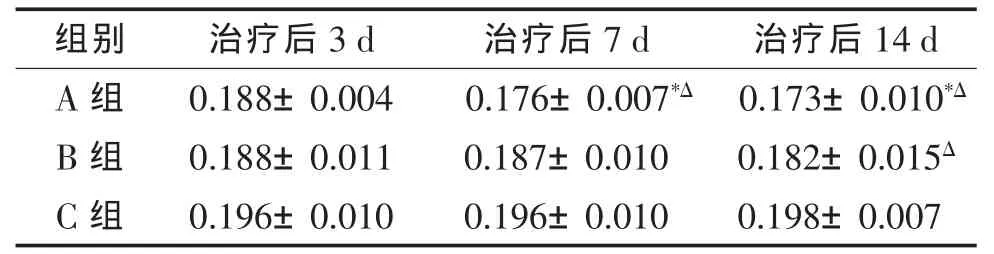
表1 3组神经根TNF-α平均光密度值比较(±s)
注:*与治疗后3 d组内比较差异有统计学意义;Δ治疗后相同天数与C组比较差异有统计学意义。
组别 治疗后3 d 治疗后7 d 治疗后14 d A 组 0.188±0.004 0.176±0.007*Δ 0.173±0.010*ΔB 组 0.188±0.011 0.187±0.010 0.182±0.015ΔC 组 0.196±0.010 0.196±0.010 0.198±0.007
2.2 FA值对非压迫性神经根炎治疗后疗效评估(表2) 神经根FA值组内比较:A组、B组治疗后14 d与治疗后3 d比较差异均有统计学意义(均P<0.05),7 d与3 d比较差异无统计学意义(P>0.05);C组治疗后神经根FA值不同天数比较,差异均无统计学意义(均 P>0.05)。 组间比较:治疗后 3、7、14 d A 组与C组比较差异均有统计学意义(均P<0.05);治疗后3、7 d B组与C组比较差异均无统计学意义(均P>0.05),治疗后14 d B组与C组比较差异有统计学意义(P<0.05)。经Spearman相关分析表明,神经根FA值与TNF-α平均光密度值之间呈负相关关系,rs=-0.323(P<0.05)。
表2 3组神经根FA值比较(±s)
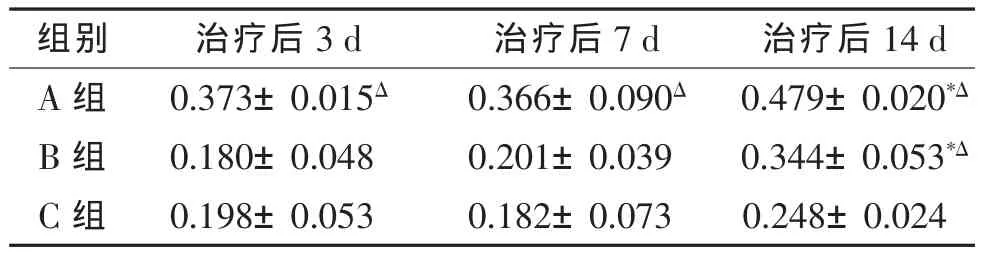
表2 3组神经根FA值比较(±s)
注:*与治疗后3 d组内比较差异有统计学意义;Δ治疗后相同天数与C组比较差异有统计学意义。
组别 治疗后3 d 治疗后7 d 治疗后14 d A 组 0.373±0.015Δ 0.366±0.090Δ 0.479±0.020*ΔB 组 0.180±0.048 0.201±0.039 0.344±0.053*ΔC 组 0.198±0.053 0.182±0.073 0.248±0.024
3 讨论
3.1 非压迫性神经根炎发生机制 近年来越来越多的证据支持导致神经根炎的机制包括机械性压迫和非机械性压迫,甚至只有非机械性压迫因素。Kuslich等[3]研究发现,机械性因素引起的神经根刺激仅在神经暴露于髓核时才引起疼痛,从而最早提出了非神经根压迫性的椎间盘突出所导致的炎症环境同样足以导致神经根性疼痛。Zhang等[4]运用自体移植髓核液至SD大鼠神经根周围成功制作了非压迫性神经根炎模型。Cuéllar等[5]进一步运用 SD 大鼠非压迫性神经根炎模型研究了髓核液移植至神经根周围导致炎症时神经根硬膜外细胞因子的表达。导致非压迫性神经根炎的细胞因子有白细胞介素、TNF-α、IFNγ等,而TNF-α是目前普遍接受的非压迫性髓核突出导致神经根炎的介质,采用TNF-α抑制剂注入神经根周围可抑制髓核液引起的神经传导速度减慢和其形态学改变[6]。而TNF-α的产生机制可能为神经根损伤导致丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族中的p38蛋白在神经元中高表达,而TNF-α可磷酸化并激活p38从而上调合成更多的TNF-α。TNF-α致疼痛的机制可能为:可使神经根伤害感受器敏化或神经根痛觉过敏,从而导致非压迫性神经根性疼痛。
3.2 非压迫性神经根炎治疗后病理变化 笔者自2007年至今致力于CT引导下腰痛的微创治疗,并经长期随访证实CT引导下微创治疗后未见明显并发症[7]。基于上述基础,该实验采用CT引导下硬膜外注射药物治疗非压迫性神经根炎,而实验过程中动物创伤小,手术时间短,术中及术后均未见明显并发症,从而提示该模型可为进一步探索非压迫性神经根炎微创治疗提供实验基础。消炎液主要以糖皮质激素为主,硬膜外注射治疗腰椎神经根性疼痛已得到普遍认可。然而,糖皮质激素硬膜外注射可明显缓解患者临床症状的机制尚未明确,推测其可能的机制为:消炎液硬膜外注射的主要作用是抑制前列腺素的合成,稳定细胞膜,阻断痛觉C纤维的传导,且糖皮质激素对神经根的修复也有帮助,能调节成纤维细胞生长因子的合成,短期内促进神经根功能的恢复[8-9]。本实验发现硬膜外注射糖皮质激素后7、14 d与3 d TNF-α的平均光密度值比较差异有统计学意义。笔者推测其可使TNF-α降低的机制为:糖皮质激素可在mRNA水平下调TNF-α的表达,并抑制其合成及释放,但具体作用机制有待进一步探索。脉络宁注射液主要成分为牛膝、玄参、石斛、金银花等,具有提高血液纤溶活性、降低血小板黏附性和高凝状态、解除血管痉挛、扩张血管、改善血液循环的作用。Zhi等[10]研究证实硬膜周围注射脉络宁可使腰椎间盘突出患者症状在短期内明显改善,本研究发现硬膜外注射脉络宁后神经根TNF-α的平均光密度值呈下降趋势,且治疗后14 d与生理盐水组比较差异有统计学意义。查阅文献,未见确切脉络宁可缓解神经根性疼痛的机制,推测原因可能为:脉络宁的主要成分可解除神经根周围炎症造成的血管痉挛,扩张血管,改善血液循环,减轻神经根的缺血症状,同时其本身可抑制炎性介质分泌,调节细胞因子水平,扩张神经根周围的微循环,从而使TNF-α的平均光密度值下降。
3.3 DTI对非压迫性神经根炎治疗效果评估 2010年,Eguchi等[11]运用 DWI评估腰椎间盘突出患者神经根病理变化,并证实神经根ADC值的增加可能是由神经根水肿及沃勒变性引起的。笔者前期研究[12]证实,神经根ADC值可预测腰椎间盘突出患者治疗效果。由于神经组织中水分的运动沿着神经纤维走行,具有异性弥散,所以理论上运用神经纤维素示踪成像的DTI可更好评估神经根病理变化。DTI主要参数包括FA值及ADC值,本研究仅探讨了FA值的变化,而未探讨ADC值的变化,主要基于预实验中发现,ADC值在不同研究者中测量偏差较大,该结果与Balbi等[13]研究结论基本一致;其次,预实验发现FA值相对于ADC值更能敏感反映神经根炎症的微结构变化,Facon等[14]研究结果与本研究基本一致。Chuanting等[15]研究发现DTI中的FA值可评估神经根受压程度,且其在神经根受压侧明显降低。Takagi等[16]采用大鼠坐骨神经受损模型进行DTI研究,发现坐骨神经受损后DTI的FA值下降,主要因神经远端轴突及髓鞘崩解,神经发生沃勒变性等引起,但同时发现随着神经远端轴索密度、直径及新生轴索的增加,FA值升高,提示神经功能恢复。本研究发现,神经根FA值在治疗后总体呈上升趋势,与Takagi等[16]研究结果一致。采用影像学手段对受损神经治疗后恢复情况进行评估是目前医学研究的热点之一。Morisaki等[17]证实DTI可定量评估大鼠坐骨神经的损伤与再生,且发现FA值可预测神经损伤后的退变及再生,且与组织学改变有很强的相关性。而本实验采用Spearman相关性分析得出治疗后神经根FA值与TNF-α平均光密度值呈负相关,与Morisaki等[17]研究结论基本相符,且同样提示神经根FA值的变化可用于评估治疗后神经根的病理转归。
综上所述,CT引导下硬膜外注射消炎液(糖皮质激素为主)对缓解实验猪非压迫性腰椎神经根炎短期效果较理想,且DTI可客观评估治疗后神经根病理转归。本研究不足之处:①样本量较少,可能会影响统计结果;②目前硬膜外注入药物多为配伍治疗,而本研究未探索不同药物配伍治疗的效果,有待进一步研究;③仅分析了FA值的变化,未分析相应ADC值的改变,有待进一步对比不同参数的改变。
[1] Kjell O.Combination of two cytokine inhibitors reduces nucleus pulposus-induced nerve injury more than using each inhibitor separately[J].Open Orthop J,2011,5:151-153.
[2] Hiltunen J,Suortti T,Arvela S,et al.Diffusion tensor imaging and tractography of distal peripheral nerves at 3 T[J].Clin Neurophysiol,2005,116:2315-2323.
[3] Kuslich SD,Ulstrom CL,Michael CJ.The tissue origin of low back pain and sciatica:a report of pain response to tissue stimulation during operations on the lumbar spine using local anesthesia[J].Orthop Clin North Am,1991,22:181-187.
[4] Zhang JJ,Song W,Luo WY,et al.Autologous nucleus pulposus transplantation to lumbar 5 dorsal root ganglion after epineurium dissection in rats:a modified model of non-compressive lumbar herniated intervertebral disc[J].Chin Med J (Engl),2011,124:2009-2014.
[5] Cuéllar JM,Borges PM,Cuéllar VG,et al.Cytokine expression in the epidural space:a model of non-compressive disc herniationinduced inflammation[J].Spine,2013,38:17-23..
[6] Kato K,Kikuchi S,Shubayev VI,et al.Distribution and tumor necrosis factor-alpha isoform binding specificity of locally administered etanercept into injured and uninjured rat sciatic nerve[J].Neuroscience,2009,160:492-500.
[7] Li B,Xu XX,Du Y,et al.CT-guided chemonucleolysis combined with psoas compartment block in lumbar disc herniation:arandomized controlled study[J].Pain Med,2014,15:1470-1476.
[8] Manchikanti L,Buenaventura RM,Manchikanti KN,et al.Effectiveness of therapeutic lumbar transforaminal epidural steroid injections in managing lumbar spinal pain[J].Pain Physician,2012,15:e199-e245.
[9] Buenaventura RM,Datta S,Abdi S,et al.Systematic review of therapeutic lumbar transforaminal epidural steroid injections[J].Pain Physician,2009,12:233-251.
[10] Zhi MX,Zhang GB,Hou JC,et al.Peridural injection of Mailuoning compound liquor for treatment of prolapse of lumbar intervertebral disc in 100 cases[J].J Tradit Chin Med,2009,29:6-8.
[11] Eguchi Y,Ohtori S,Yamashita M,et al.Clinical applications of diffusion magnetic resonance imaging of the lumbar foraminal nerve root entrapment[J].Eur Spine J,2010,19:1874-1882.
[12] Niu XK,Bhetuwal A,Yang HF.Diffusion-weighted imaging for pretreatment evaluation and prediction of treatment effect in patients undergoing CT-guided injection for lumbar disc herniation[J].Korean J Radiol,2015,16:874-880.
[13] Balbi V,Budzik JF,Duhamel A,et al.Tractography of lumbar nerve roots:initial results[J].Eur Radiol,2011,21:1153-1159.
[14] Facon D,Ozanne A,Fillard P,et al.MR diffusion tensor imaging and fiber tracking in spinal cord compression[J].AJNR Am J Neuroradiol,2005,26:1587-1594.
[15] Chuanting L,Qingzheng W,Wenfeng X,et al.3.0 T MRI tractography of lumbar nerve roots in disc herniation[J].Acta Radiol,2014,55:969-975.
[16] Takagi T,Nakamura M,Yamada M,et al.Visualization of peripheral nerve degeneration and regeneration:monitoring with diffusion tensor tractography[J].Neuroimage,2009,44:884-892.
[17] Morisaki S,Kawai Y,Umeda M,et al.In vivo assessment of peripheral nerve regeneration by diffusion tensor imaging[J].J Magn Reson Imaging,2011,33:535-542.
Research study on DTI evaluation of non-compressive lumbar radiculitis after CT-guided minimally invasive treatment
NIU Xiangke,XIAO Jianming,YANG Chaobing,ZHI Biao,WANG Zongyong,PENG Tao.Department of Radiology,Affiliated Hospital of Chengdu University,Chengdu,610081,China.
Objective:To explore the pathological changes of non-compressive radiculitis after CT-guided treatment,and also evaluate the changes of DTI parameters in lumbar nerve root.Methods:9 pigs with CT-guided induced non-compressive radiculitis were divided into three groups with 3 swine in each group based on implemented treatment methods.Bilateral epidural nerve root injection,at segments L2~3,L3~4,and L4~5,of specific therapeutic materials were injected into the respective groups.Thereafter,each group underwent postoperative (at 3,7 and 14 days) DTI MRI scan,and immunohistochemical study was performed on nerve root specimens.Analysis of each group in the postoperative FA value and nerve root immunohistochemical changes,the correlation between FA value and immunohistochemical changes were also analyzed.Results:There were declining trend that have been observed in nerve root FA value and TNF-α average optical density values after anti-inflammatory liquid treatment.After 14 days,the FA value and TNF-α average optical density value of Mailuoning treatment group showed statistical significance then compared with saline group.Furthermore,FA value of nerve root and immunohistochemical changes were correlated negatively.Conclusions:Nerve root inflammation could be improved by anti-inflammatory liquid treatment,and DTI could be used as a non-invasive monitoring tool for non-compressive radiculitis after minimal invasive treatment.
Lumbar vertebrae;Intervertebral disk displacement;Diffusion tensor imaging;Radiculopathy;Surgical procedures,Minimally invasive;Immunohistochemistry;Models,animal
2017-01-17)
10.3969/j.issn.1672-0512.2017.05.011
四川省医学科研青年创新课题计划(Q14004)。
彭涛,E-mail:862639224@qq.com。
