肾透明细胞癌相对强化CT值与微血管生成的相关性研究
2017-10-10欧阳爱梅苏新友魏兆龙于德新
欧阳爱梅,苏新友,魏兆龙,于德新,李 琨
(1.山东大学附属济南市中心医院影像中心,山东 济南 250013;2.山东大学齐鲁医院放射科,山东 济南 250011)
肾透明细胞癌相对强化CT值与微血管生成的相关性研究
欧阳爱梅1,苏新友1,魏兆龙1,于德新2,李 琨1
(1.山东大学附属济南市中心医院影像中心,山东 济南 250013;2.山东大学齐鲁医院放射科,山东 济南 250011)
目的:分析肾透明细胞癌CT强化参数与微血管参数的相关性,探讨肾细胞癌CT强化的血管性机制。方法:对29例肾透明细胞癌手术标本行CD34染色,行微血管计数及形态学测量,回顾CT图像,测量并计算动脉期肿瘤CT值(VTA),以及VTA与主动脉、肾皮质及肾髓质的CT值比值(RTA、RTC、RTM),VTA与肾皮质、肾髓质CT值差值(DTC、DTM),探讨微血管参数与CT强化参数的关系。根据病灶有无囊变、包膜分别分组;按照VTA和RTC大小分别分组:VTA分为<100 HU、100 HU≤VTA<150 HU、≥150 HU 3组,RTC 分为≤0.6、0.6<RTC<1、≥1 3组;比较各组之间微血管参数的差异。 结果:VTA、RTC、DTC 与微血管数目(MVD1)、面积(S1)、直径(D1)、周长(L1)及有腔微血管数目(MVD2)、直径(D2)、周长(L2)均呈正相关(均 P< 0.05)。RTA、RTM 与 MVD2、D2、L2 呈正相关(均 P<0.05)。CT 强化参数与 MVD2、D2、L2 呈正相关(均 P<0.01)。 VTA<100 HU、100 HU≤VTA<150 HU、VTA≥150 HU 3组MVD1均值之间差异无统计学意义(P>0.05);3组 MVD2均值差异有统计学意义(F=9.80,P<0.001)。 RTC≤0.6、0.6<RTC<1、RTC≥1 3 组 MVD1 差异有统计学意义(F=3.59,P=0.042 1);3组 MVD2差异有统计学意义(F=16.10,P<0.000 1)。结论:CT强化参数可在一定程度上反映肿瘤微血管生长情况,可作为宏观上判断肾癌生物学行为的指标。
肾肿瘤;体层摄影术,X线计算机;免疫组织化学;微血管;新生血管化,病理性
肾癌以富血供的透明细胞癌最常见,动脉期多明显强化。但在临床实践中,相当一部分肾透明细胞癌动脉期强化并不明显,与乳头状肾癌相似,其机制尚未明确。血管生成是肿瘤发生发展的基础,并决定肿瘤的生物学行为[1-2]。目前评价肿瘤血管生成的金标准是微血管密度(microvessel density,MVD)[3],多数研究[4-5]证明MVD与肿瘤的分级、转移、预后存在一定关系。除了血管数目外,新生血管的形态特征也可影响肿瘤的生物学行为[6-7]。 研究[8]发现,抗肿瘤新生血管的药物主要选择性作用于未成熟血管,并不影响成熟的肿瘤血管,而血管成熟程度主要由有腔微血管的形态反映,因此对肿瘤血管的研究不仅要重视其数目,更要重视其形态特征。目前对肾癌微血管形态学研究较少,且对微血管数目和形态研究的评价手段多来自肿瘤标本,存在有创、对准确取材的依赖性、离体性、非功能性等缺点,使其临床应用受限。相反,简单、无创的对比剂增强扫描技术可在一定程度上反映活体肿瘤的血流动力学特征[9],因此研究肾癌强化CT定量参数与微血管特点的关系,不仅能加深对肾细胞癌CT表现病理基础的认识,更可为肾癌的诊断、治疗及预后提供更多信息。由于CT值受对比剂剂量、流率、浓度、扫描延迟时间、血液循环状态等因素影响较大,本研究中采用相对CT值,以剔除上述不利因素的影响。
1 资料与方法
1.1 一般资料 搜集2012年10月至2015年1月济南市中心医院经手术病理证实的肾癌29例,其中男17例,女12例;年龄28~68岁,平均55.1岁。病灶位于左肾18例,右肾11例;直径最大8.5 cm,最小1.3 cm;术前均未行任何抗肿瘤治疗。
1.2 仪器与方法 采用Siemens Sensation 64排螺旋CT机,在屏气下扫描。扫描参数:140 kV,260~280 mAs。采用非离子对比剂碘海醇(300 mgI/mL)60~80 mL(剂量1.2 mL/kg体质量),经高压射器由前臂静脉注入,流率3~5 mL/s,动脉期(皮髓期)、静脉期(肾实质期)延迟时间分别为注射对比剂后30、80 s。
1.3 图像分析 CT图像由2名高年资影像诊断医师共同分析及测量。为避免容积效应,ROI尽可能大并避开血管和肿瘤坏死区,在病灶边缘区选取4个、中心区选取2个ROI,取其平均值作为测量结果。测量指标包括:①肿瘤有无囊变、坏死,有无假包膜并分别分组;②动脉期肿瘤CT值(CT value of tumor in artery phase,VTA);③动脉期肿瘤CT值与主动脉CT 值比值(the CT value ratio of tumor/aorta,RTA);④动脉期肿瘤CT值与肾皮质CT值比值(the CT value ratio of tumor/cortex,RTC);⑤动脉期肿瘤 CT值与肾髓质CT值比值(the CT value ratio of tumor/medulla,RTM);⑥动脉期肿瘤CT值与肾皮质CT值差值(the CT value diference of tumor and renal cortex,DTC);⑦动脉期肿瘤CT值与肾髓质CT值差值(the CT value diference of tumor and renal medulla,DTM);⑧动脉期肿瘤CT值与静脉期CT值差值(the tumor CT value diference of artery phase and venous phase,DAV)。 另外,根据 VTA、RTC 大小对肿瘤的血供情况分别进行分组,VTA分为<100 HU、100 HU≤VTA<150 HU,≥150 HU 3组;RTC 分为≤0.6、0.6<RTC<1,≥1 3 组。
1.4 肿瘤微血管染色及结果评估 所有标本均经甲醛溶液固定,取材部位尽量与CT图像后处理所测ROI部位一致,常规处理后4 μm连续切片,行免疫组织化学CD34染色(福州迈新生物技术有限公司),实验方法按照试剂说明书进行。MVD统计采用Weidner计数方法[10],单个内皮细胞或不相连独立的内皮细胞簇均作为1个微血管。将可见点状、裂隙样、环形、不规则形内腔的血管定义为有腔微血管。先在×100视野下随机选取肿瘤周边4个、中心2个微血管密集区(热点),再在×200视野下进行图像分析测量并取平均值,采用image plus 6.0图像自动分析系统进行。测量参数包括:总微血管数目(MVD1)、面积(S1)、直径(D1)、周长(L1)及有腔微血管数目(MVD2)、面积(S2)、直径(D2)、周长(L2)等。
1.5 统计学分析 应用SAS 9.2统计学软件分析数据,定量资料以±s表示。先对所得数据行正态性检验,多组均数行单因素方差分析(SNK检验),微血管参数与CT测量计算参数行相关性检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CT表现 29例中,囊变12例,假包膜9例,7例可见点状钙化。22例呈不均匀强化,7例均匀强化;显著强化,VTA≥150HU 11例,中等强化,100HU≤VTA<150 HU 9例,VTA<100 HU 9例;RTC≤0.6 7例呈乏血供表现,0.6<RTC<1 9例呈中等血供,RTC≥1 13例呈富血供表现。
2.2 微血管参数及与CT强化参数的关系(表1,2)VTA、RTA、RTC、RTM 分别为(125.93±48.69)HU、0.50±0.17、0.87±0.29、2.09±0.83,DTC、DTM、DAV分别为(18.31±39.00)、(64.21±46.77)、(23.31±27.05)HU。 MVD1、D1 均与 VTA、RTC、DTC、DTM 呈正相关(均 P<0.05),S1 与 VTA、RTC、RTM、DTC、DTM 呈正相关(均 P<0.05),L1 与 VTA、RTA、RTC、DTC 呈正相关(均 P<0.05)。 MVD2、S2、D2、L2 与各CT强化参数均呈正相关(均P<0.05)。
2.3 动脉期不同强化值的微血管数目比较(表3)VTA<100HU、100HU≤VTA<150HU、VTA≥150 HU 3组间MVD1差异无统计学意义(F=0.75,P=0.480 6)。3 组间 MVD2 差异有统计学意义(F=9.80,P<0.001),VTA<100 HU、100 HU≤VTA<150 HU 2组间 MVD2之间差异无统计学意义(P>0.05),VTA≥150 HU组MVD2大于其他 2组(均 P<0.05)。
2.4 富血供和乏血供肾透明细胞癌微血管数目比较(表 4) RTC≤0.6、0.6<RTC<1、RTC≥1 3 组 MVD1差异有统计学意义 (F=3.59,P=0.042 1),RTC≥1 组MVD1高于 RTC≤0.6组(P<0.05),RTC≤0.6组与0.6<RTC<1组、0.6<RTC<1组与 RTC≥1组 MVD1差异均无统计学意义(均P>0.05)。3组MVD2差异有统计学意义(F=16.10,P<0.000 1),0.6<RTC<1与RTC≥1 组MVD2差异无统计学意义(P>0.05),0.6<RTC<1与 RTC≥1组 MVD2均大于 RTC≤0.6组(均 P<0.05)。
表1 29例肾癌微血管参数平均值(±s)
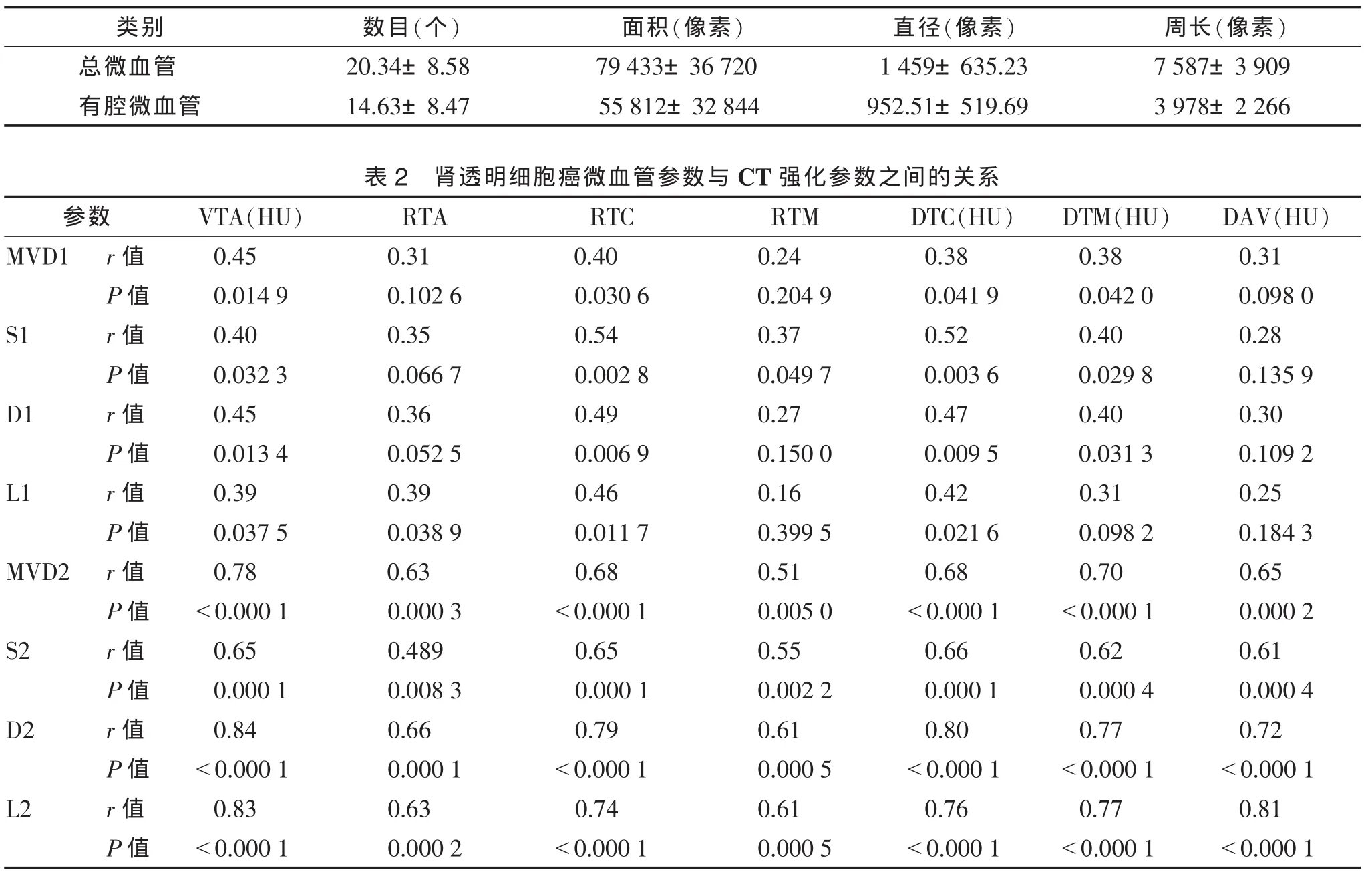
表1 29例肾癌微血管参数平均值(±s)
注:VTA,动脉期肿瘤CT值;RTA、RTC、RTM分别为动脉期肿瘤CT值与主动脉、肾皮质、肾髓质的CT值比值;DTC、DTM分别为动脉期肿瘤CT值与肾皮质、肾髓质的CT值差值;DAV,肿瘤动脉期与静脉期CT值差值;MVD1、S1、D1、L1分别为总微血管数目、面积、直径、周长;MVD2、S2、D2、L2 分别为有腔微血管数目、面积、直径、周长。
类别 数目(个) 面积(像素) 直径(像素) 周长(像素)总微血管 20.34±8.58 79 433±36 720 1 459±635.23 7 587±3 909有腔微血管 14.63±8.47 55 812±32 844 952.51±519.69 3 978±2 266表2 肾透明细胞癌微血管参数与CT强化参数之间的关系参数 VTA(HU) RTA RTC RTM DTC(HU) DTM(HU) DAV(HU)MVD1 r值 0.45 0.31 0.40 0.24 0.38 0.38 0.31 P值 0.014 9 0.102 6 0.030 6 0.204 9 0.041 9 0.042 0 0.098 0 S1 r值 0.40 0.35 0.54 0.37 0.52 0.40 0.28 P值 0.032 3 0.066 7 0.002 8 0.049 7 0.003 6 0.029 8 0.135 9 D1 r值 0.45 0.36 0.49 0.27 0.47 0.40 0.30 P值 0.013 4 0.052 5 0.006 9 0.150 0 0.009 5 0.031 3 0.109 2 L1 r值 0.39 0.39 0.46 0.16 0.42 0.31 0.25 P值 0.037 5 0.038 9 0.011 7 0.399 5 0.021 6 0.098 2 0.184 3 MVD2 r值 0.78 0.63 0.68 0.51 0.68 0.70 0.65 P值 <0.000 1 0.000 3 <0.000 1 0.005 0 <0.000 1 <0.000 1 0.000 2 S2 r值 0.65 0.489 0.65 0.55 0.66 0.62 0.61 P值 0.000 1 0.008 3 0.000 1 0.002 2 0.000 1 0.000 4 0.000 4 D2 r值 0.84 0.66 0.79 0.61 0.80 0.77 0.72 P值 <0.000 1 0.000 1 <0.000 1 0.000 5 <0.000 1 <0.000 1 <0.000 1 L2 r值 0.83 0.63 0.74 0.61 0.76 0.77 0.81 P值 <0.000 1 0.000 2 <0.000 1 0.000 5 <0.000 1 <0.000 1 <0.000 1
表3 3组不同VTA的肾透明细胞癌微血管数目比较(±s)
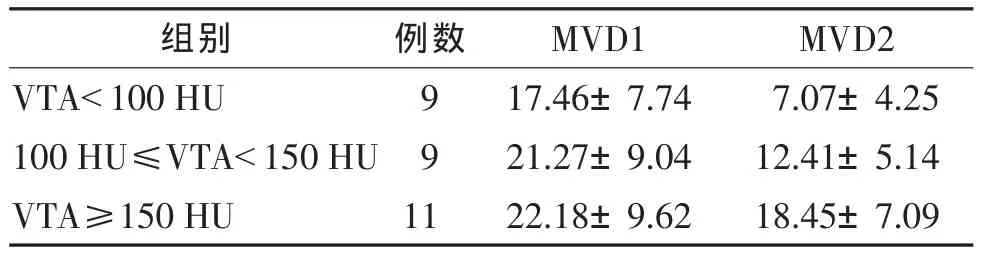
表3 3组不同VTA的肾透明细胞癌微血管数目比较(±s)
组别 例数 MVD1 MVD2 VTA<100 HU 9 17.46±7.74 7.07±4.25 100 HU≤VTA<150 HU 9 21.27±9.04 12.41±5.14 VTA≥150 HU 11 22.18±9.62 18.45±7.09
表4 3组不同RTC的肾透明细胞癌微血管数目比较(±s)
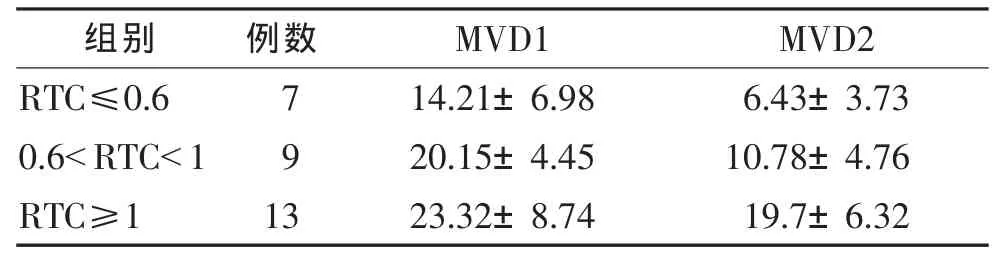
表4 3组不同RTC的肾透明细胞癌微血管数目比较(±s)
组别 例数 MVD1 MVD2 RTC≤0.6 7 14.21±6.98 6.43±3.73 0.6<RTC<1 9 20.15±4.45 10.78±4.76 RTC≥1 13 23.32±8.74 19.7±6.32
3 讨论
肾透明细胞癌是典型的血管生成依赖性疾病,肿瘤血管生成与肿瘤的生长、转移及预后密切相关[1]。目前CT多期增强扫描在其诊断、治疗及预后判断中发挥重要作用。目前,MVD计数是评价肿瘤血管生成的金标准[5]。肿瘤新生血管既包括内皮细胞芽,也包括较成熟的有腔微血管,研究[11-12]发现肿瘤血液灌注主要由有腔血管提供,因此在关注MVD的同时,也应重视微血管的其他特征,如面积、直径、周长等[13-15]。本研究显示,有腔微血管参数,如数目、面积、直径、周长与动脉期肿瘤CT参数均有相关性,且相关系数明显高于总微血管测量参数。另外,除了MVD,微血管面积、周长与动脉期肾透明细胞癌强化参数也有相关性,提示微血管构筑而不仅是数目对肿瘤血液灌注存在影响。
肿瘤动脉期强化程度与MVD相关[11],以往对强化程度的判断多依赖CT值,而相对CT值可剔除对比剂使用方式及血液循环状态的影响,更全面地反映肿瘤的血供情况。本研究发现,MVD与肾透明细胞癌VTA呈正相关,VTA≥150 HU组MVD2大于其他2组,VTA在一定程度上反映了肿瘤血管生长情况;MVD与RTC、DTC和DTM呈正相关,RTC≤0.6组MVD1、MVD2均小于RTC≥1组,而 MVD1与RTM无相关性,可能主要因透明细胞癌多位于肾脏皮质,血供丰富,因此,RTC和DTC更能反映肿瘤血液灌注情况。RTA、RTM与MVD无相关性,可能因扫描延迟时间个体差异,肾实质CT值在动脉期至静脉期之间对比剂下降速度不如肾癌快,髓质随时间延长CT值增加较快,因此扫描时间对RTA、RTM影响较大。
综上所述,肾透明细胞癌强化特征与微血管尤其是有腔微血管数目有关,也与微血管面积、周长等因素关系密切。CT增强扫描定量及半定量指标可在一定程度上反映肿瘤微血管生长情况,以为肾癌的诊断和治疗提供更多信息。本研究的不足之处为仅对肾透明细胞癌进行分析,未对肾癌的其他亚型进行研究。
[1] Folkman J,Beckner K.Angiogenesis imaging[J].Acad Radiol,2000,7:783-785.
[2] Das CJ,Thingujam U,Panda A,et al.Perfusion computed tomography in renal cell carcinoma[J].World J Radiol,2015,28,7:170-179.
[3] Brekken RA,Thorpe PE.Vascular endothelial growth factor and vascular targeting of solid tumors[J].Anticancer Res,2001,21:4221-4229.
[4] Zhang JP,Yuan HX,Kong WT,et al.Increased expression of Chitinase 3-like 1 and microvessel density predicts metastasis and poor prognosis in clear cell renal cell carcinoma[J].Tumour Biol,2014,12:12131-12137.
[5] Kouhsoltani M,Halimi M,Dibazar S.A positive correlation between immunohistochemical expression of CD31 and mast cell tryptase in odontogenic tumors[J].Pol J Pathol,2015,66:170-175.
[6] Sharma S,Sharma MC,Gupta DK,et al.Angiogenic patterns and their quantitation in high grade astrocytic tumors[J].J Neurooncol,2006,79:19-30.
[7] Khadim MT,Ahmed SA,Khan FA,et al.Evaluation of vascular endothelial growth factors A,C and D as indicators of lymphangiogenesis and angiogenesis in invasive and non-invasive urothelial carcinoma bladder[J].J Pak Med Assoc,2015,65:851-856.
[8]于德新,蔡跃红,马祥兴,等.肝细胞癌血管生成及其成熟度的临床意义[J]. 山东大学学报(医学版),2009,47(6):51-54.
[9] Xie Q,Wu J,Tang Y,et al.Whole-organ CT perfusion of the pancreas:impact of iterative reconstruction on image quality,perfusion parameters and radiation dose in 256-slice CT-preliminary findings[J].PLoS One,2013,8:e80468.
[10] Weidne N.Tumour vascularity and proliferation:clear evidence of a close ralationship[J].J Pathol,1999,189:297-299.
[11]杨毅,周俊林,郭玲,等.肾透明细胞癌的CT表现与Ki67、MVD、P73 表达的相关性研究[J]. 中国 CT 和 MRI杂志,2015,13(1):51-54.
[12] Kan Z,Phongkitkarun S,Kobayashi S,et al.Fuunctionnal CT for quantifying tumor perfusion in antiangiogenic therapy in a rat model[J].Radiology,2005,237:151-158.
[13] Sharma SG,Aggarwal N,Gupta SD,et al.Angiogenesis in renal cell carcinoma:correlation of microvessel density and microvessel area with other prognostic factors[J].Int Urol Nephrol,2011,43:125-129.
[14] Sullivan CA,Ghosh S,Ocal IT,et al.Microvessel area using automated image analysis is reproducible and is associated with prognosis in breast cancer[J].Hum Pathol,2009,40:156-165.
[15] Ehling J,Theek B,Gremse F,et al.Micro-CT imaging of tumor angiogenesis:quantitative measures describing micromorphology and vascularization[J].Am J Pathol,2014,184:431-441.
Correlation between relative CT enhancement value and microvascular architecture in clear cell renal carcinoma
OUYANG Aimei,SU Xinyou,WEI Zhaolong,YU Dexin,LI Kun.Medical Imaging Center,Jinan Central Hospital,Jinan,250013,China.
Objective:To study the correlation between parameters on enhanced CT and microvascular architecture parameters in clear cell renal carcinoma (ccRCC) and the vascular mechanism of enhancement CT.Methods:Surgical specimens of 29 patients with histologically confirmed ccRCC were immunohistostained for CD34 and then analysed for microvascular architecture.The CT value of tumor (VTA),the CT value ratio of tumor to aorta (RTA),tumor to cortex (RTC) and tumor to medulla(RTM) during arterial phase were measured.The CT value difference of tumor and cortex (DTC),tumor and medulla (DTM)were also calculated.The correlation of parameters on enhanced CT and microvascular architecture parameters was investigated.Results:VTA,RTC and DTC showed positive correlation with microvessels density(MVD1),area (S1),diameter (D1),perimeter(L1) and that of microvessels with lumen including MVD2,S2,D2 and L2 (P<0.05).RTA,RTM showed positive correlation with MVD2,D2 and L2 (P<0.05).Parameters on enhanced CT demonstrated positive correlation with MVD2,D2 and L2 (P<0.01).The differences of MVD1 in group VTA<100 HU,100~150 HU,≥150 HU had no statistically significances(P>0.05),and the differences of MVD2 in 3 groups were statistically significant (F=9.80,P<0.01).The differences of MVD1 in group RTC≤0.6,0.6~1,≥1 were statistically significant (F=3.59,P=0.042 1),and the differences of MVD2 in 3 groups were statistically significant (F=16.10,P<0.000 1).Conclusion:The parameters of ccRCC on enhanced CT imaging may shed some light on the tumor vascularity and function as the indicators of the biological behaviour of ccRCC.
Kidney neoplasms;Tomography;Immunohistochemistry;Micro vessel;Neovascularization,pathologic
2017-02-28)
10.3969/j.issn.1672-0512.2017.05.008
山东大学基本科研业务费资助(2014QLKY01)。
李琨,E-mail:kunchen1025@163.com。
